Реконструкция послеоперационного дефекта углеродным наноструктурным имплантатом с интрамедуллярным остеосинтезом после резекции длинных трубчатых костей по поводу первичных и метастатических опухолей
Автор: Сафин И.Р., Родионова А.Ю., Рукавишников Д.В., Хасанов Р.Ш.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Актуальность. Приоритетным в лечении первичных и метастатических злокачественных опухолей костей является комбинированное лечение, включающее хирургический этап, а также лекарственную и лучевую терапию, что позволило улучшить выживаемость. Достаточно важным является вопрос сохранения функции конечности. Хороший функциональный результат после оперативных вмешательств по поводу опухолей длинных трубчатых костей в первую очередь обусловлен реконструктивным этапом. Выбор метода реконструкции обусловливается локализацией опухоли, степенью ее локального распространения, наличием угрозы развития или уже состоявшегося патологического перелома, соматическим статусом пациента. Реконструктивный этап при диафизарной локализации опухолей является достаточно сложной задачей. Для реконструкции диафизарных послеоперационных дефектов используются эндопротезы, аллоимпланаты, аутокость. Для обеспечения стабильности пораженного сегмента конечности используются различные варианты остеосинтеза. Современные научные разработки обеспечивают появление материалов, обладающих характеристиками, близкими к характеристикам человеческой костной ткани, однако не имеющими недостатков, присущих алло- и аутокостным имплантатам. Цель исследования - улучшение результатов хирургического лечения опухолей длинных трубчатых костей диафизарной локализации. Материал и методы. Предложена технология, основой которой является реконструкция постоперационного дефекта углеродным нано-структурным имплантатом (УНИ) в комбинации с интрамедуллярным остеосинтезом блокированным штифтом. С использованием предложенного метода оперировано 25 пациентов, из них 9 - с состоявшимся патологическим переломом, у 24 - опухоль представлена метастазами рака. Дооперационно у всех пациентов был выражен болевой синдром и ограничение функции конечности. Результаты. Интра- и послеоперационных осложнений не было. Через 1 мес все пациенты отметили значительное уменьшение выраженности болевого синдрома. Функциональные результаты через 3 мес были хорошими. Ни у одного пациента не выявлено локального рецидива, нестабильности оперированного сегмента конечности, а также реакции отторжения углеродного наноструктурного имплантата. Заключение. Реконструктивный этап с использованием углеродных наноструктурных имплантатов после резекций длинных трубчатых костей по поводу метастатического поражения обеспечивает хорошие функциональные результаты и удовлетворительный локальный контроль.
Метастазы, патологический перелом, остеосинтез, углеродный наноструктурный имплантат, комбинированное лечение, выживаемость
Короткий адрес: https://sciup.org/140295085
IDR: 140295085 | УДК: 616.71-006.6-089.843 | DOI: 10.21294/1814-4861-2022-21-3-81-89
Текст научной статьи Реконструкция послеоперационного дефекта углеродным наноструктурным имплантатом с интрамедуллярным остеосинтезом после резекции длинных трубчатых костей по поводу первичных и метастатических опухолей
Первичные злокачественные опухоли костей составляют 0,001 % от всех впервые выявленных злокачественных новообразований [1]. Метастатическое поражение костей встречается в 35–40 раз чаще первичных опухолей. По частоте метастатического поражения кости занимают 3-е место после печени и легких. У 9–29 % пациентов с метастазами в кости первым проявлением опухолевого процесса является патологический перелом. Наиболее часто поражение скелета метастазами встречается при раке молочной железы, щитовидной железы, предстательной железы, легкого, почки, колоректальном раке. Метастазы в длинные трубчатые кости составляют 13–24 % [2]. Течение метастатического процесса в 5–30 % осложняется патологическим переломом, что требуют хирургического лечения у 9–12 % больных. Первичные опухоли костей осложняются развитием патологического перелома в 1–10 %. Современные методы диагностики и лечения позволяют выполнять органосохраняющие операции как при первичных, так и при метастатических опухолях костей [3].
Лечение диссеминированных форм рака шагнуло далеко вперед, благодаря появлению новых поколений цитостатиков, таргетных и иммуноон-кологических препаратов. В связи с этим значительно увеличилась выживаемость пациентов, что расширяет показания к резекционным операциям с реконструктивным этапом [4]. Поражение диафиза длинных трубчатых костей как при первичных, так и при метастатических опухолях встречается значительно реже, чем поражение эпиметафизов [5].
В эпифизарной зоне могут локализоваться гигантоклеточная опухоль, хондробластома, хондросаркома [6]. Метафизарное расположение характерно для остеосаркомы. Наиболее часто диафиз кости поражается при саркоме Юинга и PNET, а также при метастазах [7, 8].
При литических поражениях кости высок риск патологического перелома. Угроза развития патологического перелома при поражении длинных костей оценивается по шкале Mirel (1989). Развитие патологического перелома при локализации очага в области диафиза в значительной степени ухудшает состояние пациента с выпадением функции пораженной конечности [9]. Несмотря на то, что патологический перелом не является противопоказанием к химиотерапии, нередко больным отказывают в ее проведении в связи с невозможностью пациента самостоятельно передвигаться, поэтому при угрозе патологического перелома приоритетным является вопрос о хирургическом лечении.
Выбор метода операции зависит от гистотипа и степени дифференцировки опухоли, протяженности поражения [10]. При первичных опухолях оперативные вмешательства включают сегментарные резекции кости и ампутации/экзартикуляции. Сегментарные резекции длинных костей при первичных злокачественных опухолях включают обязательный реконструктивный этап в виде эндопротезирования, реконструкции с использованием аллоимплантов или аутокости с дополнением ее остеосинтезом (накостным, интрамедуллярным, чрескостным) [11–15]. При метастазах диафизарной локализации выполняются резекционные и стабилизирующие операции [16]. Стабилизирующие операции (интрамедуллярный остеосинтез блокированным штифтом, накостный остеосинтез) не предусматривают резекции патологического очага и являются паллиативными вмешательствами, обеспечивающим контроль болевого синдрома и стабильность пораженного сегмента конечности [17] и в дальнейшем требуют дополнительной дистанционной лучевой терапии для обеспечения локального контроля [18, 19]. Однако достаточно часто лучевой терапии бывает недостаточно для достижения данной цели, что приводит к росту метастатического очага и, как следствие, нестабильности металлоконструкции. Резекционные операции включают внутриочаговую резекцию с использованием методов локальной деструкции (криодеструкция, термоаблация) и пластикой костным цементом, сегментарные резекции с пластикой дефекта эндопротезом, аллоимплантатами, костными аутотрансплантатами [20].
При опухолевом поражении диафиза в ходе реконструкции постоперационного дефекта ставятся следующие задачи: обеспечение стабильности концов резецированной кости и имплантата, профилактика формирования ложного сустава, восстановление длины конечности, реализация возможности ранней реабилитации с максималь- ным восстановлением функции конечности [21]. Для реконструкции диафизарных послеоперационных дефектов применяются аутотрансплантаты (васкуляризированные и неваскуляризированные), аллоимплантаты, эндопротезы, имплантаты (титановые и углеродные) в сочетании с погружным остеосинтезом (БИОС), а также компрессионнодистракционный остеосинтез по Илизарову [22–24]. Учитывая особенности комбинированного лечения опухолей костей, метод Илизарова, предполагающий длительные сроки лечения (3–4 мес), не является удовлетворительным вариантом, поскольку требует отсрочки начала лучевой и/ или химиотерапии, что негативно влияет на общую и безрецидивную выживаемость. Неваскуляризированные аутотрансплантаты и аллоимплантаты также имеют свои недостатки, в частности, отсутствие биоинтеграции, ограниченные возможности реконструкции (замещение непротяженных дефектов), функциональный и косметический дефект в донорской области [25, 26]. Применение аллотрансплантатов ограничивается отсутствием банков донорской кости в большинстве лечебных учреждений, а также ввиду длительных сроков для консолидации имплантата (длительная иммобилизация и задержка проведения химиолучевой терапии) [27]. Диафизарные эндопротезы изготавливаются из титанового сплава или полиоксиметилена, чаще индивидуального дизайна [28, 29]. При оперативном лечении опухолей с поражением диафиза эндопротезирование или сочетание углеродного имплантата с остеосинтезом являются наиболее предпочтительными вариантами, т.к. обеспечивают раннюю активизацию и своевременное начало лучевой и/или химиотерапии (3–4 нед после операции).
Цель исследования – улучшение результатов хирургического лечения опухолей длинных трубчатых костей диафизарной локализации.
Материал и методы
Для решения данных задач нами была предложена технология, основанная на реконструкции постоперационного дефекта углеродным наноструктурным имплантатом (УНИ) в комбинации с интрамедуллярным остеосинтезом блокированным штифтом. Имплантаты представляют собой прочный пористый композит из углеродных волокон, связанных наноструктурной углеродной матрицей, который по своим свойствам близок к свойствам человеческой кости [30]. Данный материал, являющийся инновационным изобретением, запатентован в 2002 г., а в 2008 г. получил регистрационное удостоверение. С 2008 г. начали выполняться оперативные вмешательства с реконструкцией послеоперационных дефектов углеродными наноструктурными имплантатами. С этого времени совершенствуются линейка продукции, технологии изготовления материала, а в 2015 г. был построен завод по производству УНИ. Углеродные наноструктурные имплантаты используют-

Рис. 1. Углеродный наноструктурный имплант
Fig. 1. Carbon nanostructured implant ся для реконструкции дефектов при оперативных вмешательствах на длинных костях, позвонках [31]. Имплантаты имеют плотность, близкую к костной ткани человека, биоинертны, обладают свойством остеоиндукции, рентгенонегативны, а также могут являться депо для лекарственных препаратов (рис. 1). При опухолях костей УНИ используются для замещения пострезекционных дефектов и формирования спейсеров при двухэтапном эндопротезировании [32, 33]. Нами предложен метод реконструкции диафизарных послеоперационных дефектов с использованием углеродных наноструктурных имплантатов в сочетании со стабилизирующей системой. Этапы операции по поводу злокачественного новообразования с поражением диафиза включают резекцию пораженного участка кости в пределах здоровых тканей; установку интрамедуллярного блокированного штифта с углеродным имплантатом, замещающим постоперационный дефект; блокировку штифта винтами, обеспечивающую плотный контакт имплантата с костью и стабильность конструкции. В последующем это обеспечивает формирование костно-углеродного блока.
Всего прооперировано 25 пациентов (таблица). Морфологические варианты опухолей представлены метастазами рака молочной железы (n=11), рака почки (n=9), меланомы (n=1), эпителиоидной гемангиоэндотелиомой (n=1), гигантоклеточной опухолью (n=1), деструкцией костной ткани на фоне гиперпаратиреоза, вызванного аденомой паращитовидной железы (n=2). У 9 пациентов был состоявшийся патологический перелом. До операции все пациенты получали анальгетики (от нестероидных противовоспалительных средств до морфина), индекс боли по ВАШ составлял от 5 до 8 баллов. Во всех случаях ранний послеоперационный период протекал без осложнений.
Данный вариант реконструкции позволяет начать реабилитационные мероприятия через 1–2 нед (через 2 нед – при резекции бедренной кости) после вмешательства с максимальным восстановлением функции оперированной конечности, а также обеспечить продолжение лекарственной терапии через 2–3 нед после операции. После хирургического лечения (результат анализировался через 3 мес после операции) большинство пациентов (n=22) ограничиваются приемом ненаркотических анальгетиков до 2 раз в нед, 3 больных получают трамадол перорально до 4 раз в нед. В среднем функциональные результаты (по MSTS) через 3 мес после операции составили для верхней конечности 80 %, для нижней конечности – 70 %. Локальное прогрессирование не выявлено ни в одном случае. Системная диссеминация отмечена у 8 пациентов, что потребовало смены схемы лекарственного лечения.
Клинический случай
Пациентка З., 1946 г.р. В январе 2017 г. выполнено иссечение пигментной опухоли кожи поясничной области справа в условиях поликлиники по месту жительства с использованием аппарата «Сургитрон». При пересмотре гистологических препаратов в РКОД верифицирована меланома кожи pTхN0M0 (установить уровень инвазии невозможно). Выполнено широкое реиссечение послеоперационного рубца, затем больная находилась под диспансерным наблюдением. В августе 2019 г. стала отмечать боли в области левого плеча, не связанные с физической нагрузкой, травмой. В сентябре 2019 г., при плановой позитронно-эмиссионной томографии выявлено очаговое поражение левой плечевой кости. По данным рентгенографии имелся очаг в средней трети диафиза литического характера с деструкцией кортикального слоя (патологический перелом без смещения) (рис. 2). При остеосцинтиграфии
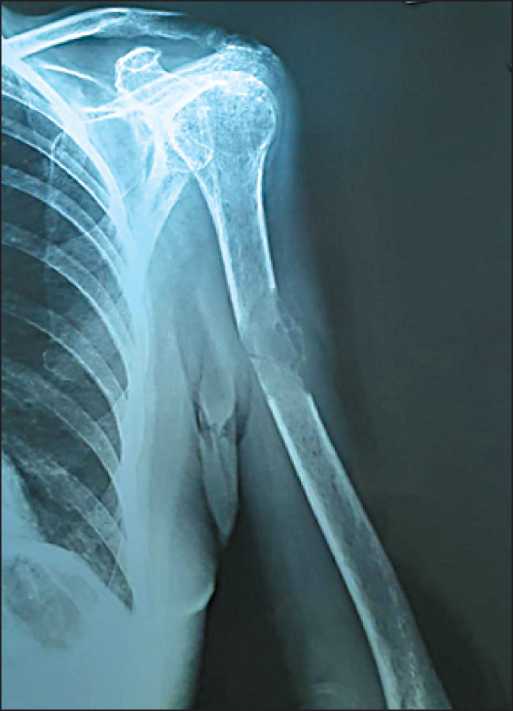
Рис. 2. Рентгенограмма до операции
Fig. 2. X-ray before surgery
Таблица/table
Характеристика больных с реконструкцией послеоперационных дефектов углеродным наноструктурным имплантатом
patients with reconstruction of postoperative defects with a carbon nanostructured implant
|
Пациент/ Patient |
Морфологический вариант/ Morphological type |
Локализация патологического очага/ Tumor location |
ВАШ до операции/ VAS before surgery |
ВАШ после операции/ VAS after surgery |
Функциональный результат до операции по шкале MSTS/ Functional result before surgery (MSTS) |
Функциональный результат после операции по шкале MSTS/ Functional result after surgery (MSTS) |
Выживаемость/ Survival rate |
|
Ж., 78 лет/ W., 78 years |
Меланома/ Melanoma |
Плечевая кость/ Humerus |
8 |
3 |
40 % |
67 % |
12 мес, прогрессирование (висцеральные метастазы)/ 12 months, progression (visceral metastases) |
|
Ж., 61 год/ W., 61 years |
Рак молочной железы/ Breast cancer |
Бедренная кость/ Femur |
7 |
2 |
40 % |
83 % |
26 мес, без прогрессирования/ 26 months, without progression |
|
Ж., 70 лет/ W., 70 years |
Рак молочной железы/ Breast cancer |
Бедренная кость/ Femur |
8 |
4 |
40 % |
83 % |
24 мес, жива, без прогрессирования/ 24 months, alive, without progression |
|
М., 51 год/ М., 51 years |
Гигантоклеточная опухоль/ Giant cell tumor |
Лучевая кость/ Radius bone |
8 |
4 |
53 % |
70 % |
24 мес, жив, без прогрессирования/ 24 months, alive, without progression |
|
М., 72 года/ М., 72 years |
Рак почки/ Kidney cancer |
Бедренная кость/ Femur |
8 |
3 |
40 % |
83 % |
7 мес, жив, без прогрессирования/ 7 months, alive, without progression |
|
Ж., 80 лет/ W., 80 years |
Рак почки/ Kidney cancer |
Бедренная кость/ Femur |
7 |
3 |
40 % |
83 % |
4 мес, жива, без прогрессирования/ 4 months, alive, without progression |
|
Ж., 80 лет/ W., 80 years |
Рак молочной железы/ Breast cancer |
Плечевая кость/ Humerus |
8 |
3 |
40 % |
83 % |
3 мес, жива, без прогрессирования/ 3 months, alive, without progression |
|
М.,77 лет/ М., 77 years |
Рак почки/ Kidney cancer |
Бедренная кость/ Femur |
7 |
3 |
40 % |
83 % |
24 мес, жив, без прогрессирования/ 24 months, alive, without progression |
|
Ж., 59 лет/ W., 59 years |
Рак молочной железы/ Breast cancer |
Бедренная кость/ Femur |
8 |
2 |
40 % |
83 % |
14 мес, жива, без прогрессирования/ 14 months, alive, without progression |
|
Ж., 72 года/ W., 72 years |
Эпителиоидная гемангиоэндотелиома/ Epithelioid hemangioendothelioma |
Бедренная кость/ Femur |
7 |
2 |
73 % |
83 % |
24 мес, без прогрессирования/ 24 months, alive, without progression |
|
М., 56 лет/ М., 56 years |
Гиперпаратиреоз/ Hyperparathyroidism |
Бедренная кость/ Femur |
7 |
2 |
73 % |
83 % |
16 мес, жив, без прогрессирования/ 16 months, alive, without progression |
|
М., 62 года/ М., 62 years |
Гиперпаратиреоз/ Hyperparathyroidism |
Бедренна я кость/ Femur |
7 |
3 |
40 % |
83 % |
20 мес, жив, без прогрессирования/ 20 months, alive, without progression |
|
Ж., 67 лет/ W., 67 years |
Рак молочной железы/ Breast cancer |
Плечевая кость/ Humerus |
6 |
2 |
73 % |
83 % |
14 мес, жива, прогрессирование (скелет)/ 14 months, alive, progression (skeleton) |
Окончание таблицы/end of table
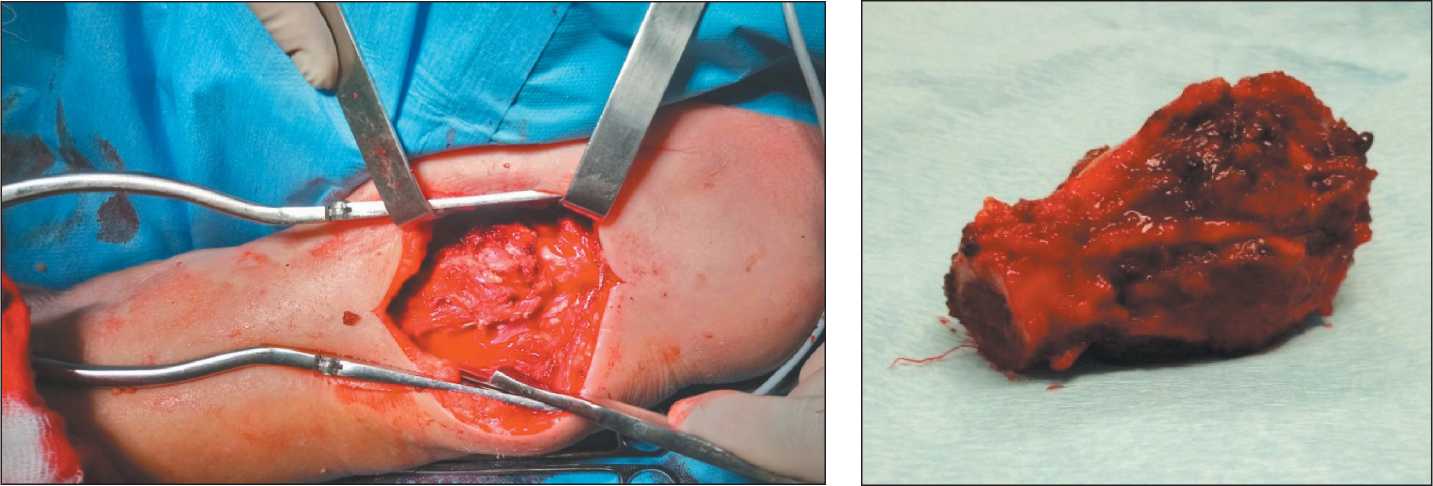
Рис. 4. Удаленный препарат
Fig. 4. Surgical resection specimen
Рис. 3. Пострезекционный дефект
Fig. 3. Post-resection defect
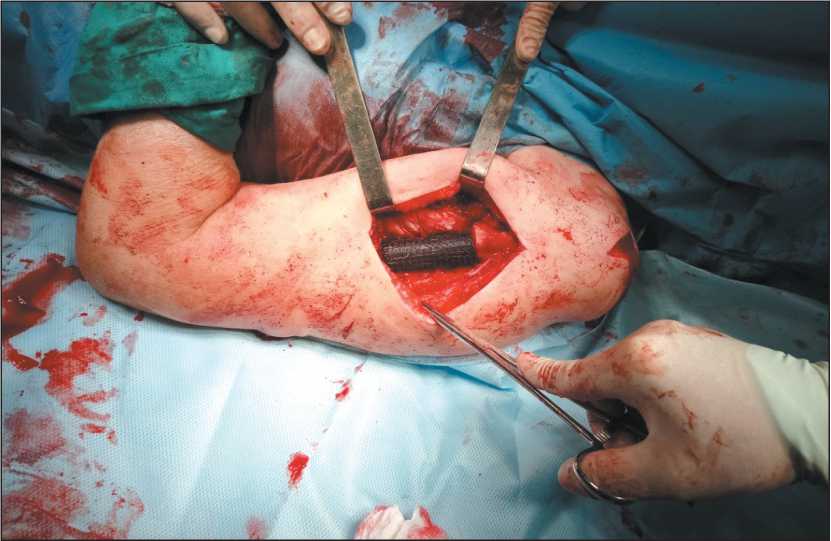
Рис. 5. Реконструктивный этап
Fig. 5. Reconstruction of postoperative defect
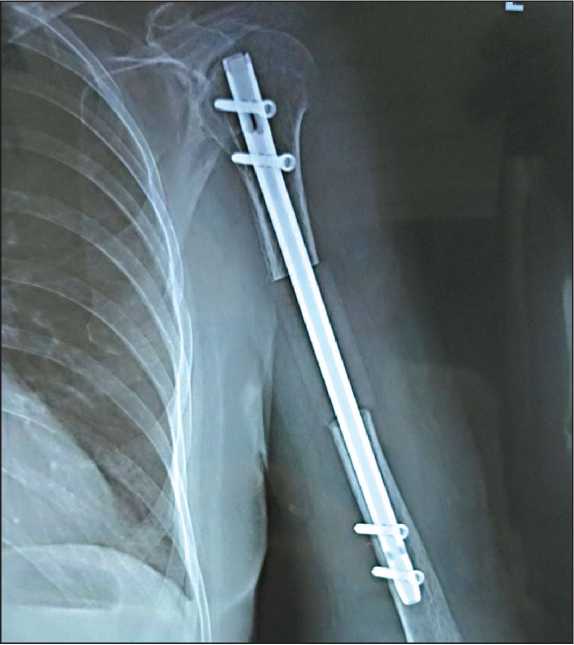
Рис. 6. Рентгенограмма после операции
Fig. 6. X-ray after surgery
2 – в области проксимального эпиметафиза, 2 – в нижней трети диафиза плечевой кости (рис. 5). Рана послойно ушита с оставлением дренажа. Послеоперационное течение гладкое, дренаж удален на 3-и сут. С 7-х сут начаты реабилитационные мероприятия. В раннем послеоперационном периоде пациентка отмечала умеренный болевой синдром, купируемый введением НПВС. К моменту выписки (10-е сут) движения в плечевом суставе незначительно ограничены за счет сохраняющегося незначительного болевого синдрома, в локтевом суставе движения в полном объеме. В последующем назначена иммунотерапия, отмечена стабилизация заболевания. Период наблюдения – 8 мес. Функциональный результат хороший (MSTS – 80 %). Рентгенологически система стабильна (рис. 6).
Заключение
Выполнение резекционных операций с реконструктивным этапом при метастазах диафизарной локализации показано в случае солитарных метастазов рака молочной железы, почки, толстой и прямой кишки, меланомы кожи, при хорошем онкологическом прогнозе заболевания и удовлетворительном соматическом статусе пациента, а также при первичных злокачественных опухолях костей в качестве метода выбора на этапе оперативного лечения. Оперативное вмешательство обеспечивает удовлетворительный локальный контроль заболевания, а также хорошие функциональные результаты. Углеродные наноструктурные имплантаты позволяют реконструировать костные дефекты различной протяженности, также с возможностью использования металлоконструкций и различных способов закрытия дефектов мягких тканей. Имплантаты не вызывают реакции отторжения. При обеспечении плотного контакта имплантата с костью в последующем происходит формирование костно-углеродного блока, способствующего стабильности имплантата. Наличие в организме пациента углеродного наноструктурного имплан- тата не является противопоказанием для любого системного противоопухолевого лечения, а также
Список литературы Реконструкция послеоперационного дефекта углеродным наноструктурным имплантатом с интрамедуллярным остеосинтезом после резекции длинных трубчатых костей по поводу первичных и метастатических опухолей
- Coleman R.E. Skeletal complications of malignancy. Cancer. 1997; 80(8): 1588-94. doi: 10.1002/(sici)1097-0142(19971015)80:8+(1588::aid-cncr9)3.3.co;2-z. PMID: 9362426.
- Ebeid W., Amin S., AbdelmegidA., Refaat Y., GhoneimyA. Reconstruction of distal tibial defects following resection of malignant tumours by pedicled vascularised fibular grafts. Acta Orthop Belg. 2007; 73(3): 354-9.
- Eneking W.F., Dunham W., Gebhardt M.C., Malawar M., Prit-chard D.J. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop Relat Res. 1993; (286): 241-6.
- Gebert C., Hardes J., Hoffmann C., Winkelmann W., Gosheger G. Options for surgical treatment of malignant bone tumors. Chirurg. 2002; 73(12): 1162-9. doi: 10.1007/s00104-002-0565-7.
- Gokaraju K., Sri-Ram K., Donaldson J., Parratt M.T., Blunn G.W., Cannon S.R., Briggs T.W. Use of a distal radius endoprosthesis following resection of a bone tumour: a case report. Sarcoma. 2009. doi: 10.1155/2009/938295.
- Gutowski C.J., BAsu-Mallick A., Abraham J.A. Management of bone sarcoma. Surg Clin North Am. 2016; 96(5): 1077-1106. doi: 10.1016/j. suc.2016.06.002.
- HatanoH., Morita T., Kobayashi H., Otsuka H. A ceramic prosthesis for the treatment of tumours ofthe distal radius. J Bone Joint Surg Br. 2006; 88(12): 1656-8. doi: 10.1302/0301-620X.88B12.17989.
- Kabukcuoglu Y., Grimer R.J., Tillman R.M., Carter S.R. Endopros-thetic replacement for primary malignant tumors of the proximal femur. Clin Orthop. 1999; 358: 8-14.
- Marcove R.C., Lewis M.M., Rosen G., Huvos A.G. Total femur replacement. Compr Ther. 1977 Feb; 3(2):13-19.
- MaruthainarN., Zambakidis C., Harper G., CalderD., Cannon S., Briggs T. Functional outcome following excision of tumors of the distal radius and reconstruction by autologous non-vascularized osteoar-ticular fibula grafting. J Hand Surg. 2002; 27(2): 171-4. doi: 10.1054/ jhsb.2001.0707.
- McGrath A., Sewell M.D., Hanna S.A., Pollock R.C., Skinner J.A., Cannon S.R., Briggs T. W.R. Custom endoprosthetic reconstruction for malignant bone disease in the humeral diaphysis. Acta Orthop Belg. 2011; 77(2): 171-9.
- Niu X.H., Hao L., Zhang Q., Ding Y. Massive allograft replacement in management of bone tumors. Zhonghua Wai Ke Za Zhi. 2007; 45(10): 677-80.
- Sewell M.D., Hanna S.A., McGrath A., Aston W.J.S., Blunn G.W., PollockR.C., Skinner J.A., CannonS.R., BriggsT.W.R. Intercalary diaphyseal endoprosthetic reconstruction for malignant tibial bone tumors. J Bone Joint Surg Br. 2011; 93(8): 1111-7. doi: 10.1302/0301-620X.93B8.25750.
- Sewell M.D., Spiegelberg B.G.I., Hanna S.A., Aston W.J.S., Meswania J.M., Blunn G.W., Henry C., Cannon S.R., Briggs T.W.R. Non-invasive extendible endoprostheses for limb reconstruction in skeletally-mature patients. J Bone Joint Surg Br. 2009; 91(10): 1360-5. doi: 10.1302/0301-620X.91B10.22144.
- Shalaby S., Shalaby H., Bassiony A. Limb salvage for osteosarcoma of the distal tibia with resection arthrodesis, autogenous fibular graft and Ilizarov external fixator. J Bone Joint Surg Br. 2006; 88(12): 1642-6. doi: 10.1302/0301-620X.88B12.17879.
- Shekkeris A.S., Hanna S.A., Sewell M.D., Spiegelberg B.G.I., Aston W.J.S., Blunn G.W., Cannon S.R., Briggs T.W.R. Endoprosthetic reconstruction of the distal tibia and ankle joint after resection of primary bone tumors. J Bone Joint Surg Br. 2009; 91(10): 1378-82. doi: 10.1302/0301-620X.91B10.22643.
- Алиев М.Д. Становление и современное состояние отечественной онкологической ортопедии. Вопросы онкологии. 2005; 3: 283-7. [Aliev M.D. Formation and current state of domestic oncological orthopedics. Problems in Oncology. 2005; 3: 283-7. (in Russian)].
- Алиев М.Д., Соколовский В.А., Дмитриева Н.В., Синюкова Г.Т., Сычева Л.Ю., Амирасланов А.А., Мистакопуло Н.Ф. Осложнения при эндопротезировании больных с опухолями костей. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2003; 14(2): 35-39. [Aliev M.D., Sokolovsky V.A., Dmitrieva N.V., Sinyukova G.T., Sycheva L.Yu., Amiraslanov A.A., Mistakopulo N.F. Complications during endoprosthet-ics in patients with bone tumors. Bulletin of the N.N. Blokhin Russian Academy of Medical Sciences. 2003; 14 (2): 35-39. (in Russian)].
- Алиев М.Д., Тепляков В.В., Каллистов В.Е., Валмев А.К., Трапезников Н.Н. Современные подходы к хирургическому лечению метастазов злокачественных опухолей в кости. Практическая онкология. 2001; 1(5): 39-43. [AlievM.D., Teplyakov V.V., Callistov V.E., Valmev A.K., Trapeznikov N.N. Modern approaches to the surgical treatment of bone metastases of malignant tumors. Practical Oncology. 2001; 1(5): 39-43. (in Russian)].
- ВагнерЕ.А., ДенисовА.С., СкрябинВ.Л. Углеродный материал нового поколения в эндопротезировании костей и суставов. Пермь, 1993. 64 с. [Wagner E.A., Denisov A.S., Skryabin V.L. New generation carbon material in endoprosthetics of bones and joints. Perm, 1993. 64 p. (in Russian)].
- Залуцкий И.В. Реконструктивная и пластическая хирургия в клинической онкологии. Минск, 2007, 252 с. [Zalutsky I.V. Reconstructive and plastic surgery in clinical oncology. Minsk, 2007, 252 p. (in Russian)].
- Зацепин С.Т. Сохранные операции при опухолях костей. М., 1984. С. 82-144, 154-203, 206-215. [Zatsepin S.T. Preservation operations for bone tumors. Moscow, 1984. P. 82-144, 154-203, 206-215. (in Russian)].
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2019 году. М., 2020. 236 с. [Kaprin A.D., Starinskiy V.V., Petrova G.V The state of cancer care for the population of Russia in 2019. Moscow, 2020. 236 p. (in Russian)].
- Литвинов С.Д. Наноразмерный композитный материал «ЛитАр» - универсальный имплантат. Самара, 2008. 250 с. [Litvi-nov S.D. Nano-sized composite material «LitAR» is a universal implant. Samara, 2008. 250 p. (in Russian)].
- Махсон А.Н., Щупак М.Ю. Принципы хирургических вмешательств адекватной терапии больных с опухолями бедренной кости. Настоящее и будущее костной патологии. М., 1997: 61-62. [Makhson A.N., Shchupak M.Yu. Principles of surgical interventions for adequate therapy of patients with femoral tumors. Present and future of bone pathology. Moscow, 1997: 61-62. (in Russian)].
- Скрябин В.Л., Денисов А.С. Использование углеродных на-ноструктурных имплантатов для замещения пострезекционных дефектов при опухолевых и кистозных поражениях костей. Клинические рекомендации. Пермь, 2014. 17 с. [Skryabin V.L., Denisov A.S. The use of carbon nanostructured implants to replace post-resection defects in tumor and cystic bone lesions. Clinical guidelines. Perm, 2014: 17 p. (in Russian)].
- Соловьев Ю.Н. Новые нозологические формы в классификации опухолей костей. Архив патологии. 1998; 60(4): 57-61. [Soloviev Yu.N. New nosological forms in the classification of bone tumors. Archive of Pathology. 1998; 60 (4): 57-61. (in Russian)].
- СтоляровВ.И., КолосовА.Е., Кастельянос Х.Э. Сберегательные операции и прогноз при саркомах мягких тканей и костей. Ленинград, 1991. 160 с. [Stolyarov V.I., Kolosov A.E., Castellanos H.E. Savings operations and prognosis for soft tissue and bone sarcomas. Leningrad, 1991. 160 p. (in Russian)].
- Сушенцов Е.А., Соколовский В.А., Кабардаев Р.М. Дзам-паев А.З., КубировМ.С., Николаев А.П. Эндопротезирование диафизар-ных дефектов при опухолях костей. Саркомы костей, мягких тканей и опухоли кожи. 2014; 3-4: 20-25. [Sushentsov E.A., Sokolovsky V.A., KabardaevR.M., DzampaevA.Z., KubirovM.S., NikolaevA.P. Endoprosthetics of diaphyseal defects in bone tumors. Sarcomas of Bones, Soft Tissues and Skin Tumors. 2014; 3-4: 20-25. (in Russian)].
- Тепляков В.В., Карпенко В.Ю., Франк Г.А., Буланов А.А., Державин В.А., ШаталовА.М. Эндопротезирование при опухолевом поражении длинных костей. Российский онкологический журнал. 2009; 5: 11-15. [Teplyakov V.V., Karpenko V.Yu, Frank G.A., BulanovAA, Derzhavin V.A., Shatalov A.M. Endoprosthetics for tumor lesions of long bones. Russian Journal of Oncology. 2009; 5: 11-15. (in Russian)].
- Тяжелов О.А., Акушина Н.А., Иванов Г.В. Оценка биосовместимости углерод-углеродного композиционного материала в экспериментах. Ортопедия, травматология и протезирование. 2006; 4: 47-50. [Tyazhelov O.A., Akushina N.A., Ivanov G.V. Evaluation of the biocompat-ibility of a carbon-carbon composite material in experiments. Orthopedics, Traumatology and Prosthetics. 2006; 4: 47-50. (in Russian)].
- Чиссов В.И., Алиев М.Д., Семиглазов В.Ф. Сберегательные и органосохраняющие операции при злокачественных опухолях костей и мягких тканей. СПб., 2004. [Chissov V.I., AlievM.D., Semiglazov V.F. Savings and organ-preserving surgeries for malignant tumors of bones and soft tissues. St. Petersburg, 2004. (in Russian)].
- ШугабейкерХ., МалауэрМ.М. Хирургия сарком мягких тканей и костей. М., 1996: 84-5. [ShugabakerH., MalauerM.M. Surgery for soft tissue and bone sarcomas. Moscow, 1996: 84-5. (in Russian)].


