Реконструкция шейных позвонков остеозамещающими материалами при переломах
Автор: Алексанян М.М., Микаелян К.П., Хейло А.Л., Макаров С.А., Аганесов А.Г.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 3 (29), 2017 года.
Бесплатный доступ
Цели: оценить клиническую эффективность и безопасность применения коралл-основанного трабекулярного гидроксиапатитового остеозамещающе- го материала «Bonemedik» при переломах позвонков в шейном отделе позвоночника.Материалы и методы: в работе представлены результаты хирургического лечения 89 пациентов с травмами шейного отдела позвоночника с приме- нением коралл-основанного остеозамещающего материала «Bonemedik», проведенного с 2010 по 2016 годы, период наблюдения составил от 1,4 до 7,3 лет. Во всех случаях проводился декомпрессивный этап операции, дефект костной ткани заполнялся остеозамещающим материалом, проводилась фиксация пластиной. Для оценки реорганизации исполь-зованного материала применялась компьютерная томография, плотность ткани измерялась в еденицах Ха- унсфилда.Результаты: во всех случаях выявлен плотный контакт в зоне имплантации. Плотность костной ткани в зоне контакта соответствовала критериям выраженной остеоинтеграции (разница плотности кости в зоне контакта имплант-кость составляла 2-9%), отсутствовали зоны просветления в местах контакта имплант-кость.Вывод: материал на основе коралла «Bonemedik» является эффективным и безопасным материалом для замещения дефектов костной ткани при опера- тивных вмешательствах в шейном отделе позвоночника.
Переломы шейных позвонков, замещение костной ткани, заместители костной ткани
Короткий адрес: https://sciup.org/142212785
IDR: 142212785 | УДК: 617.547
Текст научной статьи Реконструкция шейных позвонков остеозамещающими материалами при переломах
В настоящее время переломы шейного отдела позвоночника являются распространенной проблемой. В 2011 году в США около 730 тыс. человек получили переломы позвоночника, что составило около 2,0% от всех травм. [1]
Распространенность переломов позвонков в России составила 3,3% от всех переломов костей опорно-двигательной системы, при частоте 70,9 на 100000 населения в год. Повреждения шейного отдела составляют 20-30% всех переломов позвонков, 10-20% которых осложняются повреждением спинного мозга. Основными этиологическими факторами повреждений шейного отдела позвоночника у 75,7% взрослых и у 60,5% детей являются дорожно-транспортные происшествия, падения и повреждения ныряльщиков. [2]
Ежегодно проводится большое количество оперативных вмешательств по поводу травм шейного отдела позвоночника, целью оперативного вмешательства является декомпрессия невральных структур, а также стабилизация сегментов. Часто применяется дискэктомия, корпорэктомия из переднего доступа с последующей фиксацией тел позвонков имплантами. Используются пластины и межпозвонковые кейджи различных модификаций, а также костнозамещающие методики при необходимости замещения костной ткани. Ежегодно в мире выполняется около 4 млн. [3] операций с использованием остеозаме- щающих материалов, при этом их спектр постоянно активно расширяется благодаря разработке новых биоматериалов.
Идеальный заместитель костной ткани должен обладать остеоинтегративными, остеоиндуктивными, остеокондуктив-ными и остеогенными свойствами, а также опорной функцией, но, к сожалению, материал, отвечающий всем требованиям, отсутствует, хотя в настоящий момент времени ведутся работы над его созданием. [4]
Гистологическое определение термина «остеоинтеграция» приводится в словаре Dorland: прямая якорная фиксация имплантата посредством формирования костной ткани вокруг него без развития фиброзной ткани на границе «имплантат – кость». [5] Также существует биомеханическое определение остеоинтеграции, которое демонстрирует лишь клинический результат имплантации: процесс, посредством которого достигается жесткая фиксация пластического материала и удерживается в кости при функциональной нагрузке. [6] Как следует из определений, под остеоинтеграцией подразумевается процесс, при котором на микроскопическом уровне костная ткань и имплант так контактируют друг с другом, что в зоне контакта нет разграничивающей соединительно-тканной капсулы. [7]
«Золотым стандартом» при этих операциях до настоящего времени считалось применение костного аутотрансплантата, т.к. он обладает в большей мере всеми необходимыми свой- ствами. В то же время, применение аутотранспланата сопровождается определёнными сложностями. Забор ткани (в основном из крыла подвздошной кости) требует проведения еще одной операции, что увеличивает общую продолжительность вмешательства. Это приводит к дополнительной травматиза-ции, появлению еще одного локуса боли в послеоперационном периоде, возможным инфекционным осложнениям, дополнительной кровопотери. Осложнения в области забора, по разным данным, достигают 20-30 % [8, 9] и, разумеется, снижают качество жизни и результаты лечения пациента. Также аутотрансплантат не может быть использован при снижении минеральной плотности костной ткани и остеопорозе (особенно среди пожилых лиц), онкологических процессах, а также при ранее выполненных заборах. [10] Отягчающими факторами являются сопутствующие заболевания, такие как сахарный диабет, ишемическая болезнь сердца, сосудистая патология. Размер аутотрансплантата ограничен (составляет около 20 см3). При использовании аутологичной кости в ортотопических и эктотопических локациях отмечался лизис трансплантата. [8]
По всем этим причинам в последнее время широкое распространение получила практика применения алло-, ксенотрансплантатов, синтетических полимеров, композитных материалов. При их использовании нет необходимости в нанесении дополнительной травмы, большинство заместителей костной ткани обладают остеокондуктивными свойствами, и, в меньшей мере, остеоиндуктивными. Костные аллотрансплантаты обладают хорошими остеокондуктивными свойствами, но отличаются слабыми остеоиндуктивными свойствами и медленной остеоинтеграцией, риском передачи инфекции, возможностью развития несовместимости, а также низкой прочностью. [11] Синтетические заменители костной ткани обладают большей стабильностью, чем аутологичные трансплантаты [12], что особенно актуально у пациентов с протяженными костными дефектами. В мировой литературе существует множество исследований, посвященных синтетическим заместителям костной ткани, а также их применению в комбинации с различными человеческими костными морфогенетическими протеинами, гидроксиапатитом, трикальцийфосфатом, коллагеном. Данные методики рассматриваются как альтернативы применению аутологичной костной ткани. [8,9,13]
Результаты имплантации деминерализованного костного матрикса сильно различаются и зависят от производителя и партии материала. Керамические заместители являются перспективной группой, особенно в сочетании с аспиратами из костного мозга, т.к. обладают выраженными остеокондуктив-ными, достаточными индуктивными свойствами и хорошей опорной функцией. Также в настоящий момент активно изучается группа рекомбинантных костных морфогенетических протеинов. Именно эта группа препаратов наиболее близка к «свержению аутокости с трона», но отдаленные результаты их использования до сих пор недостаточно исследованы. Аутологичные факторы роста и обогащенная тромбоцитами плазма не оправдали возлагаемых надежд в формировании костной ткани: в сравнительном исследовании применения изолированно аутокости и аутокости с применением данных методик не было выявлено разницы в образовании костной ткани. Данные о препаратах на основе стволовых клеток и синтетических пептидах пока еще крайне скудны. [11] Таким образом к настоящему моменту отсутствуют достоверные данные о сравнительных результатах использования различных заместителей костной ткани между собой и в сравнении с аутографтом.
Monish et al. провел исследование, в котором выявил большую удовлетворенность пациентов операциями с использованием аллогенных имплантов, т.к. уровень боли в послеоперационном периоде и длительность пребывания в стационаре были ниже. [9]
Jung-Chul Park et al. в своем гистологическом исследовании на кроликах указал, что применение комбинаций двухфазного фосфата кальция (гидроксиапатита с трикальция фосфатом и гидроксиапатита с содержанием кремния с трикальция фосфатом) продемонстрировало удовлетворительную опорную функцию и вызвало образование значительной массы костной ткани по сравнению с применением аутокости в сроки 4 и 8 недель с момента имплантации. [14]
Напротив, Zamzuri Zakaria et al. в своем исследовании на кроликах, которым проводилась фиксация поперечных отростков изолированно аутологичной костью и ее комбинацией с гидроксиапатитом, говорит о том, что аутологичная кость имеет преимущества над гранулами гидроксиапатита. Гранулы показали отличные остеокондуктивные свойства, но слабую биодеградацию. Несмотря на это, гранулы гидроксиапатита, в комбинации с обогащенной тромбоцитами плазмой или без, могут быть использованы с хорошим клиническим эффектом. [13]
В исследовании Ho-JungChung et al. на 20 пациентах, которым выполнена передняя дискэктомия и стабилизация на шейном уровне, показал, что применение полимерных кейджей с деминерализованным костным матриксом при фиксации позвонков в шейном отделе является весьма эффективной альтернативой золотому стандарту с использованием аутокости, т.к. отмечен хороший уровень фиксации и ремоделирования, а также более низкий уровень боли в послеоперационном периоде. [15]
В настоящее время существует множество различных вариантов заменителей костной ткани, доступных к применению в хирургии. Различия в их строении, химических и физических свойствах крайне важны, т.к. имеют прямое влияние на реакцию тканей организма. [16] Интенсивные фундаментальные исследования и клиническое применение синтетических кальций-фосфатных боиматериалов показали, что данные материалы являются биосовместимыми и остеокондуктивными, способствующими образованию новой костной ткани на их поверхности. Эти материалы по своему составу близки к костной ткани человека и индуцируют реакции, схожие с ремоделированием кости. [3] Во время резорбции кальций-фосфатные материалы деградируют до продуктов (йоны кальция и фосфатов), которые естественно метаболизируются и не индуцируют повышения уровня кальция и фосфатов в моче, сыворотке или внутренних органах. [7]
Для баланса роста костной ткани и абсорбции импланта необходима двойная макро-микропористость (что отмечается крайне редко среди современных заместителей костной ткани), которая приводит к миграции клеток и ангиогенезу, что предшествует эктопическому костеобразованию. Общая пористость материала 90 % и размер пор более 100 мкм благоприятны для проникновения клеток в материал и врастания сосудов. [17] Увеличение количества микропор и уменьшение размеров кристаллов имплантатов способствует увеличению реактивной поверхности и индуктивной активности. [3] Хорошо известно, что материалы, не обладающие порозностью, не имеют индуктивных свойств.
Некоторые биоматериалы имеют гетерогенную микроструктуру, что приводит к неповторимым и невоспроизводимым результатам и трудностям для их клинического применения. При имплантации костнозамещающих материалов отмечаются различия в поверхностных зарядах имплантов, что является важным фактором в механизмах адсорбции белков биологических жидкостей, а значит и клеточного ответа. Для понимания данных процессов необходимо дальнейшее изучение проблемы. [16]
Одним из множества заместителей костной ткани является гидроксиапатитовый материал «Bonemedik». В исследовании на 16 новозеландских кроликах, которым имплантировались гранулы «Bonemedik-DM» в теменные кости, гранулы были интегрированы в окружающую костную ткань и резорбированы в процессе ремоделирования через 4 недели. Области частиц четко визуализировались, вокруг отмечалось образование новой костной ткани в различном объеме, при этом не выявлено капсулы, сформированной фиброзной соединительной тканью. [14]
По данным других авторов, гранулы на основе гидроксиапатита способны к остеоинтеграции, которая обеспечивается якорным врастанием костной ткани в поверхностные поры имплантатов. Ими был проведен эксперимент на 6 беспородных собаках, которым проводилась имплантация гидроксиапатитовых гранул «Bonemedik-S» в тела поясничных позвонков; через 6 мес. после имплантации пластического материала в пространство между гидроксиапатитовыми гранулами в сформированном дефекте тела позвонка образовалась зрелая трабекулярная костная ткань. (рис.1) На границе между костной тканью и гидроксиапатитовыми гранулами соединительнотканная капсула отсутствовала. [7] (рис.2)
При проведении анализа лечения 39 пациентов с повреждениями шейного отдела позвоночника с применением остеозамещающего материала Bonemedik-S не было выявлено эпизодов остеолиза, миграции, склероза контактной поверхности. Не было выявлено полной деградации. Во всех случаях отмечен плотный контакт имплантата с костью, что соответствует остеоинтеграции. Осложнений, связанных с оперативным вмешательством, не выявлено. Наличие кремния в составе импланта на основе гидроксиапатита является важным фактором в формировании костной ткани. [18]

Рис. 1. Электронная микрофотография поверхности распила тела позвонка беспородной собаки и имплантированными гранулами (41 кратное увеличение) спустя 6 месяцев после имплантации. Отмечается прямой контакт костной ткани и имплантированных гранул

Рис. 2. Электронная микрофотография поверхности распила тела позвонка и имплантированными гранулами (500 кратное увеличение, материал особи 30). Спустя 6 месяцев после имплантации в тело поясничного позвонка беспородной собаки. Отмечается прямой контакт костной ткани и имплантированных гранул
Множество исследований с положительными оценками делает данный имплант весьма привлекательным для изучения и применения.
Материалы и методы
В клинике хирургии позвоночника в период с 2010 по 2016 годы было оперировано 89 пациентов по поводу различных травм шейного отдела позвоночника (наблюдались переломы типа A2, A3, A4, B2, B3, C по классификации AO/ASIF). В качестве остеозамещающего препарата применялся кораллоснованный трабекулярный (поры размером около 400 мкм) гидроксиапатитовый (не менее 95%) остеоза-мещающий материал «Bonemedik-S» с небольшим (до 1%) включением кремния в состав. Средний возраст пациентов составил 42 года (от 22 до 73 лет), среднее время наблюдения 4,3 года (от 1,4 до 7,3 лет). Все пациенты были разделены на мужчин и женщин (52 и 37, соответственно), и по возрасту до 35 лет (39 и 25, соответственно) и после 35 лет (13 и 12, соответственно). Для оценки остео- интеграции и результатов оперативного вмешательства применялся стандартный рентгенологический метод, при котором использовались стандартная рентгенография, компьютерная томография. Плотность костной ткани измерялась в единицах Хаунсфилда.
Таблица 1
Половозрастные характеристики пациентов и сроки наблюдения
|
Пол |
Мужчины |
Женщины |
||
|
Возраст |
до 35 |
после 35 |
до 35 |
после 35 |
|
Срок наблюдения |
4,48±0,37 |
4,03±0,31 |
4,11±0,29 |
4,71±0,33 |
Оперативные вмешательства выполнены по поводу осложненных (14 случаев), которые сопровождались неврологическими нарушениями, и неосложненных (75 случаев) переломов в шейном отделе позвоночника. Во всех случаях выполнялся передний доступ к шейному отделу позвоночника, частичная или тотальная корпорэктомия, декомпрессия позвоночного канала, установка остеозамещающего импланта в месте дефекта (рис. 3), фиксация пластиной для достижения спондилодеза.
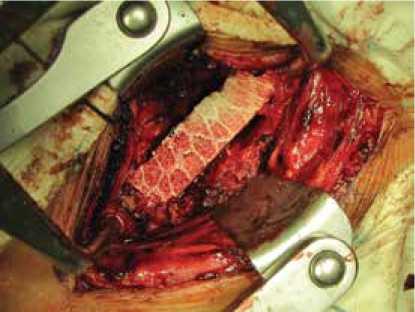
Рис. 3. Пример установки заместителя костной ткани «Bonemedik» после корпорэктомии
После вмешательства отмечено купирование, или, по крайней мере, облегчение симптомов. Осложнений, связанных с оперативным вмешательством, установленным имплантом и пластиной, выявлено не было.
Всем пациентам проводилось рентгенологическое исследование через 6 недель, 6 и 12 месяцев, далее каждый год компьютерная томография.
Результаты
По результатам компьютерной томографии во всех случаях выявлена качественная интеграция костного материала и его частичная деградация. Для оценки остеоинтеграции выполнялось сравнение плотности в зоне контакта импланта с нормальной костной тканью с плотностью костной ткани соседнего позвонка, а также выявлялись критерии интеграции: четкий контакт импланта с костью реципиента, отсутствие зоны просветления в области контакта. Для оценки деградации плотность ткани в области импланта сопоставлялась с плотностью ткани соседнего позвонка.
Во всех случаях выявлен плотный контакт реципиент-имплант. Разницы в плотности кости составляла 2-9%, что соответствовало критериям остеоинтеграции.
Таблица 2
Результаты измерений плотности костной ткани
|
Пол |
Мужчины |
Женщины |
||
|
Возраст (год) |
до 35 |
после 35 |
до 35 |
после 35 |
|
Плотность костной ткани в месте имплантации (HU) |
952±325 |
832±218 |
827±211 |
821±232 |
|
Плотность костной ткани в зоне контакта имплантат-кость (HU) |
593±180 |
585±178 |
579±176 |
553±168 |
|
Плотность костной ткани в соседнем позвонке (имплантационная зона) (HU) |
541±160 |
548±179 |
528±165 |
497±161 |
|
Плотность костной ткани в соседнем позвонке (зона контакта имплантат-кость) (HU) |
552±169 |
563±182 |
557±223 |
518±159 |
|
Разница HU (%) (имплантат) |
79 |
48 |
54 |
72 |
|
Разница HU (%) (зона контакта имплантат-кость) |
9 |
6 |
2 |
7 |
У всех больных в результате проведенного оперативного вмешательства достигнут спондилодез. За время наблюдения (1,4-7,3 лет) не было отмечено осложнений, связанных с разрушением импланта или металлофиксатора, развитием локального или системного воспаления.
Так же в ходе работы было отмечено, что материал «Bonemedik» удобен для моделирования в операционной, обладает высокой прочностной и опорной функцией.
Клинический пример.
Пациент Б. 25 лет, травму получил 28.06.2011 г. в результате удара головой о дно водоема. Был доставлен в центральную районную больницу по месту травмы, где получал консервативное лечение. 01.01.2011 г. доставлен в отделении хирургии позвоночника, где установлен диагноз: осложненный перелом тела и дуги 6 шейного позвонка (рис. 4). Нижняя параплегия, верхний парапарез. Нарушение функции тазовых органов.
В тот же день выполнено оперативное вмешательство: субтотальная резекция тела 6 шейного позвонка. Декомпрессия спинного мозга. Установка остеозамещающего импланта «Bonemedik» С5-С7, фиксация пластиной С5-С7. Пациент ежегодно после операции являлся на контрольные осмотры (рис. 5). Отмечается полное восстановление функции.
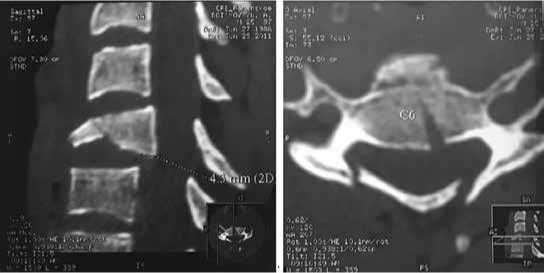
Рис. 4. Компьютерная томография пациента Б. при поступлении
Обсуждение
По результатам исследования, при проведении контрольных компьютерных томографий и измерении плотности ткани в области импланта и смежных позвонков, отмечалось ремоделирование до 60-70% импланта, но не выявлена полная деградация и перестройка в зоне имплантации. Также выявлен плотный контакт импланта с костной тканью без зон просветления, не было ни одного эпизода склерозирования контактной поверхности кости реципиента. Данные результаты свидетельствуют о присутствии индуктивных и кондуктивных свойств материала «Bonemedik», а также биосовместимости.
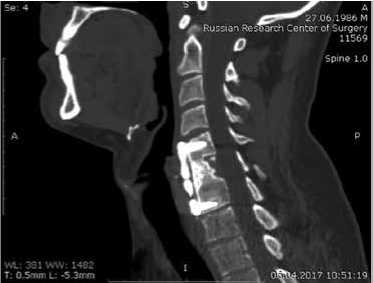
При анализе материала не было выявлено ни одного случая деформации или миграции импланта, из чего можно сделать вывод о том, что данный материал обладает хорошей опорной функцией. Во всех случаях после оперативного лечения и установки импланта достигнут спондилодез.
Вывод
Таким образом, материал на основе коралла «Bonemedik» является эффективным и безопасным материалом для замещения дефектов костной ткани при оперативных вмешательствах на шейном отделе позвоночника и является хорошей альтернативой применению аутотрансплантатов и костных аллотрансплантатов в травматологии и ортопедии. «Bonemedik» обладает выраженными остеокондуктивными и остеоиндуктивными свойствами, хорошей биосовместимостью. Остеоинтегратив-ные свойства также оказались удовлетворительными – через 6 лет после имплантации выявлено неполное ремоделирование импланта (до 70%). Обладает хорошей опорностью.
Список литературы Реконструкция шейных позвонков остеозамещающими материалами при переломах
- National Hospital Ambulatory Medical Care Survey: 2011 Emergency Department Summary Tables. S. 59-61
- Миронов С. П., Котельников Г. П. Национальное руководство по травматологии. 2011 стр.799-802 Mironov S.P., Kotelnikov G.P. National guidelines of traumatology.//2011. pp.799-802
- Берченко Г. Н. Синтетические кальций-фосфатные материалы в травматологии и ортопедии. Сборник работ Всероссийской научно-практической конференции. М., 2010.стр. 3-5. Berchenko G.N. Synthetic calcium-phosphate materials in traumatology and orthopedics.//Sbornik rabot Vserossiyskoy nauchno-prakticheskoy konferentsii М., 2010.pp. 3-5.
- Jared M. Theler. Bone tissue substitutes and replacements Current Opinion Otolaryngology, Head and Neck Surgery. 2011 Aug;19(4):317-322 DOI: 10.1097/MOO.0b013e32834883f2
- Albrektsson T, Johansson C. Osteoinduction, osteoconduction and osseointegration. Eur Spine J. 2001; 10(Suppl 2): S96-S101 DOI: 10.1007/s005860100282
- Zarb G, Albrektsson T. Osseointegration -a requiem for the periodontal ligament? Editorial. Int. J. Periodont. Res. Dent. 1991; 11: 88-91.
- Рерих В.В., Аветисян А.Р., Зайдман А.М., Ластевский А.Д., Батаев В.А., Никулина А.А. Остеоинтеграция гидроксиапа- титовых гранул в телах поясничных позвонков в экспери- менте. //Хирургия позвоночника. - 2013. - №4. - С. 43-51. Rerikh V.V., Avetisyan A.R., Zaydman A.M., Lastevskiy A.D., Bataev V.A., Nikulina A.A. Experimental osseointegration of hydroxyapatite granules un the lumbar vertebral bodies. // Khirurgiya pozvonochnika. - 2013. - №4. - pp. 43-51.
- Cho D.Y., Liau W. R., Lee W. Y. et al. Preliminary experience using a polyetheretherketone (PEEK) cage in the treatment of cervical disc disease. Neurosurgery 2002;51:1343-49; discussion 1349-50
- Monish M. Maharaj, Kevin Phan, Ralph J. Mobbs. Anterior cervical discectomy and fusion (ACDF) autograft versus graft substitutes: what do patients prefer?-A clinical study J. Spine Surgery 2016; 2(2): 105-110 DOI: 10.21037/jss.2016.05.01
- Kyung-Hyun Kim, Jeong-Yoon Park, Hyo-Suk Park et al. The Influences of Different Ratios of Biphasic Calcium Phosphate and Collagen Augmentation on Posterior Lumbar Spinal Fusion in Rat Model.//Yonsei Med J. -2017. -№2. -407-414 DOI: 10.3349/ymj.2017.58.2.407
- Abhijeet Kadam, Paul W Millhouse, Christopher K Kepler et al. Bone substitutes and expanders in Spine Surgery: A review of their fusion efficacies.//Int J Spine Surg. -2016. S.29 DOI: 10.14444/3033
- Fellah B.H., Gauthier O., Weiss P. et al. Osteogenicity of biphasic calcium phosphate ceramics and bone autograft in a goat model. Biomaterials. 2008 Mar; 29 (9):1177-88. Doi: 10.1016/j. biomaterials.2007.11.034
- Zamzuri Zakaria, Che N. Z. C. Seman, Zunariah Buyong et al. Histological Evaluation of Hydroxyapatite Granules with and without Platelet-Rich Plasma versus an Autologous Bone Graft Comparative study of biomaterials used for spinal fusion in a New Zealand white rabbit model.//Sultan Qaboos University Med J. -2016. -№ 4. -422-429 DOI: 10.18295/squmj.2016.16.04.004
- Jung-Chul Park, Hyun-Chang Lim, Joo-Yeon Sohn. Bone regeneration capacity of two different macroporous biphasic calcium materials in rabbit calvarial defect J Korean Acad Periodontol. 2009 Aug;39(Suppl):223-230 doi: 10.21037/jss.2016.05.01
- Ho-Jung Chung, Jung-Woo Hur, Kyeong-Sik Ryu et al. Surgical Outcomes of Anterior Cervical Fusion Using Deminaralized Bone Matrix as Stand-Alone Graft Material: Single Arm, Pilot Study.//Korean J Spine. -2016. №3. -114-119. doi: 10.14245/kjs.2016.13.3.114 T.
- Miramond, P. Borget, S. Baroth, D. Guy, «Comparative Critical Study of Commercial Calcium Phosphate Bone Substitutes in Terms of Physic-Chemical Properties», Key Engineering Materials, Vol. 587, pp. 63-68, 2014 net/KEM.587.63 DOI: 10.4028/www.scientific
- Alexander D, Hoffmann J, Munz A, et al. Analysis of OPLA scaffolds for bone engineering constructs using human jaw periosteal cells. J Mater Sci Mater Med. 2008; 19: 965-974 DOI: 10.1007/s10856-007-3351-8
- Skrtic D, Antonucci JM, Eanes ED, Brunworth RT. Silica and zirconia-hybridized amorphous calcium phosphate: effect on transformation to hydroxyapatite.//J Biomed Mater Res. -2002. -59. -597-604.


