Реконструкция тазового кольца у пациентов с опухолевым поражением крестцово-подвздошного сочленения
Автор: Державин Виталий Андреевич, Карпенко Вадим Юрьевич, Бухаров Артем Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (69), 2015 года.
Бесплатный доступ
Представлен опыт хирургического лечения 10 пациентов с опухолевым поражением крестцовоподвздошного сочленения. Всем пациентам была выполнена реконструкция тазового кольца при помощи полиаксиальных винтов и титановых стержней. Средний возраст больных составил 39 лет (23-59 лет). По морфологическому строению опухоли распределились так: у 6 (60 %) пациентов была хондросаркома и по одному пациенту было с фибросаркомой (10 %), саркомой Юинга (10 %), метастазом рака почки (10 %) и метастазом остеосаркомы (10 %). результаты. Средняя продолжительность операции составила 4,2 ч (3-6 ч). Объем интраоперационной кровопотери в среднем составил 2 800 мл (1500-5000 мл). При микроскопическом исследовании операционного материала положительный край резекции с индексом R1 был выявлен у 2 (20 %) пациентов. Средний период наблюдения составил 18,5 мес (2-40 мес), все прооперированные больные живы без признаков прогрессирования заболевания. Послеоперационные осложнения отмечены у 4 (40 %) пациентов. Средний показатель по шкале MSTS составил 70 % (62-92 %).
Опухоли костей таза, реконструкция, хирургическое лечение
Короткий адрес: https://sciup.org/14056540
IDR: 14056540 | УДК: 616.718.19-006-089.844
Текст научной статьи Реконструкция тазового кольца у пациентов с опухолевым поражением крестцово-подвздошного сочленения
Первичные злокачественные опухоли, локализующиеся в костях таза, составляют от 3 до 6 % всех сарком скелета [5, 29]. Характерной особенностью этих опухолей является экспансивный рост в полость малого таза, ввиду чего клиническое течение продолжительное время может быть бессимптомным. Диагноз обычно устанавливают при выраженном местном распространении опухоли, когда со стороны ее мягкотканного компонента имеется воздействие на сосудисто-нервные структуры малого таза, тазобедренный сустав, мочевой пузырь или прямую кишку. Эти обстоятельства определяют сложность хирургического лечения данной категории больных [1, 24, 26].
Первыми и единственными операциями, которые выполняли при местнораспространенных опухолях костей таза, до середины прошлого столетия были межподвздошно-брюшная ампутация и межподвздошно-брюшная резекция [19]. Эти методики не позволяли достигнуть значимых функциональных, эстетических результатов и адекватной социальной адаптации. С 1960–70-х гг. ХХ века начала развиваться реконструктивная онкохирургия таза, расширившая показания для органосохраняющего лечения при опухолях тазового кольца. Было разработано достаточное количество хирургических техник реконструкции тазового кольца после удаления опухоли [8, 12, 14, 15, 16, 18, 22, 23]. Каждая из них имеет свои преимущества и недостатки, но все характеризуются высоким уровнем послеоперационных осложнений (до
25–53 %), в связи с чем универсальной методики реконструкции костей таза, удовлетворяющей всем онкологическим, хирургическим и функциональным требованиям, до настоящего времени не разработано [14, 15, 17, 28, 30].
Особые сложности возникают при реконструкции тазового кольца при местнораспространенных опухолях крестцово-подвздошного сочленения (КПС). Для обеспечения максимального хирургического радикализма в большинстве случаев необходимо выполнение блоковой резекции КПС с включением костных структур крестца и подвздошной кости, что приводит к нарушению целостности костей таза. Со временем невосстановленная непрерывность тазового кольца приводит к грубым нарушениям биомеханики осевого скелета, вторичному сколиозу, подвывиху лонного симфиза и болевому синдрому [2, 6]. В современной онкоортопедии используется ряд хирургических методик реконструкции КПС с использованием аутографтов, аллографтов и металлостеосинтеза, которые позволяют значимо улучшить функциональные результаты лечения [3, 8, 14, 27]. В данной работе мы представляем наш опыт реконструкции тазового кольца после резекции крестцово-подвздошного сочленения.
Материал и методы
В период с 2011по 2015 г. в отделении онкологической ортопедии МНИОИ им. П.А. Герцена хирургическое лечение в объеме резекции
Таблица
Характеристики прооперированных больных
|
№ пациента |
Возраст, лет |
Диагноз |
Статус |
Химиотерапия |
Лучевая терапия |
Осложнения |
Срок наблюдения, мес |
Срок начала передвижения без опоры, нед |
|
1 |
42 |
Саркома Юинга |
ЖБП |
Да |
Да |
Перелом направляющей |
40 |
4 |
|
2 |
49 |
Хондросаркома |
ЖБП |
Нет |
Нет |
Кровотечение |
39 |
5 |
|
3 |
31 |
Хондросаркома |
ЖБП |
Нет |
Нет |
Нет |
31 |
3 |
|
4 |
23 |
Метастаз остеосаркомы |
ЖБП |
Да |
нет |
Нет |
17 |
3 |
|
5 |
38 |
Фибросаркома |
ЖБП |
Нет |
нет |
Нет |
15 |
3 |
|
6 |
32 |
Хондросаркома |
ЖБП |
Нет |
нет |
Инфицирование |
15 |
3 |
|
7 |
59 |
Метастаз рака почки |
ЖБП |
Нет |
Нет |
Нет |
12 |
5 |
|
8 |
34 |
Хондросаркома |
ЖБП |
Нет |
нет |
Нет |
8 |
5 |
|
9 |
45 |
Хондросаркома |
ЖБП |
Нет |
Нет |
Краевой некроз раны |
6 |
4 |
|
10 |
35 |
Хондросаркома |
ЖБП |
Нет |
Нет |
Нет |
2 |
4 |
Примечание: ЖБП – жив без прогрессирования.
крестцово-подвздошного сочленения с реконструкцией тазового кольца металлостеосинтезом полиаксиальными винтами и титановыми стержнями выполнено 10 пациентам, из них 5 мужчин и 5 женщин. Средний возраст больных – 39 лет (23–59 лет). Распределение по морфологическому строению опухоли: у 6 (60 %) пациентов – хондросаркома, по одному пациенту было с фибросаркомой (10 %), саркомой Юинга (10 %), метастазом рака почки (10 %) и метастазом остеосаркомы (10 %) (таблица). Во всех случаях с первичными злокачественными опухолями клиническая стадия определена как IIb по классификации Enneking [10]. На этапе предоперационного планирования выполнялось комплексное инструментальное обследование: компьютерная томография костей таза и легких, УЗИ брюшной полости, печени, регионарных зон, сцинтиграфия костей, трепан-биопсия с последующим морфологическим исследованием. При необходимости проводилась магнитнорезонансная томография зоны поражения.
С целью снижения объема интраоперационной кровопотери больному с метастазом рака почки перед операцией выполнена селективная эмболизация сосудов, питающих опухоль. Для достижения максимального радикализма всем больным была выполнена парциальная резекция боковых масс крестца. Хирургический доступ осуществлялся от задней верхней подвздошной кости вдоль проекции верхнего края крыла подвздошной кости. При удалении опухоли выполнялась блоковая резекция костей таза с нарушением непрерывности тазового кольца. В края резекции крестцово-подвздошного сочленения, крестца, подвздошной или седалищной костей под рентгенологическим контролем фиксировали от одного до двух полиаксиальных винтов. У 2 пациентов полиаксиальный винт был фикси- рован в тело пятого поясничного позвонка. Далее, интраоперационно при помощи инструментов модулировали длину и геометрию титановых стержней соответственно замещаемому дефекту костной ткани и расположению полиаксиальных винтов. После придания необходимых параметров фиксировали от одного до двух стержней к полиаксиальным винтам краев резецированного тазового кольца (рис. 1, 2). В область металлоконструкции устанавливался один дренаж, который удалялся не позднее 3–4-х сут после операции. Активизация больных проводилась на 5–8-е сут после лечения. Динамическое наблюдение осуществлялось через каждые 3 мес в течение последующих трех лет после операции, далее, через каждые 6 мес, сроком до 5 лет после лечения. Функциональный результат оценивался по шкале Международного общества опухолей опорнодвигательного аппарата MSTS [11].
Результаты
Хирургические результаты
Средняя продолжительность операции составила 4,2 ч (3–6 ч). Объем интраоперационной кровопотери в среднем составил 2 800 мл (1 500–5 000 мл). На 4 операциях для обеспечения адекватной трансфузии собственных компонентов крови использовался аппарат интраоперационного кровосбережения типа «CellSaver». Средняя продолжительность нахождения больного в стационаре после операции – 12 сут (10–25 сут). Продолжительность антибактериальной терапии – 8 сут (5–23 сут).
Онкологические результаты
При микроскопическом исследовании операционного материала положительный край резекции с индексом R1 был выявлен у 2 (20 %) пациентов с высокодифференцированной хондросаркомой G1.
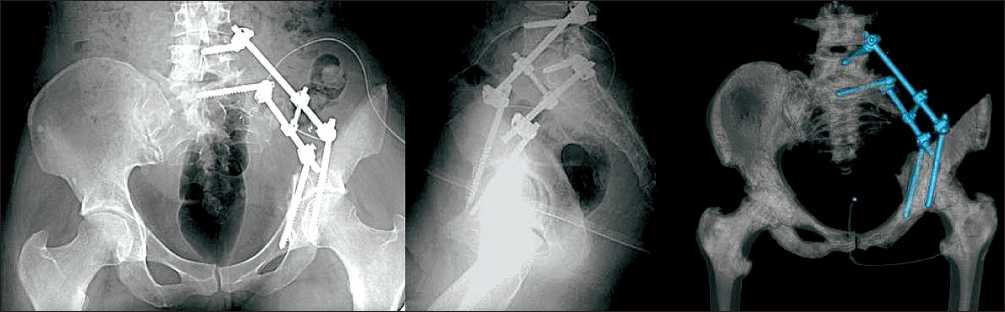
Рис. 1. Рентгенограммы и компьютерная реконструкция после операции. Вариант фиксации полиаксиального винта в тело пятого поясничного позвонка
Дальнейшее лечение, учитывая морфологический подтип опухоли, не назначалось, было рекомендовано строгое динамическое наблюдение. На момент написания статьи данных за прогрессирование процесса у этих пациентов не получено.
Средний период наблюдения составил 18,5 мес (2–40 мес). За это время все прооперированные больные с первичными злокачественными опухолями костей и солитарным метастатическим поражением крестцово-подвздошного сочленения раком почки и остеосаркомой живы без признаков прогрессирования заболевания.
Осложнения
Послеоперационные осложнения отмечены у 4 (40 %) пациентов. У одного пациента на 12-е сут после операции диагностировано кровотечение в области вмешательства с формированием гематомы, что потребовало срочной операции. Инфицирование ложа установленного металлоимпланта наблюдалось у одной больной, ей была проведена ревизионная операция с установкой приточноотточной промывной системы. Путем длительной санации антисептиками и антибактериальной терапии воспалительный процесс удалось купировать без удаления металлоконструкции. Срок наблюдения больной после лечения составил 15 мес без признаков возобновления инфекционного процесса. Перелом направляющей штанги возник у одной пациентки, однако это не сопровождалось клиническими проявлениями нестабильности металлоконструкции и не требовало хирургической коррекции. Поверхностный краевой некроз послеоперационной раны также диагностирован у одной пациентки. Таким образом, значимые послеоперационные осложнения, которые потребовали коррегирующих операций, развились у 2 (20 %) больных.
Функциональные результаты
Средний временной интервал от операции до начала передвижения больного без средств дополнительной опоры составил 4 нед (3–5 нед). Средний показатель по шкале MSTS составил 70 % (62–92 %). У всех пациентов в послеоперационном периоде двигательного и нейросенсорного дефицита не отмечено.
Обсуждение
Наиболее часто восстановление целостности тазового кольца при илеосакральных резекциях проводят васкуляризированными или неваскуляризированными аутографтами, аллографтами, металлостеосинтезом полиаксиальными винтами в комбинации с титановыми стержнями и костным цементом [3, 4, 8, 14, 27]. Каждая методика имеет
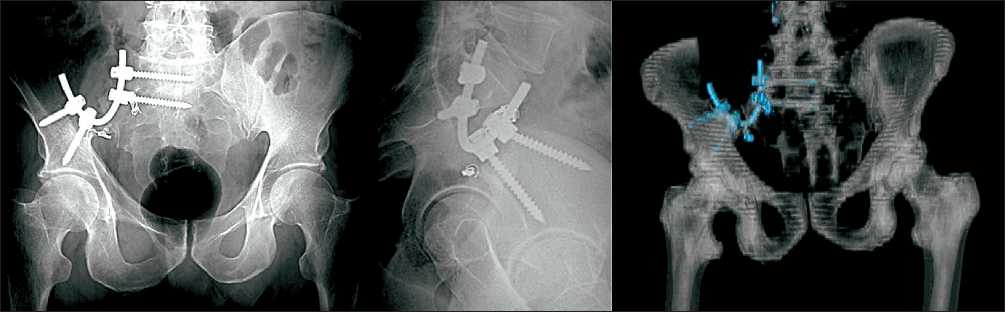
Рис. 2. Рентгенограммы и компьютерная реконструкция после операции. Вариант фиксации полиаксиальных винтов в крестец
свои преимущества и недостатки, которые не позволяют выделить какую-либо одну универсальную технику реконструкции КПС.
Объективным недостатком биологической реконструкции с использованием ауто- или алло-графтов является техническая сложность операции, особенно при использовании васкуляризированных аутотрансплантатов, что значимо увеличивает продолжительность вмешательства, интраоперационную кровопотерю, а значит, косвенно повышает риск развития послеоперационных осложнений [4, 7, 21]. Кроме того, после биологической реконструкции пациент нуждается в длительной иммобилизации для адекватного сращения трансплантата [3, 9, 20]. Наиболее частыми осложнениями являются перелом и отсутствие консолидации костных трансплантатов [25].
Использование металлоимплантатов позволяет интраоперационно наиболее адекватно смоделировать область реконструкции и характеризуется технической простотой выполнения оперативного пособия, возможностью обеспечить достаточно высокую стабильность тазового кольца, тем самым активизировать больного в максимально ранние сроки. Однако эта хирургическая методика может сопровождаться достаточно высоким риском развития инфекционных послеоперационных осложнений [14, 25].
По данным T. Akiyama, который выполнил реконструкцию крестцово-подвздошного сочленения при помощи неваскуляризированного малоберцового аутотрансплантата, у 10 пациентов общее количество осложнений составило 50 %, при этом наиболее частым из них было несраще-ние трансплантата, которое значимо не изменило функциональный результат после операции. Автор не сообщает о возникновении осложнений инфекционного характера [3].
C. Gebert выполнил 35 реконструкций после илеосакральных резекций при помощи комбинации металлостеосинтеза полиаксиальными винтами и стержнями с костным цементом. Автор сообщает о развитии клинически значимых осложнений в 31 %, из них инфекционные осложнения составили 14 %, механические (перелом полиаксиальных винтов) – 17 % [14].
В нашем исследовании общее количество осложнений составило 40 %. Клинически значимые осложнения отмечены у 2 (20 %) больных. У 1 (10 %) пациента диагностировано кровотечение и у 1 (10 %) больной – инфицирование послеоперационной раны. В целом количество осложнений в нашем исследовании коррелирует с данными других авторов. Необходимо отметить, что о кровотечении как о послеоперационном осложнении в проанализированной нами литературе не сообщается.
Среднее значение показателей функционального результата после операции по шкале MSTS в нашем исследовании составило 70 % (62–92 %). По дан- ным C. Gebert, аналогичный показатель составил 71 %, T. Akiyama – 75 % (16–96 %), M. Sabourin – 61,1 %. Можно отметить, что, несмотря на различия в методике реконструкции крестцово-подвздошного сочленения, полученные разными исследователями функциональные результаты в целом сопоставимы. В настоящее время большинство авторов высказывается за необходимость выполнения реконструкции тазового кольца после илеосакральных резекций для достижения максимально возможных функциональных и эстетических результатов без ущерба для радикальности лечения [3, 13, 14, 29]. Однако, по данным G. P. Beadel, сравнившего функциональные результаты 12 пациентов, которым были выполнены илеосакральные резекций без реконструкции тазового кольца, и 4 пациентов с биологической реконструкцией ауто- и аллографтами, значимых различий при оценке функционального статуса не выявлено. В первой группе значение показателя по шкале MSTS составило 58 % (23–90), во второй – 51 % (43–57).
Преимуществом используемой нами методики является техническая простота и удобство выполнения реконструкции путем интраоперационного моделирования металлоконструкции в соответствии с предъявляемыми требованиями, что уменьшает продолжительность операции и интраоперационную кровопотерю. Так, в нашем исследовании средняя продолжительность операции составила 4 ч (3–6 ч), в то время как у T. Akiyama, который использовал для реконструкции неваскуляризированную малоберцовую кость, она равнялась 5 ч (3–6,5 ч), у M. Sabourin, при использовании алло- и аутографтов, – 5,5 ч (2,5–12 ч) [3, 27].
Среднее значение объема интраоперационной кровопотери в нашем исследовании составило 2 800 мл (1 500–5 000 мл). G.P. Beadel сообщает о среднем значении объема кровопотери в 6 250 мл (2 500–12 000 мл) у больных, которым была проведена биологическая реконструкция после илео-сакральных резекций [4].
Сравнения результатов нашего исследования с данными, представленными в аналогичных публикациях по теме, ввиду небольшого количества пациентов и непродолжительного периода наблюдения, мы не проводили.
Заключение
Следует отметить, что, несмотря на совершенствование хирургических методик реконструкции тазового кольца после илеосакральных резекций и в целом после расширенных органосохранняющих операций по поводу местнораспространенных опухолей костей таза, лечение данной категории больных остается одной из самых сложных дисциплин в онкологической ортопедии. Небольшое количество больных в исследовательских работах, ввиду отсутствия адекватной маршрутизации таких пациентов в специализированные клиники, непродолжительные сроки наблюдения, порой противоречащие друг другу результаты лечения не позволяют выработать единственно правильную и удовлетворяющую всем онкологическим, хирургическим и функциональным требованиям хирургическую тактику лечения данных злокаче- ственных новообразований. Это обстоятельство требует дальнейшего изучения и совершенствования методов лечения больных с опухолевым поражением крестцово-подвздошного сочленения и костей тазового кольца в целом.
Список литературы Реконструкция тазового кольца у пациентов с опухолевым поражением крестцово-подвздошного сочленения
- Тепляков В.В., Карпенко В.Ю., Державин В.А., Франк Г.А., Буланов А.А., Бухаров А.В., Мыслевцев И.В., Анурова О.А., Рубцова Н.А., Епифанова С.В., Воробьев Н.В., Сундуй Ю.Ю., Сехина О.В. Реконструктивные операции при лечении пациентов со злокачественными опухолями костей тазового кольца//Саркомы костей, мягких тканей и опухоли кожи. 2012. № 3. C. 16-28
- Aebi M. The adult scoliosis//Eur. Spine. J. 2005. Vol. 14 (10). P. 925-948
- Akiyama T., Clark J.C., Miki Y., Choong P.F. The non-vascularised fibular graft.Asimple and successful method of reconstruction of the pelvic ring after internal hemipelvectomy//J. Bone Joint. Surg. Br. 2010. Vol. 92 (7). P. 999-1005 DOI: 10.1302/0301-620X.92B7.23497
- Beadel G.P., McLaughlin C.E., Aljassir F., Turcotte R.E., Isler M.H., Ferguson P., Griffin A.M., Bell R.S., Wunder J.S. Iliosacral resection for primary bone tumors: is pelvic reconstruction necessary?//Clin. Orthop. Relat. Res. 2005. Vol. 438. P. 22-29
- Campannacci M., Cappana R. Pelvic resection: the Rizzoli institute experience//Orthop. Clin. North. Am. 1991. Vol. 22 (1). P. 65-86
- Chan K., Resnick D., Pathria M., Jacobson J. Pelvic instability after bone graft harvesting from posterior iliac crest: report of nine patients//Skeletal. Radiol. 2001. Vol. 30 (5). P. 278-281
- Chang D.W., Fortin A.J., Oates S.D., Lewis V.O. Reconstruction of the pelvic ring with vascularized double-strut fibular flap following internal hemipelvectomy//Plast. Reconstr. Surg. 2008. Vol. 121 (6). P. 1993-2000 DOI: 10.1097/PRS.0b013e3181706ff2
- Court C., Bosca L., Le Cesne A., Nordin J.Y., Missenard G. Surgical excision of bone sarcomas involving the sacroiliac joint//Clin. Orthop. 2006. Vol. 451. P. 189-194
- Delloye C., Cornu O., Druez V., Barbier O. Bone allografts: what they can offer and what they cannot//J. Bone Joint Surg. Br. 2007. Vol. 89 (5). P. 574-579
- Enneking W.F. A system of staging musculoskeletal neoplasms//Clin. Orthop. Relat. Res. 1986. Vol. 204. P. 9-24
- Enneking W.F., Dunham W., Gebhardt M.C., Malawar M., Pritchard D.J. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system//Clin. Orthop. Relat. Res. 1993. Vol. 286. P. 241-246
- Fuchs B., O’Connor M.I., Kaufman K.R., Padgett D.J., Sim F.H. Iliofemoral arthrodesis and pseudarthrosis: a long-term functional outcome evaluation//Clin. Orthop. Relat. Res. 2002. Vol. 397. P. 29-35
- Fuchs B., Yaszemski M.J., Sim F.H. Combined posterior pelvis and lumbar spine resection for sarcoma//Clin. Orthop. Relat. Res. 2002. Vol. 397. P. 12-18
- Gebert C., Wessling M., Gosheger G., Aach M., Streitbürger A., Henrichs M. P., Dirksen U., Hardes J. Pelvic reconstruction with compound osteosynthesis following hemipelvectomy//Bone Joint J. 2013. Vol. 95-B (10). P. 1410-1416. 1410-6 DOI: 10.1302/0301-620X.95B10.31123
- Gebert С., Wessling M., Hoffmann C., Roedl R., Winkelmann W., Gosheger G., Hardes J. Hip Transposition as a Limb Salvage Procedure Following the Resection of Periacetabular Tumors//J. Surg. Oncol. 2011. Vol. 103 (3). P. 269-275 DOI: 10.1002/jso.21820
- Harrington K.D. The use of hemipelvic allografts or autoclaved grafts for reconstruction after wide resections of malignant tumors of the pelvis//J. Bone Joint Surg. Am. 1992. Vol. 74. P. 331-341
- Jansen J.A., Van de Sande M.A.J., Dijkstra P.D.S. Poor Long-term Clinical Results of Saddle Prosthesis After Resection of Periacetabular Tumors//Clin. Orthop. Relat. Res. 2013. Vol. 471 (1). P. 324-331 DOI: 10.1007/s11999-012-2631-x
- Johnson J.T. Reconstruction of the pelvic ring following tumor resection//J. Bone Joint Surg. Am. 1978. Vol. 60. P. 747-751
- Karakousis C.P., Vezeridis M.P. Variants of hemipelvectomy//Am. J. Surg. 1983. Vol. 145. P. 273-277
- Kawai A., Healey J.H., Boland P.J., Lin P.P., Huvos A.G., Meyers P.A. Prognostic factors for patients with sarcomas of the pelvic bones//Cancer. 1998. Vol. 82 (5). P. 851-859
- Leung P.C. Reconstruction of the pelvic ring after tumour resection//Int. Orthop. 1992. Vol. 16. P. 168-171
- Menendez L.R., Ahlmann E.R., Falkinstein Y., Allison D.C. Periacetabular Reconstruction with a New Endoprosthesis//Clin. Orthop. Relat. Res. 2009. Vol. 467 (11). P. 2831-2837. -1043-z DOI: 10.1007/s11999-009
- O’Connor M.I., Sim F.H. Salvage of the limb in the treatment of malignant pelvic tumors//J. Bone Joint Surg. Am. 1989. Vol. 71. P. 481-494
- Ozaki T., Flege S., Kervic M. Osteosarcoma of the pelvis: Experience of the Cooperative-Osteosarcoma Study Group//J. Clin. Oncol. 2003. Vol. 21. P. 334-341
- Ozaki T., Hillmann A., Bettin D., Wuisman P., Winkelmann W. High complication rates with pelvic allografts: experience of 22 sarcoma resections//Acta. Orthop. Scand. 1996. Vol. 67. P. 333-338
- Pring M.E., Weber K.L., Unni K., Sim F.H. Chondrosarcoma of the pelvis: A review of sixty-four cases//J. Bone. Joint. Surg. 2001. Vol. 83-A (11). P. 1630-1642
- Sabourin M., Biau D., Babinet A., Dumaine V., Tomeno B., Anract P. Surgical management of pelvic primary bone tumors involving the sacroiliac joint//Orthop. Traumatol. Surg. Res. 2009. Vol. 95 (4). P. 284-292 DOI: 10.1016/j.otsr.2009.04.008
- Satcher Jr. R.L., O’Donnell R.J., Johnston J.O. Reconstruction of the pelvis after resection of tumors about the acetabulum//Clin. Orthop. Relat. Res. 2003. Vol. 409. P. 209-217
- Wirbel R.J., Schulte M., Mutschler W.E. Surgical treatment of pelvic sarcomas: Oncologic and functional outcome//Clin. Orthop. Relat. Res. 2001. Vol. 390. P. 190-205
- Witte D., Bernd L., Bruns J., Gosheger G., Hardes J., Hartwig E., Lehner B., Melcher I., Mutschler W., Schulte M., Tunn P.U., Wozniak W., Zahlten-Hinguranage A., Zeifang F. Limb-salvage reconstruction with MUTARS hemipelvicendoprosthesis: A prospective multicenter study//Eur. J. Surg. Oncol. 2009. Vol. 35 (12). P. 1318-1325 DOI: 10.1016/j.ejso.2009.04.011


