Ремоделирование левого желудочка в отдаленный 5-летний период переднего инфаркта миокарда
Автор: Тетеркина Т.В., Рябов В.В., Рябова Т.Р., Марков В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-2 т.23, 2008 года.
Бесплатный доступ
К настоящему времени выполнено большое количество исследований, изучающих постинфарктное ремоделирование, однако большинство работ выполнено в период до широкого внедрения различных методов экстренной реперфузии миокарда, эффективных препаратов, обеспечивающих нейрогуморальную разгрузку сердца. Способно ли широкое внедрение современных методов тромболитической реперфузионной и разгрузочной терапии приостановить ремоделирование ЛЖ в отдаленный 5-летний период ИМ и снизить летальность? Цель исследования: изучить клинико-эхокардиографические параметры ЛЖ у больных, перенесших первичный передний ИМ, по данным 5-летнего наблюдения, используя серийное ультразвуковое исследование (1-е, 2-е, 3-и, 5-е, 7-е, 10-е, 21-е сутки, 6 мес, 12 мес, 5 лет) сердца. Обследовано 92 пациента в возрасте от 24 до 72 лет, доставленные в отделение через 2,5-5 ч от начала ИМ. Все пациентам применяли тромболитическую терапию (системную и внутрикоронарную), а также первичную баллонную ангиопластику. Через пять лет в зависимости от исхода заболевания больных разделили на две группы: 1-я группа - выжившие - 60 (79%) пациентов и 2-я группа - умершие 16 (21%) пациентов. Выявлено, что 5-летняя летальность составила 21%, при этом у 2/3 больных смерть наступала в пос- ледние два года исследуемого периода. Дилатация ЛЖ в ранние сроки (до 1-го месяца) расценивается как проявление острой компенсаторно-приспособительной реакции. В дальнейшем при 5-летнем наблюдении у больных 1-й группы увеличения ЛЖ не наблюдалось, тогда как у больных 2-й группы оно носила прогрессирующий дезадаптивный характер. Многососудистое поражение коронарных артерий и отсутствие стажа стенокардии напряжения - факторы, ассоциирующиеся с летальным исходом. Отмечается низкая приверженность больных к рекомендованной разгрузочной нейрогуморальной терапии, отсутствие дислипидемической терапии на этапе реабилитации.
Ремоделирование, левый желудочек, передний инфаркт миокарда
Короткий адрес: https://sciup.org/14918967
IDR: 14918967 | УДК: 616.127-005.8-089-06:616.124
Текст научной статьи Ремоделирование левого желудочка в отдаленный 5-летний период переднего инфаркта миокарда
E-mail: tteterkina@mail.ru
РЕМОДЕЛИРОВАНИЕ ЛЕВОГО
ЖЕЛУДОЧКА В ОТДАЛЕННЫЙ 5-ЛЕТНИЙ ПЕРИОД ПЕРЕДНЕГО ИНФАРКТА МИОКАРДА
ГУ НИИ кардиологии Томского научного центра СО РАМН
Кардиоваскулярная патология прочно удерживает лидерство в структуре общей смертности населения России [1]. Инфаркт миокарда (ИМ) является одной из ведущих причин хронической сердечной недостаточности (ХСН) [2]. После ИМ риск развития ХСН в 7-10 раз выше, чем в общей популяции. Известно, что 5-летняя выживаемость больных с ХСН составляет 50%, причем среди пациентов с тяжелой СН III-IV классов по классификации NYHA смертность в течение первых 2 лет составляет около 50%, несмотря на активную терапию ингибиторами ангио-тензинпревращающего фермента (и-АПФ), диуретиками и дигоксином [3].
Следующие за коронарной окклюзией и ИМ изменения числа и размера кардиомиоцитов как в поврежденных, так и в интактных регионах левого желудочка (ЛЖ), а также перестройка интерстициального компонента миокарда обусловливают модификацию анатомии сердца, что лежит в основе патогенеза ХСН. Указанные изменения ЛЖ объединяют под общим термином «ремоделирование сердца» [4]. В исследованиях последних лет во многом определены функциональные [5], биохимические [6], струк- турные [7] и молекулярные [8] основы эволюции постинфарктной дисфункции и прогрессирования ХСН. К настоящему времени выполнено большое количество как экспериментальных, так и клинических работ, посвященных динамической оценке процессов постинфарктного ремоделирования ЛЖ, эффективности различных методов воздействия на этот процесс после ИМ. В то же время надо отметить, что большинство исследований, изучающих постинфарктное ремоделирование сердца выполнено в период времени до широкого внедрения различных методов экстренной реперфузии миокарда, эффективных препаратов, обеспечивающих нейрогу-моральную разгрузку сердца, что, несомненно, повлияло на течение и прогноз болезни. Представляет интерес вопрос: способно ли широкое внедрение современных методов реперфузионной и разгрузочной терапии приостановить ремоделирование ЛЖ в отдаленный период ИМ [15], а также значение ранее определенных критериев неблагоприятного течения и исходов острого ИМ, возможно ли прогнозировать эти явления у больных, получивших современное лечение.
Цель исследования: изучить клинико-эхокардиографические параметры ЛЖ у больных, перенесших первичный передний ИМ, по данным 5-летнего наблюдения, используя серийное ультразвуковое исследование (УЗИ) сердца.
МАТЕРИАЛ И МЕТОДЫ
В исследование включено 92 пациента в возрасте от 24 до 72 лет с первым острым передним ИМ, который диагностировали по критериям ВОЗ. Пациенты были доставлены в палату интенсивной терапии через 2,5-5 ч от начала ИМ. Кровоток в инфарктсвя-занной коронарной артерии был восстановлен у 78 (85%) пациентов, при помощи ферментного тромболизиса у 73 (79%) больных, спасательная и механическая реканализация применялась у 10 (11%) и 5 (5%) пациентов. Спонтанный тромболизис диагностировали у 4 (4%) пациентов. Критериями исключения из исследования были: неудовлетворительная визуализация сердца; острая недостаточность ЛЖ III-IV ФК по классификации T.Killip (ОСН); атриовентрикулярная блокада и блокада ножек пучка Гиса, ИМ в анамнезе, мерцательная аритмия, клапанные пороки сердца; тяжелая сопутствующая патология.
Эхокардиографию выполняли при поступлении и на 2, 3, 5, 7, 10, 21-е сутки ИМ, через 6 и 12 месяцев и 5 лет после ИМ, используя системы «Acuson 128 XP/10» (США) и «Vivid 7, GE» в соответствии с рекомендациями Американской ассоциации эхокардиографии. Объемы ЛЖ рассчитывали по формуле «площадь-длина» с вычислением конечного диастолического (КДИ), конечного систолического (КСИ) индексов, ФВ ЛЖ. Для количественной характеристики изменения геометрической формы ЛЖ измеряли (рис. 1): продольный конечно-диастолический 36
Динамика ОСН в 1-й группе
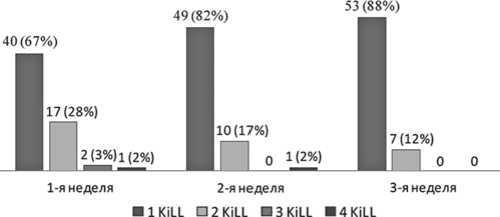
Рис. 1а. Динамика тяжести острой сердечной недостаточности (по Т. Killip) у пациентов 1-й группы
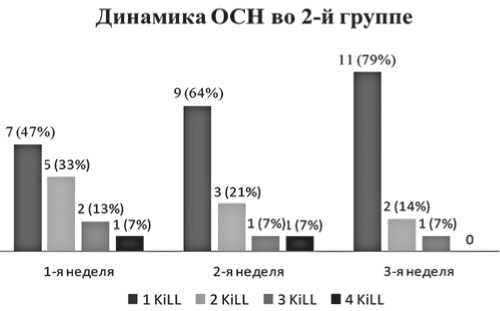
Рис. 1б. Динамика тяжести острой сердечной недостаточности (по Т. Killip) у пациентов 2-й группы размер ЛЖ (d1), поперечный конечно-диастолический размер ЛЖ (d2), поперечный конечно-диастолический регионарный размер ЛЖ (d3) в апикальной четырехкамерной позиции ЛЖ; поперечные взаимно перпендикулярные конечно-диастолические диаметры (D1 и D2) – в парастернальной позиции по короткой оси ЛЖ. Методики описаны нами ранее [20].
Анализ полученных данных проводился на IBM совместимом компьютере при помощи пакета прикладных программ «Statistiсa for Windows ver 6.0» с использованием непараметрического критерия Манна-Уитни. Во всех процедурах анализа данных различия считали статистически значимыми при уровне р<0,05. Непрерывные количественные переменные выражались в виде M±SD, где M – среднее арифметическое, а SD – среднеквадратическое отклонение, медианы; 25 и 75 процентилях.
РЕЗУЛЬТАТЫ
Через пять лет с помощью телефонного интервью и документам ЗАГС был установлен статус 76 (83%) пациентов. В зависимости от исхода заболевания больных разделили на две группы: 1-я группа – выжившие к 5-му году наблюдения – 60 (79%) пациентов и 2-я группа – умершие – 16 (21%) пациентов. Клинико-демографические характеристики обеих групп представлены в табл. 1. Больные обеих групп были сопоставимы по полу и факторам риска и использованию инвазивных методов лечения острого
Таблица 1
Продолжение табл. 1
Клинико-анамнестическая характеристика групп выживших и умерших к 5-летнему периоду, M±SD, n (%)
|
Показатели |
Выжившие |
Умершие |
Р |
|
Количество больных |
60 (79%) |
16 (21%) |
|
|
Возраст, годы |
53,1±12,9 |
57±11 |
0,23 |
|
Мужчины |
50 (83,3%) |
12 (75%) |
0,33 |
|
Вес |
0,08 |
||
|
Индекс Кетле |
26,10±0,42 |
26,62±0,76 |
0,56 |
|
Предынфарктная стенокардия |
30 (50%) |
11 (68,8%) |
0,15 |
|
Коронарный стаж (стенокардия напряжения) |
|||
|
Отсутствует |
32 (53,3%) |
3 (19%) |
0,01 |
|
до 1 года |
15 (25%) |
0 |
0,02 |
|
1-3 года |
4 (6,7%) |
1 (6%) |
0,72 |
|
3-5 лет |
9 (15%) |
2 (13%) |
0,58 |
|
Факторы риска ИБС |
|||
|
Отягощенная наследственность |
26 (43,3%) |
7 (43,8%) |
0,6 |
|
Курение |
46 (76,7%) |
13 (81,3%) |
0,49 |
|
Артериальная гипертензия |
36 (60%) |
10 (62,5%) |
0,55 |
|
Сахарный диабет |
5 (8,3%) |
0 |
0,3 |
|
Ожирение |
15 (25%) |
3 (18,7%) |
0,44 |
|
Реперфузия ИСКА |
|||
|
Время от начала ИМ до открытия ИСКА |
4,5±2,3 |
5±1,4 |
0,28 |
|
Эффективность тромболитической терапиии |
52 (86,6%) |
11 (68,8%) |
0,05 |
|
Частота использования инвазивных методов |
|||
|
Спасательная |
7 (58,3%) |
2 (50%) |
0,6 |
|
Внутривенный тромболизис |
48 (80%) |
12 (75%) |
0,45 |
|
Механическая реканализация |
2 (16,7%) |
2 (50%) |
0,19 |
|
Спонтанная |
3 (25%) |
— |
0,49 |
|
Поражение коронарного русла |
|||
|
1 артерия |
15 (38,5%) |
4 (36,4%) |
0,64 |
|
2 артерии |
13 (33,3%) |
0 |
0,03 |
|
3 артерии |
9 (23%) |
7 (63,6%) |
0,02 |
|
Показатели |
Выжившие |
Умершие |
Р |
|
Без сосудистого поражения |
2 (5%) |
0 |
0,62 |
|
Инфарктсвязанная коронарная артерия |
|||
|
Поражение ПНА |
36 (97,3%) |
11 (100%) |
0,37 |
|
Поражение ОА |
1 (2,7%) |
0 |
0,79 |
|
Сопутствующая терапия: сердечные гликозиды |
|||
|
4-я неделя |
2 (3,9%) |
2 (16,7%) |
0,19 |
|
6 мес |
3 (7,5%) |
2 (18,2%) |
0,28 |
|
12 мес |
2 (9,1%) |
2 (20%) |
0,19 |
|
5 лет |
3 (7,5%) |
— |
|
|
диуретики: |
|||
|
4-я неделя |
11 (22%) |
3 (25%) |
0,61 |
|
6 мес |
10 (25,6%) |
3 (27,3%) |
0,55 |
|
12 мес |
5 (22,7%) |
3(30%) |
0,22 |
|
5 лет |
8 (15,7%) |
— |
|
|
нитраты: |
|||
|
6 мес |
19 (47,5%) |
5(45,5%) |
0,61 |
|
12 мес |
8 (36,4%) |
6(66,7%) |
0,04 |
|
5 лет |
25 (49%) |
— |
|
|
^-блокаторы |
|||
|
4-я неделя |
0 |
0 |
|
|
6 мес |
29 (72,5%) |
7 (63,6%) |
0,48 |
|
12 мес |
11 (50%) |
6 (66,7%) |
0,1 |
|
5 лет |
26 (51%) |
— |
|
|
Блокаторы СА-каналов |
|||
|
4-я неделя |
0 |
0 |
|
|
6 мес |
4 (10%) |
2 (18,2%) |
0,37 |
|
12 мес |
2 (9,1%) |
1 (10%) |
0,51 |
|
5 лет |
9 (18%) |
— |
|
|
Ингибиторы АПФ |
|||
|
4-я неделя |
7 (13,7%) |
5 (41,7%) |
0,07 |
|
6 мес |
16 (40%) |
6 (54,6%) |
0,29 |
|
12 мес |
11 (50%) |
6 (60%) |
0,1 |
|
5 лет |
27 (51,9%) |
— |
|
|
Антиагреганты |
|||
|
5 лет |
39 (76,5%) |
— |
|
|
Антиаритмики |
|||
|
5 лет |
4 (8,3%) |
— |
|
|
Статины |
|||
|
5 лет |
8 (13,3%) |
— |
|
ИМ, однако у пациентов 2-й группы чаще отсутствовал коронарный стаж, и поражение коронарных артерий было многососудистым. Повторный фатальный ИМ явился причиной смерти 8 (50%) пациентов 2-й группы, у 2 (13%) иные сердечно-сосудистые ос- ложнения, у 6 (37%) больных другие причины смерти. В течение первых трех лет наблюдения летальные исходы выявлены у 1/3 больных, а у 2/3 больных смерть наступила в последние два года исследуемого периода.
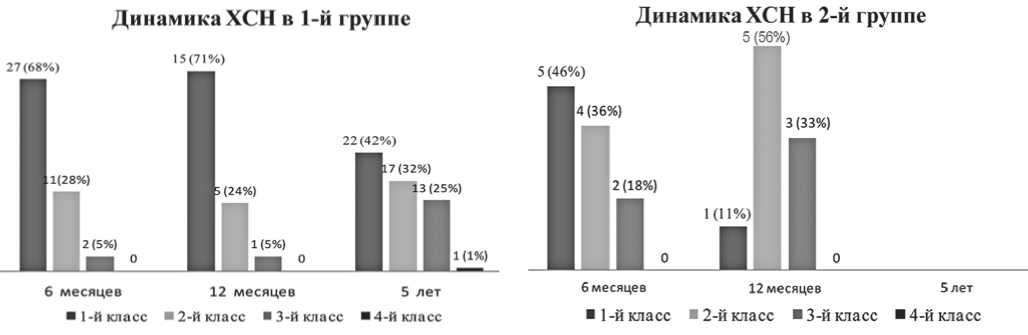
Рис. 2а. Динамика хронической сердечной недостаточности у пациентов 1-й группы
Рис. 2б. Динамика хронической сердечной недостаточности у пациентов 2-й группы
В госпитальный период пациенты 2-й группы имели более высокие классы ОСН по сравнению с больными 1-й группы (рис. 1), подобная тенденция сохраняется в течение 1-го года наблюдения в динамике ХСН (рис. 2). К 5-му году в 1-й группе признаки ХСН I ФК выявлены у 22 (42%) пациентов, II ФК у 17 (32%) больных, III ФК – 13 (25%) пациентов, IV ФК – 1 (1%) пациента. Пациенты предъявляли чаще жалобы на слабость – в 33 (56%) случаев и сердцебиение – в 29 (56%), реже одышку – в 27 (52%), кашель – в 5 (10%) случаев. Стенокардия напряжения выявлена у 30 (58%) пациентов: I ФК – 3 (10%), II ФК – 15 (50%), III ФК – 12 (40%). Эпизоды нестабильной стенокардии в течение 5 лет имели место у 43% больных. Каждый четвертый пациент за истекший период перенес нефатальный повторный ИМ; 4 (7%) больным выполнена операция аортокоронарного шунтирования, а 2 (4%) пациентам проведено стентирование ин-фарктсвязанной коронарной артерии (ИСКА). Выяснено, что из обследованных пациентов 1-й группы почти половина больных не получала рекомендованную медикаментозную терапию ХСН, что, с одной стороны, демонстрирует низкую приверженность больных к рекомендованному лечению, с другой, позволяет изучить естественную эволюцию процессов структурно-функциональной перестройки миокарда ЛЖ в отдаленный период у больных с эффективной реперфузионной терапией острого ИМ.
В течение всего периода наблюдения и-АПФ принимали только 52% больных, 51% – бета-адреноблокаторы, 18%
– антагонисты кальция, нитраты – 49% (по требованию), диуретики – 16%, 2% – сердечные гликозиды, дезагреганты – 77%. И лишь 8 (13%) пациентов за
Таблица 2
Изменения некоторых показателей сократимости ЛЖ у больных ИМ 1-й группы (числитель) и 2-й группы (знаменатель) к 5-му году наблюдения, (M±SD)
|
Сроки ИМ |
КДИ, мл/м 2 |
p |
КСИ, мл/м 2 |
p |
ФВ, % |
p |
|
1-е сут |
58,3±1 4 ,0 |
0,09 |
30,2±9,9 |
0,3 |
47,0±10,9 |
0,9 |
|
59,9±9,3 |
33,7±10,0 |
46,7±10,1 |
||||
|
2-е сут |
58,3±14,0 |
0,6 |
29,9±9,6 |
0,8 |
49,2±6,5 |
0,7 |
|
59,9±9,3 |
30,6±6,9 |
49,2±3,4 |
||||
|
3-и сут |
65,3±13,4 |
0,9 |
33,8±9,8 |
0,3 |
49,0±6,5 |
0,06 |
|
67,4±13,0 |
38,4±11,0 |
43,8±6,6 |
||||
|
5-е сут |
65,3±13,4 |
0,09 |
31,9±10,7 |
0,2 |
48,5±8,6 |
0,8 |
|
73,0±17,0 |
38,2±12,7 |
48,0±7,9 |
||||
|
7-е сут |
66,3±17,0 |
0,08 |
34,1±10,8 |
0,06 |
48,5±7,3 |
0,7 |
|
77,0±12,5 |
42,0±13,1 |
46,1±9,0 |
||||
|
10-е сут |
71,6±17,3 |
0,38 |
34,8±11,3 |
0,2 |
52,0±7,3 |
0,2 |
|
76,9±15,4 |
40,1±13,6 |
48,3±8,9 |
||||
|
21-е сут |
66,9±18,0 |
0,03 |
34,6±12,0 |
0,03 |
48,3±9,4 |
0,2 |
|
78,6±22,5 |
44,1±17,2 |
44,7±9,3 |
||||
|
6 мес |
68,6±24,2 |
0,02 |
36,8±22,3 |
0,02 |
48,9±10,9 |
0,1 |
|
88,8±32,4 |
53,1±28,5 |
42,6±11,8 |
||||
|
12 мес |
71,4±17,9 |
0,04 |
36,8±22,3 |
0,02 |
50,2±7,0 |
0,1 |
|
101,7±41,6 |
53,5±28,6 |
42,0±14,3 |
||||
|
5 лет |
63,7±22,8 |
32,8±18,0 |
50,3±11,5 |
|||
Примечание: КДИ – конечный диастолический индекс ЛЖ; КСИ – конечный систолический индекс ЛЖ; ФВ – фракция выброса ЛЖ. Статистическая значимость различий между двумя группами оценивалась по критерию Манна-Уитни.
Таблица 3
Динамика прироста объемов, ФВ и индекса локальной сократимости ЛЖ относительно первых суток острого ИМ у пациентов 1-й группы (числитель) и 2-й группы (знаменатель) к 5-му году, (n,%)
|
Сроки ИМ, |
Прирост КДИ,% |
Прирост КСИ, % |
Прирост ФВ, % |
Прирост ИЭ, % |
Прирост ИС1, % |
Прирост ИС2, % |
|
7-е сутки |
17±2 |
18±3 |
2±2 |
1,4±7 |
-5±11 |
-5±0,1* |
|
18±1 |
28±2 |
-8±2 |
6±13 |
-5±6 |
-11±0,7 |
|
|
21-е сутки |
22±3 |
24±5* |
6±3 |
1,3±9 |
-6±11 |
-6±0,1** |
|
29±2 |
44±3 |
-5±2 |
7±28 |
-10±12 |
-17±0,1 |
|
|
6 мес |
29±6* |
40±10** |
2±2* |
0,2±9% |
-9±14 |
-9±0,1* |
|
54±3 |
82±5 |
-14±1 |
-0,4%±10% |
-16±10 |
-19±0,1 |
|
|
1-й год |
16±3** |
40±10** |
-0,4±1,6** |
-3%±8% |
-5±13* |
-8±0,1** |
|
76±4 |
82±5 |
-22±2 |
0,7%±13% |
-2±8 |
-23±0,2 |
|
|
5-й год |
18±6 |
22±10 |
11±4 |
2±0,9 |
3±0,3 |
10±0,3 |
Примечание: ИС1 – индекс сферичности ЛЖ (di1/di2); ИС2 – региональный индекс сферичности (di1/di3); КДИ – конечный диастолический индекс ЛЖ; КСИ – конечный систолический индекс ЛЖ; ФВ – фракция выброса ЛЖ; * – p<0,05, ** – p<0,01: различия между двумя группами статистически значимы с указанными достигнутыми уровнями значимости по критерию Манна-Уитни.
5-летний период наблюдения принимали статины, из которых только 2 (3%) пациента достигли целевых значений (ОХС<4,5 ммоль/л и ХС ЛНП<2,5 ммоль/л) при медикаментозной коррекции дислипидемии.
Выявлено, что КДИ ЛЖ у больных 1-й и 2-й групп увеличивался к 7-м суткам на 17±2% и 18±1% соответственно (табл. 3), и к 21-м суткам расширение ЛЖ продолжалось и достигало 22±3,1% и 29±2,4% (p<0,3), без статистически значимой разницы между группами. А к 6 месяцам наблюдения неблагоприятная тенденция сохранялась только во 2-й группе: прирост КДИ достигает 54±3,3%(p<0,05), в тот же период в 1-й группе значимого увеличения ЛЖ не происходит (табл. 3). В последующем к 12-месячному и 5-летнему сроку наблюдения в 1-й группе дилатации ЛЖ не наблюдали, более того, к году наблюдения выявлено уменьшение его размеров до величины, определенной на 7-е сутки ИМ. При этом у больных 2-й группы увеличение ЛЖ к 12 месяцам достигало 76%.
Подобным же образом изменялся КСИ ЛЖ, а именно, в обеих группах он увеличивался с 1-х суток ИМ, к 7-м суткам достигая 18±3 и 28±2 соответственно (табл. 3). Однако статистически значимая разница между группами формируется уже на госпитальном этапе: к 21-м суткам обе группы больных значимо различаются по приросту КСИ ЛЖ +24±5% против +44±3%. При этом прогрессирующее снижение сократимости ЛЖ продолжалось во 2-й группе и к 6-му и к 12-му месяцам наблюдения и составила 82±5%. У больных 1-й группы выявлена иная динамика КСИ ЛЖ: увеличение достигает максимума к 6-му месяцу, и в дальнейшем нарастание этого показателя не происходило. К 5-летнему периоду наблю- дения в 1-й группе увеличение КСИ ЛЖ сопоставимо с приростом к 7-м суткам ИМ.
Увеличение конечно-диастолических размеров и объемов ЛЖ (табл. 3) происходило преимущественно за счет прироста поперечных диаметров ЛЖ (Di 1, Di 2, di 2, di 3). Обычная эллипсоидность ЛЖ утрачивалась в результате преобладания прироста поперечных размеров ЛЖ (Di 1, Di 2, di 2, di 3) над продольным (di 1), начиная со вторых суток. Нарастание ИЭ ЛЖ в целом по группе к 7-м суткам ИМ составило +2±8%. Увеличение ИЭ к 21-м суткам во 2-й группе более выражено, чем в 1-й группе (7%±28% и 1,3%±9% соответственно) без значимой разницы в течение всего госпитального периода наблюдения (табл. 3). Далее к 6 месяцам показатели прироста ИЭ ЛЖ стремятся к исходным значениям в обеих группах, и хотя в годовом и 5-летнем периоде значимого прироста не выявлено, следует напомнить что ИС –это отношение Di1/Di2 и абсолютные показатели этих размеров у указанные выше сроки нарастают. Поперечный размер Di 1 к году наблюдения в 1-й группе 60,6±6,1мм/м2 против 68,5±6,0мм/м2 (p<0,05) во 2-й группе (табл. 4).
Свою нормальную эллипсоидность ЛЖ начинает утрачивать с 1-х суток ИМ (в норме ИС1 стремится к 2). Выявлено, что к 7-м суткам разница стандартного ИС1 между 1-й и во 2-й группой составила 1,77±0,25 и 1,52±0,12 при p<0,05 (табл. 4). В последующем к 6- и 12-месячному периоду наблюдения увеличивается сферичность в обеих группах, но прирост ИС1 во 2-й группе к 6 месяцам был в два раза больше, чем в 1-й группе. К году наблюдения у обеих групп замечен феномен «псевдонормализации», а именно, нарастает дилатация: в абсолютных показа-39
Таблица 4
Q сл -н s
к s s у 1 5
Я s
|
5 У II 04 и к |
ко о" 4 of |
Ок о" 4 04 of |
'Я о" 4 •о 04" |
ок о" 4 ок |
ко 04^ о" 4 ко °ч |
04^ о" 4 ■о |
о" 4 ко о 04" |
о" 4 ок °ч |
* оо о" 4 •о 04" |
04^ о" 4 |
о" 4 со |
оо о" 4 ок ко^ |
* оо о" 4 04" |
оо о" 4 ко |
* о" 4 ОА 04" |
о" 4 ко^ |
* ОО о" 4 ко |
04^ о" 4 ■ZK |
04 ■/к о" 4 Ок 04" |
|
|
е| у у II и к |
КО о" 4 ОО оо^ |
о" 4 со |
04^ о" 4 |
04 04^ о" 4 |
ОО о" 4 ко^ |
Я о" 4 04 |
Я о" 4 |
оо 04^ о" 4 04 |
* ■ZK 04^ о" 4 |
04 о" 4 04 io |
04^ о" 4 04 ко^ |
о" 4 ок •гк |
О о" 4 ко |
О4о о" 4 04 ко^ |
* ко 04^ о" 4 |
ок о" 4 о LO |
■55-ОК о" 4 о ко^ |
ко о" 4 |
■ГК о" 4 ок |
|
|
S |
ок" 4 ^ч |
ко^ ко" 4 ОО оо" |
<о 4 о |
4 ОО о |
о 4 4 со |
■ГК 4 4 4 |
'О, оо" 4 со of |
'О, оо" 4 |
ко^ 4 |
4 °ч |
ко" 4 |
оо ко" 4 |
ок ок" 4 ко^ о |
■ГК о" 4 |
* Of о" 4 04^ of |
о" 4 о" ■ГК |
* ко^ urf 4 ок |
of 4 о^ of ■ГК |
<О о" 4 ^ |
|
|
^ ~5 s ej |
ок 4 LO |
4 о |
ко" 4 LO ко |
04^ of 4 LO >4 |
'О, 4 04^ о" ко |
4 4 4 |
ОА 4 |
4 ок |
ко" 4^ 4 |
4 4 LT) |
ОА ко" 4 ■ZK LT) |
•rf 4 LT) |
■ГК 4 |
04^ 4 о" LT) |
оо" 4 ■ZK ок" |
ко" 4 |
ок ко" 4 оо Csf ■ГК |
4 ок ок" ■ГК |
ко^ оо" 4 |
|
|
^ S у |
■ГК 4 кол ОО |
'4 4 о" ОО |
ОО ко" 4 о" ОО |
ОО ко" 4 оо" |
ко" 4 of ОО |
ок оо" 4 ко^ of оо |
о ко" 4 ок of оо |
ко^ 4 4 о" оо |
4 ко^ со |
4 4 оо о" оо |
ко^ ко" 4 of оо |
О ко" 4 ок о" оо |
оо^ 4 04^ СО |
ОО ко" 4 оо ок" |
ок" 4 of оо |
■ZK 4 о^ оо |
о urf 4 ■ZK со |
ок" 4 оо |
ок" 4 ■ок of оо |
|
|
е| Q Q m к |
о о" 4 ■ГК |
04 о" ■ГК |
ОО <о о" 4 |
ко •о о" 4 ко |
ОО •о о" 4 |
оо •о о" 4 оо |
* о" 4 оо |
о" 4 ко |
о" 4 оо |
оо •о о" 4 04^ |
о о" 4 оо |
04 о" 4 ОК |
о" 4 ок |
ко о" 4 04^ |
оо о^ о" 4 |
ок <о о" 4 |
LD О о" 4 ок СО |
оо о^ о" 4 |
оо о^ о" 4 |
|
|
^ S rf Q |
4 |
ко^ '4 4 <о о" ■ГК |
ко" 4 ОО |
■4 4 ок ок" |
'О, 4 4 04 LT) |
ок 4 4 оо of ■ГК |
оо ко" 4 оо 4 |
ко^ оо" 4 ок о" LT) |
о 4 '-о ок" |
04^ 4 ок LO |
ко" 4 о" ■ГК |
оо^ 4 of LT) |
ко" 4 о о" ■ГК |
О1 оо" 4 ко^ LO |
оо ко" 4 о LT) |
■о 4 ко" ■ГК |
urf 4 urf ■ГК |
4 о^ о" ко |
о 4 о о" ■ГК |
|
|
^ S Q |
ок ко" 4 >4 ■ГК |
ко" 4 LO ^ |
04^ 4 ^ |
ОА ко" 4 ок ^ |
ко" 4 ОО ок" ко |
4 ок 3 |
ко" 4 04 1Г) |
о_ 4 оо" LT) |
04^ оо" 4 оо" ■ГК |
of 4 3 |
ко" 4 оо ок" ■ГК |
■о 4 ок of ко |
ок ко" 4 оо" ■ГК |
ок ко" 4 of ко |
04^ 4 оо" ■ГК |
04^ ■о 4 LO S |
* ко" 4 о" ко |
СО ко" 4 ■ZK оо" ко |
4 ■ZK оо" ■ГК |
|
|
2 к S Он и |
о V |
о о 04 |
о S |
о о LT) |
о V |
н^ о о о |
н^ о V 04 |
о со ко |
о со 04 |
н о 1=5 LT) |
||||||||||
триситета (Di1/Di2); di1 – индекс продольного конечно-диастолического размера ЛЖ ; di2 – индекс поперечного конечно-диастолического размера ЛЖ (измерен в апикальной четырехкамерной позиции на уровне средней трети желудочка); di3 – индекс поперечного конечно-диастолического размера ЛЖ (измерен в апикальной четырехкамерной позиции на уровне верхушечной трети желудочка); ИС1 – индекс сферичности ЛЖ (di1/di2); ИС2 – региональный индекс сферичности (di1/di3); * –p<0,01 – различия между группами статистически значимы по критерию Манна-Уитни.
телях di 1, di 2 отмечен значимый прирост относительно исходных значений.
Обе группы значимо различаются по показателям прироста регионального индекса сферичности ИС 2 к 7-м суткам, затем на протяжении всего госпитального периода и до года наблюдения уменьшение диастолической кривизны более выражено во 2-й группе -23% против -8% в 1-й группе (p<0,005), табл. 3. Выражена неблагоприятная динамика вследствие увеличения размера di 3, который отражает локальное истончение и выпячивание пораженной стенки. У обследованных к 5-му году больных прирост ИС2 составляет +10%, наблюдается псевдостабилизация показателей за счет увеличения di 1.
В течение госпитального периода у пациентов обеих групп ФВ ЛЖ оставалась сохранной >45%, хотя у больных 2-й группы наблюдалось снижение ФВ относительно исходной на 8% к 7-м суткам и на 5% – к 21-м суткам. Нам не удалось выявить различий ФВ ЛЖ пациентов 1-й и 2-й группы по абсолютным значениям, хотя у пациентов 2-й группы ФВ ЛЖ в 6 и 12 месяцев снижалась <45%. Прирост ФВ ЛЖ к 6 месяцам в 1-й группе составил 2% против -14% во 2-й группе (p<0,05). Максимальная разница по динамике прироста ФВ ЛЖ между выжившими и умершими 22% отмечена к году наблюдения (табл. 3). Таким образом, пациенты 1-й группы при исходно сниженной ФВ ЛЖ, в сравнении со средней статистической нормой, имели положительную динамику на 7-е сутки, 21-е сутки, к 6-му месяцу и на протяжении 5-летнего периода снижение указанного показателя не отмечалось (p<0,01).
ОБСУЖДЕНИЕ
В настоящее время прогнозирование течения ХСН после перенесенного ИМ имеет огромное практическое значение, так как застойная сердечная недостаточность является самой частой причиной госпитализаций у лиц старше 65 лет, а ежегодная смертность 5,5 на 100 человек в год – у пациентов с симптомами сердечной недостаточности и показателем LVEF более 40% (по данным исследования с CHARM-Preserved). В нашем исследовании медиана ФВ ЛЖ у пациентов, перенесших ИМ и получивших эффективную тромболитическую терапию в ранние сроки, не опускалась меньше 47%, и годовая летальность составила 5,2%. По данным Anthony J.J. McClelland и соавт., смертность в течение первого года у пациентов с ИМ после тромболитической терапии составила 7% [17], в нашем исследовании более низкий процент летальности – 5,2%, был обусловлен успешной реперфузионной терапией у большей части больных в ранние сроки ИМ. Известно, что летальность от повторного ИМ наиболее вероятна у пациентов с многососудистым поражением коронарных артерий и меньшим стажем стабильной стенокардии напряжения.
По-прежнему главной причиной развития ХСН при ИМ считается гибель кардиомиоцитов и следующий за этим комплекс изменений, которые М. Pfeffer и E. Braunwald охарактеризовали как «ремоделирование ЛЖ». В данном исследовании была предпринята попытка изучить особенности позднего ремоделирования у больных, получивших раннюю эффективную тромболитическую терапию ИМ. Отмечено, что в ранние сроки ИМ структурно-функциональная перестройка, которая сопровождалась сферификацией ЛЖ–увеличением ИЭ и ИС1, ИС2, направлена на поддержание насосной функции сердца. В дальнейшем к окончанию госпитального периода у пациентов выявлена псевдонормализация геометрических показателей, которая обусловлена вовлечением неинфарцированных участков ЛЖ и ассоциировалась с ухудшением его сократительной функции и риском фатальных событий.
Достоверно известно, что для предотвращения раннего ремоделирования важнейшим этапом лечения является достижение быстрой и стойкой реперфузии окклюзированного сосуда, что в свою очередь способствует сохранению миокарда, уменьшению распространения ИМ, снижению электрической нестабильности миокарда, улучшению остаточной функции ЛЖ. Именно этим можно объяснить, что обе группы пациентов к 21-м суткам имели сохранную систолическую функцию ЛЖ, однако значимо отличались по приросту КСИ и КДИ ЛЖ. И, как выяснилось, расширение объемов ЛЖ в подгруппе выживших происходило только в госпитальный период и имело благоприятную динамику, тогда как в подгруппе умерших дилатация, начавшись, нарастала в течение года после ИМ. Для позднего ремоделирования ЛЖ важно, что хроническая ишемия части функционирующего миокарда запускает нейро-эндокринные механизмы структурной и функциональной перестройки сердца – активации ренин-ангиотен-зин-альдостероновой и симпатико-адреналовой систем [17, 18 ]. Вследствие этого столь широкое применение нашла медикаментозная терапия ИАПФ, З-адреноблокаторами и тд. К событиям, вызывающим длительную хроническую ишемию миокарда, следует отнести стаж стенокардии и многососудистое поражение сердца.
Таким образом, по результатам наблюдения следует отметить, что усугубление ремоделирования сердца в отделенный 5-летний период ИМ у больных, получивших современную реперфузионную и разгрузочную терапию, не происходило. Позитивный вклад эффективной тромболитической терапии в раннем периоде реализуется сохранением глобальной систолической функции ЛЖ. В отдаленном периоде у пациентов с благоприятным постинфарктным ремоделированием структурно-функциональные параметры возвращаются к исходным значениям. Основными предикторами летальности и де-задаптивного ремоделирования ЛЖ в отдаленный период являются трехсосудистое поражение и низ- кая приверженность больных к рекомендованной разгрузочной нейрогуморальной терапии.
ВЫВОДЫ
-
1. У пациентов, получивших эффективную тромболитическую и разгрузочную терапию на ранних сроках ИМ, 5-летняя летальность составила 21%, при этом у 2/3 больных смерть наступала в последние два года исследуемого периода.
-
2. Многососудистое поражение коронарных артерий и отсутствие стажа стенокардии напряжения – факторы, ассоциирующиеся с летальный исходом.
-
3. Отмечается низкая приверженность больных к рекомендованной разгрузочной нейрогумораль-ной терапии, отсутствие дислипидемической терапии на этапе реабилитации.
-
4. Дилатация ЛЖ в ранние сроки (до 1 месяца) у пациентов с ОИМ расценивается как проявление острой компенсаторно-приспособительной реакции. В дальнейшем при 5-летнем наблюдении у больных 1-й группы увеличение ЛЖ не наблюдалось, тогда как у больных 2-й группы оно носило прогрессирующий дезадаптивный характер.
Список литературы Ремоделирование левого желудочка в отдаленный 5-летний период переднего инфаркта миокарда
- Оганов Р.Г. Факторы риска и профилактика сердечно-сосудистых заболеваний.//Качество жизни. Медицина -2003. -№ 2.-С. 10-15.
- Сидоренко Б.А., Преображенский Д.В., Батыралиев Т.А. и др. Современные подходы к лечению сердечной недостаточности у взрослых больных.//Кардиология. 2006. № 4. С. 95-103.
- Pitt B., Zannad F., Remme W.J. The effect of spironolactone on morbidity and mortality in patients with severe heart failure//N. Engl. J. Med. -1999. -Vol. 341. -P. 709-717.
- Pfeffer M.A., Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications//Circulation. -1990. -Vol. 81. -№ 4. -P. 1161 -1172.
- DeFelice A., Frering R., Horan P. Time course of hemodynamic changes in rats with healed severe myocardial infarction//Am. J. Physiol. -1989. -Vol. 257. -P. H289-H296.
- Geenen D., Malhotra A., Liang D., Scheuer J. Ventricular function and contractile proteins in the infarcted overloaded rat heart//Cardiovasc. Res. -1991. -Vol. 25. -P. 330-336.
- Anversa P., Beghi C., Kikkawa Y., Olivetti G. Myocardial Infarction in rats, infarct size, myocyte hypertrophy, and capillary growth//Circ. Res. -1986. -Vol. 58, № 1. -P. 26-37.
- DeAnda A. Jr., Moon M.R., Nikolic S.D. et al. A method to assess endocardial regional longitudinal curvature of the left ventricle (Abstract)//Am. J. Physiol. -1995. -Vol. 268, № 6, Pt. 2. -P. H2553-H2560.
- Белов Ю.В., Вараксин В.А. Современные представления о постинфарктном ремоделировании левого желудочка.//Российский медицинский журнал 2002. № 10. С. 469-479.
- Белов Ю.В., Вараксин В.А. Структурногеометрические изменения миокарда и особенности центральной гемодинамики при постинфарктном ремоделировании левого желудочка//Кардиология. 2003. № 1. С. 19-23.
- Флоря В.Г. Роль ремоделирования левого желудочка в патогенезе хронической недостаточности кровообращения (Обзор)//Кардиология. 1997. № 5. С. 63-70.
- Тимофеева И.В., Суханов И.Н., Туев А.В. Особенности обратного ремоделирования сердца после коронарного шунтирования у больных ИБС с Q-позитивным инфарктом миокарда в анамнезе.//Кардиоваскулярная терапия и профилактика. -№ 7. 2006 г. -С. 11-16.
- Gesele S. Bleumink., Anneke M. Knetsch., Miriam C.J.M., Sturkenboom., Quantifeing the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure. Rotterdam Studi//European Heart Journal 2004. № 25. P. 1614-1619.
- Leonardo Bolognese.MD, FESC, Neskovic A.N.MD, FESC et al. Left Ventricular Remodeling After Primary Coronary Angioplasty//Circulation. 2002. 5\12. P. 2351-2357.
- Pfeffer J.M., Pfeffer M.A., Braunwald E. Influence of chronic captopril therapy on the infarcted left ventricle of the rat//Circ. Res. 1985. Vol. 57. P. 84-95.
- Anthony J.J. McClelland1, Colum G. Et al Percutaneous coronary intervention and 1 year in patients treated with fibrinolytic therapy//European Heart Journal 2005. 26, 544-548.
- Мареев В.Ю. Российские национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН, второй пересмотр 2006 г.
- Оганов Р.Г. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации III пересмотр 2007.
- Рябова Т.Р., Соколов А.А., В.А. Дудко, В.В. Рябов, Марков В.А. Динамика структурных и функциональных показателей ЛЖ у больных ОИМ//Кардиология-2002, № 9, С. 30-34.


