Ренальная денервация как новая стратегия нефропротекции у больных резистентной артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа
Автор: Фальковская А. Ю., Мордовин В. Ф., Пекарский С. Е., Рипп Т. М., Манукян М. А., Личикаки В. А., Ситкова Е. С., Зюбанова И. В., Гусакова А. М., Баев А. Е., Рябова Т. Р., Рюмшина Н. И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Обоснование. При сочетании резистентной артериальной гипертонии (РАГ) и сахарного диабета (СД) 2-го типа темпы ежегодного снижения скорости клубочковой фильтрации (СКФ) составляют до 14 мл/мин/1,73 м2/год. Дистальный способ ренальной денервации (РД) снижает артериальное давление (АД) в большей степени, чем стандартная методика. Однако отдаленная эффективность и безопасность выраженного снижения АД при дистальной РД в отношении функции почек остаются неизученными.Цель исследования: оценить отдаленный профиль безопасности и нефропротективную эффективность дистальной РД в сравнении со стандартной методикой у больных РАГ, ассоциированной с СД 2-го типа, в течение 3 лет наблюдения.Материал и методы. В рандомизированное двойное слепое интервенционное исследование (рег. номерNCT02667912) включены 27 больных РАГ в сочетании с СД 2-го типа [возраст 61,6 ± 7,3 лет, офисное АД - систолическое АД/диастолическое АД (САД/ДАД) 171,8 ± 21,9/87,7 ± 17,7 мм рт. ст., расчетная СКФ (рСКФ) 72,1 ± 19,9 мл/мин/1,73 м2, уровень гликозилированного гемоглобина (HbA1c) 6,3 ± 1,1%; 8 мужчин]. Больные были рандомизированы в две сопоставимые группы: в группы дистальной и стандартной РД (n = 13 и n = 14 соответственно). Исходно и в течение 3 лет наблюдения проводили измерение офисного АД, суточное мониторирование АД (СМАД), допплерографию почечных артерий, оценку функции почек [рСКФ (CKD-EPI), суточной экскреции альбумина (СЭА) с мочой], МРТ почек. Больные были инструктированы не менять режим терапии.Результаты. Через 3 года наблюдения изменение рСКФ в группе дистальной РД было незначимым (-5,3 ± 0,4 мл/мин/1,73 м2; p = 0,63) и сопоставимым с таковым при стандартной РД (6,7 ± 4,2; p = 0,3; для межгруппового сравнения p = 0,7), несмотря на более выраженное снижение САД-24ч при дистальной РД по сравнению со стандартной РД (25,3 ± 15,3 vs.4,4 ± 22 мм рт. ст.; p = 0,04). Темпы снижения рСКФ при дистальной РД не имели значимых отличий от таковых в группе стандартной РД (2,7 ± 2,4 мл/мин/1,73 м2/год и 2,7 ± 4,0 мл/мин/1,73 м2/год соответственно; p = 0,9). Значимых изменений показателей почечного кровотока, СЭА, размеров почек по данным МРТ, числа больных с почечной дисфункцией и альбуминурией в обеих группах отмечено не было.Выводы. Дистальная РД у больных РАГ, ассоциированной с СД 2-го типа, имеет сопоставимый со стандартной методикой профиль безопасности и аналогичную нефропротективную эффективность в течение 3 лет наблюдения, несмотря на более выраженное снижение АД.
Резистентная артериальная гипертония, сахарный диабет, почечная функция, почечная дисфункция, ренальная денервация, нефропротекция
Короткий адрес: https://sciup.org/149126168
IDR: 149126168 | УДК: 616.136.7-089.819-072.1-089.168: | DOI: 10.29001/2073-8552-2020-35-1-80-92
Текст научной статьи Ренальная денервация как новая стратегия нефропротекции у больных резистентной артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа
–92
Артериальная гипертензия (АГ) и сахарный диабет (СД) – две глобальные проблемы XXI в., ведущие этиологические факторы сердечно-сосудистых осложнений [1], почечной недостаточности и потребности в гемодиализе [2]. Коморбидность АГ с СД оказывает синергичное повреждающее воздействие на паренхиму и сосуды почек, что ускоряет процессы почечного повреждения. При этом темпы ухудшения функции почек у данной категории больных напрямую зависят от уровня артериального давления (АД), и снижение расчетной скорости клубочковой фильтрации (рСКФ) может превышать 10 мл/мин/год [3]. Поэтому сочетание СД с резистентной АГ (РАГ) ассоциируется с наиболее высоким риском почечных осложнений [4], и необходимость поиска эффективных лечебных стратегий, направленных на сохранение структуры и функции почки, становится максимально очевидной.
Согласно современным представлениям, существенную роль в развитии гипертензивно-диабетической нефропатии играет активация ренин-ангиотензин-альдосте-роновой системы (РААС), и применение блокаторов этой системы позволяет замедлить прогрессирование почечной дисфункции [5]. Однако по данным крупного итальянского проспективного исследования, наличие РАГ у больных СД снижало нефропротективный потенциал фармакотерапии. Так, успешный контроль АД у этих пациентов не сопровождался улучшением почечного прогноза [6]. Более того, когда авторами исследования отдельно была проанализирована подгруппа больных СД в сочетании с РАГ, имеющих хроническую болезнь почек ХБП ( n = 2778), то оказалось, что нормализация АД у этих пациентов повышала риск достижения конечной точки (в виде снижения рСКФ на 30% за 4 года) на 79% [7].
Хорошо известными недостатками фармакотерапии являются неизбирательность фармакологических эффектов препаратов и развитие толерантности к ним, что ограничивает органопротективные эффекты медикаментозного лечения. Другой значимой и труднопреодолимой проблемой фармакотерапии является низкая приверженность пациентов к пожизненному приему препаратов [8]. В связи с этим обнадеживающим способом лечения, результаты которого не зависят от степени приверженности к фармакотерапии, стало развитие инвазивных технологий, среди которых доказанной эффективностью обладает ренальная денервация (РД) с использованием системы внутриартериальной радиочастотной аблации [9]. Целью воздействия при РД является блокада симпатической активации почек и «выключение» почечного механизма восходящей стимуляции симпатической нервной системы. В результате такого вмешательства происходит не только снижение гемодинамической нагрузки на почечные клубочки вследствие антигипертензивного эффекта, но и уменьшение выраженности патологического влияния на почечную ткань метаболических факторов и компонентов РААС, которые тесно связаны с процессами симпатической гиперакти- вации. Кроме того, РД позволяет добиться улучшения почечного кровотока [10, 11] за счет снижения тонуса мышечной стенки и расширения почечных артерий, что увеличивает кислородное обеспечение почечной ткани с восстановлением ее функциональной активности. В контексте вышеперечисленных эффектов РД может быть перспективным методом лечения ХБП [12, 13].
Способность РД замедлять прогрессирование почечной дисфункции, приближая ее к физиологическим возрастным изменениям, документирована результатами 3 лет наблюдения за больными РАГ, включенными в глобальный регистр SYMPLICITY [14]. Согласно этому регистру, РД у больных РАГ в сочетании с СД 2-го типа сопровождалась замедлением темпов снижения рСКФ до 2,6 мл/мин/год. Однако необходимо отметить, что в этом исследовании РД проводилась преимущественно по стандартной методике, согласно которой аппликации радиочастотной энергии наносились на ствол почечных артерий, тогда как изучение особенностей анатомии симпатической иннервации почек показало, что почечные нервы более плотно прилегают к стенке почечных артерий в их дистальных сегментах [15]. Поэтому вполне закономерно, что дистальная методика денервации, применяемая в НИИ кардиологии (Томск) с 2012 г., в большей степени снижает уровень спилловеров норэпинефринов почек [16] и, следовательно, может оказывать более выраженное нефропротективное действие.
Вместе с тем дистальная методика РД может нести в себе и потенциальные риски ухудшения функции почек. Эти риски, во-первых, обусловлены выраженным снижением АД [17], что на фоне сформировавшихся морфофункциональных изменений в виде микрососудистой облитерации, тубулоинтерстициального фиброза, а также нарушения почечной ауторегуляции может привести к нескомпенсированному уменьшению почечной перфузии, усугублению тканевой гипоксии и снижению клубочковой фильтрации. Кроме того, увеличение просвета почечных артерий может усилить гемодинамическую нагрузку на патологически измененные и, следовательно, уязвимые нефроны, поскольку, несмотря на значимое снижение АД, это вмешательство не всегда полностью нормализует его. Данный феномен гемодинамической нагрузки связан с тем, что уменьшение активности симпатических нервов снижает сосудистое сопротивление, которое могло бы препятствовать вызванному АГ и СД растяжению мезангиальных клеток. Более того, вазодилатация мелких артерий и снижение сосудистого сопротивления уменьшают способность артериальной стенки демпфировать пульсовые колебания, что на фоне повышенной жесткости крупных сосудов, свойственной СД, может облегчать проведение пульсовых колебаний на клубочки и усиливать их баротравму. Во-вторых, в снижении СКФ после РД может принимать участие реализация механизма обратной тубулогломерулярной связи, когда в ответ на усиление натрийуреза происходит вазоконстрикция приносящей артериолы. В-третьих, нельзя не учитывать факт близкого к почечной ткани воздействия радиочастотной энергии, последствия ко- торого остаются неизученными. В-четвертых, глубокое введение контраста в сегментарные артерии с целью их тугого заполнения и лучшего контрастирования может повысить риск контраст-индуцированной нефропатии, особенно у больных с СД, имеющих исходные морфофункциональные изменения.
Таким образом, безопасность РД у больных РАГ в сочетании с СД не столь однозначна, а нефропротективная эффективность может быть сомнительной. Но, несмотря на это, данные об отдаленной безопасности дистальной методики РД, базирующиеся на результатах рандомизированных контролируемых исследований у больных РАГ, ассоциированной с СД 2-го типа, к настоящему времени отсутствуют.
В основу нашего исследования положена гипотеза о том, что дистальная методика РД, обладая выраженной способностью снижения симпатического тонуса, позволяет замедлить темпы прогрессирования почечной дисфункции, несмотря на значительное снижение АД и технические особенности процедуры.
Цель работы: оценить отдаленный профиль безопасности и нефропротективную эффективность дистальной РД в сравнении со стандартной методикой у больных РАГ, ассоциированной с СД 2-го типа, в течение 3 лет наблюдения.
Анализируемые первичные конечные точки: рСКФ, суточная экскреция альбумина с мочой; вторичные конечные точки: параметры офисного и среднесуточного АД.
Материал и методы
Исходное обследование проведено у 28 больных РАГ, ассоциированной с СД 2-го типа, госпитализированных в отделение артериальных гипертоний НИИ кардиологии Томского НИМЦ, из которых в двойное слепое рандомизированное контролируемое исследование (рег. номер NCT02667912) были включены 27 человек. Критерием РАГ было АД > 140/90 мм рт. ст. на фоне оптимальной и стабильной в течение полугода терапии, включавшей прием трех и более антигипертензивных препаратов в максимальных дозах, в том числе диуретика, а также комплекс немедикаментозных мероприятий. Оценку приверженности к терапии проводили по данным опроса. Критериями невключения были симптоматическая АГ, низкая приверженность к терапии, гипертония «белого халата», уровень гликозилированного гемоглобина (HbA1c) > 10%, СД 1-го типа, беременность, рСКФ < 30 мл/мин/1,73 м2, указание на острые сосудистые осложнения, нестабильная стенокардия в течение предшествующих 6 мес., хроническая сердечная недостаточность выше 2-го функционального класса ФК (NYHA), тяжелые сопутствующие заболевания, выраженный периферический атеросклероз, ятрогенный характер РАГ. Исследование выполнено в соответствии с национальными и международными регуляторными нормами и правилами, одобрено комитетом по биомедицинской этике при НИИ кардиологии Томского НИМЦ (протокол № 60 от 02.03.2010 г.) и утверждено на ученом совете НИИ кардиологии Томского НИМЦ. До начала исследования все участники исследования подписали информированное согласие.
Всем больным исходно, через 6, 12, 24 и 36 мес. после вмешательства проводили общеклинические исследования с измерением офисного АД на обеих руках по стандартной методике, амбулаторное мониторирование АД с помощью компьютерной системы ABPM–04 (Meditech, Hungary).
Ультразвуковое сканирование магистральных артерий почек и внутрипочечных артерий с цветным допплеровским картированием кровотока выполняли согласно установленным стандартам исследования, с расчетом максимальной систолической, конечно-диастолической скорости потока, пульсационного и резистивного индексов.
Лабораторные тесты включали определение креатинина крови с рСКФ (формула CKD-EPI) и суточной экскреции альбумина (СЭА) с мочой (иммунотурбодиметриче-ским методом на полуавтоматическом биохимическом анализаторе FP-900 стандартными наборами фирмы RANDOX, Англия).
МРТ почек выполняли на высокопольном томографе с индукцией магнитного поля 1,5 Тесла в стандартных режимах.
Для РД использовали катетеры Symplicity Fleх (Medtronic), среднее количество аблаций на одного пациента составило 13,0 ± 1,8. Рандомизацию пациентов 1 : 1 осуществляли в соответствии с простой нестрати-фицированной, рандомизационной последовательностью, полученной с помощью компьютерной генерации случайных чисел. У 13 больных была выполнена стандартная методика РД, при которой радиочастотные аппликации наносили билатерально на ствол почечной артерии. Четырнадцать пациентов составили группу дистальной РД с областью воздействия на сегментарных артериях.
Структура антигипертензивной и сахароснижающей терапии представлена в таблице 1. Все пациенты принимали статины и были инструктированы не менять режим терапии на протяжении всего исследования.
Статистический анализ выполняли с использованием пакета программ STATISTICA ver. 10.0 for Windows. Согласие с нормальным законом распределения признаков проверяли по критерию Шапиро – Уилка. Непрерывные переменные при нормальном распределении представлены как M ± SD, где М – среднее арифметическое, SD – стандартное отклонение или в виде средней и 95% доверительных интервалов M [95% ДИ] (для оценки величины эффекта вмешательства), а при отсутствии нормального распределения – в виде медианы и 25–75% квартилей: Me [25%; 75%]. Категориальные переменные отражены количественно и в процентном отношении. Анализ выполнен по принципу намерения лечить (intention to treat). Реконструкцию данных пациентов, не завершивших исследование, не проводили. Различия непрерывных переменных (от исходных до последующих) проверяли парными t-тестами. Для выявления различий между группами при нормальном распределении использовали непарный t-критерий Стьюдента для независимых выборок, а при отсутствии нормального распределения критерий Манна – Уитни. Для анализа качественных данных применяли таблицы сопряженности с использованием критерия хи-квадрат Пирсона; если ячейки с ожидаемой частотой меньше 5 – точный критерий Фишера (для таблиц 2 × 2). Поиск возможных взаимосвязей проводили с помощью корреляционного анализа количественных признаков (параметрический корреляционный анализа Пирсона). Для критического уровня значимости p всех процедур статистического анализа использовали значение 0,05.
Таблица 1. Исходная клиническая характеристика сравниваемых групп ( n = 27), M + SD
Table 1. Baseline clinical characteristics of patients ( n = 27), M + SD
|
Режим ренальной денервации Renal denervation mode |
Стандартный Conventional n = 14 |
Дистальный Distal n = 13 |
p |
|
Возраст, лет Age, years |
63,1 ± 6,5 |
60,0 ± 8,1 |
0,27 |
|
Мужской пол, n (%) Male gender, n (%) |
5 (36) |
3 (23) |
0,47 |
|
ИБС, n (%) CHD, n (%) |
8 (57) |
7 (53) |
0,86 |
|
Офисное АД, мм рт. ст. Office BP, mmHg |
165/82 ± 16/15 |
180/92 ± 27/18 |
0,07/0,1 |
|
АД-24ч, мм рт. ст. 24-h BP, mmHg |
155/78 ± 11/15 |
167/86 ± 24/15 |
0,05/0,2 |
|
Офисная ЧСС, уд./мин Office HR, bpm |
67,1 ± 10,4 |
66,3 ± 12,3 |
0,86 |
|
рСКФ (CKD-EPI), мл/мин/1,73 м2 eGFR, mL/min/1.73 m2 |
66,6 ± 13,6 |
78,1 ± 24,2 |
0,14 |
|
ХБП 3-й стадии, n (%) CKD 3 stage, n (%) |
3 (21) |
4 (30) |
0,58 |
|
Альбуминурия, мг/24 ч, Me [25%; 75%] UAE, mg/24 h |
16,9 [6,8; 34,7] |
19,6 [7,9; 59,9] |
0,36 |
|
HbA1c, % |
6,6 ± 1,5 |
7,1 ± 1,2 |
0,40 |
|
ИМТ, кг/м2 BMI, kg/m2 |
34,3 ± 5,3 |
36,2 ± 5,6 |
0,36 |
|
Количество антигипертензивных препаратов, n (%) Number of antihypertensive drugs, n (%) |
4,4 ± 0,9 |
4,5 ± 1,0 |
0,70 |
|
Бета-блокаторы, n (%) Beta-blockers, n (%) |
6 (42) |
12 (92) |
0,007 |
|
Диуретики, n (%) Diuretics, n (%) |
14 (100) |
13 (100) |
– |
|
ИАПФ/АРА/ACEI/ARB, n (%) |
14 (100) |
13 (100) |
|
|
АК/CCBs, n (%) Антагонисты альдостерона, n (%) |
12 (85) |
9 (69) |
0,3 |
|
Aldosterone antagonists, n (%) Другие, n (%) |
5 (36) |
7 (53) |
0,3 |
|
Others, n (%) |
6 (43) |
4 (31) |
0,4 |
|
Сахароснижающая терапия / Antihyperglycaemic therapy, n (%) Метформин, n (%) |
14 (100) |
13 (100) |
– |
|
Metformin, n (%) Комбинированная ПССС, n (%) |
4 (29) |
5 (38) |
0,5 |
|
Combined OHT, n (%) ИТ + ПССС, n (%) Insulin + combined OHT, n (%) |
5 (35) |
3 (23) |
0,4 |
|
Препараты СМ, n (%) Sulfonylureas, n (%) |
4 (29) |
4 (31) |
0,6 |
|
1 (7) |
1 (8) |
0,7 |
Примечание: M + SD - среднее и стандартное отклонение, Me [25%; 75%] - медиана и 25-75% квартили, n - число больных, ИМТ - индекс массы тела, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ЧСС – частота сердечных сокращений, HbA1c – гликозилированный гемоглобин, рСКФ – расчетная скорость клубочковой фильтрации, ХБП – хроническая болезнь почек, ИБС – ишемическая болезнь сердца, ПССТ – пероральная сахароснижающая терапия, СМ – сульфонилмочевина.
Note: M + SD – mean and standard deviation; Me [25%; 75%] – median and 25%–75% quartiles; n – the number of patients; BMI – body mass index; SBP - systolic blood pressure; DBP - diastolic blood pressure; HR - heart rate; bpm - beat per minute; HbAlc - glycated hemoglobin; eGFR - estimated glomerular filtration rate; CKD – chronic kidney disease; CHD – coronary heart disease; ACEI/ARB – Angiotensin-Converting Enzyme Inhibitors/ Angiotensin Receptor Blockers; CCBs – calcium channel blockers; OHT – oral hypoglycemic therapy.
Результаты
Клинико-демографические характеристики пациентов, включенных в исследование, представлены в таблице 1, согласно которой больные из групп дистальной и стандартной методик РД не отличались по возрасту, полу, рСКФ, СЭА, частоте ХБП и альбуминурии. Имело место незначимое различие по уровню офисного и среднесуточного АД с тенденцией к более высоким показателям в группе дистальной методики. Количество антигипертензивных препаратов в обеих группах было сопоставимым, вместе с тем в группе дистальной РД исходная частота приема бета-блокаторов была в 2,2 раза выше, чем в группе стандартной РД при сопоставимой частоте сердечных сокращений (ЧСС).
На рисунке 1 представлена блок-схема исследования. Девятнадцать человек завершили исследование в соответствии с протоколом (8 человек из группы дистальной РД и 11 пациентов из группы стандартного вмешательства), потери наблюдений имели место для 8 человек (30%).
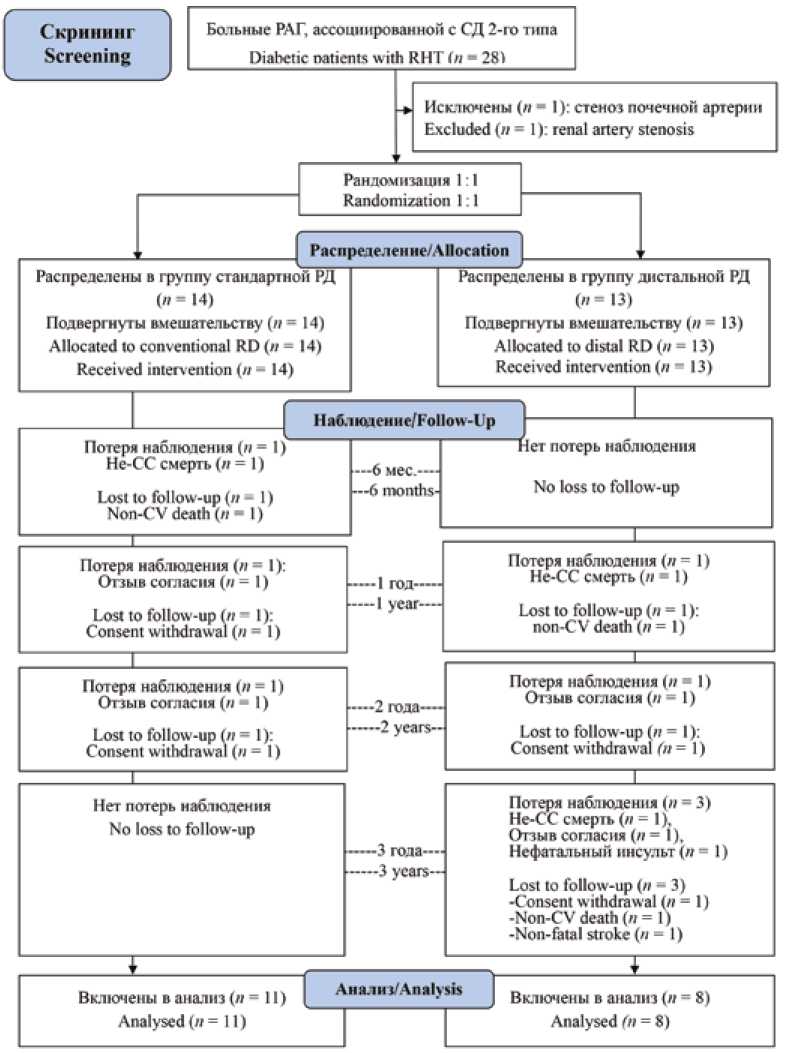
Рис. 1. Блок-схема исследования
Примечание: n – число наблюдений, РД – ренальная денервация, СС – сердечно-сосудистая.
Fig. 1. Flow diagram
Note: n – the number of patients; RD – renal denervation; CV – cardiovascular.
Обе методики существенно снижали офисное АД, однако значимое уменьшение среднесуточного систолического АД на протяжении всего периода наблюдения было лишь в группе дистальной денервации (табл. 2, рис. 2). Изменений ЧСС при обоих режимах РД отмечено не было.
Таблица 2. Показатели офисного и 24-часового измерения артериального давления и частоты сердечных сокращений исходно и через 3 года после ренальной денервации, M + SD
Note: M + SD - mean and standard deviation; RD - renal denervation; n - the number of patients; BP - blood pressure; SBP - systolic BP; DBP -diastolic BP; HR – heart rate, bpm – beat per minute; CI – circadian indexes; p – versus baseline, Student t-test.
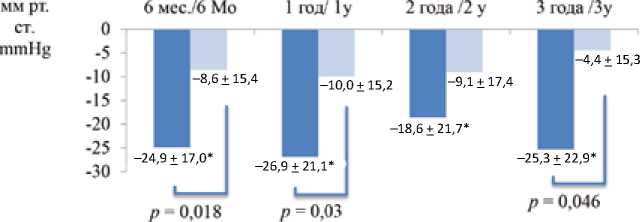
Table 2. Office and ambulatory blood pressure and heart rate before and after renal denervation, M + SD
|
Показатели Parameters |
Стандартная РД Conventional RD |
Дистальная РД Distal RD |
||||
|
Исходно Baseline n = 14 |
36 мес. 36 months n = 11 |
p |
Исходно Baseline n = 13 |
36 мес. 36 months n = 8 |
p |
|
|
Офисное АД (САД/ДАД), мм рт. ст. Office BP (SBP/DBP), mmHg |
164,5 ± 16/ 81,7 ± 15,0 |
143,9 ± 15,5/ 70,7 ± 9,3 |
0,002/0,04 |
179,6 ± 26,5/ 92,2 ± 18,3 |
152,5 ± 19,9/ 80,7 ± 9,9 |
0,02/0,11 |
|
Офисная ЧСС, уд./мин Office HR, bpm |
67,1 ± 10,4 |
66,5 ± 10,6 |
0,89 |
66,3 ± 12,3 |
63,5 ± 7,2 |
0,56 |
|
АД-24ч, мм рт. ст. 24-h BP, mmHg |
154,6 ± 11,4/ 77,8 ± 14,5 |
150,2 ± 14,8/ 70,2 ± 12,7 |
0,7/0,16 |
166,9 ± 23,6/ 85,8 ± 14,6 |
141,6 ± 11,6/ 74,8 ± 9,7 |
0,03/0,07 |
|
ЧСС-24ч, уд./мин 24-h HR, bpm |
65,3 ± 13,0 |
62,7 ± 13,0 |
0,62 |
65,5 ± 10,6 |
61,0 ± 8,8 |
0,33 |
Примечание: M + SD – среднее и стандартное отклонение, n – число пациентов, РД – ренальная денервация, АД – артериальное давление, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ЧСС – частота сердечных сокращений, СИ – суточный индекс, p – сравнение с исходом, t-критерий Стьюдента.
■ дистальная РД/distal RD стандартная P/Vconv. RD
Рис. 2. Изменение уровня среднесуточного систолического артериального давления после ренальной денервации ( M + SD ) Примечание: M + SD – среднее и стандартное отклонение, РД – ренальная денервация, t-критерий Стьюдента.
Fig. 2. Changes in 24-h systolic blood pressure after renal denervation ( M + SD )
Note: M + SD – mean and standard deviation; RD – renal denervation; conv. – conventional; mo – months; y – years; Student t-test.
Через 3 года после вмешательства снижение САД-24ч при дистальной РД составило 25,3 [95% ДИ 3,243,2] мм рт. ст. против 4,4 [95% ДИ 5,6; 15,6] мм рт. ст. при стандартной методике, разница между группами: –20,8 [95% ДИ 0,4; 41,3] мм рт. ст.; p = 0,046 (cм. рис. 2). При этом изменение рСКФ в группе дистальной РД было незначимым (-5,3 [95% ДИ 1,96; 14,1] мл/мин/1,73м2; p = 0,63) и сопоставимым с таковым в группе стандартной РД (6,7 [95% ДИ 0,19; 16,11] мл/мин/1,73 м2; p = 0,3), p = 0,7 для межгруппового сравнения (рис. 3). Темпы ежегодного снижения рСКФ в сравниваемых группах не имели значимых отличий ( p = 0,9) и составили 2,7 [95% ДИ 0,67; 4,71] мл/мин/1,73 м2/год для дистальной РД и 2,7 [95% ДИ 0,01; 5,45] мл/мин/1,73 м2/год для стандартной РД.
Корреляционных связей изменения рСКФ со степенью снижения АД в обеих группах отмечено не было.
Значимых изменений показателей почечного кровотока, СЭА, числа больных с ХБП и альбуминурией, размеров почек по данным МРТ в обеих группах отмечено не было (табл. 3). Вместе с тем имело место увеличение диаметра правой почечной артерии в группе стандартной методики без изменения скоростных показателей ( p = 0,007). Среднее количество принимаемых препаратов в сравниваемых группах на протяжении 3 лет наблюдения существенно не изменилось и составило 4,6 ± 0,9 в группе дистальной РД (для сравнения с исходом p = 0,57) и 4,8 ± 0,9 ( p = 0,50) в группе стандартного вмешательства.
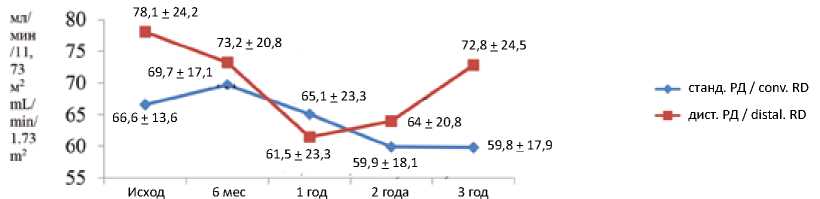
Baseline 6 мо 1 у 2 у 3 у
Рис. 3. Изменение расчетной скорости клубочковой фильтрации после ренальной денервации ( M + SD )
Примечание: M + SD – среднее и стандартное отклонение, станд. РД – стандартная ренальная денервация, дист. РД – дистальная
РД, t-критерий Стьюдента.
Fig 3. Changes in estimated glomerular filtration rate after renal denervation ( M + SD )
Note: M + SD – mean and standard deviation, RD – renal denervation; сonv. – сonventional; mo – months; y – years; Student t-test.
Таблица 3. Показатели почечного кровотока, структурно-функционального состояния почек и почечных артерий по данным магнитно-резонансной томографии исходно и через 3 года после ренальной денервации ( M + SD )
Table 3. Renal blood flow, renal function, and renal structure by magnetic resonance imaging before and three years after renal denervation ( M + SD )
|
Показатели Parameters |
Стандартная РД Conventional RD |
Дистальная РД Distal RD |
||||
|
Исходно Baseline n = 14 |
36 мес. 36 months n = 11 |
p |
Исходно Baseline n = 13 |
36 мес. 36 months n = 8 |
p |
|
|
VPs в стволе ПА справа/слева, см/с |
96,7 ± 32,7/ |
120,1 ± 67,8/ |
0,28/ |
87,2 ± 19,1/ |
90,5 ± 10,7/ |
0,68/ |
|
VPs in trunk of RA R/L, cm/s |
92,2 ± 31,2 |
102,1 ± 33,8 |
0,46 |
94,2 ± 23,9 |
90,5 ± 12,7 |
0,71 |
|
VPs сегментарных ПА справа/ слева, см/с VPs in segmental RA, R/L, cm/s |
49,2 ± 12,0/ 49,0 ± 12,0 |
53,7 ± 12,0/ 53,7 ± 12,0 |
0,39/ 0,39 |
43,3 ± 10,0/ 45,1 ± 9,6 |
48,5 ± 6,2/ 45,2 ± 4,8 |
0,24/ 0,98 |
|
RI в стволе ПА справа/слева |
0,74 ± 0,07/ |
0,76 ± 0,09/ |
0,46/ |
0,73 ± 0,08/ |
0,73 ± 0,07/ |
0,91/ |
|
RI in trunk of RA R/L |
0,74 ± 0,07 |
0,76 ± 0,08 |
0,47 |
0,72 ± 0,08 |
0,75 ± 0,08 |
0,42 |
|
RI в сегментарных ПА справа/слева |
0,70 ± 0,10/ |
0,69 ± 0,09 |
0,88/ |
0,67 ± 0,08/ |
0,67 ± 0,07/ |
0,98/ |
|
RI in segmental, RA R/L |
0,70 ± 0,10 |
0,69 ± 0,09 |
0,88 |
0,66 ± 0,07 |
0,68 ± 0,06 |
0,42 |
|
Объем почки, мл3 справа/слева |
170,8 ± 23,7/ |
168,9 ± 21,1/ |
0,86/ |
189,1 ± 48,4/ |
178,3 ± 49,7/ |
0,44/ 0,66 |
|
Kidney volume, mL3, R/L |
172,6 ± 39,0 |
182,7 ± 42,2 |
0,60 |
202,3 ± 47,7 |
191,0 ± 58,0 |
|
|
Объем коркового вещества, мл3 справа/слева Cortical volume, mL3, R/L |
59,9 ± 15,8/ |
51,4 ± 9,7/ |
0,19/ |
69,5 ± 25,5/ |
72,7 ± 53,6/ |
0,87/ |
|
62,5 ± 24,9 |
55,3 ± 10,6 |
0,44 |
76,5 ± 26,3 |
79,7 ± 58,8 |
0,88 |
|
|
Объем мозгового вещества, мл3 справа/слева Medullary volume, mL3, R/L |
110,6 ± 14,5/ |
117,6 ± 17,0/ |
0,36/ |
119,9 ± 28,2/ |
105,3 ± 36,3/ |
0,37/ |
|
110,1 ± 21,8 |
127,3 ± 34,1 |
0,22 |
131,7 ± 28,7 |
111,0 ± 31,7 |
0,19 |
|
|
Диаметр правой/левой ПА, мм |
6,2 ± 1,3/ |
7,7 ± 0,7/ |
0,007/ |
6,8 ± 0,8/ |
6,7 ± 0,6/ |
0,74/ |
|
Renal artery diameter R/L, mm |
7,2 ± 1,2 |
7,6 ± 0,5 |
0,39 |
7,3 ± 1,0 |
6,3 ± 1,2 |
0,22 |
|
Частота ХБП ≥ С3, n (%) CKD stage ≥ 3, n (%) |
3 (21) |
6 (43) |
0,09 |
4 (31) |
3 (33%) |
0,56 |
|
Частота альбуминурии, n (%)/ Albuminuria frequency, n (%) |
4 (28) |
3 (27) |
0,64 |
6 (46) |
2 (22) |
0,31 |
Примечание: M + SD – среднее и стандартное отклонение, Vps – пиковая систолическая скорость, ПА – почечная артерия, RI – резистивный индекс, ХБП – хроническая болезнь почек, p – сравнение с исходом, t-критерий Стьюдента.
Note: M + SD – mean and standard deviation; Vps – peak systolic velocity; RA – renal artery; R/L – right/left; RI – resistive index; CKD – chronic kidney disease; p – versus baseline; Student t-test.
Обсуждение
Как известно, морфофункциональные изменения в почках у больных РАГ и СД, возникающие вследствие микрососудистой облитерации, тубулоинтерстициального воспаления и фиброза, приводят к снижению почечной перфузии и тканевой гипоксии, что является триггером повышения активности симпатического отдела нервной системы [18]. Гиперсимпатикотония, в свою очередь, вызывает вазоконстрикцию почечных артерий, усугубляя ишемизацию почечной ткани и повреждение нефронов, а также повышает активность РААС, что дополнительно усиливает клубочковую гиперфильтрацию, гипертрофию мезангния, повреждение подоцитов, гломерулосклероз и протеинурию. Понимание связи симпатической гиперактивности с повреждением почек привело к формированию новой стратегии в лечении и профилактике почечной дисфункции, основанной на использовании РД [12, 13]. Несмотря на преимущество дистальной методики РД перед стандартным режимом, вопросы ее безопасности и эффективности в отношении функции почек у больных РАГ в сочетании с СД оставались открытыми. Наша работа стала одной из первых, оценивших отдаленную эффективность и безопасность дистального способа РД в сравнении со стандартным режимом у больных очень высокого риска почечных осложнений, к которым относятся пациенты с РАГ, ассоциированной с СД 2-го типа. Согласно нашим данным, темпы ежегодного снижения СКФ при дистальной методике РД не отличались от таковых при стандартном режиме РД, составляя в среднем 2,7 мл/мин/1,73 м2, что подтверждает правоту нашей гипотезы о безопасности дистальной РД. При этом документированные нами темпы снижения СКФ приближались к физиологическим возрастным изменениям [19] и были существенно ниже, чем на фоне фармакотерапии, описанной G.L. Bakris и соавт. [3], для которой ежегодное снижение рСКФ составляет от 10 до 14 мл/мин/1,73 м2. Полученные нами результаты согласуются с данными глобального регистра SYMPLICITY, в котором темпы ежегодного снижения СКФ у больных РАГ в сочетании с СД составили 2,6 мл/мин [14], однако наблюдательный характер этого исследования накладывает ограничения на интерпретацию его результатов. Еще более выраженное замедление снижения СКФ было документировано у 12 больных РАГ в работе П.В. Глыбочко и соавт., согласно которой снижение СКФ через 5 лет после РД составило 9,5 мл/мин/1,73 м2 (или 1,9 мл/мин/год) [20]. Однако в этом исследовании участвовали более молодые пациенты (средний возраст 43,7 ± 12,9 лет), большинство из которых были без СД. Важно, что нефропротективная эффективность РД была продемонстрирована и для больных с умеренной, а также выраженной ХБП. Так, согласно результатам D. Hering и соавт. [21], у больных с ХБП и исходной средней рСКФ 46,2 ± 13,0 мл/мин/1,73 м2 за год до вмешательства было отмечено значимое снижение рСКФ на 3,41 мл/мин, тогда как через 2 года после вмешательства рСКФ оставалась относительно стабильной, и через 3, 6, 12, 24 мес. наблюдения изменение рСКФ составило +3,73; +2,54; +1,78; –0,24 мл/мин/1,73 м2 соответственно (p = 0,02; 0,13; 0,28; 0,91 соответственно).
Согласно метаанализу семи рандомизированных контролируемых исследований, в которых принимали участие и пациенты с СД 2-го типа (DENERHTN, SYMPLICITY-FLEX, SYMPLICITY HTN-2, SYMPLICITY HTN-3, OSLO RDN, PRAGUE-15 и SYMPLICITY HTN-Japan), рСКФ через полгода в контрольной группе (n = 397) снизилась в среднем на 2,3 мл/мин/1,73 м2; p = 0,002, тогда как в группе РД (n = 588) снижение СКФ было незначимым (1,48 мл/мин/1,73 м2; p = 0,112) [22]. В другом метаанализе 52 исследований, дополненном качественным анализом 14 исследований, с общим количеством больных, равным 2898 человек, значимого изменения рСКФ в те- чение 9 мес. после РД также выявлено не было [23]. Это свидетельствует не только о безопасности процедуры, но и об ее нефропротективных свойствах. Кроме того, имеются публикации о возможности увеличения рСКФ после РД [10, 24–26].
В нашей работе снижение альбуминурии в обеих группах было незначимым, что могло быть обусловлено малым размером выборки. Вместе с тем в исследовании Z.H. Zhang и соавт. у больных ХБП ( n = 39, из них 7 больных СД) в течение года после РД отмечалось нарастающее снижение альбуминурии (на 4,9; 8,9; 14,9; 16,9 мг/дл через 1, 3, 6, 12 мес. соответственно). Характерно, что в группе сравнения ( n = 38) на одной фармакотерапии уровень альбуминурии продолжал увеличиваться (+1,1; +0,9; +1,5; +4,5 мг/дл; p < 0,05 для сравниваемых групп) [27]. Уменьшение частоты альбуминурии у больных РАГ через полгода после РД было документировано и в контролируемом сравнительном исследовании F. Mahfoud и соавт. с участием 88 больных РАГ (15 больных с СД) [11]. Аналогичные результаты через полгода после РД были получены C. Ott и соавт. [28] у 59 больных РАГ с исходно повышенным альбумин-креатининовым соотношением и альбуминурией, среди которых СД имел место у 51% больных, а также в работе M.G. Kiuchi и соавт. (11 больных с СД, 2 года наблюдения) [25]. Дополнительно к этому H. Sousa и соавт. [26] у больных РАГ в сочетании с СД ( n = 22) через год после РД обнаружили уменьшение альбумин-креатининового соотношения.
Среди механизмов нефропротективного действия РД обсуждаются изменения системной гемодинамики в виде снижения АД и гемодинамической нагрузки как на артериальную стенку, так и на клубочки, восстановления функции подоцитов, уменьшения фиброза и воспаления в почечной ткани и кровоснабжающих ее сосудах [29], а также уменьшения тканевой гипоксии вследствие расширения почечных артерий [10, 11]. Последнее косвенно подтверждает документированное нами увеличение диаметра одной из почечных артерий при стандартной методике РД, однако это требует дальнейшего изучения на большем объеме выборки. Кроме того, РД может оказывать положительное влияние на клубочковую эндотелиальную функцию, о чем свидетельствует документированное другими исследователями снижение альбуминурии [11, 28, 29]. Закономерно, что по данным экспериментального исследования Y. Yao и соавт. [30] на модели СД у крыс с АГ, более полную нефропротекцию обеспечивала комбинация блокады РААС и симпатической нервной системы. Что касается нашей работы, то блокаторы РААС получали все пациенты обеих групп. Вместе с тем в группе дистальной методики РД отмечалась более высокая частота приема бета-блокаторов, что могло обеспечивать большую степень снижения активности симпатического тонуса. Однако мы не имели возможности измерить симпатическую активность, и изучение влияния сочетанного использования блокаторов РАС, бета-блокаторов и РД на функцию почек может стать предметом будущих исследований.
Согласно результатам нашей работы, значимое снижение среднесуточного АД имело место лишь у пациентов из группы дистальной РД, что соответствует ранее опубликованным данным [17]. Другим клинически важным результатом нашего исследования следует считать то, что выраженное снижение АД в группе дистальной РД не сопровождалось ухудшением почечной функции, что подтверждает нашу гипотезу о безопасности данной методики. Аналогичные результаты были получены в небольшой работе C. Ott и соавт. [31], согласно которой через 3 мес. после РД у 19 больных РАГ показатели почечной перфузии, по данным МРТ, и функции почек остались неизменными, несмотря на значимое снижение АД. Вместе с тем небольшое снижение СКФ является вполне закономерным явлением вследствие снижения внутригломерулярного давления при уменьшении системного АД. Микрососудистая патология при АГ характеризуется ослаблением вазоконстрикторных и сосудорасширяющих свойств прегломерулярных афферентных артериол в ответ на изменения почечного перфузионного давления. Следовательно, любое изменение системного и почечного давления будет сопрово- ждаться пропорциональным изменением СКФ. В этом патофизиологическом контексте поддержание рСКФ, несмотря на значительное снижение АД, предполагает, что РД способна улучшать тонкие механизмы ауторегуляции почечного кровотока. Отсутствие изменений объемов почек, особенно коркового вещества, может косвенно свидетельствовать о сохранении количества функциональных структурных единиц.
Список литературы Ренальная денервация как новая стратегия нефропротекции у больных резистентной артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа
- Васильцева О.Я., Ворожцова И.Н., Крестинин А.В., Cтефанова Е.В., Карпов Р.С. Влияние основной нозологической патологии и выбранной врачебной стратегии на исход тромбоэмболии легочной артерии. Кардиология. 2017;1:37-41. DOI: 10.18565/car-dio.2017.1.37-41.
- US Renal Data System 2019 Annual Data Report: Epidemiology of Kidney Disease in the United States. URL: http://www.usrds.org/.
- Bakris G.L., Williams M., Dworkin L., Elliott W., Epstein M., Toto R. et al. Preserving renal function in adults with hypertension and diabetes: A consensus approach. Am. J. Kidney Dis. 2000;36(3):646-661. DOI: 10.1053/ajkd.2000.16225.
- De Nicola L., Borrelli S., Gabbai F.B., Chiodini P., Zamboli P., Iodice C. et al. Burden of resistant hypertension in hypertensive patients with non-dialysis chronic kidney disease. Kidney Blood Press. Res. 2011;34:58-67. DOI: 10.1159/000322923.
- Подзолков В.И., Брагина А.Е., Ишина Т.И., Брагина Г.И., Васильева Л.В. Нефропротективная стратегия в лечении артериальной гипертензии как современная общемедицинская задача. Российский кардиологический журнал. 2018;23(12):107-118. DOI: 10.15829/1560-4071-2018-12-107-118.
- Viazzi F., Piscitelli P., Ceriello A., Fioretto P., Giorda C., Guida P. et al. Resistant hypertension, time-updated blood pressure values and renal outcome in type 2 diabetes mellitus. J. Am. Heart Assoc. 2017;6(9):e006745. DOI: 10.1161/JAHA.117.006745.
- Viazzi F., Greco E., Ceriello A., Fioretto P., Giorda C., Guida P. et al. Apparent treatment resistant hypertension, blood pressure control and the progression of chronic kidney disease in patients with type 2 diabetes. Kidney Blood Press. Res. 2018;43(2):422-438. DOI: 10.1159/000488255.
- Vrijens B., Antoniou S., Burnier M., de la Sierra A., Volpe M. Current situation of medication adherence in hypertension. Front. Pharmacol. 2017;8:100. DOI: 10.3389/fphar.2017.00100.
- Investigators Simplicity HTN-1. Catheter-based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months. Hypertension. 2011;57(5):911-917. DOI: 10.1161/HYPERTENSIONAHA.110.163014.
- Delacroix S., Chokka R.G., Nelson A.J., Wong D.T., Sidharta S., Peder-son S.M. et al. Renal sympathetic denervation increases renal blood volume per cardiac cycle: a serial magnetic resonance imaging study in resistant hypertension. Int. J. Nephrol. Renovasc. Dis. 2017;10:243-249. DOI: 10.2147/IJNRD.S131220.
- Mahfoud F., Cremers B., Janker J., Link B., Vonend O., Ukena C. et al. Renal hemodynamics and renal function after catheter-based renal sympathetic denervation in patients with resistant hypertension. Hypertension. 2012;60(2):419-424. DOI: 10.1161/HYPERTENSIONA-HA.112.193870.
- Singh R.R., Denton K.M. Renal denervation: А treatment for hypertension and chronic kidney disease. Hypertension. 2018;72(3):528-536. DOI: 10.1161/HYPERTENSIONAHA.118.10265.
- Пекарский С.Е., Мордовин В.Ф., Рипп Т.М., Фальковская А.Ю. Ренальная денервация в 2019 году. Сибирский медицинский журнал. 2019;34(3):21-32. DOI: 10.29001/2073-8552-2019-34-3-2132.
- Mahfoud F., Böhm M., Schmieder R., Narkiewicz K., Ewen S., Ruilope L. et al. Effects of renal denervation on kidney function and long-term outcomes: 3-year follow-up from the Global SYMPLICITY Registry. European Heart Journal. 2019;40(42):3474-3482. DOI: 10.1093/eu-rheartj/ehz118.
- Sakakura K., Ladich E., Cheng Q., Otsuka F., Yahagi K., Fowler D.R. et al. Anatomic assessment of sympathetic peri-arterial renal nerves in man. J. Am. Coll. Cardiol. 2014;64(7):635-643. DOI: 10.1016/j. jacc.2014.03.059.
- Mahfoud F., Tunev S., Ewen S., Cremers B., Ruwart J., Schulz-Jander D. et al. Impact of lesion placement on efficacy and safety of catheter-based radiofrequency renal denervation. J. Am. Coll. Cardiol. 2015;66(16):1766-1775. DOI: 10.1016/j.jacc.2015.08.018.
- Pekarskiy S., Baev A., Mordovin V., Sitkova E., Semke G., Ripp T. et al. Failure of renal denervation in SYMPLICITY HTN-3 is a predictable result of anatomically inadequate operative technique and not the true limitations of the technology. Journal of Hypertension. 2015;33(1):e108. DOI: 10.1097/01.hjh.0000467641. 39623.fb.
- Grassi G., Quarti-Trevano F., Seravalle G., Arenare F., Volpe M., Fu-riani S. et al. Early sympathetic activation in the initial clinical stages of chronic renal failure. Hypertension. 2011;57(4):846-851. DOI: 10.1161/HYPERTENSIONAHA.110.164780.
- Glassock R.J., Winearls C. Ageing and the glomerular filtration rate: truths and consequences. Trans. Am. Clin. Climatol. Assoc. 2009;120:419-428.
- Глыбочко П.В., Светанкова А.А., Родионов А.В., Мальцева А.С., Сулимов В.А., Фомин В.В. Ренальная денервация при резистентной артериальной гипертензии: результаты 5-летнего наблюдения. Терапевтический архив. 2018;09:88-91. DOI: 10.26442/ter-arkh201890988-91.
- Hering D., Marusic P., Duval J., Sata Y., Head G.A., Denton K.M. et al. Effect of renal denervation on kidney function in patients with chronic kidney disease. International. Int. J. Cardiol. 2017;232:93-97. DOI: 10.1016/j.ijcard.2017.01.047.
- Fadl Elmula F.E.M., Jin Y., Yang W.-Y., Thijs L., Lu Y.-C., Larstorp A.C. et al. Meta-analysis of randomized controlled trials of renal denervation in treatment-resistant hypertension. Blood Press. 2015;24(5):263-274. DOI: 10.3109/08037051.2015.1058595.
- Sanders M.F., Reitsma J.B., Morpey M., Gremmels H., Bots M.L., Pisa-no A. et al. Renal safety of catheter-based renal denervation: systematic review and meta-analysis. Nephrology Dialysis Transplantation. 2017;32(9):1440-1447. DOI: 10.1093/ndt/gfx088.
- Ott C., Mahfoud F., Schmid A., Toennes S.W., Ewen S., Ditting T. et al. Renal denervation preserves renal function in patients with chronic kidney disease and resistant hypertension. J. Hypertens. 2015;33(6):1261-1266. DOI: 10.1097/HJH.0000000000000556.
- Kiuchi M.G., Graciano M.L., Carreira M.A., Kiuchi T., Shaojie C., Lugon J. Long-term effects of renal sympathetic denervation on hypertensive patients with mild to moderate chronic kidney disease. J. Clin. Hypertens. (Greenwich). 2016;18(3):190-196. DOI: 10.1111/jch.12724.
- Sousa H., Branco P., de Sousa Almeida M., de Araujo Gonçalves P., Gaspar A., Dores H. et al. Changes in albumin-to-creatinine ratio at 12-month follow-up in patients undergoing renal denervation Rev. Port. Cardiol. 2017;36(5):343—351. DOI: 10.1016/j.repc.2016.09.019.
- Zhang Z.-H., Yang K., Jiang F.-L., Zeng L.-X., Jiang W.-H., Wang X.-Y. The effects of catheter-based radiofrequency renal denervation on renal function and renal artery structure in patients with resistant hypertension J. Clin. Hypertens. 2014;16(8):599-605. DOI: 10.1111/jch.12367.
- Ott C., Mahfoud F., Schmid A., Ditting T., Veelken R., Ewen S. et al. Improvement of albuminuria after renal denervation. Int. J. Card. 2014;173(2):311—315. DOI: 10.1016/j.ijcard.2014.03.017.
- Yao Y., Fomison-Nurse I.C., Harrison J.C., Walker R.J., Davis G., Sam-mut I.A. Chronic bilateral renal denervation attenuates renal injury in a transgenic rat model of diabetic nephropathy. Am. J. Physiol. Renal. Physiol. 2014;307(3):F251—F262. DOI: 10.1152/ajprenal.00578.2013.
- Yao Y., Davis G., Harrison J.C., Walker R.J., Sammut I.A. Renal functional responses in diabetic nephropathy following chronic bilateral renal denervation. Auton. Neurosci. 2017;204:98-104. DOI: 10.1016/j.aut-neu.2016.09.019.
- Ott C., Janka R., Schmid A., Titze S., Ditting T., Sobotka P.A. et al. Vascular and renal hemodynamic changes after renal denervation. Clin. J. Am. Soc. Nephrol. 2013;8(7):1195-1201. DOI: 10.2215/CJN.08500812.


