Рентгенэндоваскулярное лечение больных со стенотически-окклюзионным поражением аорто-подвздошного сегмента
Автор: Чернявин М.П., Белов Ю.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Литературные обзоры
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
Введение. Хроническая ишемия нижних конечностей - одно из самых распространенных проявлений атеросклеротической болезни у пациентов старшей возрастной группы. Стенотически-окклюзионное поражение аорто-подвздошного сегмента может наблюдаться более чем у 30 % таких больных. В настоящее время лечение таких пациентов может происходить хирургическими методами (эндартерэктомией, аорто-подвздошным или аорто-феморальным шунтированием). Отдаленные послеоперационные исследования демонстрируют удовлетворительные результаты, однако эти операции связаны с высоким риском осложнений и летальности. За последнее время произошли изменения взглядов на подходы к лечению этой патологии. Эндоваскулярные методы становятся все более предпочтительными, особенно у пациентов пожилого возраста, с тяжелой сопутствующей патологией даже при протяженных атеросклеротических поражениях сосудов.Заключение. В настоящее время, учитывая тенденцию к увеличению количества больных пожилого возраста с сопутствующей патологией, встречаемости тяжелого протяженного атеросклеротического заболевания, применение эндопротезирования может быть предпочтительной стратегией, особенно при сильно кальцинированных поражениях, когда существует повышенный риск разрыва сосуда. Это наиболее безопасный и эффективный метод реваскуляризации.
Хроническая ишемия нижних конечностей, аорто-подвздошный сегмент, реваскуляризация, забрюшинная гематома, стент-графт
Короткий адрес: https://sciup.org/142241727
IDR: 142241727 | УДК: 616-005.1-08 | DOI: 10.17238/2072-3180-2024-2-124-130
Текст обзорной статьи Рентгенэндоваскулярное лечение больных со стенотически-окклюзионным поражением аорто-подвздошного сегмента
Хроническая ишемия нижних конечностей (ХИНК) – одно из основных распространенных проявлений атеросклеротической болезни у пациентов особенно пожилого возраста, им страдают практически 20 % мужчин и женщин в возрасте старше 55 лет [1]. Стенотически-окклюзионное поражение аорто-подвздошного сегмента может наблюдаться более чем у 30 % таких больных [2].
В некоторых случаях это заболевание клинически проявляется описанной Леришем и Морелем триадой симптомов: перемежающейся хромотой, эректильной дисфункцией и отсутствием пульса на бедренной артерии. Отмечается вариабельность клинических проявлений: от бессимптомного течения до тяжелой ишемии нижних конечностей [3].
В настоящее время лечение таких пациентов может происходить хирургическими методами (эндартерэктомией, аорто-подвздошным или аортофеморальным шунтированием). Отдаленные послеоперационные исследования демонстрируют удовлетворительные результаты, однако эти операции связаны с высоким риском осложнений и летальности [4].
Для более молодых, без значимой сопутствующей патологией больных и больных с протяженными поражениями артерий открытая хирургия все еще может считаться предпочтительным вариантом. Однако с появлением эндоваскулярных методов лечение пациентов с ХИНК и поражением аорто-подвздошного сегмента (ангиопластики, стентирования или эндопротезирования) открытые операции отошли на второй план во многих клинических случаях [5].
Стенотически-окклюзионное поражение аорто-подвздошного сегмента: эпидемиология, классификация и клинические проявления.
По различным наблюдениям, пациенты с изолированным локальным поражением, у которых выявлена наследственная предрасположенность, длительное курение, гиперлипидемия и прочие факторы, чаще молодого возраста [6]. Больные с многоуровневыми диффузными атеросклеротическими изменениями сосудистой стенки, как правило, старше 55 лет, мужского пола и имеют сопутствующий сахарный диабет. По разным оценкам, распространенность стенотически-окклюзи-онного поражения аорто-подвздошного сегмента колеблется от 15 % до 25 % у пациентов старше 70 лет, но в эту группу не входят бессимптомные больные, которых сложно отследить [7].
Анатомическая классификация стенотически-окклюзион-ного поражения аорто-подвздошного сегмента основана на ее протяженности: тип 1 ограничен инфраренальной брюшной аортой и проксимальными сегментами общих подвздошных артерий, тип 2 включает наружные подвздошные артерии, а тип 3 распространяется на бедренно-подколенный сегмент [8]. В настоящее время в клинической практике активно применяется классификация TASC-II, которая включает локализацию, протяженность, выраженность заболевания, а также предпочтительную тактику лечения.
Клинически у пациентов наблюдается перемежающаяся хромота, эректильная дисфункция у мужчин. Это прогрессирующее заболевание, однако благодаря наличию коллатеральной артериальной сети нижней конечности не всегда отмечается резкое ухудшение состояния вплоть до ишемической боли в покое и некротических изменений тканей, в некоторых случаях заболевание протекает бессимптомно [9]. При физикальном осмотре у больных обычно отмечается снижение или отсутствие пульса на бедренной артерии, хотя нижняя конечность может казаться хорошо кровоснабжаемой, а иногда может даже ощущаться пульс на стопе. Односторонние признаки и симптомы указывают на поражение подвздошной артерии, а двусторонние предполагают вовлечение дистального отдела аорты и/или ее бифуркации [5].
Лечение пациентов с ХИНК и стенотически-окклюзи-онным поражением аорто-подвздошного сегмента.
Консервативная тактика ведения таких пациентов направлена на снижение факторов риска атеросклероза, замедление прогрессирования заболевания и облегчение симптомов. Оптимальная медикаментозная терапия применяется независимо от того планируется ли вмешательство, рекомендовано при любой стадии ХИНК [10].
Прекращение курения имеет первостепенное значение. В исследованиях было продемонстрировано, что отказ от курения улучшает переносимость физической нагрузки у пациентов с ХИНК [11]. Применение статинов снижает частоту серьезных неблагоприятных сердечно-сосудистых событий, а также замедляет прогрессирование заболевания. В некоторых исследо- ваниях было показано, что аспирин снижает частоту серьезных неблагоприятных сердечно-сосудистых событий в этой группе больных [12]. В исследовании «COMPASS» отмечена эффективность и безопасность применения низких доз ривароксабана в комбинации с аспирином [13]. А по данным исследования «CAPRIE», использование клопидогреля привело к снижению на 8,7% риска смерти, инфаркта миокарда и острого нарушения мозгового кровообращения по сравнению с использованием аспирина [14]. Оптимальная медикаментозная терапия также связана со снижением частоты ампутаций у пациентов с ХИНК, которым проведено хирургическое вмешательство [15].
По данным классификации TASC II, поражение аорто-подвздошного сегмента классифицировано на типы A–D на основе степени стеноза, наличия и протяженности окклюзионных поражений. Традиционно при поражениях TASC A эндоваскулярные вмешательства являлись операцией выбора, при TASC B и C говорилось о потенциально возможной эндоваскулярной реваскуляризации, но реконструктивная операция оказывалась предпочтительнее (особенно при TASC C), при TASC D открытое хирургическое вмешательство рекомендовалось операцией выбора [16]. Однако эти устоявшиеся взгляды на лечение больных с ХИНК были пересмотрены в клинической практике. Описаны эндоваскулярные методы лечения пациентов с поражениями типа C и D с хорошими ближайшими и отдаленными результатами. В мета-анализе 66 исследований (9319 пациентов), сравнивавших эндоваскулярное и открытое хирургическое лечение больных с поражением аорто-подвздошной области TASC C и D, летальность в течение месячного наблюдения была ниже у пациентов после эндоваскулярного лечения, чем после открытой операции (0,79 % против 3%; р<0,01) [17]. В другом исследовании, включавшем 74 пациентов, перенесших бифуркационное стентирование по сравнению с открытым аорто-бифеморальным шунтированием, не обнаружено различий в первичной проходимости через 5 лет наблюдения (84,1 % против 88,3 %; р=0,454) [18]. При поражениях TASC C и D в мета-анализе 16 исследований сообщалось о высоком техническом успехе эндоваскулярного лечения в 92 % и хорошей проходимости в 88,7 % в течение 12 месяцев [19].
Выбор метода реваскуляризации в зависимости от операционного риска для пациентов с сопутствующими заболеваниями и целей самой операции является сложным вопросом особенно в наше время. Известно, что ведущей причиной периоперационных осложнений является инфаркт миокарда, частота которого у пациентов, перенесших открытую операцию, значительно выше [20]. Хроническая обструктивная болезнь легких и терминальная стадия почечной недостаточности также связаны с плохой отдаленной выживаемостью. У таких пациентов предпочтение отдается миниинвазивным подходам [21].
Значительные достижения в области эндоваскулярных технологий в настоящее время расширили их роль в лечении больных благодаря высокой эффективности и безопасности. Однако проблемы, связанные с осложнениями в месте доступа, повреждением сосуда и дистальной эмболией все еще актуаль- ны. Развитие эндоваскулярных методов началось с применения баллонной ангиопластики, которая при стенотическом поражении подвздошных артерий считается успешной, если по данным ангиографии остаточный стеноз составляет менее 30 % и отсутствует ограничивающая кровоток диссекция интимы сосуда [22]. Позже стали использовать внутрисосудистые стенты, которые обеспечили более надежную механическую поддержку для сохранения внутреннего просвета сосуда [23].
В рандомизированных контролируемых исследованиях продемонстрирована высокая эффективность и многообещающие долгосрочные клинические результаты при использовании стентов с лекарственным покрытием при локальных атеросклеротических поражениях [24]. Однако риск развития рестеноза в стенте оставался высок. Имплантация стентов значимо повлияла на результаты лечения: успешность реваскуляризации в раннем послеоперационном периоде увеличивалась более чем до 98,7 % [25]. Долгосрочная проходимость зависит от нескольких факторов, таких как первоначальное увеличение диаметра просвета, ремоделирование артерий и гиперплазия интимы.
В мета-анализе, в котором результаты аорто-подвздошной баллонной ангиопластики сравнивались с результатами установки стента, было продемонстрировано, что показатель первичной проходимости за 4 года, без учета технических неудач, составил 68 % при ангиопластике и 77 % при стентировании [26].
Появление стент-графтов открыло новые возможности эндоваскулярной хирургии атеросклеротического поражения подвздошных артерий. Если раньше их имплантация рассматривалась только при аневризмах или перфорациях после баллонной ангиопластики и стентирования, сейчас предложены новые подходы к применению эндопротезов сразу после реканализации и баллонной ангиопластики стенотически-ок-клюзивного поражения аорто-подвздошного сегмента с целью снижения рисков осложнений как в раннем, так и в отдаленном послеоперационных периодах [25].
За последнее время эндоваскулярная хирургия достигла хороших результатов лечения пациентов с хронической ишемией нижних конечностей. Успешность лечения больных с поражением подвздошного сегмента артерий превышает 90 % при лечении стенозов и более 80 % при лечении окклюзий [27]. Неудовлетворительные результаты реваскуляризации могут зависеть от невозможности реканализации, остаточного гемодинамически значимого стеноза, диссекции артерии, ограничивающей кровоток, поэтому появляются новые методики, совершенствуются технологии – это дает возможность расширения показаний для внутрисосудистых вмешательств у пациентов, которым ранее были доступны лишь реконструктивные операции.
Использование стент-графтов, которые состоят из металлического стента с биологически совместимым полимерным покрытием, позволило значимо ограничить неоинтимальное врастание по всей длине имплантируемого устройства и тем самым улучшить проходимость сосуда. Теоретические преимущества стент-графтов многообразны: они могут предотвращать диссекцию артерии и ее перфорацию, а также ограничивать ремоделирование сосуда, инфильтрацию тканей и гиперплазию интимы [28].
Однако, по данным ранних исследований, отмечались проблемы, связанные с использованием эндолюминальных стент-графтов, такие как ранняя тромбогенность, отсроченная окклюзия, вызванная гиперплазией интимы на проксимальном или дистальном конце стент-графта из-за жесткости стент-графта или из-за врастания неоинтимы через ткань при большом размере пор [29].
По данным нашего исследования, проведенного в отделении рентгенхирургических методов диагностики и лечения, и хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции (РХМДиЛ и ХЛСНРСиЭ) на базе ФГБУ «Клиническая больница № 1» (Волынская) Управления делами Президента РФ (г. Москва), в которое вошли 128 больных с ХИНК (I группа (n=69) – имплантация стента, II – группа (n=59) – эндопротезирование), отмечено, что эндопротезирование при стенотически-оклюзионном поражении аорто-подвздошного сегмента артерий является наиболее безопасной и эффективной методикой реваскуляризации. Не было выявлено ни одного случая интраоперационного геморрагического осложнения или раннего тромбоза стент-графта. Напротив, частота серьезных осложнений после стентирования подвздошной артерии (перфорация артерии с формированием забрюшинной гематомы) составляла 7 % (χ2=4,14; df=1; р=0,041), причем в 3 % (χ2=1,69; df=1; р=0,193) наблюдений отмечен летальный исход. С 2021 года в нашей клинике отмечается значительное увеличение количества имплантаций стент-графтов в область аорто-подвздошного сегмента (рис. 1).
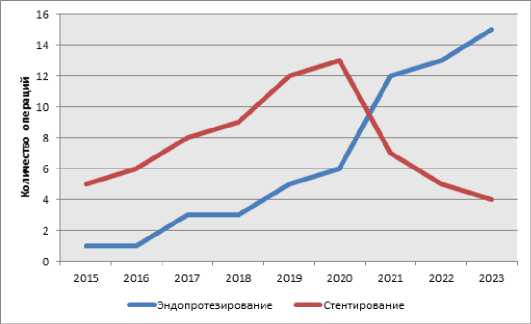
Рис. 1. График изменения количества операций в отделении РХМДиЛ, и ХЛСНРСиЭ ФГБУ «Клиническая больница № 1» (Волынская) Управления делами Президента РФ
Fig. 1. Schedule of changes in the number of operations in the department of X-ray surgical methods of diagnosis and treatment, and surgical treatment of complex cardiac arrhythmias and electrocardiostimulation on the basis of the Federal State Budgetary Institution «Clinical Hospital № 1» (Volynskaya) of the Office of the President of the Russian Federation
По данным крупнейшего многоцентрового исследования Maldonado T.S. с коллегами, включавшего данные 91 (56 мужчин [62 %]) пациентов с ХИНК и стенотически-окклюзионным поражением аорто-подвздошного сегмента, технический успех эндопротезирования составил 100 %; месячная летальность – 1 % (1/91). Через 1 год у 73% пациентов наблюдалось значимое улучшение клинического состояния. Девяти пациентам (10 %) потребовались повторные вмешательства. Во все исследуемые периоды показатели первичной проходимости составляли более 90 %, а показатели вторичной проходимости 100 % [30].
Заключение
Лечение больных с ХИНК и стенотически-окклюзионным поражением аорто-подвздошного сегмента может быть выполнено с помощью различных методов, включая консервативные, открытую реконструкцию и малоинвазивные технологии. По мере накопления опыта и развития медицины эндоваскулярная реваскуляризация продемонстрировала эффективность и безопасность у большинства пациентов, даже в случаях более сложных и протяженных поражениях сосудистого русла. Учитывая тенденцию к увеличению количества пациентов пожилого возраста с сопутствующей патологией, встречаемости тяжелого атеросклеротического заболевания, в настоящее время использование эндопротезирования может быть предпочтительной стратегией, особенно при сильно кальцинированных поражениях, когда существует повышенный риск разрыва сосуда. Это наиболее безопасный и эффективный метод реваскуляризации. По данным многих исследований, благодаря имплантации стент-графтов уже удалось кардинально снизить число осложнений и значимо увеличить возможность сохранения жизнеспособности конечностей у большого количества больных.
Список литературы Рентгенэндоваскулярное лечение больных со стенотически-окклюзионным поражением аорто-подвздошного сегмента
- Aronow W.S., Ahn C., Gutstein H. Prevalence and incidence of cardiovascular disease in 1160 older men and 2464 older women in a longterm health care facility. J Gerontol A Biol Sci Med Sci., 2002, № 57(1), рр. M45-M46. https://doi.org/10.1093/gerona/57.1.m45
- Синявин Г.В., Винокуров И.А., Мнацаканян Г.В., Белов Ю.В. Эпидемиология и патогенез острой ишемии нижних конечностей. Кардиология и сердечно-сосудистая хирургия, 2019. № 12(4). С. 291- 295.
- Покровский А.В., Абугов С.А., Алекян Б.Г., Аракелян В.С., Белов Ю.В. и др. Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей.Российский согласительный документ. Москва, 2013.
- Белов Ю.В., Синявин Г.В., Винокуров И.А., Мнацаканян Г.В. Частные аспекты острой ишемии нижних конечностей. Кардиология и сердечно-сосудистая хирургия, 2019. № 12(6). С. 564-567. [
- Paisley M.J., Adkar S., Sheehan B.M., Stern J.R. Aortoiliac occlusive disease. Semin Vasc Surg., 2022, Jun; № 35(2), рр. 162-171. https://doi.org/10.1053/j.semvascsurg.2022.04.005
- Krug R.T., Calligaro K.D., Dougherty M.J. Claudication in the young patient. Perspect Vasc Surg Endovasc Ther., 2000, № 13, рр. 27-38.
- Selvin E., Erlinger T.P. Prevalence of and risk factors for peripheral arterial disease in the United States: results from the National Health and Nutrition Examination Survey, 1999-2000. Circulation, 2004, № 110(6), рр. 738-743. https://doi.org/10.1161/01.CIR.0000137913.26087.F0
- Wooten C., Hayat M., du Plessis M. et al. Anatomical significance in aortoiliac occlusive disease. Clin Anat., 2014, № 27(8), рр. 1264-1274. https://doi.org/10.1002/ca.22444
- Katsaros I., Georgakarakos E., Frigkas K. et al. Arterial collateral circulation pathways in patients with aortoiliac occlusive disease. Vascular, 2019, № 27, рр. 677-683.
- Aboyans V., Ricco J.B., Bartelink M.E.L. et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Rev Esp Cardiol (Engl Ed), 2018, № 71(2), рр. 111. https://doi.org/10.1016/j.rec.2017.12.014
- Fowler B., Jamrozik K., Norman P., Allen Y., Wilkinson E. Improving maximum walking distance in early peripheral arterial disease: randomised controlled trial. Aust J Physiother, 2002, № 48(4), рр. 269-275. https://doi.org/10.1016/s0004-9514(14)60166-5
- Hess C.N., Norgren L., Ansel G.M. et al. A Structured Review of Antithrombotic Therapy in Peripheral Artery Disease With a Focus on Revascularization: A TASC (InterSociety Consensus for the Management of Peripheral Artery Disease) Initiative. Circulation, 2017, № 135(25), рр. 2534-2555. https://doi.org/10.1161/CIRCULATIONAHA.117.024469
- Steffel J., Eikelboom J.W., Anand S.S., Shestakovska O., Yusuf S., Fox K.A.A. The COMPASS Trial: Net Clinical Benefit of Low-Dose Rivaroxaban Plus Aspirin as Compared With Aspirin in Patients With Chronic Vascular Disease Circulation, 2020, № 142(1), рр. 40-48. https://doi.org/10.1161/CIRCULATIONAHA.120.046048
- CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet, 1996, № 348(9038), рр. 1329-1339. https://doi.org/10.1016/s0140-6736(96)09457-3
- Zil-E-Ali A., Medina D., Orozco D., Yang Q., Aziz F. Preoperative Statin Use is Associated With Lower Incidence of Limb Loss After Lower Extremity Endovascular Interventions. Am Surg., 2022, № 88(11), рр. 2719-2729. https://doi.org/10.1177/00031348211068000
- Norgren L., Hiatt W.R., Dormandy J.A. et al. Inter-society consensus for the management of peripheral arterial disease. Int Angiol., 2007, № 26(2), рр. 81-157.
- Salem M., Hosny M.S., Francia F. et al. Management of Extensive Aorto-Iliac Disease: A Systematic Review and Meta-Analysis of 9319 Patients. Cardiovasc Intervent Radiol., 2021, № 44(10), рр. 1518-1535. https://doi.org/10.1007/s00270-021-02785-6
- Squizzato F., D’Oria M., Bozza R., Porcellato L., Grego F., Lepidi S.. Propensity-Matched Comparison of Endovascular versus Open Reconstruction for TASC-II C/D AortoIliac Occlusive Disease. A Ten-Year Single-Center Experience with Self-Expanding Covered Stents. Ann Vasc Surg., 2021, № 71, рр. 84-95. https://doi.org/10.1016/j.avsg.2020.08.139
- Ye W., Liu C.W., Ricco J.B., Mani K., Zeng R., Jiang J. Early and late outcomes of percutaneous treatment of TransAtlantic Inter-Society Consensus class C and D aorto-iliac lesions. J Vasc Surg., 2011, № 53(6), рр. 1728-1737. https://doi.org/10.1016/j.jvs.2011.02.005
- Bredahl K., Jensen L.P., Schroeder T.V., Sillesen H., Nielsen H., Eiberg J.P. Mortality and complications after aortic bifurcated bypass procedures for chronic aortoiliac occlusive disease. J Vasc Surg., 2015, № 62(1), рр. 75-82. https://doi.org/10.1016/j.jvs.2015.02.025
- Khashram M., Williman J.A., Hider P.N., Jones G.T., Roake J.A. Systematic Review and Meta-analysis of Factors Influencing Survival Following Abdominal Aortic Aneurysm Repair. Eur J Vasc Endovasc Surg., 2016, № 51(2), рр. 203-215. https://doi.org/10.1016/j.ejvs.2015.09.007
- Haimivici H., ed. Haimovici’s Vascular Surgery. 5th ed. Oxford, UK: Blackwell Publishing Ltd, 2004. https://doi.org/10.1002/9781118481370
- Koizumi A., Kumakura H., Kanai H. et al. Ten-year patency and factors causing restenosis after endovascular treatment of iliac artery lesions. Circ J.. 2009, № 73(5), рр. 860-866. https://doi.org/10.1253/circj.cj08-0765
- Lakhter V., Aggarwal V. Current Status and Outcomes of Iliac Artery Endovascular Intervention. Interv Cardiol Clin., 2017, № 6(2), рр. 167-180. https://doi.org/10.1016/j.iccl.2016.12.001
- Yang M., Zhang B., Niu G., Yan Z., Tong X., Zou Y. Long-term results of endovascular reconstruction for aortoiliac occlusive disease. Quant Imaging Med Surg, 2021, № 11(4), рр. 1303-1312. https://doi.org/10.21037/qims-20-599
- Bosch J.L., Hunink M.G.M. Meta-analysis of the results of percutaneous transluminal angioplasty and stent placement of aortoiliac occlusive disease. Radiology, 1997, № 204, рр. 87-96.
- Lammer J., Dake M.D., Bleyn J. et al. Peripheral arterial obstruction: prospective study of treatment with a transluminally placed selfexpanding stent-graft. International Trial Study Group. Radiology, 2000, № 217(1), рр. 95-104. https://doi.org/10.1148/radiology.217.1.r00se0595
- Tomoi Y., Takahara M., Soga Y. et al. Clinical outcome of endovascular therapy using a VIABAHN VBX-covered stent for complex aortoiliac artery disease: the AVOCADO II study. Heart Vessels. 2023, № 38(10), рр. 1288-1297. https://doi.org/10.1007/s00380-023-02274-5
- Maynar M., Reyes R., Ferral H. et al. Cragg Endopro-I: early experience in femoral arteries. J Vasc Interv Radiol, 1997, № 8, рр. 203-207.
- Maldonado T.S., Westin G.G., Jazaeri O., Mewissen M., Reijnen M.M., Dwivedi A.J., Garrett H.E. Jr., Dias Perera A., Shimshak T., Mantese V., Smolock C.J., Arthurs Z.M. Treatment of Aortoiliac Occlusive Disease with the Endologix AFX Unibody Endograft. Eur J Vasc Endovasc Surg., 2016, Jul; № 52(1), рр. 64-74. https://doi.org/10.1016/j.ejvs.2016.04.003


