Рентгенэндоваскулярное лечение клапанного стеноза аорты в сочетании с ишемической болезнью сердца: систематический обзор
Автор: Алекян Б.Г., Титов Н.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 2 т.28, 2024 года.
Бесплатный доступ
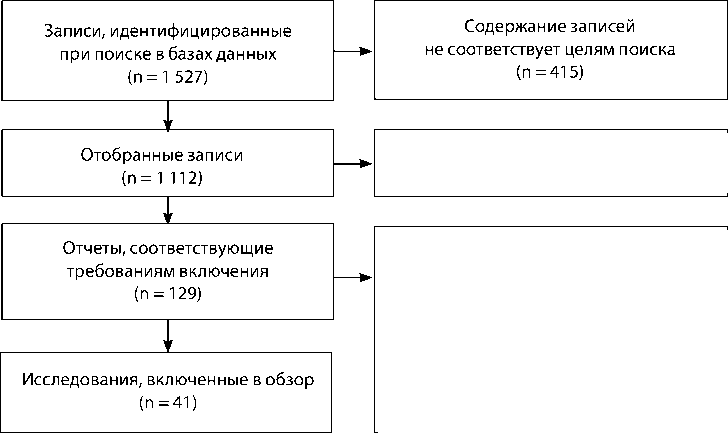
Цель. Оценить и сравнить эффективность и безопасность одномоментных и этапных чрескожных коронарных вмешательств и транскатетерных имплантаций аортального клапана. Методы. Поиск источников проводили в базах данных PubMed, Google Scholar и Cochrane Library по ключевым словам. Отобрали наиболее цитируемые исследования, содержащие данные о подходах к эндоваскулярному лечению пациентов с ишемический болезнью сердца и аортальным стенозом при помощи одномоментных и этапных чрескожного коронарного вмешательства и транскатетерной имплантации аортального клапана. Анализировали показатели выживаемости, осложнений и других конечных точек исследований, а также влияние очередности вмешательств на исходы лечения. Результаты. При поиске по ключевым словам в базах данных выявили 1 527 оригинальных источников, из которых в обзор включили 60: проспективные и ретроспективные исследования, а также последние рекомендации профессиональных сообществ по сердечно-сосудистым заболеваниям, данные статистики оперативных вмешательств и заболеваемости, фундаментальные работы. Приблизительно в 70 % случаев используют этапный подход, при котором сначала выполняют чрескожное коронарное вмешательство, а затем транскатетерную имплантацию аортального клапана. В большинстве работ при сравнении различных подходов не выявлено достоверной разницы по конечным точкам, в госпитальном периоде их частота, как правило, в пределах 3 %, а в отдаленном — до 30 %. Тем не менее при детальном анализе частоты определенных контрольных точек в ряде работ выявлены противоречия. Заключение. Несмотря на активное изучение результатов одномоментных и этапных чрескожных коронарных вмешательств и транскатетерных имплантаций аортального клапана, ответ на вопрос о том, какой подход лучше, не определен. Последовательность вмешательств не отражена в современных рекомендациях, большинство крупных работ носит ретроспективный характер, а их выводы неоднозначны. Необходимы дополнительные проспективные исследования, чтобы определить категории пациентов, которым та или иная очередность операций принесет наибольшую пользу.
Аортальный стеноз, ишемическая болезнь сердца, транскатетерная имплантация аортального клапана, чрескожное коронарное вмешательство
Короткий адрес: https://sciup.org/142241017
IDR: 142241017 | DOI: 10.21688/1681-3472-2024-2-7-20
Текст научной статьи Рентгенэндоваскулярное лечение клапанного стеноза аорты в сочетании с ишемической болезнью сердца: систематический обзор
Цитировать: Алекян Б.Г., Титов Н.С. Рентгенэндоваску-лярное лечение клапанного стеноза аорты в сочетании с ишемической болезнью сердца: систематический обзор. Патология кровообращения и кардиохирургия. 2024;28(2):7-20.
How to cite: Alekian B.G., Titov N.S. Endovascular treatment of aortic valve stenosis in combination with coronary artery disease: a systematic review. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2024;28(2):7-20. (In Russ.) https://doi. org/10.21688/1681-3472-2024-2-7-20
B.G. Alekian, https://orcid. org/0000-0001-6509-566X
N.S. Titov, https://orcid. org/0000-0002-5151-4920
Клапанный стеноз аорты (КСА) — тяжелый порок сердца. В зависимости от этиологии выделяют врожденный, ревматический и дегенеративный стеноз [1; 2].
Склерозирование створок аортального клапана и начальный этап дегенеративного аортального стеноза схожи с патогенезом атеросклероза и включают накопление липопротеинов c выработкой IgM-антител к ним, мононуклеарную инфильтрацию и кальциноз створок клапана, а также связаны с тем же набором факторов риска: гиперлипидемия, курение табака и малоподвижный образ жизни [3; 4]. Исходя из этого взрослые пациенты с КСА должны быть дообследованы на наличие ишемической болезни сердца (ИБС).
Однородная клиническая картина КСА и ИБС существенно затрудняет определение ведущего заболевания, что напрямую влияет на тактику лечения. Единственным радикальным методом лечения КСА у взрослых является открытое или транскатетерное протезирование. Однако ИБС значительно повышает периоперационный риск этих вмешательств. Необходимость реваскуляризации миокарда в большинстве случаев должна быть верифицирована либо внутрисосудистыми физиологическими исследованиями коронарного кровотока, либо лучевыми методами, способными показать наличие или отсутствие жизнеспособного миокарда. У пациентов с КСА ввиду общего состояния и коморбидности применение данных методов может быть затруднительным, а результаты — недостоверными.
Рентгенэндоваскулярное лечение ИБС и КСА прочно вошло в клиническую практику, однако при сочетании патологий этапность и сроки выполнения чрескожного коронарного вмешательства (ЧКВ) и транскатетерной имплантации аортального клапана (ТИАК) в российских, европейских и американских рекомендациях профессиональных обществ не определены [5–7]. Цель обзора — проанализировать результаты одномоментных и этапных ТИАК и ЧКВ у пациентов с КСА и ишемической болезнью сердца.
Методы
Для поиска литературы использовали базы данных PubMed, Google Scholar и Cochrane Library, содержащие информацию о ТИАК в сочетании с эндоваскулярным лечением ИБС. Статьи отбирали в соответствии с принципами составления систематического обзора Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) 2020.
Проанализировали работы, опубликованные до 31 декабря 2023 г., по ключевым словам transcatheter aortic valve implantation (TAVI), percutaneous coronary intervention (PCI), aortic stenosis (AS), coronary artery disease (CAD). Главные критерии включения: пациенты в возрасте от 18 лет с КСА и ИБС; сравнение результатов одномоментных и этапных ТИАК и ЧКВ; наличие данных о больших кардиальных и цереброваскулярных событиях после ТИАК и ЧКВ; публикации на английском языке. Критерии исключения: повторяющиеся данные, отчеты без публикации полного текста, клинические случаи. Конечными точками изучения являлись смерть, инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК) в госпитальном и отдаленном периодах. Анализ статей на соответствие критериям включения/исключения независимо выполняли авторы статьи, изучая публикации на языке первоисточника, при наличии разногласий достигали консенсуса обсуждением. Кроме того, использовали данные статистики, фундаментальных работ и рекомендаций по лечению сердечно-сосудистых заболеваний (ССЗ). Всего для цитирования в обзоре отобрали 60 источников литературы, из которых 41 — исследования по ТИАК и ЧКВ, выполненных одномоментно или этапно (рисунок) .
Результаты
В систематический обзор вошли наиболее крупные и цитируемые исследования, которые опубликованы в ведущих журналах по профилям «кардиология» и «сердечно-сосудистая хирургия» и содержат данные об исходах ТИАК и ЧКВ, выполненных одномоментно или этапно у пациентов с КСА и ишемической болезнью сердца.
Эпидемиология
По данным М. Vaduganathan и соавт., в 2021 г. ИБС была лидирующей патологией в структуре ССЗ и причиной летальных исходов более чем 9 млн человек во всем мире [8]. Согласно отчету Росстата, в 2021 г. заболеваемость ИБС составила 5 064,8 на 100 тыс. человек населения, а общая смертность по этой причине — 507 800 человек [9].
Дегенеративный аортальный стеноз в развитых странах стоит на третьем месте среди наиболее распространенных CCЗ после ИБС и артериальной гипертензии с частотой от 0,4 % в общей популяции до 1,7 % среди лиц старше 65 лет [10]. Значительный объем операций при тяжелом аортальном стенозе выполняется эндоваскулярно. Например, в США в 2021 г. проведено 82 тыс. ТИАК, что составило 88 % яицакифитнедИ

гниниркС
{ {
Отбор исследований
Повторяющиеся записи (n = 983)
Исключенные отчеты (n = 88):
• серии клинических случаев (n = 11)
• невозможно ознакомиться с полным текстом (n = 54)
• неподходящий дизайн исследования (n = 23)
от всех вмешательств по поводу КСА [11]. В Российской Федерации в 2022 г. выполнено 7 279 операций протезирования аортального клапана, из них 5 632 — при дегенеративном пороке [12]. Страна находится в общемировом тренде ежегодного увеличения числа ТИАК, но темп роста гораздо ниже: в 2022 г. проведено всего 1 585 вмешательств [13].
Частота встречаемости ИБС у больных тяжелым аортальным стенозом в исследованиях варьируется от 15 до 80 %, в среднем составляя около 60 % [14; 15]. Большой разброс обусловлен неоднородностью выборок, отличающихся критериями включения и исключения: в первую очередь возрастом пациентов и уровнем кардиохирургического риска. Так, у лиц с высоким хирургическим риском частота встречаемости ИБС особенно высока: в исследовании CoreValve US Extreme Risk она составила 81,8 % [15]. У пациентов с аортальным стенозом промежуточного риска ИБС присутствовала в 67,8 % случаев [16].
В когорте пациентов с тяжелым КСА, которым выполнили ТИАК, ИБС наблюдалась не менее чем в 40 % случаев, и у многих поражение носило многососудистый характер [17; 18]. Такую статистику коморбидности можно объяснить критериями отбора больных, так как, согласно рекомендациям Европейского общества кардиологов (англ. European Society of Cardiology, ESC) по лечению клапанных пороков сердца 2021 г., ТИАК — метод выбора у пациентов с тяжелым аортальным стенозом высокого кардиохирургического риска (STS-PROM/ EuroSCORE II > 8 %) и/или старше 75 лет (класс ре- комендаций I, уровень доказательности А) и может быть рассмотрена у больных с умеренным риском (класс рекомендаций I, уровень доказательности B [5].
Таким образом, с учетом большого количества пациентов с КСА и ИБС, а также увеличения доли транскатетерных вмешательств при КСА вопрос выбора стратегии прямой реваскуляризации миокарда становится еще более актуальным.
Изучение анатомии коронарного русла у пациентов с клапанным стенозом аорты
Самым распространенным методом диагностики ИБС остается селективная коронарография. В рекомендациях ESC по лечению клапанных пороков сердца 2021 г. она определена как предоперационное обследование пациентов с тяжелым КСА вне зависимости от вида предполагаемого хирургического вмешательства. Согласно рекомендациям, процедура обязательно должна выполняться в следующих случаях: наличие любого ССЗ в анамнезе; систолическая дисфункция левого желудочка (ЛЖ); предполагаемая клинически (ангинозные боли в покое и при нагрузке) или доказанная инструментально (положительные неинвазивные стресс-тесты) ишемия миокарда; хотя бы один фактор риска ССЗ; возраст старше 40 лет у мужчин, постменопауза у женщин (класс рекомендаций I, уровень доказательности C) [5].
Необходимо крайне осторожно относиться к клиническим исследованиям лечения пациентов с ИБС в анамнезе, перенесших ТИАК, так как они могут различаться определением значимого стеноза коронарных артерий, что прямо влияет на составление выборки [14]. В то время как в ряде публикаций значимым считается стеноз ≥ 50 %, в рекомендациях Американской коллегии кардиологов / Американской кардиологической ассоциации / Общества сердечно-сосудистой ангиографии и интервенций (англ. American College of Cardiology / American Heart Association / Society for Cardiovascular Angiography and Interventions, ACC/AHA/SCAI) по стабильной ИБС 2017 г. показанием к реваскуляризации является сужение просвета коронарной артерии более 70 % [19–22]. В рекомендациях ESC по реваскуляризации миокарда 2018 г. по ангиографическим критериям только стенозы ≥ 90 % определяются как гемодинамически значимые [6].
Мультиспиральная компьютерная томография (МСКТ) коронарных артерий все чаще рассматривается как альтернатива селективной коронарографии [23]. У пациентов – кандидатов на ТИАК проведение МСКТ – ангиографии с синхронизацией по электрокардиографии от уровня дуги аорты до уровня артерий подвздошно-бедренного сегмента включительно является обязательным, так как необходимо для подбора размера протеза и определения доступа для операции. Также во время исследования оценивают вероятность обструкции устьев коронарных артерий, распределение кальцинатов на створках и фиброзном кольце аортального клапана, подбирают размеры баллонных катетеров для вальвулопластики и постдилатации, определяют оптимальные проекции для позиционирования клапана [24].
Разумеется, было бы предпочтительно оценивать коронарное русло на этапе планирования операции, так как это позволит избежать инвазивной процедуры с дополнительным введением контрастного вещества, которое увеличивает риск для пациента. Однако специфичность и прогностическая значимость МСКТ – коронарографии снижаются по мере увеличения степени выраженности коронарного атеросклероза [25]. Кроме того, метод позволяет лишь анатомически оценить имеющиеся поражения коронарного русла, что далеко не всегда достаточно для определения показаний к реваскуляризации миокарда.
Измерение фракционного резерва кровотока (ФРК) — надежный метод функциональной оценки и определения гемодинамической значимости стенозов коронарных артерий, однако его диагностическая точность при увеличенной постнагрузке на ЛЖ достоверно не установлена [26]. Помимо увели- чения давления в ЛЖ при КСА часто возникает компенсаторная концентрическая гипертрофия ЛЖ, которая, с одной стороны, помогает поддержать сердечный выброс и отсрочить сердечную недостаточность, но, с другой, может нарушать микроциркуляцию и влиять на коронарную гемодинамику и физиологические показатели [27]. Недостоверность измерения ФРК до ТИАК связывают с недостаточным ответом сосудистой стенки на введение аденозина из-за исходной гиперактивации симпатоадреналовой и ренин-ангиотензиновой систем, а также низким микрососудистым сопротивлением в покое и повышенным при гиперемии вследствие структурных и функциональных изменений микроциркуляции при гипертрофии левого желудочка [28].
Если отдельно рассматривать фазы сердечного цикла, то меньше всего КСА влияет на коронарную гемодинамику в диастолу желудочков, включая безволновой период [29]. В связи с этим вошедшее в клиническую практику определение моментального резерва кровотока (МРК) считается более надежным методом, поскольку не требует введения вазодилататора и менее подвержено влиянию степени аортального стеноза, так как выполняется именно в безволновой период [14]. R. Scarsini и со-авт. предлагают использовать гибридный подход при физиологических исследованиях у пациентов с КСА и ИБС, комбинируя МРК и ФРК. Согласно предложенному алгоритму, если при коронарографии выявлены пограничные стенозы коронарных артерий, то в первую очередь измеряется МРК. При значении < 0,83 реваскуляризация однозначно рекомендована, при значении > 0,93 — не показана. Если значение находится в промежутке от 0,83 до 0,93, то сначала выполняют ТИАК, а потом измеряют ФРК, по которому и определяют окончательные показания к реваскуляризации с использованием стандартного порогового значения 0,8 [30].
Перспективной разработкой является МСКТ – коронарография с ФРК (ФРК–КТ), при которой математически моделируется коронарный кровоток с его последующей функциональной оценкой [31].
Одномоментные чрескожное коронарное вмешательство и транскатетерная имплантация аортального клапана
Главные преимущества данного подхода — возможность использовать один и тот же доступ (в случае если ТИАК выполняется через артериальный доступ) для обоих вмешательств, что позволяет избежать повторных артериальных пункций, и потенциальное снижение стоимости лечения за счет сокращения числа койко-дней [14; 32]. Z. Tran и со-авт. в крупном ретроспективном анализе оценивали результаты лечения 5 843 пациентов, прооперированных в США с 2016 по 2018 г. Больных разделили на три группы: первую составили 843 (14,4 %) пациента после одномоментных ЧКВ и ТИАК; вторую — 745 (12,7 %) после этапных ЧКВ и ТИАК, выполненных в одну госпитализацию; третью — 4 255 (72,8 %) после этапных ЧКВ и ТИАК, выполненных в разные госпитализации. Согласно результатам, одномоментное выполнение вмешательств, по сравнению с ранним и поздним этапными, экономически более выгодно и ассоциировано с более низкой частотой острого повреждения почек, несмотря на то, что, как правило, при одномоментных ЧКВ и ТИАК пациент получает больший объем контрастного вещества (6,32 % при одномоментных операциях против 27,5 % при этапных за одну госпитализацию и 12,5 % при этапных в разные госпитализации, p < 0,001) [33].
Среди недостатков одномоментных ЧКВ и ТИАК выделяют потребность в большем объеме контрастного вещества за один раз и, соответственно, более высокий риск контраст-индуцированной нефропатии, длительность вмешательства, которая влияет на дозу поглощенного облучения и утомляемость операционной бригады, а также необходимость использования инструментария больших размеров (14 Fr и более) для доставки клапана в условиях двойной антиагрегантной терапии, что потенциально повышает риск кровотечений [14; 32]. Тем не менее Y. Yang и соавт. в метаанализе, включавшем четыре исследования с общим количеством пациентов 209, не выявили достоверной разницы между группами одномоментных и этапных ЧКВ и ТИАК по 30-дневной летальности [отношение шансов (ОШ) 1,47, 95% доверительный интервал (ДИ) 0,47– 4,62; p = 0,51], почечной недостаточности [OШ 3,22, 95% ДИ 0,61–17,12; p = 0,17], перипро-цедурному ИМ [OШ 1,44, 95% ДИ 0,12–16,94; p = 0,77], жизнеугрожающему кровотечению [OШ 0,45, 95% ДИ 0,11–1,87; p = 0,27] или ОНМК [OШ 3,41, 95% ДИ 0,16–74,2; p = 0,44] [17]. В уже упомянутой работе Z. Tran и соавт. госпитальная смертность между группами ЧКВ и ТИАК, выполненных одномоментно, этапно за одну госпитализацию и в разные госпитализации, достоверно не различалась (0,79 %, 1,89 % и 1,62 % соответственно, p = 0,34) [33].
Отдаленные результаты исследований ЧКВ и ТИАК демонстрируют отсутствие достоверной разницы между одномоментным и этапными подходами. Согласно данным T. Ochiai и соавт., двух- летние большие кардио- и цереброваскулярные осложнения (англ. Major Adverse Cardiovascular and Cerebrovascular Events, MACCE) не различались у пациентов после одномоментного (n = 77) и этапного (n = 181) выполнения ЧКВ и ТИАК. Для одномоментных вмешательств против ЧКВ 1-м этапом и ТИАК 2-м этапом отношение рисков (ОР) составило 0,92, 95% ДИ 0,52–1,66; p = 0,79; для ТИАК 1-м этапом и ЧКВ 2-м этапом против ЧКВ 1-м этапом и ТИАК 2-м этапом — ОР 0,45, 95% ДИ 0,18–1,16; p = 0,10 [34]. Эти результаты соответствуют данным более ранней проспективной работы M. Barbanti и соавт., в которой у пациентов после одноэтапных ЧКВ и ТИАК, ТИАК при отсутствии ИБС и ТИАК без реваскуляризации миокарда в течение 2 лет частота комбинированной конечной точки (смерть, ИМ, инвалидизи-рующий ОНМК) достоверно не различалась (ТИАК и ЧКВ — 10,4 %, ТИАК у пациентов без ИБС — 14,8 %, ТИАК без реваскуляризации миокарда — 15,4 %, p = 0,765) [35].
Чрескожное коронарное вмешательство первым этапом, транскатетерная имплантация аортального клапана — вторым
Данный подход к реваскуляризации миокарда применяется чаще всего. Например, согласно анализу T. Rheude и соавт., в регистре REVASC-TAVI из 2 402 пациентов ЧКВ перед ТИАК выполнили 1 357 (65,6 %) [36]. К преимуществам подхода относят беспрепятственный доступ к устьям коронарных артерий, снижение риска перипроцедурного ИМ при ТИАК и уменьшенный расход контрастного вещества за одно вмешательство, что снижает риск кон-траст-индуцированной нефропатии. Недостатками считают осуществление отдельного артериального доступа, высокий риск интраоперационных осложнений и гемодинамической нестабильности при ЧКВ из-за КСА, необходимость предварительного приема двойной антиагрегантной терапии [14; 32].
В большинстве опубликованных работ достоверно не установлено, что ЧКВ перед ТИАК приводит к лучшим результатам по сравнению с ЧКВ вторым этапом или двумя вмешательствами одномоментно. R.A. Kotronias и соавт. в метаанализе продемонстрировали, что сроки выполнения ЧКВ (совместно с ТИАК или перед ней) не влияли на результаты лечения [18]. По данным метаанализов Y. Yang и соавт. и Z. Tran и соавт., проведение ЧКВ до или во время ТИАК достоверно не влияло на результаты, однако в работе Z. Tran и соавт. при сравнении исходных характеристик пациенты из одномоментной группы были менее коморбидны, чем из ранней или поздней этапных (индекс Эликсхаузер (стандартное отклонение) составил 4,93 (1,63) против 5,71 (1,55) и 5,15 (1,61) соответственно) [17; 33]. В работе T. Rheude и соавт. частота двухлетней комбинированной конечной точки (смерть от всех причин, ОНМК, ИМ, повторные госпитализации по поводу сердечной недостаточности) была сопоставимой среди пациентов, которым выполняли два вмешательства одномоментно или ЧКВ — первым этапом, и значительно более высокой по сравнению с больными, которым проводили ЧКВ после ТИАК (30,0 %, 30,4 % и 17,4 % соответственно, p < 0,01) [36].
Транскатетерная имплантация аортального клапана первым этапом, чрескожное коронарное вмешательство — вторым
К преимуществам выполнения ЧКВ после ТИАК относят низкий риск гемодинамической нестабильности при реваскуляризации миокарда, возможность получения более достоверных результатов физиологических исследований коронарного русла (МРК/ФРК), уменьшенный расход контрастного вещества за одно вмешательство и снижение риска кровотечений за счет возможности введения двойной антиагрегантной терапии уже после имплантации клапана [14; 32].
Главный недостаток подхода — необходимость выполнения ЧКВ через ячейки каркаса са-мораскрывающегося протеза аортального клапана. M. Barbanti и соавт. в исследовании RE-ACCESS оценили возможность катетеризации коронарных артерий у 300 пациентов после ТИАК и отметили, что через каркас клапанов CoreValve Evolut R/PRO (Medtronic, Миннеаполис, США) в 14 (4,7 %) и 12 (4,0 %) случаях устья ствола левой коронарной артерии и правой коронарной артерии соответственно катетеризировать не удалось. Еще у 36 (12,0 %) пациентов в случае ствола левой коронарной артерии и у 95 (31,7 %) — в случае правой коронарной артерии устья артерий смогли катетеризировать только полуселективно. Также при катетеризации устьев коронарных артерий после ТИАК возрастало количество затраченного времени и контрастного вещества, и наиболее существенно — при имплантации протезов CoreValve Evolut R/PRO [37].
Это особенно важно в свете выполнения экстренных вмешательств у пациентов с имплантированным транскатетерным протезом. В исследовании L. Faroux и соавт. в группе пациентов с ТИАК в анамнезе по сравнению с больными без ТИАК были больше время «дверь – баллон» (40 [межквартильный размах 25–57] мин против 30 [25–35] мин, p = 0,003), общее время вмешательства (46 [37–69] мин против 36 [25–49] мин, p < 0,001), время флюороскопии (18,3 [10,1–24,5] мин против 10,1 [6,4–16,0] мин, p < 0,001), объем использованного контрастного вещества (170 [120–130] мл против 146 [110–185] мл, p < 0,008). Что более важно, у 5 (4,2 %) пациентов с имплантированным клапаном вовсе не удалось восстановить кровоток по инфаркт-связанной артерии в связи с невозможностью катетеризации устьев [38]. С учетом увеличения количества выполняемых ТИАК по всему миру вероятность столкнуться в клинической практике с подобной ситуацией также будет расти.
Кроме того, по мнению экспертов Европейской ассоциации чрескожных сердечно-сосудистых вмешательств (англ. European Association of Percutaneous Cardiovascular Interventions, EAPCI) и ESC, выполнение ЧКВ через каркас ранее установленного клапана сопряжено с меньшей устойчивостью и поддержкой гайд-катетера, а также потенциально может привести к дислокации протеза [32].
J.J.L. Yap и K.W. Ho предлагают следующие приемы для упрощения доступа к устьям коронарных артерий и безопасного выполнения ЧКВ у пациента с транскатетерным протезом аортального клапана: аортография для определения пространственных отношений устьев и протеза, применение катетеров с меньшей кривизной (например, Judkins Left 3,5 см вместо Judkins Right 4,0 см), использование стандартного диагностического проводника 0,035” с J-образным кончиком при манипуляции катетером, катетеризация по заведенному интракоронарно проводнику, использование гайд-экстензоров и деликатное удаление гайд-катетера по коронарному проводнику. Кроме того, при выполнении самой ТИАК с высоким риском обструкции устьев коронарных артерий авторы рекомендуют рассмотреть стентирование по технике «дымоход» или предварительное рассечение створки клапана (процедура BASILICA) [39]. Для последней уже разработана специальная электрохирургическая система TELLTALE (идентификатор ClinicalTrials.gov: NCT05666713).
M. Lunardi и соавт. в ретроспективном анализе приводят данные 144 пациентов после ЧКВ и ТИАК, из которых у 68 % коронарный этап выполняли после имплантации клапана. У 113 (78,4 %) больных ЧКВ было сопряжено с высоким риском (незащищенный ствол левой коронарной артерии, трехсосудистое поражение, проксимальное поражение передней межжелудочковой ветви или правой коронарной артерии при правом типе коронарного кровоснабжения), в связи с чем этих пациентов выделили в отдельную группу. Согласно двухлетним результатам, частота ОНМК была ниже среди пациентов, которым выполняли ЧКВ после ТИАК вне зависимости от тяжести поражения коронарного русла (6,5 % в группе ЧКВ до ТИАК против 0,0 % в группе ЧКВ после ТИАК, p = 0,031; среди пациентов с ЧКВ высокого риска 9,3 против 0,0 % соответственно, p = 0,025). Выживаемость без MACCE по истечении 2 лет была ниже среди пациентов, которым выполняли ЧКВ до ТИАК (84,4 против 97,9 %, скорректированное ОР 10,16, 95% ДИ 1,19–86,57; p = 0,019; среди пациентов с ЧКВ высокого риска 84,4 против 97,3 %, скорректированное ОР 7,34, 95% ДИ 0,78–62,28; p = 0,082) [40].
T. Rheude и соавт. сравнили три подхода к эндоваскулярному лечению ИБС и КСА и показали, что в группе пациентов, которым выполняли ЧКВ после ТИАК, по сравнению с одномоментными вмешательствами или предварительным ЧКВ, были ниже двухлетняя частота смерти от всех причин (6,8 %, 20,1 % и 20,6 % соответственно, p < 0,01) и ОНМК (0,3 %, 7,9 % и 4,0 % соответственно, p < 0,01). Частота повторных госпитализаций из-за сердечной недостаточности составила 6,9 %, что меньше, чем при ЧКВ первым этапом (8,5 %), но больше, чем при одномоментном лечении (3,0 %, p < 0,01). Авторы делают вывод, что именно выполнение ЧКВ после ТИАК позволяет достигнуть наилучших результатов. Обусловлено это тем, что за счет снижения постнагрузки на ЛЖ после устранения КСА возможно адекватно выполнить внутрисосудистые физиологические исследования коронарных артерий и получить лучшие результаты реваскуляризации. Кроме того, выполнение ЧКВ при КСА может компрометировать системную гемодинамику и стать причиной нарушения почечного или церебрального кровотока [36].
Влияние ишемической болезни сердца на исходы транскатетерной имплантации аортального клапана
Несмотря на огромное количество пациентов с ИБС и КСА, а также возможность проводить по этому поводу эндоваскулярные вмешательства в той или иной последовательности, не решен вопрос о том, насколько в целом велико влияние сопутствующей ИБС на выживаемость пациентов после ТИАК. В литературе отражены противоречивые результаты.
По данным некоторых одноцентровых исследований, наличие ИБС не влияет на выживаемость больных после ТИАК. J.B. Masson и соавт. отмеча- ют, что 30-дневная и годичная выживаемость после ТИАК достоверно не различалась среди пациентов с разной степенью выраженности поражения коронарных артерий по шкале Duke Myocardial Jeopardy Score (DMJS) [41]. G.P. Ussia и соавт. не выявили достоверной разницы по частоте MACCE в течение 12 мес. после ТИАК у пациентов с ИБС в анамнезе и без таковой (15,7 против 18,3 %, ОР 0,76, 95% ДИ 0,42–1,36; p = 0,353) [42].
В других исследованиях установлено обратное. T.M. Dewey и соавт. продемонстрировали, что общая смертность после ТИАК у пациентов с ИБС была почти в два раза выше, чем у больных без ИБС [ОШ 20,3, 95% ДИ 2,4–172,3; p = 0,006], а 30-дневная смертность — в 10 раз выше [ОШ 10,1, 95% ДИ 2,1– 174,8; p = 0,009] [43]. По данным M.Z. Khawaja и со-авт., у пациентов с остаточным значением SYNTAX Score > 9 была выше годичная и 30-дневная смертность после ТИАК, чем у больных со значением SYNTAX Score < 9 (20,7 против 34,3 % и 3,7 против 11,3 %). При сравнении групп пациентов из этой же когорты, но сформированных только по ангиографическому критерию, достоверной разницы по тем же показателям 30-дневной или годичной смертности не получено (6,7 против 7,5 % и 21,5 против 23,7 %; log-rank p = 0,805). Это еще раз подтверждает вывод, что при интерпретации результатов любого исследования крайне важно обращать внимание на его дизайн [44].
K. Sankaramangalam и соавт. в метаанализе, включавшем более 8 000 пациентов из 15 исследований, показали, что ИБС в анамнезе не влияла на 30-дневную смертность от всех причин после ТИАК [ОШ 1,07, 95% ДИ 0,82–1,40; p = 0,62], но годичная смертность от всех причин была значительно выше в группе пациентов с ИБС [ОШ 1,21, 95% ДИ 1,07– 1,36; p = 0,002] [45]. В метаанализе F. D’Ascenzo и со-авт., который включал 13 исследований с общим количеством пациентов 8 334, установлено, что ИБС в анамнезе не влияла на 30-дневную или годичную смертность после ТИАК [ОШ 1,57, 95% ДИ 0,71–3,46 и ОШ 1,25, 95% ДИ 0,74–2,11], но при мультивари-антном анализе пациенты с показателем SYNTAX Score > 22 умирали чаще [ОШ 1,71, 95% ДИ 1,24– 2,36], а среди больных, перенесших ЧКВ, с резидуальным SYNTAX Score < 8 годичная смертность была ниже [ОШ 0,34, 95% ДИ 0,012–0,93]. Авторы делают вывод, что показатели SYNTAX Score и резидуальный SYNTAX Score могут быть полезными инструментами при отборе пациентов для реваскуляризации миокарда, которым предстоит или уже выполнена транскатетерная имплантация [46].
Вопрос влияния непосредственно реваскуляризации миокарда на результаты ТИАК также остается спорным. Например, в работе M. Abdel-Wahab и со-авт. смертность в течение 30 дней и 6 мес. в группе из 55 пациентов (трем из которых ТИАК и ЧКВ выполнили одномоментно, а остальным — этапно) достоверно не отличалась от группы из 70 пациентов исходно без значимых поражений коронарных артерий, которым провели только ТИАК (2,0 против 6,0 %, p = 0,027 и 9,0 против 14,0 %, p = 0,42 соответственно) [47]. В то же время S.S. Goel и соавт. сравнили результаты ЧКВ между группами пациентов с тяжелым КСА (n = 254) и без КСА (n = 508). 30-дневная смертность не различалась между группами (4,3 % [11 из 254] против 4,7 % [24 из 508], ОР 0,93, 95% ДИ 0,51–1,69; p = 0,2), но была достоверно выше среди пациентов с фракцией выброса менее 30 % (5,4 % [7 из 45] против 1,2 % [4 из 209]; p < 0,001) и показателем по шкале Общества торакальных хирургов (англ. Society of Thoracic Surgeons, STS score) 10 и более баллов (10,4 % [10 из 96] против 0 %; p < 0,001), что может существенно повлиять на тактику лечения ИБС у пациентов высокого риска с тяжелым КСА, которым может быть выполнена транскатетерная имплантация аортального клапана [48].
Подобные противоречивые выводы также делают авторы метаанализов о влиянии реваскуляризации миокарда на результаты ТИАК. N. Lateef и соавт. проанализировали итоги лечения 5 580 пациентов из 11 когорт и не выявили разницы между группами ТИАК с предшествующим ЧКВ и без него по 30-дневной и годичной смертности от всех причин [OШ 1,30, 95% ДИ 0,85–1,98; p = 0,22, I2 = 37,5 % и ОШ 1,19, 95% ДИ 0,92–1,52; p = 0,18, I2 = 0,0 %], частоте ОНМК [OШ 0,7, 95% ДИ 0,36–1,45; p = 0,36, I2 = 32,8 %], ИМ [OШ 2,71, 95% ДИ 0,55–2,23; p = 0,22, I2 = 41,3 %], острого повреждения почек [OШ 0,7, 95% ДИ 0,46–1,06; p = 0,08, I2 = 14,4 %] [49]. По данным R.A. Kotronias и соавт., которые провели метаанализ 9 исследований с общим числом пациентов 3 858, были достоверно выше 30-дневная смертность [ОШ 1,42, 95% ДИ 1,08–1,87; p = 0,01] и частота сосудистых осложнений [ОШ 1,86, 95% ДИ 1,33–2,60; p = 0,0003] среди тех, кому выполнили ЧКВ перед или во время ТИАК, по сравнению с теми, кому провели только ТИАК. При этом не получена достоверная разница по 30-дневной смертности от сердечно-сосудистых причин [ОШ 1,03, 95% ДИ 0,35–2,99], годичной смертности [ОШ 1,05, 95% ДИ 0,71–1,5], частоте ИМ [ОШ 0,86, 95% ДИ 0,14–5,28], острого повреждения почек [ОШ 0,89, 95% ДИ 0,42–1,88], ОНМК [ОШ 1,07, 95% ДИ 0,38–2,97] [18].
Одной из немногих проспективных рандомизированных работ, сравнивающих результаты выполнения ЧКВ перед ТИАК и только ТИАК без реваскуляризации миокарда у пациентов с ИБС и тяжелым аортальным стенозом, является исследование ACTIVATION, опубликованное T. Patterson и соавт. в 2021 г. Согласно дизайну, пациенты с функциональным классом стенокардии по классификации Канадского кардиологического общества (англ. Canadian Cardiovascular Society, CCS) ≤ 2, со значимым поражением коронарных артерий и сопутствующим тяжелым КСА случайным образом были распределены в две группы, в одной из которых выполняли ЧКВ перед ТИАК (n = 119), а в другой проводили только ТИАК без реваскуляризации миокарда (n = 116). По частоте смертности и повторной госпитализации в течение 1 года группы достоверно не различались (41,5 против 44,0 % соответственно, p = 0,067), при этом среди пациентов группы ЧКВ и ТИАК частота кровотечений была существенно выше, чем среди перенесших только ТИАК (44,5 против 28,4 % соответственно, p = 0,021). Авторы сделали вывод, что при отсутствии у пациента выраженной стенокардии (функциональный класс CCS ≥ 3) нет необходимости выполнять ЧКВ перед ТИАК. Существенное ограничение данной работы — очень небольшое количество пациентов с трехсосудистым поражением (n = 3) или поражением ствола левой коронарной артерии (n = 9) [50].
Некоторые авторы оценивали влияние полноты реваскуляризации миокарда на исходы больных после ТИАК. G. Costa и соавт. в наиболее крупном исследовании REVASC-TAVI изучали результаты лечения 1 314 пациентов, которых поровну разделили на группы по критерию неполной или полной реваскуляризации миокарда, достигнутой при этапных или одномоментных ЧКВ и ТИАК. Анализ показал, что ни госпитальные, ни отдаленные (2 года) результаты достоверно не различались [51]. J.M. Paradis и со-авт. сравнивали две группы пациентов после ЧКВ и ТИАК: с резидуальным SYNTAX Score ≥ 8 (n = 37) и < 8 (n = 17). Достоверно не различалась частота комбинированной конечной точки (30-дневная: 5,4 против 0 % соответственно, p = 0,33; годичная: 10,8 против 0 %, p = 0,16), смерти от всех причин (30-дневная: 2,7 против 0 %, p = 0,49; годичная: 8,1 против 0 %, p = 0,23), смерти от ССЗ (30-дневная: 0 против 0 %; годичная: 0 против 0 %), ИМ (30-дневная: 0 против 0 %; годичная: 0 против 0 %) и ОНМК (30-дневная: 2,7 против 0 %, p = 0,49; годичная: 2,7 против 0 %, p = 0,49) [52].
Обсуждение
Согласно рекомендациям ESC по реваскуляризации миокарда 2018 г., у пациентов, которым планируется ТИАК, рекомендовано рассмотреть выполнение ЧКВ при наличии стеноза > 70 % в проксимальных сегментах коронарных артерий (класс рекомендаций IIa, уровень доказательности С). Тем не менее в документе не обозначен ключевой момент эндоваскулярного лечения ИБС и КСА, а именно сроки и этапность выполнения ЧКВ и ТИАК [6]. Американская коллегия кардиологов предлагает собственный алгоритм принятия решения о выполнении ЧКВ у больных, идущих на ТИАК. Согласно данному алгоритму, выполнение ЧКВ рекомендовано до или одномоментно с ТИАК у пациентов со стенозом > 70 % в проксимальном сегменте эпикардиальной артерии и со стенозом > 50 % ствола левой коронарной артерии. Если у больного присутствует поражение не в проксимальном сегменте, то только при наличии явных признаков стенокардии напряжения рекомендовано ЧКВ до ТИАК. Кроме того, если после имплантации клапана доступ к коронарным артериям будет ограничен, то также рекомендовано рассмотреть ЧКВ до ТИАК [53]. На момент написания данной статьи опубликован только один экспертный консенсусный документ Европейской ассоциации чрескожных сердечно-сосудистых вмешательств совместно с рабочей группой ESC по сердечно-сосудистой хирургии, в котором наиболее детально отражены преимущества и недостатки каждого подхода. При эндоваскулярном лечении пациентов с ИБС и КСА выполнение ЧКВ возможно либо до ТИАК, либо одномоментно, либо после имплантации клапана [32].
Как было показано, в зарубежной литературе существует достаточное количество работ об эффективности одномоментного или этапных подходов, но большинство из них носит ретроспективный характер и не дает однозначного ответа на вопрос об оптимальных сроках проведения ЧКВ и ТИАК, что является существенным ограничением. Кроме того, при изучении результатов одномоментных и этапных вмешательств просматривается предвзятость в отношении отбора пациентов: как правило, одномоментные вмешательства выполняют у лиц с «менее тяжелым» поражением коронарного русла (одно- и двухсосудистое поражение) или у менее коморбидных больных, как указано в работе Z. Tran и соавт. [33]. В связи с этим имеющиеся данные не дают полноценного ответа, какая такти- ка является оптимальной или как отбирать пациентов для того или иного подхода. На практике многие интервенционные кардиологи предпочитают выполнять ЧКВ первым этапом. Согласно данным из 147 европейских клиник L. Rosseel и соавт., так поступают в 72 % случаев [54]. Данный подход сугубо технический и обусловлен тем, что в случае выполнения ЧКВ при установленном самораскрываю-щемся клапане CoreValve Evolut, который является одной из самых популярных моделей, вероятнее всего, селективная катетеризация, а также проведение инструментария в коронарное русло будут затруднительными. Такие ситуации, действительно, нередки, однако указанный подход делает невозможной достоверную функциональную оценку коронарного русла или верификацию ишемии миокарда за счет наличия компрометированной гемодинамики. Со временем технические проблемы катетеризации через платформу клапанов CoreValve будут устранены, так как компания Medtronic уже зарегистрировала новую модель протеза Evolut FX+, каркас которого имеет увеличенную в 4 раза боковую ромбовидную ячейку для обеспечения облегченного доступа к устьям коронарных артерий . В связи с этим стоит ожидать крупных проспективных рандомизированных исследований, авторы которых не будут учитывать технический аспект выполнения операций, что позволит полноценно оценить клинические исходы эндоваскулярного лечения ИБС и клапанного стеноза аорты.
Заключение
Тактика лечения пациентов с КСА и сопутствующей ИБС однозначно не определена. Существующие рекомендации и крупные исследования основаны преимущественно на данных ретроспективных работ. Результаты многих из них противоречивы, но в большинстве не выявлена достоверная разница по показателям смертности, ИМ, ОНМК в госпитальном, 30-дневном и отдаленном периодах при сравнении одномоментного и этапных подходов. Тем не менее очевидна необходимость проспективных исследований, так как на основании имеющихся данных крайне трудно выработать единый подход к данной категории пациентов.
Список литературы Рентгенэндоваскулярное лечение клапанного стеноза аорты в сочетании с ишемической болезнью сердца: систематический обзор
- Shang M., Kahler-Quesada A., Mori M., Yousef S., Geirsson A., Vallabhajosyula P. Progression of aortic stenosis in patients with bicuspid aortic valve. J Card Surg. 2021;36(12):4665-4672. PMID: 34585444. https://doi.org/10.1111/jocs.16026
- Okor I., Bob-Manuel T., Garikapati K., Baldawi H., Gillies C., Ibebuogu U.N. Transcatheter aortic valve replacement in rheumatic aortic stenosis: a comprehensive review. Curr Probl Cardiol. 2021;46(12):100843. PMID: 33994024. https://doi.org/10.1016/j.cpcardiol.2021.100843
- Burdeynaya A.L., Afanasieva O.I., Ezhov M.V., Klesareva E.A., Saidova M.A., Pokrovsky S.N. Lipoprotein(a) and its autoantibodies in association with calcific aortic valve stenosis. Diseases. 2023;11(1):43. PMID: 36975592; PMCID: PMC10047835. https://doi.org/10.3390/diseases11010043
- Stritzke J., Linsel-Nitschke P., Markus M.R.P., Mayer B., Lieb W., Luchner A., Döring A., Koenig W., Keil U., Hense H.-W., Schunkert H.; MONICA/KORA Investigators. Association between degenerative aortic valve disease and long-term exposure to cardiovascular risk factors: results of the longitudinal population-based KORA/MONICA survey. Eur Heart J. 2009;30(16):2044-2053. PMID: 19608594. https://doi.org/10.1093/eurheartj/ehp287
- Vahanian A., Beyersdorf F., Praz F., Milojevic M., Baldus S., Bauersachs J., Capodanno D., Conradi L., De Bonis M., De Paulis R., Delgado V., Freemantle N., Gilard M., Haugaa K.H., Jeppsson A., Jüni P., Pierard L., Prendergast B.D., Sádaba J.R., Tribouilloy C., Wojakowski W.; ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561-632. Erratum in: Eur Heart J. 2022;43(21):2022. PMID: 34453165. https://doi.org/10.1093/eurheartj/ehab395
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U., Byrne R.A., Collet J.-P., Falk V., Head S.J., Jüni P., Kastrati A., Koller A., Kristensen S.D., Niebauer J., Richter D.J., Seferovic P.M., Sibbing D., Stefanini G.G., Windecker S., Yadav R., Zembala M.O.; ESC Scientific Document Group. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87-165. Erratum in: Eur Heart J. 2019;40(37):3096. PMID: 30165437. https://doi.org/10.1093/eurheartj/ehy394
- Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F., Jneid H., Krieger E.V., Mack M., McLeod C., O'Gara P.T., Rigolin V.H., Sundt T.M. 3rd, Thompson A., Toly C. 2020 ACC/AHA Guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):e35-e71. Erratum in: Circulation. 2021;143(5):e228. Erratum in: Circulation. 2021;143(10):e784. PMID: 33332149. https://doi.org/10.1161/CIR.0000000000000932
- Vaduganathan M., Mensah G., Turco J., Fuster V., Roth G.A. The global burden of cardiovascular diseases and risk: A сompass for future health. J Am Coll Cardiol. 2022;80(25):2361-2371. PMID: 36368511. https://doi.org/10.1016/j.jacc.2022.11.005
- Окладников С.М., Никитина С.Ю., Александрова Г.А., Ахметзянова Р.Р., Голубев Н.А., Кириллова Г.Н., Огрызко Е.В., Оськов Ю.И., Романенко О.И., Харькова Т.Л., Чумарина В.Ж. Здравоохранение в России. 2023: стат. сб. М.: Росстат, 2023. 179 с. Okladnikov S.M., Nikitina S.Yu., Aleksandrova G.A., Ahmetzyanova R.R., Golubev N.A., Kirillova G.N., Ogryzko E.V., Oskov Yu.I., Romanenko O.I., Harkova T.L., Chumarina V.Zh. Healthcare in Russia. 2023. Statistical collection. Moscow: Rosstat Publ.; 2023. 179 p.
- Lindman B.R., Clavel M.-A., Mathieu P., Iung B., Lancellotti P., Otto C.M., Pibarot P. Calcific aortic stenosis. Nat Rev Dis Primers. 2016;2:16006. PMID: 27188578; PMCID: PMC5127286. https://doi.org/10.1038/nrdp.2016.6
- Sharma T., Krishnan A.M., Lahoud R., Polomsky M., Dauerman H.L. National trends in TAVR and SAVR for patients with severe isolated aortic stenosis. J Am Coll Cardiol. 2022;80(21):2054-2056. PMID: 36122626. https://doi.org/10.1016/j.jacc.2022.08.787
- Бокерия Л.А., Милиевская Е.Б., Прянишников В.В., Юрлов И.А. Сердечно-сосудистая хирургия – 2022. Болезни и врожденные аномалии системы кровообращения. М.: НМИЦ ССХ им. А.Н. Бакулева Минздрава России, 2023. 344 с. Bokeriya L.A., Milievskaya E.B., Pryanishnikov V.V., Yurlov I.A. Cardiovascular surgery – 2022. Diseases and congenital anomalies of the circulatory system. Moscow: Bakulev National Medical Research Center for Cardiovascular Surgery Publ.; 2023. 344 p. (In Russ.)
- Алекян Б.Г., Григорьян А.М., Стаферов А.В., Карапетян Н.Г. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации – 2021 год. Эндоваскулярная хирургия. Специальный выпуск. 2022;9:S5-S254. https://doi.org/10.24183/2409-4080-2022-9S-S5-S254 Alekyan B.G., Grigoryan A.M., Staferov A.V., Karapetyan N.G. X-ray endovascular diagnosis and treatment of heart and vascular diseases in the Russian Federation — 2021. Endovaskulyarnaya hirurgiya = Russian Journal of Endovascular Surgery. Special Edition. 2022;9:S5-S254. (In Russ.) https://doi.org/10.24183/2409-4080-2022-9S-S5-S254
- de Azevedo Filho A.F., Accorsi T.A., Ribeiro H.B. Coronary artery disease in patients with aortic stenosis and transcatheter aortic valve implantation: implications for management. Eur Cardiol. 2021;16:e49. PMID: 34950245; PMCID: PMC8674631. https://doi.org/10.15420/ecr.2021.27
- Popma J.J., Adams D.H., Reardon M.J., Yakubov S.J., Kleiman N.S., Heimansohn D., Hermiller J. Jr, Hughes G.C., Harrison J.K., Coselli J., Diez J., Kafi A., Schreiber T., Gleason T.G., Conte J., Buchbinder M., Deeb G.M., Carabello B., Serruys P.W., Chenoweth S., Oh J.K.; CoreValve United States Clinical Investigators. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63(19):1972-1981. PMID: 24657695. https://doi.org/10.1016/j.jacc.2014.02.556
- Leon M.B., Smith C.R., Mack M.J., Makkar R.R., Svensson L.G., Kodali S.K., Thourani V.H., Tuzcu E.M., Miller D.C., Herrmann H.C., Doshi D., Cohen D.J., Pichard A.D., Kapadia S., Dewey T., Babaliaros V., Szeto W.Y., Williams M.R., Kereiakes D., Zajarias A., Greason K.L., Whisenant B.K., Hodson R.W., Moses J.W., Trento A., Brown D.L., Fearon W.F., Pibarot P., Hahn R.T., Jaber W.A., Anderson W.N., Alu M.C., Webb J.G.; PARTNER 2 Investigators. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374(17):1609-1620. PMID: 27040324. https://doi.org/10.1056/NEJMoa1514616
- Yang Y., Huang F.-Y., Huang B.-T., Xiong T.-Y., Pu X.-B., Chen S.-J., Chen M., Feng Y. The safety of concomitant transcatheter aortic valve replacement and percutaneous coronary intervention: a systematic review and meta-analysis. Medicine (Baltimore). 2017;96(48):e8919. PMID: 29310382; PMCID: PMC5728783. https://doi.org/10.1097/MD.0000000000008919
- Kotronias R.A., Kwok C.S., George S., Capodanno D., Ludman P.F., Townend J.N., Doshi S.N., Khogali S.S., Généreux P., Herrmann H.C., Mamas M.A., Bagur R. Transcatheter aortic valve implantation with or without percutaneous coronary artery revascularization strategy: a systematic review and meta-analysis. J Am Heart Assoc. 2017;6(6):e005960. PMID: 28655733; PMCID: PMC5669191. https://doi.org/10.1161/JAHA.117.005960
- Gohmann R.F., Lauten P., Seitz P., Krieghoff C., Lücke C., Gottschling S., Mende M., Weiß S., Wilde J., Kiefer P., Noack T., Desch S., Holzhey D., Borger M.A., Thiele H., Abdel-Wahab M., Gutberlet M. Combined coronary CT-Angiography and TAVI-planning: a contrast-neutral routine approach for ruling-out significant coronary artery disease. J Clin Med. 2020;9(6):1623. PMID: 32471233; PMCID: PMC7356559. https://doi.org/10.3390/jcm9061623
- Malebranche D., Hoffner M.K.M., Huber A.T., Cicovic A., Spano G., Bernhard B., Bartkowiak J., Okuno T., Lanz J., Räber L., Praz F., Stortecky S., Windecker S., Pilgrim T., Gräni C. Diagnostic performance of quantitative coronary artery disease assessment using computed tomography in patients with aortic stenosis undergoing transcatheter aortic-valve implantation. BMC Cardiovasc Disord. 2022;22(1):178. PMID: 35436856; PMCID: PMC9014581. https://doi.org/10.1186/s12872-022-02623-8
- Matsumoto S., Yamada Y., Hashimoto M., Okamura T., Yamada M., Yashima F., Hayashida K., Fukuda K., Jinzaki M. CT imaging before transcatheter aortic valve implantation (TAVI) using variable helical pitch scanning and its diagnostic performance for coronary artery disease. Eur Radiol. 2017;27(5):1963-1970. PMID: 27562479. https://doi.org/10.1007/s00330-016-4547-4
- Patel M.R., Calhoon J.H., Dehmer G.J., Grantham J.A., Maddox T.M., Maron D.J., Smith P.K. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 appropriate use criteria for coronary revascularization in patients with stable ischemic heart disease: a report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. J Nucl Cardiol. 2017;24(5):1759-1792. Erratum in: J Nucl Cardiol. 2018;25(6):2191-2192. PMID: 28608183. https://doi.org/10.1007/s12350-017-0917-9
- Francone M., Budde R.P.J., Bremerich J., Dacher J.N., Loewe C., Wolf F., Natale L., Pontone G., Redheuil A., Vliegenthart R., Nikolaou K., Gutberlet M., Salgado R. CT and MR imaging prior to transcatheter aortic valve implantation: standardisation of scanning protocols, measurements and reporting-a consensus document by the European Society of Cardiovascular Radiology (ESCR). Eur Radiol. 2020;30(5):2627-2650. Erratum in: Eur Radiol. 2020;30(7):4143-4144. PMID: 31489471; PMCID: PMC7160220. https://doi.org/10.1007/s00330-019-06357-8
- Blanke P., Weir-McCall J.R., Achenbach S., Delgado V., Hausleiter J., Jilaihawi H., Marwan M., Nørgaard B.L., Piazza N., Schoenhagen P., Leipsic J.A. Computed tomography imaging in the context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR): an expert consensus document of the Society of Cardiovascular Computed Tomography. JACC Cardiovasc Imaging. 2019;12(1):1-24. PMID: 30621986. https://doi.org/10.1016/j.jcmg.2018.12.003
- Knaapen P. Computed tomography to replace invasive coronary angiography? Circ Cardiovasc Imaging. 2019;12(2):e008710. PMID: 30764640. https://doi.org/10.1161/CIRCIMAGING.119.008710
- Mylotte D., Wijns W. Anatomical or functional assessment of coronary artery disease in aortic stenosis: haven't we been down this road before? J Am Heart Assoc. 2019;8(22):e014367. PMID: 31718440; PMCID: PMC6915286. https://doi.org/10.1161/JAHA.119.014367
- Barone-Rochette G., Piérard S., Seldrum S., de Meester de Ravenstein C., Melchior J., Maes F., Pouleur A.-C., Vancraeynest D., Pasquet A., Vanoverschelde J.-L., Gerber B.L. Aortic valve area, stroke volume, left ventricular hypertrophy, remodeling, and fibrosis in aortic stenosis assessed by cardiac magnetic resonance imaging: comparison between high and low gradient and normal and low flow aortic stenosis. Circ Cardiovasc Imaging. 2013;6(6):1009-1017. PMID: 24100045. https://doi.org/10.1161/CIRCIMAGING.113.000515
- Aleksandric S., Banovic M., Beleslin B. Challenges in diagnosis and functional assessment of coronary artery disease in patients with severe aortic stenosis. Front Cardiovasc Med. 2022;9:849032. PMID: 35360024; PMCID: PMC8961810. https://doi.org/10.3389/fcvm.2022.849032
- Vendrik J., Ahmad Y., Eftekhari A., Howard J.P., Wijntjens G.W.M., Stegehuis V.E., Cook C., Terkelsen C.J., Christiansen E.H., Koch K.T., Piek J.J., Sen S., Baan J. Jr. Long-term effects of transcatheter aortic valve implantation on coronary hemodynamics in patients with concomitant coronary artery disease and severe aortic stenosis. J Am Heart Assoc. 2020;9(5):e015133. PMID: 32102615; PMCID: PMC7335578. https://doi.org/10.1161/JAHA.119.015133
- Scarsini R., Pesarini G., Lunardi M., Piccoli A., Zanetti C., Cantone R., Bellamoli M., Ferrero V., Gottin L., Faggian G., Ribichini F. Observations from a real-time, iFR-FFR "hybrid approach" in patients with severe aortic stenosis and coronary artery disease undergoing TAVI. Cardiovasc Revasc Med. 2018;19(3 Pt B):355-359. PMID: 29113864. https://doi.org/10.1016/j.carrev.2017.09.019
- Rajiah P., Cummings K.W., Williamson E., Young P.M. CT fractional flow reserve: a practical guide to application, interpretation, and problem solving. Radiographics. 2022;42(2):340-358. PMID: 35119968. https://doi.org/10.1148/rg.210097
- Tarantini G., Tang G., Nai Fovino L., Blackman D., Van Mieghem N.M., Kim W.-K., Karam N., Carrilho-Ferreira P., Fournier S., Pręgowski J., Fraccaro C., Vincent F., Teles R.C., Mylotte D., Wong I., Bieliauskas G., Czerny M., Bonaros N., Parolari A., Dudek D., Tchetche D., Eltchaninoff H., de Backer O., Stefanini G., Sondergaard L. Management of coronary artery disease in patients undergoing transcatheter aortic valve implantation. A clinical consensus statement from the European Association of Percutaneous Cardiovascular Interventions in collaboration with the ESC Working Group on Cardiovascular Surgery. EuroIntervention. 2023;19(1):37-52. PMID: 36811935; PMCID: PMC10174192. https://doi.org/10.4244/EIJ-D-22-00958
- Tran Z., Hadaya J., Downey P., Sanaiha Y., Verma A., Shemin R.J., Benharash P. Staged versus concomitant transcatheter aortic valve replacement and percutaneous coronary intervention: A national analysis. JTCVS Open. 2022;10:148-161. PMID: 36004248; PMCID: PMC9390561. https://doi.org/10.1016/j.xjon.2022.02.019
- Ochiai T., Yoon S.-H., Flint N., Sharma R., Chakravarty T., Kaewkes D., Patel V., Nakamura M., Cheng W., Makkar R. Timing and outcomes of percutaneous coronary intervention in patients who underwent transcatheter aortic valve implantation. Am J Cardiol. 2020;125(9):1361-1368. PMID: 32106928. https://doi.org/10.1016/j.amjcard.2020.01.043
- Barbanti M., Todaro D., Costa G., Pilato G., Picci A., Gulino S., Capranzano P., La Spina K., Di Simone E., D'Arrigo P., Deste W., Indelicato A., Cannata S., Giannazzo D., Immè S., Tamburino C., Patanè M., Buccheri S., Capodanno D., Sgroi C., Tamburino C. Optimized screening of coronary artery disease with invasive coronary angiography and ad hoc percutaneous coronary intervention during transcatheter aortic valve replacement. Circ Cardiovasc Interv. 2017;10(8):e005234. PMID: 28768757. https://doi.org/10.1161/CIRCINTERVENTIONS.117.005234
- Rheude T., Costa G., Ribichini F.L., Pilgrim T., Santos I.J.A., De Backer O., Kim W.-K., Ribeiro H.B., Saia F., Bunc M., Tchétché D., Garot P., Mylotte D., Burzotta F., Watanabe Y., Bedogni F., Tesorio T., Tocci M., Franzone A., Valvo R., Savontaus M., Wienemann H., Porto I., Gandolfo C., Iadanza A., Bortone A.S., Mach M., Latib A., Biasco L., Taramasso M., Zimarino M., Tomii D., Nuyens P., Sondergaard L., Camara S.F., Palmerini T., Orzalkiewicz M., Steblovnik K., Degrelle B., Gautier A., Del Sole P.A., Mainardi A., Pighi M., Lunardi M., Kawashima H., Criscione E., Cesario V., Biancari F., Zanin F., Esposito G., Adam M., Grube E., Baldus S., De Marzo V., Piredda E., Cannata S., Iacovelli F., Andreas M., Frittitta V., Dipietro E., Reddavid C., Strazzieri O., Motta S., Angellotti D., Sgroi C., Xhepa E., Kargoli F., Tamburino C., Joner M., Barbanti M. Comparison of different percutaneous revascularisation timing strategies in patients undergoing transcatheter aortic valve implantation. EuroIntervention. 2023;19(7):589-599. PMID: 37436190; PMCID: PMC10495747. https://doi.org/10.4244/EIJ-D-23-00186
- Barbanti M., Costa G., Picci A., Criscione E., Reddavid C., Valvo R., Todaro D., Deste W., Condorelli A., Scalia M., Licciardello A., Politi G., De Luca G., Strazzieri O., Motta S., Garretto V., Veroux P., Giaquinta A., Giuffrida A., Sgroi C., Leon M.B., Webb J.G., Tamburino C. Coronary cannulation after transcatheter aortic valve replacement: the RE-ACCESS study. JACC Cardiovasc Interv. 2020;13(21):2542-2555. PMID: 33069648. https://doi.org/10.1016/j.jcin.2020.07.006
- Faroux L., Lhermusier T., Vincent F., Nombela-Franco L., Tchétché D., Barbanti M., Abdel-Wahab M., Windecker S., Auffret V., Campanha-Borges D.C., Fischer Q., Muñoz-Garcia E., Trillo-Nouche R., Jorgensen T., Serra V., Toggweiler S., Tarantini G., Saia F., Durand E., Donaint P., Gutierrez-Ibanes E., Wijeysundera H.C., Veiga G., Patti G., D'Ascenzo F., Moreno R., Hengstenberg C., Chamandi C., Asmarats L., Hernandez-Antolin R., Gomez-Hospital J.A., Cordoba-Soriano J.G., Landes U., Jimenez-Diaz V.A., Cruz-Gonzalez I., Nejjari M., Roubille F., Van Belle É., Armijo G., Siddiqui S., Costa G., Elsaify S., Pilgrim T., le Breton H., Urena M., Muñoz-Garcia A.J., Sondergaard L., Bach-Oller M., Fraccaro C., Eltchaninoff H., Metz D., Tamargo M., Fradejas-Sastre V., Rognoni A., Bruno F., Goliasch G., Santaló-Corcoy M., Jimenez-Mazuecos J., Webb J.G., Muntané-Carol G., Paradis J.-M., Mangieri A., Ribeiro H.B., Campelo-Parada F., Rodés-Cabau J. ST-segment elevation myocardial infarction following transcatheter aortic valve replacement. J Am Coll Cardiol. 2021;77(17):2187-2199. PMID: 33926655. https://doi.org/10.1016/j.jacc.2021.03.014
- Yap J.J.L., Ho K.W. Managing complex coronary access after transcatheter aortic valve implantation. Journal of Asian Pacific Society of Cardiology. 2023;2:e11. https://doi.org/10.15420/japsc.2022.28
- Lunardi M., Venturi G., Del Sole P.A., Ruzzarin A., Mainardi A., Pighi M., Pesarini G., Scarsini R., Tavella D., Gottin L., Ribichini F.L. Optimal timing for percutaneous coronary intervention in patients undergoing transcatheter aortic valve implantation. Int J Cardiol. 2022;365:114-122. PMID: 35870638. https://doi.org/10.1016/j.ijcard.2022.07.030
- Masson J.B., Lee M., Boone R.H., Al Ali A., Al Bugami S., Hamburger J., Mancini G.B.J., Ye J., Cheung A., Humphries K.H., Wood D., Nietlispach F., Webb J.G. Impact of coronary artery disease on outcomes after transcatheter aortic valve implantation. Catheter Cardiovasc Interv. 2010;76(2):165-173. PMID: 20665855. https://doi.org/10.1002/ccd.22501
- Ussia G.P., Barbanti M., Colombo A., Tarantini G., Petronio A.S., Ettori F., Ramondo A., Santoro G., Klugmann S., Bedogni F., Antoniucci D., Maisano F., Marzocchi A., Poli A., De Carlo M., Fiorina C., De Marco F., Napodano M., Violini R., Bortone A.S., Tamburino C.; CoreValve Italian Registry Investigators. Impact of coronary artery disease in elderly patients undergoing transcatheter aortic valve implantation: insight from the Italian CoreValve Registry. Int J Cardiol. 2013;167(3):943-950. PMID: 22459391. https://doi.org/10.1016/j.ijcard.2012.03.089
- Dewey T.M., Brown D.L., Herbert M.A., Culica D., Smith C.R., Leon M.B., Svensson L.G., Tuzcu M., Webb J.G., Cribier A., Mack M.J. Effect of concomitant coronary artery disease on procedural and late outcomes of transcatheter aortic valve implantation. Ann Thorac Surg. 2010;89(3):758-767. PMID: 20172123. https://doi.org/10.1016/j.athoracsur.2009.12.033
- Khawaja M.Z., Asrress K.N., Haran H., Arri S., Nadra I., Bolter K., Wilson K., Clack L., Hancock J., Young C.P., Bapat V., Thomas M., Redwood S. The effect of coronary artery disease defined by quantitative coronary angiography and SYNTAX score upon outcome after transcatheter aortic valve implantation (TAVI) using the Edwards bioprosthesis. EuroIntervention. 2015;11(4):450-455. PMID: 24832041. https://doi.org/10.4244/EIJY14M05_09
- Sankaramangalam K., Banerjee K., Kandregula K., Mohananey D., Parashar A., Jones B.M., Jobanputra Y., Mick S., Krishnaswamy A., Svensson L.G., Kapadia S.R. Impact of coronary artery disease on 30-day and 1-year mortality in patients undergoing transcatheter aortic valve replacement: a meta-analysis. J Am Heart Assoc. 2017;6(10):e006092. PMID: 29021275; PMCID: PMC5721835. https://doi.org/10.1161/JAHA.117.006092
- D'Ascenzo F., Verardi R., Visconti M., Conrotto F., Scacciatella P., Dziewierz A., Stefanini G.G., Paradis J.-M., Omedè P., Kodali S., D'Amico M., Rinaldi M., Salizzoni S. Independent impact of extent of coronary artery disease and percutaneous revascularisation on 30-day and one-year mortality after TAVI: a meta-analysis of adjusted observational results. EuroIntervention. 2018;14(11):e1169-e1177. PMID: 30082258. https://doi.org/10.4244/EIJ-D-18-00098
- Abdel-Wahab M., Mostafa A.E., Geist V., Stöcker B., Gordian K., Merten C., Richardt D., Toelg R., Richardt G. Comparison of outcomes in patients having isolated transcatheter aortic valve implantation versus combined with preprocedural percutaneous coronary intervention. Am J Cardiol. 2012;109(4):581-586. PMID: 22133754. https://doi.org/10.1016/j.amjcard.2011.09.053
- Goel S.S., Agarwal S., Tuzcu E.M., Ellis S.G., Svensson L.G., Zaman T., Bajaj N., Joseph L., Patel N.S., Aksoy O., Stewart W.J., Griffin B.P., Kapadia S.R. Percutaneous coronary intervention in patients with severe aortic stenosis: implications for transcatheter aortic valve replacement. Circulation. 2012;125(8):1005-1013. PMID: 22282327. https://doi.org/10.1161/CIRCULATIONAHA.111.039180
- Lateef N., Khan M.S., Deo S.V., Yamani N., Riaz H., Virk H.U.H., Khan S.U., Hedrick D.P., Kanaan A., Reed G.W., Krishnaswamy A., Puri R., Kapadia S.R., Kalra A. Meta-analysis comparing outcomes in patients undergoing transcatheter aortic valve implantation with versus without percutaneous coronary intervention. Am J Cardiol. 2019;124(11):1757-1764. PMID: 31575422; PMCID: PMC7453960. https://doi.org/10.1016/j.amjcard.2019.08.024
- Patterson T., Clayton T., Dodd M., Khawaja Z., Morice M.C., Wilson K., Kim W.-K., Meneveau N., Hambrecht R., Byrne J., Carrié D., Fraser D., Roberts D.H., Doshi S.N., Zaman A., Banning A.P., Eltchaninoff H., Le Breton H., Smith D., Cox I., Frank D., Gershlick A., de Belder M., Thomas M., Hildick-Smith D., Prendergast B., Redwood S.; ACTIVATION Trial Investigators. ACTIVATION (PercutAneous Coronary inTervention prIor to transcatheter aortic VAlve implantaTION): a randomized clinical trial. JACC Cardiovasc Interv. 2021;14(18):1965-1974. PMID: 34556269. https://doi.org/10.1016/j.jcin.2021.06.041
- Costa G., Pilgrim T., Amat Santos I.J., De Backer O., Kim W.-K., Ribeiro H.B., Saia F., Bunc M., Tchetche D., Garot P., Ribichini F.L., Mylotte D., Burzotta F., Watanabe Y., De Marco F., Tesorio T., Rheude T., Tocci M., Franzone A., Valvo R., Savontaus M., Wienemann H., Porto I., Gandolfo C., Iadanza A., Bortone A.S., Mach M., Latib A., Biasco L., Taramasso M., Zimarino M., Tomii D., Nuyens P., Sondergaard L., Camara S.F., Palmerini T., Orzalkiewicz M., Steblovnik K., Degrelle B., Gautier A., Del Sole P.A., Mainardi A., Pighi M., Lunardi M., Kawashima H., Criscione E., Cesario V., Biancari F., Zanin F., Joner M., Esposito G., Adam M., Grube E., Baldus S., De Marzo V., Piredda E., Cannata S., Iacovelli F., Andreas M., Frittitta V., Dipietro E., Reddavid C., Strazzieri O., Motta S., Angellotti D., Sgroi C., Kargoli F., Tamburino C., Barbanti M.; REVASC-TAVI Registry. Management of myocardial revascularization in patients with stable coronary artery disease undergoing transcatheter aortic valve implantation. Circ Cardiovasc Interv. 2022;15(12):e012417. PMID: 36538579. https://doi.org/10.1161/CIRCINTERVENTIONS.122.012417
- Paradis J.M., White J.M., Généreux P., Urena M., Doshi D., Nazif T., Hahn R., George I., Khalique O., Harjai K., Lasalle L., Labbé B.M., DeLarochellière R., Doyle D., Dumont É., Mohammadi S., Leon M.B., Rodés-Cabau J., Kodali S. Impact of coronary artery disease severity assessed with the SYNTAX Score on outcomes following transcatheter aortic valve replacement. J Am Heart Assoc. 2017;6(2):e005070. PMID: 28219920; PMCID: PMC5523783. https://doi.org/10.1161/JAHA.116.005070
- Ramee S., Anwaruddin S., Kumar G., Piana R.N., Babaliaros V., Rab T., Klein L.W.; Aortic Stenosis AUC Writing Group; Interventional Section of the Leadership Council of the American College of Cardiology. The rationale for performance of coronary angiography and stenting before transcatheter aortic valve replacement: from the Interventional Section Leadership Council of the American College of Cardiology. JACC Cardiovasc Interv. 2016;9(23):2371-2375. PMID: 27931592. https://doi.org/10.1016/j.jcin.2016.09.024
- Rosseel L., Mylotte D., Cosyns B., Vanhaverbeke M., Zweiker D., Teles R.C., Angerås O., Neylon A., Rudolph T.K., Wykrzykowska J.J., Patterson T., Costa G., Ojeda S., Tzikas A., Abras M., Leroux L., Van Belle E., Tchétché D., Bleiziffer S., Swaans M.J., Parma R., Blackman D.J., Van Mieghem N.M., Grygier M., Redwood S., Prendergast B., Van Camp G., De Backer O. Contemporary European practice in transcatheter aortic valve implantation: results from the 2022 European TAVI Pathway Registry. Front Cardiovasc Med. 2023;10:1227217. PMID: 37645516; PMCID: PMC10461475. https://doi.org/10.3389/fcvm.2023.1227217


