Реперфузионное повреждение сердца. Роль микроваскулярной обструкции
Автор: Рябов В. В., Попов С. В., Вышлов Е. В., Сиротина М., Нарыжная Н. В., Мухомедзянов А. В., Деркачев И. А., Курбатов Б. К., Гомбожапова А. Е., Диль С. В., Самойлова Ю. О., Суфианова Г. З., Хлсткина М. С., Маслов Л. Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Микроваскулярная обструкция (МВО) коронарных артерий способствует увеличению смертности и неблагоприятных сердечно-сосудистых событий у пациентов с острым инфарктом миокарда (ОИМ) и чрескожным коронарным вмешательством (ЧКВ). Были получены предварительные данные, свидетельствующие о том, что в патогенез МВО могут быть вовлечены тромбоциты, воспаление, Са2+-перегрузка, нейропептид Y и эндотелин-1. Многие вопросы, связанные с патогенезом МВО, остаются без ответа. Неизвестна роль повреждения эндотелиальных клеток в формировании МВО у пациентов с ОИМ и ЧКВ. Неясно, снижается ли продукция оксида азота (NO), или же снижается чувствительность гладкомышечных клеток коронарных артерий к NO у пациентов с МВО. Получены лишь косвенные данные об участии воспаления в развитии МВО. Роль активных форм кислорода в патогенезе МВО не изучена. Роль некроптоза и пироптоза в патогенезе МВО у больных с ОИМ и ЧКВ также не изучена. Значение тромбоксана А, вазопрессина, ангиотензина II и простациклина в формировании МВО до сих пор неизвестно. Не было получено убедительных данных об участии спазма коронарных артерий в развитии МВО. Не проводился корреляционный анализ уровней нейропептида Y, эндотелина-1 и размера МВО у больных с ОИМ и ЧКВ. Неясно, усугубляет ли эндогенный адреналин МВО или, напротив, предупреждает МВО.
Сердце, ишемия, реперфузия, микроваскулярная обструкция, no-reflow
Короткий адрес: https://sciup.org/149142828
IDR: 149142828 | УДК: 616.12-005.4-06:616.132.2-007.272 | DOI: 10.29001/2073-8552-2023-39-2-14-22
Текст обзорной статьи Реперфузионное повреждение сердца. Роль микроваскулярной обструкции
Термин «no-reflow» был впервые предложен G. Majno и соавт. (1967) [1]. Этими исследователями было установлено, что после 15-минутной ишемии мозга кролика полного восстановления мозгового кровотока не происходит. Несколько лет спустя R.A. Kloner и соавт. продемонстрировали, что повреждение сосудов микроциркуляторного русла сердца собак участвует в патогенезе no-reflow [2]. В 1985 г. у пациентов с инфарктом миокарда с подъемом сегмента ST (ИМпST) был обнаружен феномен «no-reflow» [3]. Исследователи сообщили, что тромболизис не может полностью восстановить коронарный кровоток у этих пациентов [4]. В плацебо-контролируемом исследовании было продемонстрировано, что интракоронарное введение альтеплазы у пациентов с ИМпST и микрова- скулярной обструкцией (МВО) не влияло на частоту возникновения no-reflow [5].
В настоящее время исследователи чаще используют термин «микроваскулярная обструкция» или термин «феномен замедления кровотока» («the slow flow phenomenon»), поскольку полное невосстановле-ние кровотока (тромболизис при инфаркте миокарда (Thrombolysis In Myocardial Infarction) TIMI = 0) в ин-фаркт-связанной коронарной артерии ангиографически выявлялось только у 5% больных с острым инфарктом миокарда (ОИМ) и чрескожным коронарным вмешательстве (ЧКВ), у остальных больных часто наблюдалось неполное восстановление коронарного кровотока [6]. Следует отметить, что некоторые исследователи полагают, что no-reflow характеризуется TIMI = 0–1 или TIMI = 0–2
[7, 8]. В данном случае термины «no-reflow» или «МВО» используются как синонимы.
Частота микроваскулярной обструкции, смертность, прогноз
МВО была выявлена с помощью магнитно-резонансной томографии (МРТ) у 25% пациентов с ИМпST [9]. G. Ndrepepa и соавт. (2010) сообщили, что ангиографически наблюдали МВО у 29% пациентов с ИМпST и ЧКВ [7]. Согласно A. Mayr и соавт. (2012), МВО была обнаружена у 56% пациентов с ИМпST и ЧКВ по данным МРТ [10]. Эхокардиографически МВО была диагностирована у 50% пациентов с ИМпST и ЧКВ [11]. Микроваскулярная обструкция была ангиографически обнаружена у 25% пациентов (TIMI = 0 или 2) с ИМпST и ЧКВ [8].
По нашим данным, частота МВО у больных с ИМпST и ЧКВ составляет 37% [4]. Согласно нашим последним данным, МВО наблюдается у 53% пациентов с ИМпST и ЧКВ [12]. Таким образом, МВО наблюдается у 25–56% больных с ИМпST и ЧКВ. Сердечно-сосудистые события через 6 мес. после ОИМ у больных с МВО наблюдаются чаще, чем у больных без МВО [9]. Госпитальная летальность составила 14% у больных с ОИМ и МВО и только 3% у больных с ОИМ и без МВО [13]. У пациентов с ИМпST и no-reflow уровень госпитальной смертности был выше, чем у пациентов без no-reflow (TIMI = 0–1) [8].
Неблагоприятные сердечно-сосудистые события у больных с ОИМ и МВО в течение 2 лет после ОИМ развивались чаще, чем у больных с ОИМ без МВО [9]. У пациентов с ИМпST с ЧКВ no-reflow (TIMI = 0–1) является сильным независимым предиктором уровня смертности в течение 5 лет после ОИМ [7].
МВО обычно сопровождалась увеличением размера ИМ, снижением фракции выброса левого желудочка (ЛЖ) и высокой летальностью в течение 5 лет после ОИМ [14]. МВО была связана с неблагоприятным ремоделированием сердца в течение 8 мес. после ОИМ [15].
Патогенез микроваскулярной обструкции, анализ клинических данных
Высокоэффективная терапия и профилактика МВО невозможны без знания патогенеза этой патологии.
Микроэмболизация и микротромбы
В исследовании, проведенном в 2012 г., MВO оценивали по степени перфузии миокарда у пациентов с ИМ-пST и ЧКВ [16]. Образцы крови брали из коронарных артерий и аорты для обнаружения микрочастиц. Показано, что уровень микрочастиц в коронарной артерии связан с МВО. Был сделан вывод, что микрочастицы вовлечены в развитие МВО [16]. Это доказательство сомнительно, поскольку представленные данные не были подтверждены другими исследователями в течение последних 10 лет.
Скопление тромбоцитов
Исследователи сообщили, что показатель МВО у пациентов с ИМпST и ЧКВ, получавших аспирин, ниже, чем у пациентов, не получавших аспирин [17]. Была продемонстрирована корреляция между частотой МВО и АДФ-индуцированной агрегацией тромбоцитов у пациентов с ИМпST и ЧКВ [18]. Показана корреляция между частотой МВО и агрегацией тромбоцитов и нейтрофилов. Частота MВO и агрегация тромбоцитов и моноцитов также коррелирует [18]. Следовательно, тромбоциты могут быть вовлечены в MВO. Тромбоциты могут высвобождать сильный вазоконстриктор тромбоксан A2 [19]. Хроническое введение аспирина, неселективного ингибитора синтеза тромбоксана А2, приводило к снижению сывороточной концентрации тромбоксана В2, стабильного метаболита тромбоксана А2 [19]. Эти результаты показывают, что тромбоксан А2 может быть вовлечен в MВO. Следовательно, тромбоциты вовлечены в развитие МВО (рис. 1). Роль тромбоксана А2 в патогенезе MВO требуется изучить.
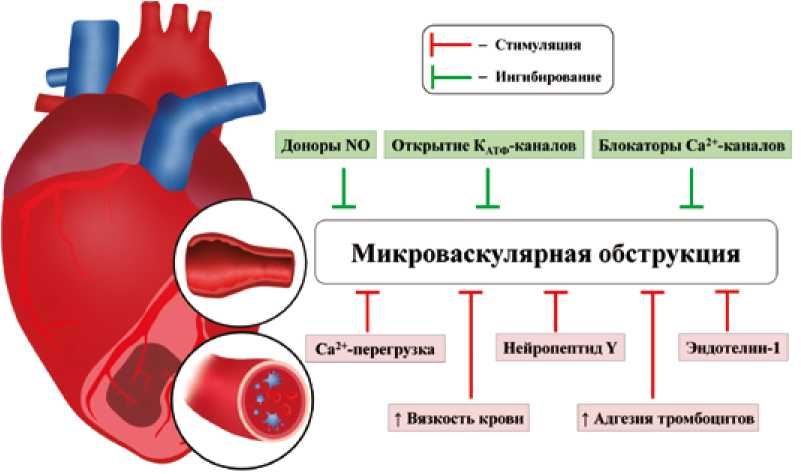
Рис. 1. Факторы, влияющие на выраженность микроваскулярной обструкции Fig. 1. Factors affecting the severity of microvascular obstruction
Вазодилатация коронарных артерий
Роль нарушений эндотелиально-зависимой вазодилатации при МВО остается невыясненной, поскольку стандартный эндотелиально-зависимый вазодилататор ацетилхолин не использовался в терапии МВО у больных с ОИМ. Тем не менее, эндотелий-независимые вазодилататоры (блокаторы Са2+-каналов L-типа, доноры NO, никорандил) применялись для лечения МВО у больных с ОИМ [20, 21]. Имеются данные о применении как эндо-телий-независимой, так и эндотелий-зависимой релаксации коронарных артерий (агонисты β-адренорецепторов, аденозин) у одних и тех же больных [22, 23].
Увеличение вязкости крови
Показано, что острый коронарный синдром связан с повышением вязкости цельной крови [24]. Выявлено, что вязкость цельной крови была выше у пациентов с ИМпST и с МВО, чем у пациентов с ИМпST без МВО [25]. Можно предположить, что вязкость цельной крови может быть вовлечена в развитие МВО у больных с ОИМ (см. рис. 1).
Микроваскулярная обструкция и неблагоприятное постинфарктное ремоделирование сердца
Было продемонстрировано, что размер инфаркта и тяжелая МВО положительно коррелируют с неблагоприятным ремоделированием миокарда в течение 6 мес. после ОИМ [26]. Другие исследователи получили аналогичные данные об участии МВО в патогенезе неблагоприятного постинфарктного ремоделирования сердца [27, 28]. Однако M.I. Dregoesc и соавт. (2019) не смогли найти взаимосвязи между постинфарктным ремоделированием сердца и МВО [29].
Роль воспаления в микроваскулярной обструкции
Было показано, что высокие показатели МВО положительно коррелируют с повышением концентрации С-реактивного белка, лейкоцитов в плазме и пикового значения креатинкиназы и отрицательно коррелируют с высокой фракцией выброса ЛЖ у пациентов с ИМпST и ЧКВ [10, 17]. Пик CD14+CD16- моноцитов, общее количество моноцитов и общее количество нейтрофилов при ИМпST были выше у пациентов с МВО, чем у пациентов без МВО [30]. Высокий уровень С-реактивного белка при поступлении может быть предиктором МВО у пациентов с ИМпST [31, 32]. Высокая концентрация интерлейкина-6 в плазме крови также является предиктором МВО у пациентов с ИМпST и ЧКВ [33]. Уровень интерлейкина-18 в сыворотке крови был выше у пациентов с ИМпST и МВО, чем у пациентов без МВО [34]. Следовательно, С-реак-тивный белок и интерлейкины могут быть вовлечены в патогенез МВО.
Роль Са2+-перегрузки в формировании микроваскулярной обструкции
Блокаторы Са2+-каналов L-типа вызывали эндоте-лий-независимую релаксацию коронарных артерий [20]. Верапамил уменьшал МВО у пациентов с ИМпST [35]. Можно предположить, что в формировании МВО участвуют спазм микрососудов и Са2+-перегрузка гладкой мускулатуры сосудов. Следовательно, эти данные демонстрируют возможное участие спазма коронарных артерий в патогенезе МВО (см. рис. 1).
Может ли оксид азота уменьшать проявления MВO?
Внутрикоронарное введение нитропруссида натрия, донора NO, улучшало степень кровотока по TIMI у пациентов с ОИМ и ЧКВ [36, 37]. Однако другие исследователи сообщили, что внутрикоронарное введение нитропруссида натрия не изменяет коронарный кровоток у пациентов с ОИМ и ЧКВ [38, 39]. В эти исследования были включены более крупные группы пациентов с ОИМ и ЧКВ, поэтому их результаты более значимы. Следовательно, эти данные демонстрируют, что спазм коронарных артерий может не участвовать в патогенезе МВО (см. рис. 1).
Роль эндотелинов и нейропептида Y в развитии микроваскулярной обструкции
Сообщалось, что концентрация эндотелина-1 в плазме крови коронарного синуса составляла 1,7 пмоль/л у больных со стабильной стенокардией и 3,0 пмоль/л у больных с ОИМ [40]. Концентрация эндотелина-1 в плазме крови из аорты была выше у больных с ОИМ, чем у больных стенокардией [40]. МВО оценивали у пациентов с ИМпST и ЧКВ ( n = 128) с помощью МРТ [41]. Уровень эн-дотелина-1 в плазме крови при поступлении был связан с МВО и уровнем смертности [41]. Эти данные показали, что повышение концентрации эндотелина-1 в крови может способствовать развитию МВО. Нейропептид Y (НПY) также является сильным вазоконстриктором, который высвобождается из симпатических окончаний [42]. Сообщалось, что внутрикоронарное введение НПY приводило к спазму коронарных артерий у добровольцев [43].
Однако N. Herring и соавт. (2019) не обнаружили различий в показателях TIMI у пациентов с высоким и низким уровнем НПY в крови коронарного синуса у пациентов с ИМпST [44]. При этом микроциркуляторное сопротивление было выше у пациентов с высоким уровнем НПY в коронарном синусе по сравнению с пациентами с низкой концентрацией НПY [44].
Эти данные показывают, что НПY может участвовать в формировании MВO (см. рис. 1). Однако корреляционный анализ между уровнями НПY и эндотелина-1 и зоной no-reflow не проводился, в связи с чем требуются дальнейшие исследования роли НПY и эндотелина-1 в патогенезе МВО.
Роль обменника Na +/H+ в МВО. Блокаторы Na+/H+-об-менника не применялись для терапии и профилактики возникновения МВО у больных с ОИМ, в связи с чем роль Na+/H+-обменника в развитии МВО у больных с ОИМ неизвестна.
Участие β-адренорецепторов (β-АР) в феномене noreflow. Сообщалось, что внутрикоронарное введение адреналина полностью устраняло no-reflow у 9 из 12 пациентов с ИМпST и ЧКВ [45]. Следует отметить, что эта группа слишком мала, поэтому неясно, могут ли агонисты β-АР устранить или уменьшить проявления МВО. Внутри-коронарное введение адреналина значительно улучшило коронарный кровоток у пациентов с ИМпST и ЧКВ и noreflow (TIMI = 0–1) [46]. Неблагоприятные сердечно-сосудистые события после ИМпST (1 год) возникали реже у пациентов, получавших адреналин, по сравнению с пациентами, получавшими аденозин [47]. Мини-свиней подвергали окклюзии коронарной артерии (3 ч) и реперфузии (1 ч) [48]. Предварительное лечение антагонистом β1- и β2-АР пропранололом не влияло на площадь МВО у свиней с окклюзией коронарной артерии (3 ч) и реперфузией (1 ч) [48].
Роль эндогенного адреналина в профилактике МВО у больных с ОИМ и ЧКВ остается неясной. Необходим корреляционный анализ размеров МВО и лечения β1-антаго-нистами у больных с ОИМ и ЧКВ.
Участие ангиотензина II в МВО. Антагонисты рецепторов ангиотензина II ранее не применялись для лечения no-reflow, поэтому роль ангиотензина II в МВО остается неясной.
Роль аденозина в МВО. Внутрикоронарная инфузия аденозина снижала частоту МВО у пациентов с ОИМ и ЧКВ [47, 49]. Следовательно, аденозин может облегчить МВО.
Роль КАТФ-каналов в МВО. Пинацидил, открывающий КАТФ-каналы, вызывает эндотелий-зависимую вазодилатацию коронарных артерий [23]. Никорандил, донор NO и активатор КАТФ-каналов, приводил к эндотелий-независи-мой вазодилатации коронарных артерий [21]. Показано, что никорандил снижает частоту МВО у больных ОИМ [50]. Однако нитропруссид натрия, донор NO, не был эффективен в отношении no-reflow у пациентов с ОИМ и ЧКВ [38, 39]. Таким образом, можно предположить, что никорандил вызывал вазодилатацию коронарных артерий за счет открытия КАТФ-каналов в этих сосудах, но не за счет повышения уровня NO (см. рис. 1). К сожалению, влияние других активаторов КАТФ-каналов на MВO ранее не изучалось.
Реперфузионная терапия микроваскулярной обструкции
По нашему мнению, МВО может быть мишенью для лечения реперфузионного повреждения сердца. Частота МВО у пациентов с ИМпST и ЧКВ, получавших антагонист P2Y12 клопидогрел, составила 66%, а у пациентов, получавших антагонисты P2Y12 прасугрел или тикагре-лор, данный показатель составил 49% [51]. Блокатор гликопротеина IIb/IIIa тирофибан вводили внутривенно или внутрикоронарно пациентам с ИМпST и ЧКВ [52]. Площадь МВО измеряли с помощью МРТ. Все пациенты перед ЧКВ получали клопидогрел и аспирин. Внутрикоро-нарное введение тирофибана способствовала снижению частоты возникновения МВО по сравнению с внутривенным введением тирофибана [52].
Выше сообщалось, что внутрикоронарная инфузия аденозина предотвращает появление МВО у больных с ОИМ и ЧКВ [49]. Однако G. Niccoli и соавт. (2013) сообщили, что внутрикоронарное введение аденозина не влияло на возникновение МВО у пациентов ( n = 160) с ИМпST и ЧКВ [38]. S.A. Nazir и соавт. также не удалось обнаружить улучшения МВО у пациентов ( n = 168) с ИМпST и ЧКВ [39]. Следует отметить, что аденозин может усугублять ишемическое/реперфузионное повреждение сердца у пациентов с ОИМ вследствие коронарного обкрадывания [53]. Следовательно, аденозин не может быть рекомендован для лечения ОИМ и МВО.
Выше сообщалось, что нитропруссид натрия, донор NO, не изменяет площадь МВО. Однако никорандил предотвращает появление МВО на 50% у больных ( n = 81) ОИМ [50]. Комбинированная внутрикоронарная инфузия аденозина и никорандила снижала частоту no-reflow (TIMI = 0–1) на 40% [54].
Агонисты β-адренорецепторов могут повышать коронарный кровоток у собак с интактными коронарными артериями без гипоксии миокарда [55]. Однако внутри-коронарное введение норадреналина стимулировало потребление миокардом О2 и приводило к гипоксии миокарда у собак с коронарным стенозом [56]. Внутривенное введение агониста β1- и β2-АР изопротеренола (0,1 мкг/кг/мин) в период окклюзии коронарных артерий и реперфузии приводило к увеличению размера инфаркта у кроликов [57], тем самым применение агонистов β-АР у пациентов с ОИМ может усугубить ишемическое/репер-фузионное повреждение сердца.
Однако эти данные не исключают клинического изучения эффективности внутрикоронарной инфузии адреналина при терапии МВО [46]. A. Darwish и соавт. (2022) продемонстрировали, что внутрикоронарная инфузии адреналина увеличивает коронарный кровоток у пациентов с ОИМ и ЧКВ по сравнению с пациентами без адреналина [47]. Следует отметить, что обе группы исследователей не оценивали влияние адреналина на уровень тропонина I или креатинкиназы в сыворотке крови, поэтому неясно, может ли адреналин усугубить реперфузионное повреждение сердца или предотвратить его. Кроме того, следует отметить, что эти исследования не были двойными слепыми и плацебо-контролируемыми. Следовательно, адреналин можно использовать для терапии МВО, но следует оценить его негативные эффекты.
Блокаторы Са2+-каналов L-типа вызывают вазодилатацию коронарных артерий [20]. Внутрикоронарное введение верапамила уменьшало площадь МВО у больных с ОИМ и ЧКВ [35, 58]. Внутрикоронарная инфузия блокатора Са2+-каналов L-типа никардипина улучшила степень кровотока по TIMI у 71 из 72 пациентов с ОИМ и ЧКВ [59]. Способность блокаторов Са2+-каналов улучшать кровоток по шкале TIMI у пациентов с ИМпST и ЧКВ была подтверждена другими исследователями [16]. Совместное введение никардипина, аденозина и нитроглицерина устраняло no-reflow у пациентов с ОИМ и ЧКВ [60].
Следовательно, блокаторы Са2+-каналов L-типа могут быть использованы для лечения и профилактики МВО.
Заключение
Тромбоциты могут быть вовлечены в развитие МВО у пациентов с ОИМ и ЧКВ. Са2+-перегрузка гладкомышечных клеток сосудов коронарных артерий также принимает участие в патогенезе МВО. Получены косвенные данные об участии воспаления в формировании МВО. Повышенная вязкость крови может способствовать возникновению МВО. МВО способствует формированию неблагоприятного ремоделирования миокарда.
Вероятно, эндогенные катехоламины не принимают участия в развитии МВО у больных с ОИМ и ЧКВ. Аденозин и нитропруссид натрия не способны предотвратить появление МВО. Внутрикоронарное введение никоранди-ла может быть использовано для терапии МВО. Блокатор гликопротеина IIb/IIIa тирофибан и антагонисты P2Y12 малоэффективны в профилактике и лечении МВО. Блокаторы Са2+-каналов L-типа могут быть использованы для лечения МВО.
Многие вопросы еще ждут своего ответа. Не ясна роль повреждения эндотелиальных клеток в патогенезе МВО у больных с ОИМ и реперфузией сердца. Неоспоримых доказательств участия воспаления в развитии МВО пока нет. Роль активных форм кислорода в патогенезе МВО никто не изучал. Роль некроптоза и пироптоза в патогенезе МВО у больных с ОИМ и ЧКВ также не изучена. Роль тромбоксана А, вазопрессина, ангиотензина II, нарушений продукции NO и синтеза простациклина в фор- мировании МВО ранее не изучалась. Роль нейропептида Y и эндотелина-1 в развитии МВО требует дальнейших исследований. Не ясна роль спазма коронарных артерий в формировании МВО.
Сообщалось, что нитропруссид натрия, являющийся донором NO и эндотелий-независимым вазодилататором, не улучшал коронарный кровоток у пациентов с ОИМ и ЧКВ. Однако верапамил, блокатор Са2+-каналов
Список литературы Реперфузионное повреждение сердца. Роль микроваскулярной обструкции
- Majno G., Ames A., Chaing J., Wright R.L. No reflow after cerebral ischemia. Lancet. 1967;290(7515):569-570. https://doi.org/10.1016/S0140-6736(67)90552-1.
- Kloner R.A., Ganote C.E., Jennings R.B. The “no-reflow” phenomenon after temporary coronary occlusion in the dog. J. Clin. Invest. 1974;54(6):1496-1508. https://doi.org/10.1172/JCI107898.
- Schofer J., Montz R., Mathey D.G. Scintigraphic evidence of the “no reflow” phenomenon in human beings after coronary thrombolysis. J. Am. Coll. Cardiol. 1985;5(3):593-598. https://doi.org/10.1016/s0735-1097(85)80381-8.
- Алексеева Я.В., Вышлов Е.В., Павлюкова Е.Н., Усов В.Ю., Марков В.А., Рябов В.В. Влияние разных фенотипов микрососудистого повреждения миокарда на сократительную функцию левого желудочка у пациентов с инфарктом миокарда с подъемом сегмента ST. Кардиология. 2021;61(5):23-31. https://doi.org/10.18087/cardio.2021.5.n1500.
- McCartney P.J., Eteiba H., Maznyczka A.M., McEntegart M., Greenwood J.P. Muir D.F. et al.; T-TIME Group. Effect of low-dose intracoronary alteplase during primary percutaneous coronary intervention on microvascular obstruction in patients with acute myocardial infarction: A randomized clinical trial. JAMA. 2019;321(1):56-68. https://doi.org/10.1001/jama.2018.19802.
- McCartney P.J., Berry C. Redefining successful primary PCI. Eur. Heart J. Cardiovasc. Imaging. 2019;20(2):133-135. https://doi.org/10.1093/ehjci/jey159.
- Ndrepepa G., Tiroch K., Fusaro M., Keta D., Seyfarth M., Byrne R.A. et al. 5-year prognostic value of no-reflow phenomenon after percutaneous coronary intervention in patients with acute myocardial infarction. J. Am. Coll. Cardiol. 2010;55(21):2383-2389. https://doi.org/10.1016/j.jacc.2009.12.054.
- Rossington J.A., Sol E., Masoura K., Aznaouridis K., Chelliah R., Cunnington M. et al. No-reflow phenomenon and comparison to the normal-flow population postprimary percutaneous coronary intervention for ST elevation myocardial infarction: case-control study (NORM PPCI). Open Heart. 2020;7(2):e001215. https://doi.org/10.1136/openhrt-2019-001215.
- Wu K.C., Zerhouni E.A., Judd R.M., Lugo-Olivieri C.H., Barouch L.A., Schulman S.P. et al. Prognostic significance of microvascular obstruction by magnetic resonance imaging in patients with acute myocardial infarction. Circulation. 1998;97(8):765-772. https://doi.org/10.1161/01.cir.97.8.765.
- Mayr A., Klug G., Schocke M., Trieb T., Mair J., Pedarnig K. et al. Late microvascular obstruction after acute myocardial infarction: relation with cardiac and inflammatory markers. Int. J. Cardiol. 2012;157(3):391-396. https://doi.org/10.1016/j.ijcard.2010.12.090.
- Ober C.D., Ober M.C., Iancu A.C. Serial transthoracic coronary Doppler shows complete reversibility of microvascular obstruction pattern at one month after reperfused acute myocardial infarction. Med. Ultrason. 2017;19(1):45-50. https://doi.org/10.11152/mu-941.
- Вышлов Е.В., Алексеева Я.В., Усов В.Ю., Мочула О.В., Рябов В.В. Синдром микрососудистого повреждения миокарда у пациентов с первичным инфарктом миокарда с подъемом сегмента ST: распространенность и связь с клиническими характеристиками. Сибирский журнал клинической и экспериментальной медицины. 2022;37(1):36-46. https://doi.org/10.29001/2073-8552-2022-37-1-36-46.
- Romano M., Buffoli F., Lettieri C., Aroldi M., Tomasi L., Baccaglioni N. et al. No reflow in patients undergoing primary angioplasty for acute myocardial infarction at high risk: incidence and predictive factors. Minerva Cardioangiol. 2005;53(1):7-14.
- Klug G., Mayr A., Schenk S., Esterhammer R., Schocke M., Nocker M. et al. Prognostic value at 5 years of microvascular obstruction after acute myocardial infarction assessed by cardiovascular magnetic resonance. J. Cardiovasc. Magn. Reson. 2012;14(1):46. https://doi.org/10.1186/1532-429X-14-46.
- Kitabata H., Kubo T., Ishibashi K., Komukai K., Tanimoto T., Ino Y. et al. Prognostic value of microvascular resistance index immediately after primary percutaneous coronary intervention on left ventricular remodeling in patients with reperfused anterior acute ST-segment elevation myocardial infarction. JACC Cardiovasc. Interv. 2013;6(10):1046-1054. https://doi.org/10.1016/j.jcin.2013.05.014.
- Porto I., Biasucci L.M., De Maria G.L., Leone A.M., Niccoli G., Burzotta F. et al. Intracoronary microparticles and microvascular obstruction in patients with ST elevation myocardial infarction undergoing primary percutaneous intervention. Eur. Heart J. 2012;33(23):2928-2938. https://doi.org/10.1093/eurheartj/ehs065.
- Jesel L., Morel O., Ohlmann P., Germain P., Faure A., Jahn C. et al. Role of pre-infarction angina and inflammatory status in the extent of microvascular obstruction detected by MRI in myocardial infarction patients treated by PCI. Int. J. Cardiol. 2007;121(2):139-147. https://doi.org/10.1016/j.ijcard.2006.10.022.
- Zalewski J., Durak M., Lech P., Gajos G., Undas A., Nessler J. et al. Platelet activation and microvascular injury in patients with ST-segment elevation myocardial infarction. Kardiol. Pol. 2012;70(7):677-684.
- Basili S., Tanzilli G., Raparelli V., Calvieri C., Pignatelli P., Carnevale R. et al. Aspirin reload before elective percutaneous coronary intervention: impact on serum thromboxane b2 and myocardial reperfusion indexes. Circ. Cardiovasc. Interv. 2014;7(4):577-584. https://doi.org/10.1161/CIRCINTERVENTIONS.113.001197.
- Takahashi T., Fukai T., Hata H., Kasuya H., Kuga T., Egashira K. et al. Effects of a new calcium antagonist, CD-832, on experimental coronary artery spasm in miniature pigs. Cardiovasc. Drugs Ther. 1993;7(2):265-271. https://doi.org/10.1007/BF00878517.
- Ghaleh B., Dubois-Randé J.L., Hittinger L., Giudicelli J.F., Berdeaux A. Comparisons of the effects of nicorandil, pinacidil, nicardipine and nitroglycerin on coronary vessels in the conscious dog: role of the endothelium. Br. J. Pharmacol. 1995;114(2):496-502. https://doi.org/10.1111/j.1476-5381.1995.tb13254.x.
- Abebe W., Makujina S.R., Mustafa S.J. Adenosine receptor-mediated relaxation of porcine coronary artery in presence and absence of endothelium. Am. J. Physiol. 1994;266(5):H2018-H2025. https://doi.org/10.1152/ajpheart.1994.266.5.H2018.
- Ghaleh B., Béa M.L., Dubois-Randé J.L., Giudicelli J.F., Hittinger L., Berdeaux A. Endothelial modulation of beta-adrenergic dilation of large coronary arteries in conscious dogs. Circulation. 1995;92(9):2627-2635. https://doi.org/10.1161/01.cir.92.9.2627.
- Lee S.R., Jung J.M., Jung L.Y., Lee J.H., Lee S.H., Rhee K.S. et al. Elevated coronary whole blood viscosity in acute coronary syndrome patients. Clin. Hemorheol. Microcirc. 2013;55(1):85-94. https://doi.org/10.3233/CH-131692.
- Fracassi F., Vetrugno V., Mandurino-Mirizzi A., Cosentino N., Panicale S., Caprari P. et al. Effect of hemorheological parameters on myocardial injury after primary or elective percutaneous coronary intervention. Coron. Artery Dis. 2018;29(8):638-646. https://doi.org/10.1097/MCA.0000000000000661.
- Tarantini G., Razzolini R., Cacciavillani L., Bilato C., Sarais C., Corbetti F. et al. Influence of transmurality, infarct size, and severe microvascular obstruction on left ventricular remodeling and function after primary coronary angioplasty. Am. J. Cardiol. 2006;98(8):1033-1040. https://doi.org/10.1016/j.amjcard.2006.05.022.
- Galiuto L., Garramone B., Scarà A., Rebuzzi A.G., Crea F., La Torre G. et al. The extent of microvascular damage during myocardial contrast echocardiography is superior to other known indexes of post-infarct reperfusion in predicting left ventricular remodeling: results of the multicenter AMICI study. J. Am. Coll. Cardiol. 2008;51(5):552-559. https://doi.org/10.1016/j.jacc.2007.09.051.
- Zhang L., Mandry D., Chen B., Huttin O., Hossu G., Wang H. et al. Impact of microvascular obstruction on left ventricular local remodeling after reperfused myocardial infarction. J. Magn. Reson. Imaging. 2018;47(2):499-510. https://doi.org/10.1002/jmri.25780.
- Dregoesc M.I., Iancu A.C., Ober C.D., Homorodean C., Bãlãnescu Ş., Bolboacã S. In ST-segment elevation myocardial infarction, the echocardiographic parameters of microvascular obstruction are not associated with left ventricular remodeling at five years of follow-up. Echocardiography. 2019;36(6):1103-1109. https://doi.org/10.1111/echo.14371.
- Tsujioka H., Imanishi T., Ikejima H., Tanimoto T., Kuroi A., Kashiwagi M. et al. Post-reperfusion enhancement of CD14(+)CD16(-) monocytes and microvascular obstruction in ST-segment elevation acute myocardial infarction. Circ. J. 2010;74(6):1175-1182. https://doi.org/10.1253/circj.cj-09-1045.
- Reindl M., Reinstadler S.J., Feistritzer H.J., Klug G., Tiller C., Mair J. et al. Relation of inflammatory markers with myocardial and microvascular injury in patients with reperfused ST-elevation myocardial infarction. Eur. Heart J. Acute Cardiovasc. Care. 2017;6(7):640-649. https://doi.org/10.1177/2048872616661691.
- Holzknecht M., Tiller C., Reindl M., Lechner I., Troger F., Hosp M. et al. C-reactive protein velocity predicts microvascular pathology after acute ST-elevation myocardial infarction. Int. J. Cardiol. 2021;338:30-36. https://doi.org/10.1016/j.ijcard.2021.06.023.
- Guo F., Dong M., Ren F., Zhang C., Li J., Tao Z. et al. Association between local interleukin-6 levels and slow flow/microvascular dysfunction. J. Thromb. Thrombolysis. 2014;37(4):475-482. https://doi.org/10.1007/s11239-013-0974-0.
- Shetelig C., Limalanathan S., Hoffmann P., Seljeflot I., Gran J.M., Eritsland J. et al. Association of IL-8 with infarct size and clinical outcomes in patients with STEMI. J. Am. Coll. Cardiol. 2018;72(2):187-198. https://doi.org/10.1016/j.jacc.2018.04.053.
- Abdelaziz H.K., Elkilany W., Khalid S., Sabet S., Saad M. Efficacy and safety of intracoronary verapamil versus sodium nitroprusside for the prevention of microvascular obstruction during primary percutaneous coronary intervention for ST-segment elevation myocardial infarction. Coron Artery Dis. 2017;28(1):11-16. https://doi.org/10.1097/MCA.0000000000000423.
- Hillegass W.B., Dean N.A., Liao L., Rhinehart R.G., Myers P.R. Treatment of no-reflow and impaired flow with the nitric oxide donor nitroprusside following percutaneous coronary interventions: initial human clinical experience. J. Am. Coll. Cardiol. 2001;37(5):1335-1343. https://doi.org/10.1016/s0735-1097(01)01138-x.
- Wang H.J., Lo P.H., Lin J.J., Lee H., Hung J.S. Treatment of slow/noreflow phenomenon with intracoronary nitroprusside injection in primary coronary intervention for acute myocardial infarction. Catheter. Cardiovasc. Interv. 2004;63(2):171-176. https://doi.org/10.1002/ccd.20149.
- Niccoli G., Rigattieri S., De Vita M.R., Valgimigli M., Corvo P., Fabbiocchi F. et al. Open-label, randomized, placebo-controlled evaluation of intracoronary adenosine or nitroprusside after thrombus aspiration during primary percutaneous coronary intervention for the prevention of microvascular obstruction in acute myocardial infarction: the REOPEN-AMI study (Intracoronary Nitroprusside Versus Adenosine in Acute Myocardial Infarction). JACC Cardiovasc. Interv. 2013;6(6):580-589. https://doi.org/10.1016/j.jcin.2013.02.009.
- Nazir S.A., McCann G.P., Greenwood J.P., Kunadian V., Khan J.N., Mahmoud I.Z. et al. Strategies to attenuate micro-vascular obstruction during P-PCI: the randomized reperfusion facilitated by local adjunctive therapy in ST-elevation myocardial infarction trial. Eur. Heart J. 2016;37(24):1910-1919. https://doi.org/10.1093/eurheartj/ehw136.
- Taylor A.J., Bobik A., Richards M., Kaye D., Raines G., Gould P. et al. Myocardial endothelin-1 release and indices of inflammation during angioplasty for acute myocardial infarction and stable coronary artery disease. Am. Heart J. 2004;148(2):e10. https://doi.org/10.1016/j.ahj.2004.03.018.
- Eitel I., Nowak M., Stehl C., Adams V., Fuernau G., Hildebrand L. et al. Endothelin-1 release in acute myocardial infarction as a predictor of long-term prognosis and no-reflow assessed by contrast-enhanced magnetic resonance imaging. Am. Heart J. 2010;159(5):882-890. https://doi.org/10.1016/j.ahj.2010.02.019.
- Tan C.M.J., Green P., Tapoulal N., Lewandowski A.J., Leeson P., Herring N. The role of neuropeptide Y in cardiovascular health and disease. Front. Physiol. 2018;9:1281. https://doi.org/10.3389/fphys.2018.01281.
- Clarke J.G., Davies G.J., Kerwin R., Hackett D., Larkin S., Dawbarn D. et al. Coronary artery infusion of neuropeptide Y in patients with angina pectoris. Lancet. 1987;1(8541):1057-1059. https://doi.org/10.1016/s0140-6736(87)90483-1.
- Herring N., Tapoulal N., Kalla M., Ye X., Borysova L., Lee R. et al. Neuropeptide-Y causes coronary microvascular constriction and is associated with reduced ejection fraction following ST-elevation myocardial infarction. Eur. Heart J. 2019;40(24):1920-1929. https://doi.org/10.1093/eurheartj/ehz115.
- Aksu T., Guler T.E., Colak A., Baysal E., Durukan M., Sen T. et al. Intracoronary epinephrine in the treatment of refractory no-reflow after primary percutaneous coronary intervention: a retrospective study. BMC Cardiovasc. Disord. 2015;15:10. https://doi.org/10.1186/s12872-015-0004-6.
- Navarese E.P., Frediani L., Kandzari D.E., Caiazzo G., Cenname A.M., Cortese B. et al. Efficacy and safety of intracoronary epinephrine versus conventional treatments alone in STEMI patients with refractory coronary no-reflow during primary PCI: The RESTORE observational study. Catheter Cardiovasc. Interv. 2021;97(4):602-611. https://doi.org/10.1002/ccd.29113.
- Darwish A, Frere AF, Abdelsamie M, Awady WE, Gouda M. Intracoronary epinephrine versus adenosine in the management of refractory no-reflow phenomenon: a single-center retrospective cohort study. Ann. Saudi. Med. 2022;42(2):75-82. https://doi.org/10.5144/0256-4947.2022.75.
- Zhao J., Yang Y., You S., Cui C., Gao R. Carvedilol preserves endothelial junctions and reduces myocardial no-reflow after acute myocardial infarction and reperfusion. Int. J. Cardiol. 2007;115(3):334-341. https://doi.org/10.1016/j.ijcard.2006.03.017.
- Marzilli M., Orsini E., Marraccini P., Testa R. Beneficial effects of intracoronary adenosine as an adjunct to primary angioplasty in acute myocardial infarction. Circulation. 2000;101(18):2154-2159. https://doi.org/10.1161/01.cir.101.18.2154.
- Ito H., Taniyama Y., Iwakura K., Nishikawa N., Masuyama T., Kuzuya T. et al. Intravenous nicorandil can preserve microvascular integrity and myocardial viability in patients with reperfused anterior wall myocardial infarction. J. Am. Coll. Cardiol. 1999;33(3):654-660. https://doi.org/10.1016/s0735-1097(98)00604-4.
- Khan J.N., Greenwood J.P., Nazir S.A., Lai F.Y., Dalby M., Curzen N. et al. Infarct size following treatment with second-versus third-generation P2Y12 antagonists in patients with multivessel coronary disease at ST-segment elevation myocardial infarction in the CvLPRIT study. J. Am. Heart Assoc. 2016;5(6):e003403. https://doi.org/10.1161/JAHA.116.003403.
- Ma Q., Ma Y., Wang X., Li S., Yu T., Duan W. et al. Intracoronary compared with intravenous bolus tirofiban on the microvascular obstruction in patients with STEMI undergoing PCI: a cardiac MR study. Int. J. Cardiovasc. Imaging. 2020;36(6):1121-1132. https://doi.org/10.1007/s10554-020-01800-0.
- Aetesam-Ur-Rahman M., Brown A.J., Jaworski C., Giblett J.P., Zhao T.X., Braganza D.M. et al. Adenosine-induced coronary steal is observed in patients presenting with ST-segment-elevation myocardial infarction. J. Am. Heart Assoc. 2021;10(13):e019899. https://doi.org/10.1161/JAHA.120.019899.
- Lim S.Y., Bae E.H., Jeong M.H., Kang D.G., Lee Y.S., Kim K.H. et al. Effect of combined intracoronary adenosine and nicorandil on no-reflow phenomenon during percutaneous coronary intervention. Circ J. 2004;68(10):928-932. https://doi.org/10.1253/circj.68.928.
- Knabb R.M., Ely S.W., Bacchus A.N., Rubio R., Berne R.M. Consistent parallel relationships among myocardial oxygen consumption, coronary blood flow, and pericardial infusate adenosine concentration with various interventions and beta-blockade in the dog. Circ. Res. 1983;53(1):33-41. https://doi.org/10.1161/01.res.53.1.33.
- Buffington C.W., Feigl E.O. Adrenergic coronary vasoconstriction in the presence of coronary stenosis in the dog. Circ. Res. 1981;48(3):416-423. https://doi.org/10.1161/01.res.48.3.416.
- Golino P., Maroko P.R., Carew T.E. The effect of acute hypercholesterolemia on myocardial infarct size and the no-reflow phenomenon during coronary occlusion-reperfusion. Circulation. 1987;75(1):292-298. https://doi.org/10.1161/01.cir.75.1.292.
- Taniyama Y., Ito H., Iwakura K., Masuyama T., Hori M., Takiuchi S. et al. Beneficial effect of intracoronary verapamil on microvascular and myocardial salvage in patients with acute myocardial infarction. J. Am. Coll. Cardiol. 1997;30(5):1193-1199. https://doi.org/10.1016/s0735-1097(97)00277-5.
- Huang R.I., Patel P., Walinsky P., Fischman D.L., Ogilby J.D., Awar M. et al. Efficacy of intracoronary nicardipine in the treatment of no-reflow during percutaneous coronary intervention. Catheter Cardiovasc. Interv. 2006;68(5):671-676. https://doi.org/10.1002/ccd.20885.
- Fischell T.A., Haller S., Pulukurthy S., Virk I.S. Nicardipine and adenosine “flush cocktail” to prevent no-reflow during rotational atherectomy. Cardiovasc. Revasc. Med. 2008;9(4):224-228. https://doi.org/10.1016/j.carrev.2008.03.002.


