Репродуктивная функция коров (Bos taurus) под влиянием различных кисспептинов (обзор)
Автор: Ширяев Г.В., Притужалова А.О., Никитин Г.С., Никиткина Е.В., Мусидрай А.А., Алексеева А.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Кисспептины (КП), представляющие собой семейство пептидов различной длины, и их рецептор (KISS1R) совместно с гонадотропин-рилизинг-гормоном (Гн-РГ), гонадотропинами (лютеинизирующий и фолликулостимулирующий гормоны) и половыми стероидами, - важные регуляторы репродукции у животных (S. Ohkura с соавт., 2009; K.-L. Hu с соавт., 2018). Активное изучение КП началось в 2003 году, однако в настоящее время собрано недостаточно сведений о возможностях целенаправленно и эффективно управлять половым циклом коров Bos taurus (особенно молочного направления) с помощью КП (B.R. Alves и соавт., 2015; T. Songphasuk и соавт., 2021). КП продуцируются главным образом в нейронах различных ядер гипоталамуса (V. Prashar с соавт., 2023). Расположение таких нейронов видоспецифично, поэтому подходы к управлению с их помощью репродуктивной функцией могут различаться (A. Gunn и соавт., 2020). КП - это продукты гидролиза гидрофобного прогормона, кодируемого геном kiss1 . Сначала КП гидролизуется до КП-53, который в дальнейшем распадается до более коротких пептидов (КП-14, КП-13 и КП-10), обладающих различной биологической активностью (A.E. Oakley и соавт., 2009; J. Tomikawa и соавт., 2010). Нейроны, продуцирующие КП, также коэкспрессируют пептидные нейротрансмиттеры - нейрокинин B (NKB) и динорфин, что определило название этой популяции нервных клеток (KNDy-нейроны, кисспептин/нейрокинин B/динорфин) (R.L. Goodman и соавт., 2013; Q. Xie и соавт., 2022). У крупного рогатого скота (КРС) KNDy-нейроны в основном присутствуют в аркуатном ядре гипоталамуса, которое считается важным как для положительной, так и для отрицательной обратной регуляции синтеза Гн-РГ половыми стероидами (A. Hassaneen и соавт., 2016; Y. Uenoyama и соавт., 2021). С использованием гистохимического метода продемонстрировано, что активация KNDy-нейронов у КРС зависит от фазы полового цикла (A. Hassaneen с соавт., 2016). Кисспептин-, нейрокинин В-, и динорфин-иммунореактивные клеточные тела и волокна обнаружены по всему аркуатному ядру гипоталамуса во всех фазах. В отличие от аркуатного ядра, многочисленные кисспептин-иммунореактивные клеточные тела обнаружены в преоптической области гипоталамуса в фолликулярную фазу цикла, тогда как в лютеиновую фазу зафиксировано лишь несколько иммунореактивных клеточных тел. Что касается нейрокинина В, то в преоптической области обнаружено небольшое количество нейрокинин В-иммунореактивных клеточных тел и волокон как в фолликулярную, так и в лютеиновую фазы. При этом динорфин-иммунореактивных клеточных тел и волокон в фолликулярную фазу было больше, чем в лютеиновую. В этом отношении КРС ближе к овцам и приматам, включая человека (V.M. Tanco с соавт., 2016). С первоначальной идентификации KND-нейронов, продуцирующих КП, остается большое число нерешенных вопросов, касающихся функции различных популяций этих нервных клеток в зависимости от локализации, а также о возможностях новых технологий для их изучения, в том числе применительно к Bos taurus . Существует необходимость изучения различных концентраций кисспептинов и их влияния на возможность овуляции у коров. В настоящем обзоре рассмотрены основные сведения о локализации и структурно-функциональной характеристике КП Bos taurus , о распределении и функции нейронов КП в головном мозге, о содержании КП в крови и их влиянии на органы репродуктивной системы. Отдельно освещены вопросы экзогенной регуляции КП функционирования репродуктивной системы у Bos taurus . Основное внимание уделено исследованиям, где главным объектом были животные вида Bos taurus.
Bos taurus, коровы, гормон, половой цикл, кисспептин, гонадотропин-рилизинг-гормон, нейроны
Короткий адрес: https://sciup.org/142240686
IDR: 142240686 | УДК: 636.2:591.16:612.6 | DOI: 10.15389/agrobiology.2023.6.974rus
Текст обзорной статьи Репродуктивная функция коров (Bos taurus) под влиянием различных кисспептинов (обзор)
Процесс формирования репродуктивной системы сельскохозяйственных животных начинается на ранних этапах эмбриогенеза и продолжается до достижения половой зрелости как анатомически, так и функционально. Регуляция осуществляется главным образом через гипоталамо-ги-пофизарно-гонадную ось (ГГГО). У крупного рогатого скота (КРС), как и у других видов млекопитающих, в этой системе одним из важнейших звеньев служит гонадотропин-рилизинг-гормон (Гн-РГ), контролирующий
* Исследования проведены в рамках выполнения проекта РНФ ¹ 21-76-10042.
этапы активации и реактивации полового цикла (1).
Гн-РГ стимулирует секрецию в передней доле гипофиза лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, которые через периферическое кровообращение, влияя на гонады, регулируют стероидогенез и гаметогенез (2). Образующиеся в результате этих физиологических процессов половые стероиды по принципам обратной связи контролируют секрецию Гн-РГ. Такая схема гормональной регуляции ГГГО, присущая практически всем видам животных, долгое время вызывала несколько важных вопросов. Во-первых, не существовало объяснения, каким образом реализуются механизмы обратной связи половых стероидов с высвобождением Гн-РГ соответствующими нейронами гипоталамуса при отсутствии у них эстрогеновых рецепторов α (ER α ) — основных рецепторов, обеспечивающих как отрицательные, так и положительные обратные связи (3). Во-вторых, не было понятно, как осуществляется контроль над тонической и циклической секрецией Гн-РГ.
Возможность найти ответы на эти вопросы появилась с открытием кисспептинов (КП) — семейства пептидов, имеющих общее происхождение от прогормона, кодируемого геном kiss1. В 1996 году первый идентифицированный белок этого гена был назван метастином в связи с его способностью ингибировать метастазирование раковых клеток. Через 3 года идентифицировали рецептор этого гормона KISS1R (ранее обозначаемый как GPR54, AXOR12 или Hot7T7T175). В 2003 году открыто влияния КП на реализацию репродуктивной функции.
За более чем 12 лет продемонстрирована роль КП в качестве главного фактора инициации полового созревания, регуляции тонического и циклического высвобождения Гн-РГ, оказывающего существенное влияние на фертильность самок: секрецию гонадотропинов, начало стадии полового созревания, половую дифференциацию мозга, наступление овуляции и метаболическую регуляцию фертильности (4, 5). Существует множество публикаций, раскрывающих физиологическую роль КП в нейрогуморальном аспекте у разных видов диких и домашних животных (6-10).
Цель настоящего обзора — систематизация накопленных данных по влиянию кисспептинов на репродуктивную функцию у Bos taurus .
Локализация и структурно-функциональная характеристика кисспептинов Bos taurus . Основываясь на результатах исследований, выполненных на других видах, можно предположить схожую локализацию системы kiss-1 /KISS1R в центральной нервной системе (главным образом в гипоталамусе) и плаценте. Также сообщается об экспрессии в гонадах, поджелудочной железе, печени, тонком кишечнике, селезенке, жировой ткани, лимфатических узлах (7, 9, 10).
У КРС ген kiss1 на 16-й хромосоме кодирует прогормон в виде гидрофобного белка, состоящего из 135 аминокислотных остатков (а.о.). Этот прогормон гидролизуется в белок кисспептин 53 (КП-53). Имеется множество данных, указывающих на дальнейший гидролиз КП-53 на короткие пептиды (КП-14, КП-13 и КП-10). Подобные сведения не были получены в исследованиях, посвященных КРС, но можно предположить схожую схему (рис. 1). Все четыре формы пептида обладают аффинностью , эффективно связываются с рецепторами и характеризуются высокой устойчивостью для всех видов позвоночных (11) (табл. 1).
Наиболее биологически активной формой кисспептина служит структура, состоящая из 52-54 аминокислот в зависимости от вида животного (6). Аминокислотная последовательность кисспептина по структуре консервативна и сохраняется у различных видов млекопитающих (рис. 2)
(11, 13). Например, аминокислотная последовательность КП козы на 98 % схожа с КП овцы, на 91 % — с КП коровы и на 77 % — с КП свиньи. В частности, C-терминальный домен, состоящий из 10 а.о. (минимальная последовательность для максимальной активации рецепторов), идентичен среди большинства перечисленных видов (см. рис. 2) (14, 15).
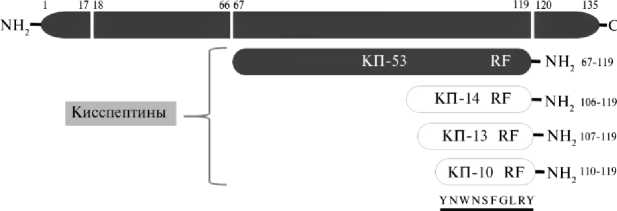
Рис. 1. Основные структурные особенности кисспептинов Bos taurus , образующихся в результате посттрансляционной модификации прогормона. Белым цветом выделены кисспептины, которые предположительно также образуются после гидролиза КП-53. Все кисспептины содержат RF-амид, который способен связывать и активировать KISS1R (адаптировано по ссылке 12).
|
Человек |
GTS LS РРР |
Е |
S SGS PQQPG LSAPH |
SR |
Q |
1 Р |
А |
PQGAV |
LVQR EKD |
L P N |
VNWNSFGLR |
F |
54 |
|||
|
Шимпанзе |
GTS L S Р Р Р |
Е |
SSGS PQQPG LSАРN |
SR |
Q |
1 Р |
А |
Р |
QGAV |
LVQR EKD |
L P N |
YNWNSFGLR |
F |
54 |
||
|
Свинья |
GTSSCQPP |
Е |
SSSGPQRPGLCTPR |
SR |
L |
1 Р |
А |
Р |
RGAV |
LVQR EKD |
L SA |
YNWNSFGLR |
Y |
54 |
||
|
Крупный рогатый скот |
GAALCPP- |
Е |
S SAGPQRLGPCAPR |
SR |
L |
1 Р |
S |
Р |
R |
GAV |
LVQR EKD |
V SA |
YNWNSFGLR |
Y |
53 |
|
|
Овца |
GАА L С Р S - |
Е |
SSAGPRQPGPCAPR |
SR |
L |
1 Р |
А |
Р |
RGAA |
LVQR EKD |
V S A |
YNWNSFGLR |
Y |
53 |
||
|
Коза |
GAA LCPS - |
Е |
SSAGPRQPGPCAPR |
SR |
L |
1 Р |
А |
Р |
RGAV |
LVQR EKD |
V S A |
YNWNSFGLR |
Y |
53 |
||
|
Крыса |
-TS PC PPV |
Е |
NPTGHQRP-PCATR |
SR |
L |
1 Р |
А |
Р |
R |
GS V |
LVQR EKD |
MSA |
YNWNSFGLR |
Y |
52 |
|
|
Мышь |
- S S PC Р PV |
Е |
GPAGRQRP-LCASR |
SR |
L |
1 Р |
А |
Р |
RGAV |
LVQR EKD |
L ST |
YNWNSFGLR |
Y |
52 |
||
|
* |
* + |
* * |
♦ |
* |
******* |
** * ****** |
||||||||||
Рис. 2. Сравнение аминокислотной последовательности кисспептина у разных видов млекопитающих (11) . В последнем столбце указано число аминокислотных остатков. Идентичные аминокислотные остатки отмечены звездочкой (*). Выделенная последовательность YNWNSFGLR показывает область КП-10, которая аналогична для многих видов млекопитающих.
Распределение и функция нейронов кисспептина в головном мозге Bos taurus . Существование тонической системы секреции Гн-РГ у обоих полов, а циклической — только у самок согласуется с представлениями о том, что регуляторные центры тонической и циклической систем расположены в различных областях гипоталамуса. Это в полной мере касается районов гипоталамуса, в которых выявлены нейроны, продуцирующие КП. Кисспептиновые нейроны коэкспрессируют пептидные нейротрансмиттеры — нейрокинин B (neurokinin B , NKB) и динорфин (16-20). Из-за высокой степени совместной локализации трех указанных нейропептидов эта популяция нейронов получила название KNDy-нейронов (kisspep-tin/neurokinin B/dynorphin, кисспептин/нейрокинин B/динорфин) (21, 22).
Локализация KNDy-нейронов в гипоталамусе видоспецифична. У КРС KNDy-нейроны в основном находятся в аркуатном ядре гипоталамуса (arcuate core, ARC), которое считается важным как для положительной, так и для отрицательной обратной регуляции синтеза Гн-РГ половыми стерои- дами (23-25). Большинство KNDy-нейронов экспрессируют эстрогеновые рецепторы α (estrogen receptors α, ERα) и рецепторы прогестерона (25-28), поэтому синтез и секреция всех продуктов этих нейронов зависят от содержания половых стероидов. При этом обгорожены области популяций нейронов, продуцирующие КП с малым количеством динорфина и NKB (22). Однако важно отметить и данные, ставящие под сомнение только прямое воздействие кисспептинов на нейроны, продуцирующие Гн-РГ. Согласно A. Gunn с соавт. (25), нейроны Гн-РГ располагаются рядом с кис-спептин-нейронами в небольшом количестве. Авторы предположили, что действие эстрогенов может передаваться через кисспептин-нейроны, но у КРС в отличие от большинства других видов млекопитающих это вряд ли будет главным фактором стимулирования.
С помощью гистохимического метода продемонстрировано, что активизация KNDy-нейронов у КРС зависит от фазы полового цикла (22). Кис-спептин-, нейрокинин В-, и динорфин-иммунореактивные клеточные тела и волокна найдены по всему ARC во всех фазах. В отличие от ARC, многочисленные кисспептин-иммунореактивные клеточные тела обнаружены в преоптической области гипоталамуса (preoptic area, POA) в фолликулярную фазу, тогда как для лютеиновой фазы зафиксировано лишь несколько иммунореактивных клеточных тел. Что касается NKB, то в POA обнаружено небольшое число нейрокинин В-иммунореактивных клеточных тел и волокон как в фолликулярную, так и в лютеиновую фазу. При этом динорфин-иммунореактивных клеточных тел и волокон в фолликулярную фазу было больше, чем в лютеиновую. В этом отношении, как показывают исследования V.M. Tanco с соавт. (29), КРС ближе к овцам и приматам, включая человека. Например, у грызунов клетки, экспрессирующие мРНК kiss1 , расположены и в ARC, и в POA (30). У овец, коз и оленей большая часть KNDy-нейронов находилась в ARC и лишь небольшая — в POA (26, 31, 32).
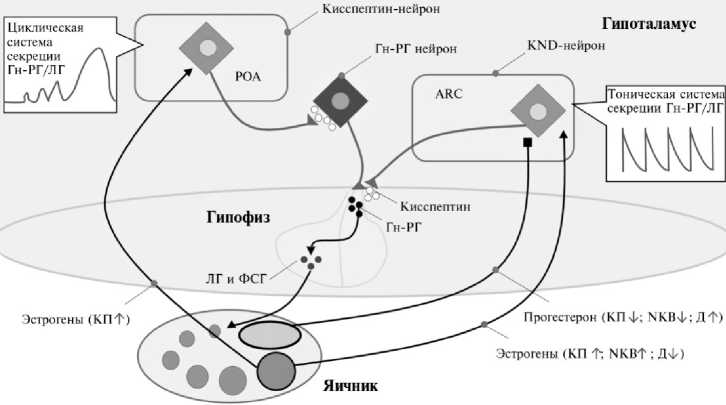
Рис. 3. Схема регуляции репродуктивной функции Bos taurus с участием кисспептина: Гн-РГ— гонадотропин-рилизинг-гормон, ЛГ — лютеинизирующий гормон, ФСГ — фолликулостимулирующий гормон, POA — преоптическая область гипоталамуса, ARC — аркуатное ядро гипоталамуса, КП — кисспептин, NKB — нейрокинин В, Д — динорфин .
Активизация трех веществ KNDy-нейронов в ARC во все фазы полового цикла позволяет реализовывать механизм тонического высвобождения Гн-РГ (рис. 3). Во многом это возможно благодаря тому, что KNDy-нейроны в ARC за счет связей через аксоны и/или дендриты формируют популяцию нейронов, оказывающих взаимное влияние друг на друга. Причем в ARC KNDy-нейроны образуют плотную сеть, что, вероятно, способствует синхронизации их активности (3, 22). Синхронная активность KNDy-нейронов считается необходимой для пульсирующей секреции Гн-РГ. Главную роль при создании подобной синхронности некоторые авторы отводят системе NKB с его рецептором NK3R (33, 34). Нейроны кисспептина не экспрессируют KISS1R, но экспрессируют рецепторы к динорфину и нейрокинину B. То есть связь между KNDy-нейронами осуществляется через нейрокинин B и динорфин, но не через кисспептин (35). Секретируемый KNDy-нейроном NKB, связываясь со своим рецептором NK3R на поверхности другого KNDy-нейрона, вызывает приток в него Ca2+. Повышение концентрации внутриклеточного Ca2+ может способствовать его движению в соседние KNDy-нейроны и глиальные клетки через межклеточные щелевые контакты (GAP junctions), даже если эти KNDy-нейроны не экспрессируют NK3R. Так формируется синхронизированная активность нейронов KNDy, которая индуцируется передачей сигналов NKB-NK3R.
Динорфин, синтезированный KNDy-нейроном, связываясь со своим κ-опиоидным рецептором (κ-opioid receptor, KOR) на поверхности соседнего KNDy-нейрона, может вызывать в отношении него реакции ингибиторного характера. Считается, что каждое колебание, опосредованное NKB/NK3R и динорфин/KOR, вызывает пульсирующий выброс кисспептина (33). Стоит отметить, что наличие в KNDy-нейронах системы динорфин/KOR определяет возможность отрицательной связи через половые стероиды (эстрогены, прогестерон и тестостерон) (36). Эти данные позволяют утверждать, что у Bos taurus KNDy-нейроны в ARC функционируют на протяжении всего эстрального цикла и регулируют развитие фолликулов и функцию желтого тела посредством тонического высвобождения Гн-РГ, тогда как вторая популяция кисспептиновых нейронов, обнаруженных в больших количествах в POA во время фолликулярной фазы, может быть вовлечена в циклический предовуляторный подъем концентрации Гн-РГ/ЛГ (22).
Данные I.J. Clarke с соавт. (37) косвенно подтверждают, что в ARC нейроны, продуцирующие кисспептин, более активные. У коров со спонтанными овариальными циклами экспрессия kiss1 в аркуатном ядре почти в 2 раза выше по сравнению с коровами, у которых фиксируются различные проблемы в проявлении цикличности (37).
В работе A. Hassaneen с соавт. (22) указано наличие некоторых кис-спептин-иммунореактивных клеточных тел и нервных волокон в супраоптическом гребне OVLT (organum vasculosum laminae terminalis). Это вызывает интерес, поскольку ранее в OVLT было обнаружено плотное скопление нейронов и волокон, продуцирующих Гн-РГ (29). В работе A. Hassaneen с соавт. (22) также зафиксировано наличие иммунореактивных волокон в PVN (paraventricular nucleus, паравентрикулярные ядра), DMH (dorsomedial hypothalamic nucleus, дорсомедиальные ядра), VMH (ventromedial nucleus, вентромедиальные ядра) и LaH (lateral hypothalamus, латеральный гипоталамус). Примечательно скопление иммунореактивных волокон во внешней зоне срединного возвышения, указывающее на то, что кисспептин секретируется в портальную сосудистую систему за пределами гематоэнцефалического барьера. Во внутренней зоне имеются многочисленные волокна, позволяющие взаимодействовать с волокнами нейронов, которые также секретируют в портальные сосуды (38).
Аналогичные данные по OVLT получили C.E. Leonardi с соавт. (39). Они изучали распределение нейронов Гн-РГ и КП в гипоталамусе во время полового цикла у коров. Основные скопления нейронов КП были локали- зованы в POA, ARC и OVLT (39). Обращает на себя внимание тот факт, что наибольшее число нейронов КП было зарегистрировано в POA у животных, находящихся в лютеальной фазе (метэструсе), а наименьшее — в диэструсе. Это согласуется с данными, что повышенное содержание прогестерона, которое характерно для фазы диэструса, вызывает синтез и секрецию динор-фина, снижающего продукцию Гн-РГ (40).
Повышение количества динорфина в ответ на стрессовые и физические нагрузки может подавлять секрецию Гн-РГ/ЛГ (36) (см. рис. 2). Стрессовые факторы (жара, транспортировка, ветеринарные манипуляции) нарушают репродуктивную функцию за счет снижения секреции Гн-РГ не только через динорфин. Частично это происходит через кортизол, действующий через глюкокортикоидный рецептор II типа. При этом нейроны Гн-РГ не экспрессируют рецептор, но KNDy-нейроны на это способны.
Примеры с динорфином и кортизолом еще раз доказывают, что гипоталамический контроль фертильности зависит от различных внешних факторов. В случае с КРС одним из важнейших факторов становится энергетический статус животных. Нейроны Гн-РГ лишены многих рецепторов метаболических гормонов, зависимых от содержания нутриентов, что подразумевает наличие соответствующих пресинаптических нейронов по отношению к нейронам Гн-РГ. Нейроны КП экспрессируют рецепторы не только стероидных, но и метаболических гормонов, таких как инсулин, лептин и грелин (41). Можно предположить, что нейроны КП могут быть ключевыми для координации энергетического состояния животных с их репродуктивной функцией (23, 38, 42, 43).
Содержание кисспептина в крови у Bos taurus . В настоящее время научных работ, посвященных изучению содержания кисспеп-тинов в организме КРС, крайне мало. Это объясняется сложностью постановки опытов и нехваткой необходимых реагентов для определения. Так, наборов для определения различных кисспептинов (КП-53, КП-14, КП-13, КП-10) методом иммуноферментного анализа практически нет, и исследования приходится делать с помощью радиоиммунного анализа, который ввиду своей специфики не всегда доступен. Альтернативным вариантом может стать определение прогормона, который также приставляет собой кис-спептин, для чего имеются доступные коммерческие наборы.
В одном из немногочисленных исследований авторы оценивали содержание КП-10 у коров молочного направления продуктивности на 10-е, 12-е, 14-е и 16-е сут после отела (44). В эксперименте также изучали концентрацию прогестерона и эстрадиола. Содержание КП-10 составило соответственно 116,99±35,29; 114,86±27,34; 149,5±36,67 и 124,69±42,76 пг/мл. При этом показатели по прогестерону сохранялись практически без изменений — около 0,35 нг/мл, а концентрация эстрогенов составила соответственно 0,92±0,34; 1,33±0,4; 1,81±0,37 и 1,78±0,33 нг/мл. Можно отметить, что максимальные количества КП-10 совпадали с повышением концентрации эстрадиола. Авторы сделали вывод, что увеличение содержания эстрогенов может по принципу обратной положительной связи усиливать синтез и секрецию гипоталамического КП-10 (44). Этот вывод подтверждают A. Rizzo с соавт. (45). По данным исследователей, в послеотельный период (80±15 сут) зафиксировано достоверное повышение КП-10 у коров в группе с фолликулярными кистами (125,06±34,47 против 97,72±21,34 пг/мл у здоровых), где также отмечалось почти 2-кратное превышение концентраций эстрадиола и прогестерона (45).
Влияние кисспептина на органы репродуктивной системы . В большом числе публикаций постулируется, что основная функция
КП реализуется в гипоталамной регуляции ГГГО. Однако появились данные, доказывающие их участие в регуляции функции яичников, трофобласта эмбриона и плаценты (46), что требуют более глубокого изучения.
В работе H. Liu с соавт. (47) обнаружена экспрессия КП-10 в пре-антральных фолликулах коровы — в ооцитах, гранулезных и тека-клетках (с максимальной экспрессией в последних). Это вызывает интерес, поскольку у КРС большинство растущих in vivo фолликулов постепенно становятся атретичными в фазу роста, которая начинается с формирования преантраль-ных фолликулов. Продемонстрировано дозозависимое негативное влияние КП-10 на рост фолликулов (вплоть до их атрезии) и высказано предположение, что КП подавляет экспрессию рецептора ФСГ (47).
На стадии фолликулярного роста развитие и созревание ооцитов зависит прежде всего от их связи с клетками гранулезы. H. Liu с соавт. (48) продемонстрировали, что КП-10, ингибируя процессы пролиферации, способствует инициации апоптоза в клетках гранулезы яичников у коров. КП10 может оказывать и несколько иное действие, не связанное с апоптозом клеток. Некоторые авторы отмечают способность КП-10 снижать экспрессию одного из видов микроРНК — miR-1246, оказывающей ингибирующее действие на синтез прогестерона гранулезными клетками в фолликулах (49).
Возможно, ингибирующий эффект КП связан с необходимостью купировать появление новых преовуляторных фолликулов. На ранних этапах эмбриогенеза влияние кисспептина может быть стимулирующим. M.M. Soares с соавт. (50) изучали действие КП при культивировании эмбрионов in vitro и продемонстрировали, что добавление КП-10 в среду повышает скорость образования бластоцисты.
Интересна также экспрессия kiss1 /KISS1R в процессе плацентации, имеющем видовые различия. У коров имплантация представляет собой менее инвазивный процесс: при синэпителиально-хориальной плацентации у жвачных трофобласт не проникает в базальную мембрану и строму матки, а образует ворсинчатые выросты в эпителии эндометрия. Основываясь на этом, M.J. D’Occhio с соавт. (46) предположили влияние экспрессии kiss1 трофобласта эмбриона на KISS1R матки. Ген может влиять на начальное прикрепление трофобласта к эпителию эндометрия матки посредством взаимодействия с молекулами межклеточной адгезии и белками внеклеточного матрикса. Поэтому у домашнего скота система kiss1 /KISS1R может играть меньшую роль.
Система kiss1 /KISS1R участвует и в регуляции развития плаценты у коров. N.A. Martino с соавт. (51) продемонстрировали, что культуры эпителиальных клеток КРС, полученных от стельных коров первого триместра, экспрессировали KISS1R (51). Добавление КП-10 к культурам как стимулировало, так и подавляло пролиферацию эпителиальных клеток в двух отдельно взятых клеточных линиях. Стимуляция этого процесса происходила в клеточной линии, которая демонстрировала повышенную регуляцию мРНК KISS1R. Это особенно важно, поскольку неспособность эмбрионов жвачных животных к прикреплению и имплантации — одна из основных причин снижения репродуктивных показателей (46, 52).
Экзогенная регуляция кисспептином функционирования репродуктивной системы у Bos taurus . Учитывая сложность определения КП в крови КРС, исследователи практически сразу обратили внимание на возможность испытания КП с помощью экзогенного введения с последующим анализом результатов воздействия. При этом до сих пор изучение биологического влияния КП на КРС проблематично ввиду отсутствия препаратов, непосредственно предназначенных для вида 980
Bos taurus . В большинстве научных работ использовали человеческий или мышиный КП-10. Учитывая, что КП-10 наиболее схож по своей аминокислотной последовательности практически у всех видов млекопитающих, именно этот пептид чаще всего используют для изучения влияния кисспеп-тинов на репродуктивную функцию через их экзогенное введение.
Однако стоит учитывать, что применение различных вариантов КП10 может вносить коррективы в результаты исследования. Это показал в своей диссертации C.E. Leonardi (53). Однократное болюсное введение или многократные внутривенные инъекции человеческого КП-10 эффективнее повышали содержание ЛГ в плазме крови в сравнении с аналогичным лечением мышиным КП-10 (53). Ввиду малочисленности сообщений о влиянии экзогенного КП на Bos taurus в обзоре мы объединили данные публикаций, где использовались различные кисспептины.
В этом отношении интерес представляют первые опыты с культурами клеток аденогипофиза телят и взрослых животных с целью обнаружения воздействия КП-10 на содержание различных гормонов (54-56). Продемонстрировано дозозависимое влияние экзогенного КП-10 на повышение количества ЛГ и гормона роста в клетках аденогипофиза независимо от возраста (54, 55). A.A. Ezzat с соавт. (56) изучали влияние КП-10 на секрецию ЛГ, ФСГ и пролактина клетками передней доли гипофиза крупного рогатого скота с оценкой способности половых стероидов усиливать чувствительность гонадотропных и лактотропных клеток к КП-10. КП-10 значительно стимулировал секрецию ЛГ клетками, обработанными эстрадиолом и тестостероном, но не клетками, обработанными прогестероном. Напротив, КП-10 не влиял на секрецию ФСГ независимо от применения стероидов. КП-10 значительно стимулировал секрецию пролактина, но влияния половых стероидов не было обнаружено. Такие результаты позволяют предположить, что эстрадиол и тестостерон повышают чувствительность гонадотропных клеток к секреции ЛГ в ответ на КП-10. КП-10 напрямую стимулирует секрецию пролактина клетками гипофиза, а половые стероиды не повышают чувствительность лактотропных клеток к КП-10 (56).
Результаты описанных опытов позволяют сделать вывод, что действие кисспептина по стимуляции секреции ЛГ у КРС может проявляться как минимум в двух вариантах: как воздействие на нейроны Гн-РГ с его последующей секрецией в POA или ARC (тела клеток, дендриты или денд-роны) и как стимуляция секреции ЛГ непосредственно в гипофизе. Это может влиять на генерацию импульсов Гн-РГ/ЛГ, а также на преовуляторный всплеск Гн-РГ/ЛГ. У других видов животных встречается третий вариант — кисспептин KNDy-нейронов, расположенных в ARC, способен воздействовать на терминали нейронов Гн-РГ в срединном возвышении, но подобных опытов на КРС не проводили (57, 58).
Стимуляция кисспептином продемонстрирована в исследованиях по инъекционному введению КП-10 и КП-53 коровам и телкам разных пород и возрастов (59 - 61). В большинстве случаев инъекции кисспептинов приводили к всплеску концентрации ЛГ, а также к повышению концентрации гормона роста (62-64). Однако в сравнении с экзогенным введением Гн-РГ влияние КП-10 было менее эффективным, а инъекции КП-53 обеспечивали содержание ЛГ, достаточное для овуляции (59, 63, 65).
Ингибирующее воздействие прогестерона на возможность кисспеп-тина повышать концентрацию ЛГ оценили A.E. Ahmed с соавт. (62). В течение 7 сут на циклирующих коров воздействовали интравагинальным устройством, высвобождающим прогестерон (progesterone releasing intravaginal device, PRID). Животные получали однократную внутривенную инъекцию КП-10
в течение 3 сут после удаления устройства. Концентрация прогестерона в плазме крови была выше на дату удаления PRID с последующим снижением на 1-е и 2-е сут. КП-10 существенно не изменял концентрации ЛГ в плазме на дату удаления PRID. Однако он значительно стимулировал высвобождение ЛГ в последующие дни. Авторы пришли к выводу, что KП-10 стимулирует высвобождение ЛГ у циклирующих послеотельных коров, а высокие концентрации прогестерона в плазме крови могут снижать влияние кис-спептина на секрецию ЛГ (62).
Почти во всех работах, где влияние кисспептинов на количество ФСГ исследовали на коровах разных пород и возрастов, концентрация ФСГ практически не изменялась. Однако встречаются публикации, демонстрирующие обратное. В статье M.A. Rodriguez с соавт. (66) эффективность введения КП-10 изучалась на телятах в возрасте 4, 7 и 11 мес. Во всех возрастах внутривенное введение КП-10 повышало содержание ФСГ.
На самцах КРС чаще фиксируется положительное влияние кисспеп-тинов на концентрацию ФСГ. В нескольких исследованиях показано, что однократная внутривенная инъекция КП-10 значительно стимулировала высвобождение ЛГ и ФСГ у телят и бычков (67, 68). S.L. Northup с соавт. (69) изучали влияние внутривенного введения КП-10 бычкам в пубертатный период на сывороточную концентрацию ЛГ и ФСГ. Острая внутривенная инфузия КП-10 повышала сывороточный ЛГ и не изменяла ФСГ. Хроническая внутривенная инфузия не оказывала эффекта на ЛГ, но снижала среднюю концентрацию ФСГ в сыворотке и амплитуду его пульсации (69).
Резюмируя данные по экзогенному введению кисспептинов, можно отметить их стимулирующее воздействие на синтез и секрецию ЛГ. В отношении гормона роста влияние КП-10 обусловлено возрастом животных, что может объяснять положительное влияние стероидных гормонов (прогестерона и эстрадиола). По влиянию кисспептинов на ФСГ данные противоречивые и требуют уточнения, хотя в большинстве сообщений синтез и секреция ФСГ были менее подвержены стимуляции. Объяснение этому может быть связано с большей устойчивостью ФСГ к пульсовой секреции Гн-РГ и с подавляющим воздействием ингибина А и В на секрецию ФСГ (36, 70).
Интерес к изучению эффективности экзогенного (инъекционного) введения кисспептинов очевиден — потенциально существует возможность управлять половым циклом через контроль секреции Гн-РГ и гонадотропинов (71). Например, M. Mondal с соавт. (72) продемонстрировали, что протокол синхронизации на основе кисспептина индуцировал лучший рост фолликулов, чем протокол овариальной синхронизации oвсинх (ovsynch). Частота овуляции была достоверно выше, процесс лютеолиза начинался раньше, даже до инъекции простагландинов (72).
Однако в целом у большинства авторов остаются вопросы к инъекционному применению кисспептинов для контроля овуляции, тем более что использование эндогенных пептидов имеет четкие ограничения. Например, период полураспада КП-10 в кровотоке составляет менее 1 мин, и в большинстве случаев желаемый эффект может достигаться только перфузией (внутривенной или интрацеребровентрикулярной) либо ежечасной инъекцией. Использование интрацеребровентрикулярной или внутривенной перфузии в сельскохозяйственных условиях сложно реализовать, а многократные внутривенные инъекции требуют увеличения затрат на ветеринарные услуги. Неудивительно, что исследователей заинтересовала возможность использовать синтетические аналоги кисспептинов, имеющие высокую активность и более длительный период полураспада (73).
Например, P.A. Parker с соавт. (74) исследовали влияние синтетиче- ского аналога кисспептина, который получил название Соединение 6 (С6), на концентрацию ЛГ, ФСГ и тестостерона на препубертатных бычках. Активность С6 in vitro была примерно в 8 раз выше, чем у КП-10. Показано, что внутримышечное введение С6 увеличивало концентрацию ЛГ без изменения содержания ФСГ и тестостерона в крови. Также в качестве примера использования синтетического аналога кисспептина (TAK448) можно привести работу C.R. Burke с соавт. (75). Авторы пришли к выводу, что лечение кисспептином может индуцировать овуляцию у послеотельных молочных коров с последующими эстральными циклами нормальной продолжительности, если оно проводится, когда в яичниках присутствует зрелый доминантный фолликул (75).
В исследованиях S.M. Popa с соавт. (76) на генно-модифицированных мышах, которые демонстрировали только 5 % экспрессии KISS1, обнаружено, что и самцы, и самки достигали полового созревания и сохраняли фертильность. Y. Uenoyama с соавт. (3) подтвердили этот феномен на крысах, установив, что 20 % KNDy-нейронов достаточно для поддержания импульсов Гн-РГ и фолликулогенеза, что свидетельствует о функциональной избыточности популяции KNDy-нейронов. Авторы указали, что пока недостаточно информации о функциональной избыточности KNDy-нейронов у других (кроме грызунов) видов млекопитающих (3).
Хотя со времени первоначальной идентификации KND-нейронов, продуцирующих КП, стало известно многое, все еще остается большое число нерешенных вопросов, касающихся функции различных популяций этих нервных клеток в зависимости от локализации, а также о возможностях новых технологий для их изучения, в том числе применительно к Bos taurus . Необходимо проанализировать влияние различных концентраций кис-спептинов на возможность овуляции у КРС. При этом есть объективная проблема, которая пока не решена даже в медицине. Как отмечают M.A. Hussain с соавт. (77), измерение концентраций циркулирующего кисспептина у различных видов млекопитающих с использованием коммерчески доступных приемов не очень надежно из-за больших различий в методах анализа, диапазонах обнаружения и неопределенности в отношении того, какие формы кисспептина (например, КП-10, КР54) обнаружены (77). Требуется дальнейшее совершенствование методов для измерения концентрации кисспеп-тина в биологических жидкостях.
Таким образом, в современной литературе имеется значительный объем информации о влиянии кисспептина на репродуктивную функцию Bos taurus , однако большая часть данных получена при экзогенном (инъекционном) введении кисспептин - содержащих препаратов с последующей оценкой физиологических эффектов в отношении гормонального фона животных . Очевиден недостаток сведений о естественных уровнях кисспеп-тина у молодых животных, концентрации кисспептина в крови циклирующих и стельных коров , взаимосвязи концентраций кисспептина с показателями воспроизводства и продуктивности . Информация, представленная в настоящее время в научной литературе, довольно часто получена на других видах животных. Кисспептин, который используется в опытах на коровах, в большинстве случав невидоспецифичен, получен от других видов либо представлен синтетическим аналогом . В целом, несмотря на то, что роль кисспептина в реализации репродуктивной функции установлена сравнительно давно, этот гормон интересен для дальнейшего изучения при условии появления необходимых инструментов точной детекции и определения его концентраций.
Список литературы Репродуктивная функция коров (Bos taurus) под влиянием различных кисспептинов (обзор)
- Abreu A.P., Kaiser U.B. Pubertal development and regulation. The Lancet Diabetes & Endocri-nology, 2016, 4(3): 254-264 (doi: 10.1016/S2213-8587(15)00418-0).
- Pielecka-Fortuna J., Chu Z., Moenter S. Kisspeptin acts directly and indirectly to increase Gon-adotropin-Releasing hormone neuron activity and its effects are modulated by estradiol. Endocri-nology, 2008, 149(4): 1979-86 (doi: 10.1210/en.2007-1365).
- Uenoyama Y., Inoue N., Nakamura S., Tsukamura H. Kisspeptin neurons and estrogen-estrogen receptor α signaling: unraveling the mystery of steroid feedback system regulating mammalian reproduction. International Journal of Molecular Sciences, 2021, 22(17): 9229 (doi: 10.3390/ijms22179229).
- Hu K.-L., Zhao H., Chang H.-M., Yu Y., Qiao, J. Kisspeptin/Kisspeptin receptor system in the ovary. Frontiers in Endocrinology, 2018, 8: 365 (doi: 10.3389/fendo.2017.00365).
- Prashar V., Arora T., Singh R., Sharma A., Parkash J. Hypothalamic kisspeptin neurons: integral elements of the GnRH system. Reproductive Sciences, 2023, 30(3): 802-822 (doi: 10.1007/s43032-022-01027-5).
- Oakley A.E., Clifton D.K., Steiner R.A. Kisspeptin signaling in the brain. Endocrine Reviews, 2009, 30(6): 713-743 (doi: 10.1210/er.2009-0005).
- Ohkura S., Uenoyama Y., Yamada S., Homma T., Takase K., Inoue N., Maeda K-I., Tsukamura H. Physiological role of metastin/kisspeptin in regulating gonadotropinreleasing hormone (GnRH) se-cretion in female rats. Peptides, 2009, 30(1): 49-56 (doi: 10.1016/j.peptides.2008.08.004).
- Clarke I.J. Control of GnRH secretion: one step back. Frontiers in Neuroendocrinology, 2011, 32(3): 367-375 (doi: 10.1016/j.yfrne.2011.01.001).
- Goodman R.L., Maltby M.J., Millar R.P., Hileman S.M., Nestor C.C., Whited B., Tseng A.S., Coolen L.M., Lehman M.N. Evidence that dopamine acts via kisspeptin to hold GnRH pulse frequency in check in anestrous ewes. Endocrinology, 2012, 153(12): 5918-27 (doi: 10.1210/en.2012-1611).
- Caraty A., Decourt C., Briant C., Beltramo M. Kisspeptins and the reproductive axis: potential applications to manage reproduction in farm animals. Domestic Animal Endocrinology, 2012, 43(2): 95-102 (doi: 10.1016/j.domaniend.2012.03.002).
- Tomikawa J., Homma T., Tajima S., Shibata T., Inamoto Y., Takase K., Inoue N., Ohkura S., Uenoyama Y., Maeda K.-I., Tsukamura H. Molecular characterization and estrogen regulation of hypothalamic KISS1 gene in the pig. Biology of Reproduction, 2010, 82(2): 313-319 (doi: 10.1095/biolreprod.109.079863).
- Uenoyama Y., Nagae M., Tsuchida H., Inoue N., Tsukamura H. Role of KNDy neurons ex-pressing kisspeptin, neurokinin B, and dynorphin A as a GnRH pulse generator controlling mam-malian reproduction. Front. Endocrinol., 2021, 12: 724632 (doi: 10.3389/fendo.2021.724632).
- Ohkura S., Takase K., Matsuyama S., Mogi K., Ichimaru T., Wakabayashi Y., Uenoyama Y., Mori Y., Steiner R.A., Tsukamura H., Maeda K.-I., Okamura H. Gonadotrophinreleasing hor-mone pulse generator activity in the hypothalamus of the goat. Journal of Neuroendocrinology, 2009, 21(10): 813-821 (doi: 10.1111/j.1365-2826.2009.01909.x).
- Kotani M., Detheux M., Vandenbogaerde A., Communi D., Vanderwinden J.M., Le Poul E., Brézillon S., Tyldesley R., Suarez-Huerta N., Vandeput F., Blanpain C., Schiffmann S.N., Vas-sart G., Parmentier M. The metastasis suppressor gene KiSS-1 encodes kisspeptins, the natural ligands of the orphan G protein-coupled receptor GPR54. The Journal of Biological Chemistry, 2001, 276(37): 34631-34636 (doi: 10.1074/jbc.M104847200).
- Ohtaki T., Shintani Y., Honda S., Matsumoto H., Hori A., Kanehashi K., Terao Y., Kumano S., Takatsu Y., Masuda Y., Ishibashi Y., Watanabe T., Asada M., Yamada T., Suenaga M., Kitada C., Usuki S., Kurokawa T., Onda H., Nishimura O., Fujino M. Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-protein-coupled receptor. Nature, 2001, 411(6837): 613-617 (doi: 10.1038/35079135).
- Foradori C.D., Amstalden M., Goodman R.L., Lehman M.N. Colocalisation of dynorphin A and neurokinin B immunoreactivity in the arcuate nucleus and median eminence of the sheep. Journal of Neuroendocrinology, 2006, 18(7): 534-541 (doi: 10.1111/j.1365-2826.2006.01445.x).
- Goodman R.L., Lehman M.N., Smith J.T., Coolen L.M., de Oliveira C.V., Jafarza-dehshirazi M.R., Pereira A., Iqbal J., Caraty A., Ciofi P., Clarke I.J. Kisspeptin neurons in the arcuate nucleus of the ewe express both dynorphin A and neurokinin B. Endocrinology, 2007, 148(12): 5752-5760 (doi: 10.1210/en.2007-0961).
- Goodman R.L., Hileman S.M., Nestor C.C., Porter K.L., Connors J.M., Hardy S.L., Mil-lar R.P., Cernea M., Coolen L.M., Lehman M.N. Kisspeptin, neurokinin B, and dynorphin act in the arcuate nucleus to control activity of the GnRH pulse generator in ewes. Endocrinology, 2013, 154(11): 4259-4269 (doi: 10.1210/en.2013-1331).
- Xie Q., Kang Y., Zhang C., Xie Y., Wang C., Liu J., Yu C., Zhao H., Huang D. The role of kisspeptin in the control of the hypothalamic-pituitary-gonadal axis and reproduction. Front. En-docrinol., 2022, 13: 925206 (doi: 10.3389/fendo.2022.925206).
- Burke M.C., Letts P.A., Krajewski S.J., Rance N.E. Coexpression of dynorphin and neurokinin B immunoreactivity in the rat hypothalamus: Morphologic evidence of interrelated function within the arcuate nucleus. J. Comp. Neurol., 2006, 498(5): 712-726 (doi: 10.1002/cne.21086).
- Cheng G., Coolen L.M., Padmanabhan V., Goodman R.L., Lehman M.N. The kisspeptin/neu-rokinin B/dynorphin (KNDy) cell population of the arcuate nucleus: sex differences and effects of prenatal testosterone in sheep. Endocrinology, 2010, 151(1): 301-311 (doi: 10.1210/en.2009-0541).
- Hassaneen A., Naniwa Y., Suetomi Y., Matsuyama S., Kimura K., Ieda N., Inoue N., Uenoyama Y., Tsukamura H., Maeda K.-I., Matsuda F., Ohkura S. Immunohistochemical char-acterization of the arcuate kisspeptin/neurokinin B/dynorphin (KNDy) and preoptic kisspeptin neuronal populations in the hypothalamus during the estrous cycle in heifers. Journal of Repro-duction and Development, 2016, 62(5): 471-477 (doi: 10.1262/jrd.2016-075).
- Alves B.R., Cardoso R.C., Prezotto L.D., Thorson J.F., Bedenbaugh M., Sharpton S.M., Caraty A., Keisler D.H., Tedeschi L.O., Williams G.L., Amstalden M. Elevated body weight gain during the juvenile period alters neuropeptide Y-gonadotropin-releasing hormone circuitry in pre-pubertal heifers. Biology of Reproduction, 2015, 92(2): 46 (doi: 10.1095/biolreprod.114.124636).
- Songphasuk T., Wannapong N., Thanantong N., Sajapitak S. Preliminary study of kisspeptin mRNA-expressing neurons at POA and ARC in hypothalamus of beef cattle. Journal of Mahanakorn Veterinary Medicine, 2021, 16(1): 99-107.
- Gunn A., Rose J., Scott C., Scott R. Kisspeptin and RFamide-related peptide 3 neurons in bovine hypothalamus: estrogen receptor expression and inputs to gonadotrophin releasing hormone neu-rons. In: SFT — Theriogenology Annual Conference Online, 2020 by Society for Theriogenology. Режим доступа: https://www.ivis.org/library/sft/sft-theriogenology-annual-conference-online-2020#table-of-content. Без даты.
- Franceschini I., Lomet D., Cateau M., Delsol G., Tillet Y., Caraty A. Kisspeptin immunoreactive cells of the ovine preoptic area and arcuate nucleus co-express estrogen receptor alpha. Neurosci-ence Letters, 2006, 401(3): 225-230 (doi: 10.1016/j.neulet.2006.03.039).
- Foradori C.D., Goodman R.L., Adams V.L., Valent M., Lehman M.N. Progesterone increases dynorphin a concentrations in cerebrospinal fluid and preprodynorphin messenger ribonucleic acid levels in a subset of dynorphin neurons in the sheep. Endocrinology, 2005, 146(4): 1835-1842 (doi: 10.1210/en.2004-1326).
- Ruiz-Pino F., Navarro V.M., Bentsen A.H., Garcia-Galiano D., Sanchez-Garrido M.A., Ciofi P., Steiner R.A., Mikkelsen J.D., Pinilla L., Tena-Sempere M. Neurokinin B and the con-trol of the gonadotropic axis in the rat: developmental changes, sexual dimorphism, and regulation by gonadal steroids. Endocrinology, 2012, 153(10): 4818-4829 (doi: 10.1210/en.2012-1287).
- Tanco V.M., Whitlock B.K., Jones M.A., Wilborn R.R., Brandebourg T.D., Foradori C.D. Dis-tribution and regulation of gonadotropin-releasing hormone, kisspeptin, RF-amide related pep-tide-3, and dynorphin in the bovine hypothalamus. PeerJ, 2016, 4: e1833 (doi: 10.7717/peerj.1833).
- Clarkson J., Herbison A.E. Postnatal development of kisspeptin neurons in mouse hypothalamus; sexual dimorphism and projections to gonadotropin-releasing hormone neurons. Endocrinology, 2006, 147(12): 5817-5825 (doi: 10.1210/en.2006-0787).
- Smith J.T., Clay C.M., Caraty A., Clarke I.J. KiSS-1 messenger ribonucleic acid expression in the hypothalamus of the ewe is regulated by sex steroids and season. Endocrinology, 2007, 148(3): 1150-1157 (doi: 10.1210/en.2006-1435).
- Wakabayashi Y., Nakada T., Murata K., Ohkura S., Mogi K., Navarro V.M., Clifton D.K., Mori Y., Tsukamura H., Maeda K., Steiner R.A., Okamura H. Neurokinin B and dynorphin A in kisspeptin neurons of the arcuate nucleus participate in generation of periodic oscillation of neural activity driving pulsatile gonadotropin-releasing hormone secretion in the goat. Journal of Neuroscience, 2010, 30(8): 3124-3132 (doi: 10.1523/JNEUROSCI.5848-09.2010).
- Tsukamura H. Kobayashi Award 2019: The neuroendocrine regulation of the mammalian reproduc-tion. General and Comparative Endocrinology, 2022, 315: 113755 (doi: 10.1016/j.ygcen.2021.113755).
- Ikegami K., Minabe S., Ieda N., Goto T., Sugimoto A., Nakamura S., Inoue N., Oishi S., Maturana A. D., Sanbo M., Hirabayashi M., Maeda K.-I., Tsukamura H., Uenoyama Y. Evi-dence of involvement of neurone-glia/neurone-neurone communications via gap junctions in synchronised activity of KNDy neurones. Journal of Neuroendocrinology, 2017, 29(6): 1-14 (doi: 10.1111/jne.12480).
- Scott C.J., Rose J.L., Gunn A.J., McGrath B.M. Kisspeptin and the regulation of the reproductive axis in domestic animals. Journal of Endocrinology, 2019, 240(1): R1-R16 (doi: 10.1530/JOE-18-0485).
- Чернуха Г.Е., Табеева Г.И., Гусев Д.В., Шмаков Р.Г. Кисспептин и репродуктивная си-стема. Доктор.Ру, 2017, 3(132): 73-78.
- Clarke I.J., Reed C.B., Burke C.R., Li Q., Meier S. Kiss1 expression in the hypothalamic arcuate nucleus is lower in dairy cows of reduced fertility. Biology of Reproduction, 2022, 106(4): 802-813 (doi: 10.1093/biolre/ioab240).
- Ghaderpour S., Ghiasi R., Heydari H., Keyhanmanesh R. The relation between obesity, kisspep-tin, leptin, and male fertility. Hormone Molecular Biology and Clinical Investigation, 2022, 43(2): 235-247 (doi: 10.1515/hmbci-2021-0058).
- Leonardi C.E., Carrasco R.A., Dias F.C., Adams G.P., Singh J. Distribution of gonadotropin-releasing hormone and kisspeptin neurons in the preoptic area and hypothalamus during the estrous cycle in cows. Reproduction, Fertility and Development, 2018, 30(1): 191-192 (doi: 10.1071/RDv30n1Ab104).
- Moore A.M., Coolen L.M., Porter D.T., Goodman R.L., Lehman M.N. KNDy cells revisited. Endocrinology, 2018, 159(9): 3219-3234 (doi: 10.1210/en.2018-00389).
- Cardoso C., Alves B.R.C., Williams G.L. Neuroendocrine signaling pathways and the nutritional control of puberty in heifers Rodolfo. Anim. Reprod., 2018, 15(1): 868-878 (doi: 10.21451/1984-3143-AR2018-0013).
- Cardoso R.C., Alves B.R., Sharpton S.M., Williams G.L., Amstalden M. Nutritional program-ming of accelerated puberty in heifers: involvement of pro-opiomelanocortin neurones in the arcuate nucleus. J. Neuroendocrinol., 2015, 27(8): 647-657 (doi: 10.1111/jne.12291).
- Rønnekleiv O.K., Qiu, J., Kelly M.J. Arcuate kisspeptin neurons coordinate reproductive activities with metabolism. Seminars in Reproductive Medicine, 2019, 37(3): 131-140 (doi: 10.1055/s-0039-3400251).
- Rizzo A., Ceci E., Guaricci A.C., Sciorsci R.L. Kisspeptin in the early postpartum of the dairy cow. Reproduction in Domestic Animals, 2018, 54(2): 195-198 (doi: 10.1111/rda.13325).
- Rizzo A., Piccinno M., Ceci E., Pantaleo M., Mutinati M., Roncetti M., Sciorsci R.L. Kis-speptin and bovine follicular cysts. Veterinaria Italiana, 2018, 54(1): 29-31 (doi: 10.12834/VetIt.1014.5413.3).
- D’Occhio M.J., Campanile G., Baruselli P.S. Peripheral action of kisspeptin at reproductive tissues — role in ovarian function and embryo implantation and relevance to assisted repro-ductive technology in livestock: a review. Biology of Reproduction, 2020, 103(6): 1157-1170 (doi: 10.1093/biolre/ioaa135).
- Liu H., Mesalam A., Joo M.-D., Zhang S., Xu L., Wang J., Lee K.-L., Song S.-H., Yuan Y.-G., Lu W., Kong I.-K. Fibronectin protected bovine preantral follicles from the deleterious effects of Kisspeptin. Theriogenology, 2020, 161: 301-312 (doi: 10.1016/j.theriogenology.2020.12.017).
- Liu H., Xu G., Yuan Z., Dong Y., Wang J., Lu W. Effect of kisspeptin on the proliferation and apoptosis of bovine granulosa cells. Animal Reproduction Science, 2017, 185: 1e7 (doi: 10.1016/j.anireprosci.2017.07.008).
- Guo L., Xu H., Li Y., Liu H., Zhao J., Lu W., Wang J. Kisspeptin-10 promotes progesterone synthesis in bovine ovarian granulosa cells via downregulation of microRNA-1246. Genes, 2022, 13(2): 298 (doi: 10.3390/genes13020298).
- Soares M.M., Antonino D.D.C., Oliveira M., Melo Júnior J., Peixoto L.R., Maia T.S., Alves K.A., Jacomini J.O., Dos Santos R.M., Macedo G.G. The role of Kisspeptin in bovine in vitro embryo production. Semina: Ciências Agrárias, 2018, 39(2): 621-630 (doi: 10.5433/1679-0359.2018v39n2p621).
- Martino N.A., Rizzo A., Pizzi F., Dell'Aquila M.E., Sciorsci R.L. Effects of kisspeptin-10 on in vitro proliferation and kisspeptin receptor expression in primary epithelial cell cultures isolated from bovine placental cotyledons of fetuses at the first trimester of pregnancy. Theriogenology, 2015, 83(6): 978-987.e1 (doi: 10.1016/j.theriogenology.2014.11.033).
- Племяшов К.В., Андреев Г.М., Захаров П.Г., Кузьмин В.А., Щепеткина С.В. Практиче-ские рекомендации по воспроизводству крупного рогатого скота. СПб, 2008.
- Leonardi C.E.P. Kisspeptin function in female bovine reproduction. PhD Thesis. University of Sas-katchewan, Saskatoon, Canada, 2018. Режим доступа: https://harvest.usask.ca/han-dle/10388/9597. Без даты.
- Kadokawa H., Suzuki S., Hashizume T. Kisspeptin-10 stimulates the secretion of growth hormone and prolactin directly from cultured bovine anterior pituitary cells. Animal Reproduction Science, 2008, 105(3-4): 404-408 (doi: 10.1016/j.anireprosci.2007.11.005).
- Gottsch M.L., Clifton D.K., Steiner R.A. From KISS1 to kisspeptins: An historical perspective and suggested nomenclature. Peptides, 2009, 30(1): 4-9 (doi: 10.1016/j.peptides.2008.06.016).
- Ezzat A. A., Saito H., Sawada T., Yaegashi T., Goto Y., Nakajima Y., Jin J., Yamashita T., Sawai K., Hashizume T. The role of sexual steroid hormones in the direct stimulation by Kis-speptin-10 of the secretion of luteinizing hormone, follicle-stimulating hormone and prolactin from bovine anterior pituitary cells. Animal Reproduction Science, 2010, 121(3-4): 267-272 (doi: 10.1016/j.anireprosci.2010.06.002).
- Ezzat A.A., Pereira A., Clarke I.J. Kisspeptin is a component of the pulse generator for GnRH secretion in female sheep but not THE pulse generator. Endocrinology, 2015, 156(5): 1828-1837 (doi: 10.1210/en.2014-1756).
- Lehman M.N., Hileman S.M., Goodman R.L. Neuroanatomy of the kisspeptin signaling system in mammals: comparative and developmental aspects In: Kisspeptin signaling in reproductive biol-ogy. Advances in experimental medicine and biology, vol. 784 /A. Kauffman, J. Smith (eds.). Springer, New York, NY, 2013: 27-62 (doi: 10.1007/978-1-4614-6199-9_3).
- Kadokawa H. Seasonal differences in the parameters of luteinizing hormone release to exogenous gonadotropin releasing hormone in prepubertal Holstein heifers in Sapporo. Journal of Reproduction and Development, 2007, 53(1): 121-125 (doi: 10.1262/jrd.18058).
- Whitlock B.K., Daniel J.A., Wilborn R.R., Rodning S.P., Maxwell H.S., Steele B.P., Sartin J.L. Interaction of estrogen and progesterone on kisspeptin-10-stimulated luteinizing hormone and growth hormone in ovariectomized cows. Neuroendocrinology, 2008, 88(3): 212-215 (doi: 10.1159/000146242).
- Whitlock B.K., Daniel J.A., Wilborn R.R., Maxwell H.S., Steele B.P., Sartin J.L. Interaction of kisspeptin and the somatotropic axis. Neuroendocrinology, 2010, 92(3): 178-188 (doi: 10.1159/000318049).
- Ahmed A.E., Goto Y., Saito H., Sawada T., Jin J., Hirata T., Hashizume T. Gonadotropin-releasing response to kisspeptin-10 and its modulation by progesterone in postpartum cyclic cows. Iranian Journal of Applied Animal Science, 2013, 3: 471-476.
- Naniwa Y., Nakatsukasa K., Setsuda S., Oishi S., Fujii N., Matsuda F., Uenoyama Y., Tsu-kamura H., Maeda K.-i., Ohkura S. Effects of full-length kisspeptin administration on follicular development in Japanese black beef cows. Journal of Reproduction and Development, 2013, 59(6): 588-594 (doi: 10.1262/jrd.2013-064).
- Pottapenjera V., Rajanala S.R., Reddy C., Gangineni A., Avula K., Bejjanki S.K., Sathagopam S., Kesharwani S., Velmurugan S. Kisspeptin modulates luteinizing hormone release and ovarian follicular dynamics in prepubertal and adult murrah buffaloes. Frontiers in Veterinary Science, 2018, 5: 149 (doi: 10.3389/fvets.2018.00149).
- Flay H.E., Reed C.B., Kuhn-Sherlock B., Phyn C.V.C., Burke C.R., Meier S., Clarke I.J. Re-sponse to kisspeptin and gonadotropin-releasing hormone agonist administration in Holstein-Friesian dairy heifers with positive or negative genetic merit for fertility traits. Journal of Dairy Science, 2022, 105(4): 3601-3614 (doi: 10.3168/jds.2021-21394).
- Rodríguez M.A., Calderón Robles R.C., Rosete Fernándezb J.V., Hernándezc K. R., Vera Ávi-lad H.R., Arreguín Arévaloe J.A., Nette T.M., Gutiérrez Aguilarf C.G., Padillaf E.G., Gómez-Chavaríng M., Godoya A.V. Kisspeptin in prepubertal heifers: I. Effects of age on the response of LH, FSH and GH to kisspeptin-10 and its association with IGF-I, leptin and estradiol. Revista Mexicana de Ciencias Pecuarias, 2017, 8(4): 375-385 (doi: 10.22319/rmcp.v8i4.4644).
- Ezzat Ahmed A., Saito H., Sawada T., Yaegashi T., Yamashita T., Hirata T.-I., Sawai K., Hashizume T. Characteristics of the Stimulatory Effect of Kis-speptin-10 on the secretion of luteinizing hormone, follicle-stimulating hormone and growth hormone in prepubertal male and female cattle. Journal of Reproduction and Development, 2009, 55(6): 650-654 (doi: 10.1262/jrd.20255).
- Ezzat A.A., Haridy M., Kassab A.Y., Ahmed H., Senosy W., Toh-Ichi H., Tsutomu H. The effi-ciency of Kisspeptin and GnRH as stimulators of gonadotrophins and testosterone in prepubertal male cattle. Zagazig Veterinary Journal, 2018, 46(2): 136-145 (doi: 10.21608/ZVJZ.2018.14386).
- Northup S.L., Coffman E.A., Strickland L.G., Pohler K.G., Daniel J.A., Whitlock B.K. Intrave-nous infusion of kisspeptin increased serum luteinizing hormone acutely and decreased serum follicle stimulating hormone chronically in prepubertal bull calves. Theriogenology, 2020, 144: 1-7 (doi: 10.1016/j.theriogenology.2019.12.013).
- Role Cortés M.E., Carrera B., Rioseco H., Pablo del Río J., Vigil P. The role of kisspeptin in the onset of puberty and in the ovulatory mechanism: a minireview. Journal of Pediatric and Adolescent Gynecology, 2015, 28(5): 286-291 (doi: 10.1016/j.jpag.2014.09.017).
- Macedo G.G., Mingoti R.D., Batista E.O.S., Monteiro B.M., Vieira L.M., Barletta R.V., Wilt-bank M.C., Nogueira G.P., Rennó F.P., Maio J.R., Baruselli P.S. Profile of LH re-lease in response to intramuscular treatment with kisspeptin in Bos indicus and Bos taurus prepubertal heifers. Theriogenology, 2019, 125: 64-70 (doi: 10.1016/j.theriogenology.2018.10.011).
- Mondal M., Baruah K.K., Karunakaran M., Ghosh M.K., Dutta T.K. Development of a new kisspeptin based method of ovulation synchronization for crossbred dairy heifers. Journal of Dairy Science and Technology, 2018, 4(3): 12-16.
- Curtis A.E., Cooke J.H., Baxter J.E., Parkinson J.R.C., Bataveljic A., Ghatei M.A., Bloom S.R., Murphy K.G. A kisspeptin-10 analog with greater in vivo biactivity than kisspeptin-10. Am. J. Physiol. Endocrinol. Metab., 2010, 298(2): E296-E303 (doi: 10.1152/ajpendo.00426.2009).
- Parker P.A., Coffman E.A., Pohler K.G., Daniel J.A., Aucagne V., Beltramo M., Whitlock B. K. Acute and subacute effects of a synthetic kisspeptin analog, C6, on serum concentrations of lute-inizing hormone, follicle stimulating hormone, and testosterone in prepubertal bull calves. Theri-ogenology, 2019, 130, 111-119 (doi: 10.1016/j.theriogenology.2019.03.002).
- Burke C.R, Roche J.R., Millar R.P., Clarke I.J. Onset of normal cycles in postpartum anovulatory dairy cattle treated with kisspeptin. Reproduction and Fertility, 2022, 2(1): 1-8 (doi: 10.1530/RAF-21-0046).
- Popa S.M., Moriyama R.M., Caligioni C.S., Yang J.J., Cho C.M., Concepcion T.L., Oak-ley A.E., Lee I.H., Sanz E., Amieux P.S., Caraty A., Palmiter R.D., Navarro V.M., Chan Y.M., Seminara S.B., Clifton D.K., Steiner R.A. Redundancy in Kiss1 expression safeguards reproduc-tion in the mouse. Endocrinology, 2013, 154(8): 2784-2794 (doi: 10.1210/en.2013-1222).
- Hussain M.A., Song W.-J., Wolfe A. There is kisspeptin — and then there is kisspeptin. Trends in Endocrinology & Metabolism, 2015, 26(10): 564-572 (doi: 10.1016/j.tem.2015.07.008).


