Ресвератрол в терапии и профилактике болезни Паркинсона: перспективы и ограничения
Автор: Семенова Е.В., Сипров А.В., Веденькин М.А.
Журнал: Медицина и биотехнологии @medbiosci
Рубрика: Фармакология
Статья в выпуске: 4 т.1, 2025 года.
Бесплатный доступ
Введение. Ресвератрол является многообещающим природным соединением для терапии болезни Паркинсона, однако данные систематического анализа результатов исследований в литературе освещены недостаточно. Цель работы – систематизировать данные о терапевтических эффектах ресвератрола и механизмах действия при болезни Паркинсона, оценить перспективы его применения в клинической практике, возникающие проблемы и возможности их решения. Материалы и методы. Проанализирована и систематизирована актуальная информация из 130 литературных источников из баз данных Medline и PubMed, из которых в обзор включены 40. Критерии включения публикаций в анализ: изолированное использование ресвератрола, модели с болезнью Паркинсона у грызунов, клинические исследования на людях. Результаты исследования. Установлено, что ресвератрол эффективен при болезни Паркинсона в экспериментах на животных, о чем свидетельствует улучшение моторных функций, снижение гибели дофаминергических нейронов, уменьшение уровня воспалительных и проапоптотических маркеров. Наиболее значимые механизмы в реализации нейропротекции связаны с антиоксидантной защитой нейронов, активацией сиртуинов с вовлечением соответствующих сигнальных механизмов регуляции апоптоза, модуляцией аутофагии, противовоспалительной активностью и подавлением развития митохондриальной дисфункции. Обсуждение и заключение. Для ресвератрола имеется существенная доказательная база относительно его эффективности при болезни Паркинсона, в основном представленная данными доклинических исследований, количество же клинических исследований ограничено. Однако наличие текущих клинических исследований ресвератрола у больных с болезнью Паркинсона свидетельствует о большом интересе к данному соединению при нейродегенеративных заболеваниях. Для широкого клинического внедрения ресвератрола необходимо решение проблемы его низкой биодоступности при пероральном применении и проведение крупных рандомизированных контролируемых исследований. Обобщенная информация будет полезной в планировании дальнейших доклинических и клинических исследований противопаркинсонической эффективности ресвератрола.
Ресвератрол, нейропротекция, фармакодинамика, болезнь Паркинсона, клинические исследования
Короткий адрес: https://sciup.org/147252583
IDR: 147252583 | УДК: 615:616.858 | DOI: 10.15507/3034-6231.001.202504.342-355
Текст научной статьи Ресвератрол в терапии и профилактике болезни Паркинсона: перспективы и ограничения
EDN:
Болезнь Паркинсона (БП) - прогрессирующее нейродегенеративное заболевание, характеризующееся гибелью дофаминергических нейронов в черной субстанции и накоплением патологических белковых агрегатов (α-синуклеина) [1]. Ключевыми патогенетическими механизмами развития БП являются окислительный стресс, нейровоспаление и митохондриальная дисфункция, которые усиливают апоптоз нейронов и ускоряют прогрессирование болезни [2]. Окислительный стресс, связанный с накоплением активных форм кислорода, нарушает клеточный гомеостаз, в то время как хроническое нейровоспаление, опосредованное активацией микроглии, способствует дальнейшему повреждению нейронов [3].
Современные подходы к лечению БП, такие как фармакотерапия предшественником дофамина (леводопа) и дофамино-миметиками, направлены на коррекцию двигательных симптомов, но не останавливают нейродегенерацию [4]. Длительное применение леводопы сопровождается моторными осложнениями (дискинезии, феномен «включения - выключения»), а также не влияет на немоторные проявления (когнитивные нарушения, депрессию) [5]. Эти проблемы подчеркивают необходимость поиска нейропротекторных средств, способных воздействовать на ключевые звенья патогенеза.
Ресвератрол - полифенольное соединение, синтезируемое растениями в ответ на стрессовые воздействия, такие как инфекции или ультрафиолетовое излучение. Основные его свойства включают мощную антиоксидантную активность, способность подавлять воспалительные процессы, модулировать апоптоз и улучшать метаболические функции [6]. По данным доклинических исследований, ресвератрол обладает выраженными нейро- и кардиопротекторными свойствами, в клинических исследованиях у человека подтверждены его кардиомета-болические эффекты – умеренное снижение уровня глюкозы, липидов и маркеров воспаления, улучшение эндотелиальной функции и инсулинорезистентности у пациентов с сахарным диабетом 2 типа и метаболическим синдромом. Ресвератрол рассматривается как один из наиболее перспективных ге-ропротекторов для обеспечения активного долголетия. Интерес к ресвератролу в контексте БП обусловлен его потенциальной способностью влиять на ключевые патогенетические механизмы развития заболевания. Во-первых, его антиоксидантное действие позволяет нейтрализовать активные формы кислорода, играющие центральную роль в гибели дофаминергических нейронов [7]. Во-вторых, ресвератрол ингибирует провос-палительные сигнальные пути (например, ядерный фактор каппа-B – NF-κB), снижая выработку цитокинов (туморнекротизиру-ющего фактора-α (TNF-α) и интерлейкинов (IL)) [8]. Кроме того, он активирует сирту-ины – белки, участвующие в поддержании клеточного гомеостаза, репарации ДНК и регуляции аутофагии – механизма, необходимого для удаления токсичных агрегатов α-синуклеина [9].
Цель исследования – систематизировать доклинические и клинические данные о терапевтической эффективности и безопасности, механизмах действия ресвератрола при болезни Паркинсона и оценить перспективы и основные препятствия для его клинического применения при указанной патологии.
МАТЕРИАЛЫ И МЕТОДЫ
Проанализирована и систематизирована актуальная информация из 130 литературных источников из баз данных PubMed и Medline, содержащих результаты доклинических и клинических исследований ресвератрола при болезни Паркинсона, 40 литературных источников представлено в списке литературы, в том числе 35 за период 2015–2025 г. Подбор статей осуществлялся по ключевым словам «ресвератрол», «эффективность», «механизм действия», «болезнь Паркинсона», «доклинические исследования», «клинические исследования». Критерии включения публикаций в анализ: изолированное использование ресвератрола, модели с болезнью Паркинсона у грызунов, клинические исследования на людях. Критерии исключения: исследования на дрозофилах, комбинированное применение ресвератрола с другими средствами.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Доклинические исследования ресвератрола на моделях БП
Клеточные модели БП с использованием нейротоксинов 1-метил-4-фенил-1,2,3,6-те-трагидропиридина (MPTP) и ротенона или с экспрессией мутантного α-синуклеина позволили изучить нейропротекторные свойства ресвератрола in vitro .
Доклинические исследования демонстрируют, что ресвератрол не только защищает нейроны от окислительного повреждения в экспериментальных моделях БП, но и улучшает двигательные функции у животных, получавших нейротоксины (MPTP, ротенон) [10; 11]. Эти данные, наряду с его способностью преодолевать гематоэнцефалический барьер, делают ресвератрол многообещающим кандидатом для разработки нейропротекторных стратегий, направленных на замедление прогрессирования БП [12].
По данным доклинических исследований, ресвератрол обладает способностью защищать дофаминергические нейроны от повреждения, вызванного MPTP и ротеноном. На культуре микроглиальных клеток BV-2 было показано, что предварительная инкубация клеток с ресвератролом снижает активацию микроглии и переход к фенотипу M1 после воздействия ротенона. Ресвератрол уменьшал уровень свободного железа, кислородных радикалов и малонового диальдегида (МДА), восстанавливал активность глутатиона, а также снижал экспрессию провоспалительных IL-1β, IL-6 и TNF-α. На молекулярном уровне наблюдалась ингибиция фосфорилирования активаторов транскрипции STAT1 и понижение уровня протеина Keap1 при одновременном повышении редокс-чувствительного транскрипционного фактора Nrf2 и компонента системы цистин/глутаматного антипортера SLC7A11, что указывает на активацию антиоксидантного пути Nrf2/Keap1 и подавление воспаления [13]. Кроме того, ресвератрол ингибирует апоптоз, модулируя баланс про- и антиапоптотических белков (Bax/Bcl-2) и снижая активность каспаз-3 и -9 [14].
В моделях с гиперэкспрессией мутантного α-синуклеина (A53T, A30P) ресвератрол (20 мкМ) уменьшал образование токсичных олигомеров на 40–60 %. Этот эффект объясняется активацией аутофагии через AMPK/ SIRT1-зависимые механизмы: ресвератрол повышал экспрессию Beclin-1 и LC3-II, маркеров аутофагосом, способствуя лизосомальной деградации агрегатов [15]. Важно, что ресвератрол также усиливает шаперон-опосредованную аутофагию, взаимодействуя с белками теплового шока (HSP70), что улучшает клиренс α-синуклеина [16].
В экспериментах с использованием нейротоксинов (MPTP, 6-гидроксидофамин (6-OHDA)) ресвератрол демонстрировал дозозависимое улучшение двигательной активности. Например, у мышей, получавших MPTP, ежедневное введение ресвератрола (20 мг/кг) в течение 14 дней повышало время удержания на вращающемся стержне на 50 % и снижало каталепсию в тесте с вертикальной решеткой [16]. Эти эффекты коррелировали с уменьшением потери дофамина в стриатуме.
В другом исследовании было обнаружено, что ресвератрол повышал концентрацию дофамина и его метаболитов в стриатуме на моделях MPTP-индуцированной БП, что также сопровождалось снижением уровня малонового диальдегида и повышением уровня глутатиона и активности супероксиддисмутазы [2]. Кроме того, он увеличивал уровень нейротрофического фактора мозга (BDNF), критического для выживаемости нейронов. В исследовании на крысах с 6-OHDA-повреждением лечение ресвератролом (10 мг/кг) повышало экспрессию BDNF в черной субстанции на 35 %, что способствовало синаптической пластичности [17].
Антиоксидантные свойства ресвератрола играют ключевую роль в его нейропро-текторном действии при БП. Ресвератрол напрямую нейтрализует активные формы кислорода и азота, предотвращая окислительное повреждение липидов, белков и ДНК в дофаминергических нейронах [17]. Это связано со структурой его фенольных групп, которые способны отдавать электроны, стабилизируя свободные радикалы.
Помимо прямого антирадикального действия, ресвератрол также активирует Nrf2 – ключевой регулятор антиоксидантного ответа. При стрессе Nrf2 диссоциирует от белка Keap1, мигрирует в ядро и индуцирует экспрессию генов, кодирующих глутатионпероксидазу (ГП), супероксиддисмутазу (СОД) и гемоксигеназу-1 [13]. Известно, что окислительный стресс, агрегаты α-синуклеина и митохондриальная дисфункция приводят к дисбалансу Keap1-Nrf2, снижая транскрипцию генов антиоксидантной защиты, поэтому способность ресвератрола активировать путь Keap1/Nrf2/ARE может представлять собой перспективную терапевтическую стратегию для замедления прогрессирования болезни Паркинсона [18].
Хроническое нейровоспаление, опосредованное активацией микроглии и астроцитов, является ключевым звеном патогенеза БП. Ресвератрол проявляет выраженные противовоспалительные свойства, преимущественно за счет ингибирования NF-κB – центрального регулятора провоспалительных сигнальных путей [8; 19]. В условиях окислительного стресса или воздействия нейротоксинов (например, α-синуклеина) ресвератрол блокирует фосфорилирование и деградацию ингибитора NF-κB, предотвращая транслокацию NF-κB в ядро и его связывание с ДНК [13]. Это подавляет экспрессию генов, кодирующих про-воспалительные цитокины, такие как TNF-α, IL-6 и IL-1β.
Эксперименты на мышах, получавших нейротоксин MPTP, показали, что лечение ресвератролом способствовало снижению экспрессии IL-6 на 40 % и подавляло ми-кроглиальную гиперреактивность, что сопровождалось улучшением двигательных функций [17].
Кроме того, ресвератрол модулирует воспаление через активацию сирту-ина-1, который деацетилирует субъединицу p65 NF-κB, нарушая его способность связываться с промоторными регионами генов-мишеней [9].
Митохондриальная дисфункция, сопровождающаяся нарушением биоэнергетики и активацией апоптоза, является ключевым патологическим звеном БП. Ресвератрол демонстрирует способность восстанавливать митохондриальную функцию через несколько механизмов. Он усиливает активность электрон-транспортной цепи, повышая уровень аденозинтрифосфата в нейронах, что подтверждено в исследованиях с ингибированием комплекса I ротеноном [14]. Также ресвератрол стимулирует биогенез митохондрий при воздействии на коактиватор 1-альфа рецептора активатора пероксисом, который регулирует синтез новых митохондрий и окислительное фосфорилирование [20].
Важным аспектом нейропротекции ресвератрола является его способность предотвращать апоптоз через регуляцию баланса про- и антиапоптотических белков семейства Bcl-2. В экспериментах на животных моделях БП ресвератрол повышал экспрессию антиапоптотического белка Bcl-2 и снижал уровень проапоптотического белка Bax, что стабилизировало митохондриальную мембрану и предотвращало высвобождение цитохрома C в цитоплазму [14]. Это блокировало активацию каспаз-3 и -9, ключевых медиаторов апоптоза.
Кроме того, ресвератрол подавляет открытие митохондриальных пор переходной проницаемости (mPTP), что снижает набухание митохондрий и их деструкцию под действием окислительного стресса. В эксперименте было изучено влияние ресвератрола на митохондриальную дисфункцию, связанную с пептидом VDAC1, на модели БП у мышей, индуцированной MPTP. Введение ресвератрола (30 мг/кг перорально в течение 14 дней) приводило к достоверному повышению уровня дофамина в стриатуме (на ≈ 45 %, p < 0,01) и уменьшению гибели дофаминергических нейронов в черной субстанции. На клеточном уровне было показано, что ресвератрол снижает экспрессию VDAC1 и предотвращает избыточное открытие mPTP, тем самым уменьшая набухание митохондрий, утечку цитохрома C и активацию каспазы-3 [21]. В сочетании с улучшением биоэнергетики и подавлением апоптоза эти эффекты способствуют сохранению дофаминергических нейронов в черной субстанции и замедлению прогрессирования БП.
Активация сиртуина-1, NAD⁺-зависи-мой деацетилазы, является одним из центральных механизмов нейропротективного действия ресвератрола при БП. Сиртуин-1 регулирует ключевые процессы, включая выживаемость нейронов, аутофагию и репарацию ДНК, что особенно актуально для патогенеза БП, связанного с накоплением поврежденных белков и окислительным стрессом [9]. Ресвератрол активирует сирту-ин-1, который деацетилирует транскрипционные факторы, такие как p53 и FOXO3a, подавляя апоптоз, а также активирует сигнальный путь PI3K/Akt, способствующий выживанию дофаминергических нейронов, увеличивает соотношение Bcl-2/Bax, снижает высвобождение цитохрома C и предотвращает активацию каспазы-3 [31]. В астроцитах и микроглии сиртуин-1 регулирует их реактивность и полярность, снижая нейровоспалительную реакцию и способствуя восстановлению нейронов. Сиртуин-1 снижает активность NF-κB за счет деацетилирования его субъединицы p65, что приводит к снижению уровня провоспалительных цитокинов [8].
Сиртуин-1 стимулирует аутофагию – процесс деградации токсичных агрегатов α-си-нуклеина, характерных для БП. Ресвератрол через активацию сиртуина-1 усиливает экспрессию генов, связанных с аутофагией (LC3, Beclin-1), и способствует лизосомальному клиренсу патологических белков. В клеточных моделях БП это приводило к снижению накопления α-синуклеина и улучшению клеточного гомеостаза [15]. Окислительный стресс при БП вызывает повреждение ДНК, что ускоряет гибель нейронов. Сиртуин-1 участвует в репарации ДНК, деацетилируя гистоны и белки репарационных путей (PARP1, XPA). Ресвератрол, активируя сиртуин-1, усиливает восстановление дву-нитевых разрывов ДНК в нейронах черной субстанции [22].
Накопление токсичных агрегатов α-сину-клеина, формирующих тельца Леви, является ключевым патологическим признаком БП. Эти агрегаты нарушают синаптическую передачу, запускают оксидативный стресс и апоптоз нейронов. Ресвератрол модулирует аутофагию – процесс деградации поврежденных органелл и белков, что способствует удалению α-синуклеина и замедляет нейродегенерацию [23].
Ресвератрол стимулирует аутофагию и через несколько других путей, в частности через прямое ингибирование серин / трео-нинкиназы мишени рапамицина у млекопитающих (mTOR) – ключевого отрицательного регулятора аутофагии. В экспериментах на клеточных линиях ресвератрол в концентрациях 25–100 мкМ вызывал дозозависимое повышение уровня LC3-II и уменьшение фосфорилирования белков p70S6K и 4E-BP1 – маркеров активности mTOR. Авторы установили, что ресвератрол связывается с каталитическим доменом mTOR и конкурирует с аденозинтрифосфатом, снижая его аффинность к субстрату. Функционально это приводило к активации аутофагосом и снижению клеточной гибели при окислительном стрессе. Таким образом, ресвератрол проявляет прямое mTOR-ингибирующее действие, отличное от опосредованных SIRT1/ AMPK-зависимых путей, и может рассматриваться как перспективный аутoфагический модулятор [24]. Помимо этого, ресвератрол индуцирует экспрессию мРНК шаперонов и способствует взаимодействию α-сину-клеина с HSP70, направляя агрегаты в лизосомы для деструкции [25]. В клеточных моделях БП ресвератрол снижал уровень олигомеров α-синуклеина на 50 % за счет усиления экспрессии маркеров аутофагии (LC3-II, Beclin-1) [26]. В исследованиях на трансгенных мышах, экспрессирующих мутантный α-синуклеин (A53T), лечение ресвератролом уменьшало количество вну-тринейрональных включений и улучшало двигательные функции, что коррелировало с активацией аутофагии [16].
Модуляция аутофагии дополняет антиоксидантные и противовоспалительные эффекты ресвератрола, создавая многоуровневую защиту нейронов. Например, удаление α-си-нуклеина снижает активацию микроглии и продукцию активных форм кислорода, разрывая порочный круг нейровоспаления и оксидативного стресса [26].
Таким образом, в большинстве проведенных исследований установлено, что ресвератрол повышает уровень дофамина и его метаболитов, увеличивает экспрессию белка дофаминовых рецепторов в полосатом теле, снижает экспрессию α-синуклеина и улучшает антиоксидантный статус нейронов, уменьшает нейровоспалительные реакции и регулирует митохондриальную дисфункцию [11] (рисунок).
Переход от доклинических моделей к клиническому применению ресвератрола сталкивается с рядом препятствий. Первым из них является его низкая биодоступность при пероральном применении, так как данное соединение подвергается быстрому пресистемному метаболизму (путем глюку-ронизации, сульфатирования) и выведению, что снижает его концентрацию в плазме и центральной нервной системе (ЦНС). Например, у людей лишь 0,5–2 % принятой дозы достигают системного кровотока в активной форме [27]. При экстраполяции доз, продемонстрировавших эффект в доклинических исследованиях (20–50 мг/кг у грызунов) [40], на человека рекомендуемая доза составляет 1–5 г/сутки, что затруднительно для длительного применения из-за побочных эффектов. Кроме того, ресвератрол плохо проникает через гематоэнцефалический барьер, что снижает его воздействие на нейроны [32].
Для преодоления этих проблем предлагается создание модифицированных лекарственных форм (наноформ), комбинаций с синергистами и синтез аналогов с улучшенной биодоступностью. Инкапсуляция в липосомы или полимерные наночастицы повышает стабильность и доставку ресвератрола в мозг. В эксперименте гибридные наночастицы с ресвератролом (с лигандами лептином и трансферрином) были нацелены на дофаминергические нейроны и лучше преодолевали гематоэнцефалический барьер. На модели MPP⁺-индуцированной нейротоксичности in vitro и на крысах было показано выраженное нейропротекторное действие изученных наночастиц с ресвератролом [29]. Добавление пиперина (ингибитора метаболизма) или кверцетина увеличивает биодоступность ресвератрола [30]. Также было показано, что синтетический аналог ресвератрола (птеростильбен, метилированный ресвератрол) обладает более высокой стабильностью и способностью проникать в ЦНС [31].
Ослабление регуляции (подавление) / Weakening of regulation (supression)
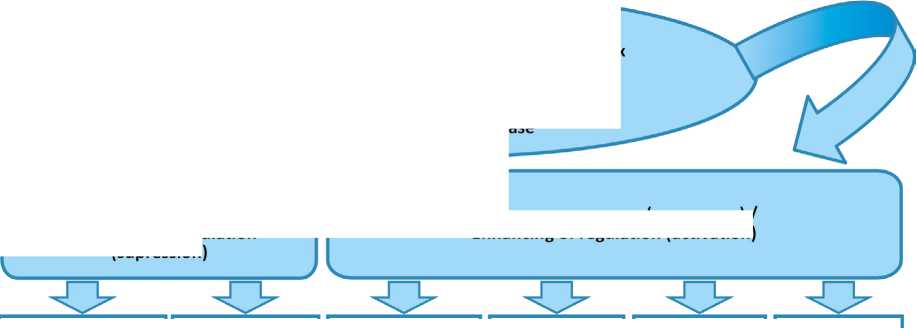
Ресвератрол в реализации нейропротекторного действия у животных в моделях болезни Паркинсона / Resveratrol in the iplementation of neuroprotective action in animal models of Parkinson's disease
Усиление регуляции (активация) / Enhancing of regulation (activation)
|
NF-kB и продукция TNF-a, IL-6, И-1₽/ NF-kB and production of TNF-a, IL-6, IL-1P |
Открытие MPTP, набухание митохондрий / MPTP opening, mitochondrial swelling |
PGC-la и биогенез митохондрий / PGC-la and mitochondrial biogenesis |
Сиртуин-1, PI3K/Akt, Bcl-2/Вах/ Sirtuin-1, PI3K/Akt, Bcl-2/Bax |
Nrf2, ГП, СОД, глутатион / Nrf2, GP, SOD, glutathione |
Аутофагия а-синуклеина, BDNF / a-synuclein autophagy, BDNF |
|
Нейровоспаление / Neuroinflammation |
Митохондриальная дисфункция / апоптоз / Mitochondrial disfunction / apoptosis |
Антиоксидантный потенциал / Antioxidant potential |
Синаптическая пластичность / Synaptic plasticity |
||

Р и с у н о к. Нейропротекторные механизмы ресвератрола у животных в моделях болезни Паркинсона F i g u r e. Neuroprotective mechanisms of resveratrol in animal models of Parkinson’s disease
Примечание: NF-κB – ядерный фактор каппа-B, TNF-α – туморнекротизирующий фактор-α, IL – интерлейкины, MPTP – 1-метил-4-фенил-1,2,3,6-тетрагидропиридин, Nrf2 – редокс-чувствительный транскрипционный фактор, ГП – глутатионпероксидаза, СОД – супероксиддисмутаза, BDNF – нейротрофический фактор мозга.
Note: NF-κB – nuclear factor kappa-B, TNF-α – tumor necrosis factor-α, IL – interleukins, MPTP – 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, Nrf2 – redox-sensitive transcription factor, GP – glutathione peroxidase, SOD – superoxide dismutase, BDNF – brain-derived neurotrophic factor.
Источник: по материалам [11].
Source: based on materials [11].
Клинические исследования ресвератрола при БП
В настоящее время отсутствуют данные крупных рандомизированных контролируемых исследований, подтверждающих нейро-протекторную эффективность ресвератрола при БП. Большинство работ сосредоточено на его применении при других нейродегенератив-ных заболеваниях, таких как болезнь Альцгеймера, где ресвератрол продемонстрировал способность снижать уровень бета-амилоида в плазме у больных [12]. Клинические исследования ресвератрола при БП остаются ограниченными, однако небольшие пилотные исследования демонстрируют его потенциальную безопасность и переносимость (исследования NCT030950921,NCT030933892).
Так, в исследовании фазы I (двойное слепое, плацебо-контролируемое) с участием здоровых добровольцев ресвератрол в дозе до 5 г/ день показал хорошую переносимость, хотя у некоторых участников наблюдались легкие желудочно-кишечные расстройства (тошнота, диарея, запор) [32]. Эти данные подтверждают относительную безопасность соединения, но подчеркивают необходимость тщательного подбора доз.
Особое внимание привлекает разработка нового препарата под торговым названием JOTROL, представляющего собой мицеллярную форму транс-ресвератрола со значительно большей биодоступностью по сравнению с немодифицированными пероральными формами, что было показано в исследовании I фазы [33]3. В исследовании приняли участие 24 здоровых добровольца, получавших однократные дозы 25–250 мг перорально. По данным фармакокинетического анализа, мицеллярная форма обеспечивала увеличение Cmax в 10–17 раз и AUC более чем в 20 раз по сравнению с немодифицированным ресвератролом [33]. На основе этих результатов инициировано дальнейшее клиническое исследование IIa фазы при болезни Паркинсона, о чем сообщается в корпоративных пресс-релизах и профильных новостных изданиях4. Поиск оптимальных форм ресвератрола для улучшения терапевтической эффективности
Ресвератрол (3,5,4′-тригидрокси-стильбен) относится к классу полифенолов и существует в виде двух изомеров – транс- и цис-ресвератрола, из которых биологически активным преимущественно является транс-форма [34]. Его молекулярная структура включает два фенольных кольца, соединенных этиленовым мостиком, что обеспечивает способность к взаимодействию с липидными мембранами и белковыми мишенями [31]. Существуют природные источники соединения (кожура красного винограда, ягоды, арахис), однако биодоступность ресвератрола при пероральном приеме крайне низка (менее 1 %) из-за быстрого метаболизма и малой растворимости в воде [27]. После перорального приема ресвератрол всасывается в тонком кишечнике, но подвергается интенсивному пресистемному метаболизму: в энтероци-тах и гепатоцитах он конъюгирует с глюкуроновой кислотой и сульфатами, образуя неактивные метаболиты [28]. Период полувыведения составляет около 8–14 ч, а максимальная концентрация в плазме достигается через 30–60 мин [27]. Низкая биодоступность и быстрое выведение ограничивают терапевтическую эффективность, что стимулирует поиск стратегий для их преодоления.
Одним из перспективных подходов является использование нанотехнологий. Например, инкапсуляция ресвератрола в липосомы, полимерные наночастицы или циклодекстрины повышает его стабильность, растворимость и способность преодолевать гематоэнцефалический барьер [29]. Другой метод – комбинация с синергистами, такими как пиперин (алкалоид черного перца), который ингибирует глюкуро-низацию, увеличивая концентрацию свободного ресвератрола в крови, или использование мицеллярной формы (винетрол – комбинация ресвератрола и виниферина), позволяющей увеличить концентрацию ресвератрола в плазме крови в 10 раз по сравнению с использованием обычной формы порошка [30]. Кроме того, разрабатываются синтетические аналоги (например, птеростильбен), обладающие улучшенной фармакокинетикой и устойчивостью к метаболизму [31].
Потенциальные терапевтические стратегии применения ресвератрола при болезни Паркинсона включают использование его в качестве адьювантной терапии совместно с леводопой, а также профилактическое применение на ранних стадиях заболевания [35; 36]. Комбинация ресвератрола с леводопой рассматривается как перспективная стратегия для снижения доз основного препарата и минимизации его побочных эффектов. Леводопа, хотя и эффективна в коррекции двигательных симптомов, при длительном применении вызывает дискинезии, колебания двигательной активности (феномен
«включения – выключения») и усиливает окислительный стресс. Ресвератрол, благодаря нейропротекторным свойствам, может компенсировать эти негативные эффекты.
В экспериментальных исследованиях на модели БП после повреждения нигростриар-ного пути нейротоксином 6-OHDA подопытные крысы получали леводопу (25 мг/кг) совместно с бенсеразидом (6,25 мг/кг), что индуцировало дискинезии, а затем ресвератрол в дозах 10, 20 и 40 мг/кг перорально в течение 21 дня. Результаты показали, что лечение ресвератролом приводило к дозозависимому снижению выраженности дискинезий – на 30, 45 и 60 % при дозах 10, 20 и 40 мг/кг соответственно, по сравнению с контрольной группой леводопы ( p < 0,01). Морфологический анализ показал повышение плотности дофаминергических нейронов в черной субстанции, а также снижение экспрессии провоспалительных TNF-α, IL-1β и IL-6 в стриатуме. Авторы сделали вывод, что ресвератрол уменьшает леводопа-индуци-рованные дискинезии за счет подавления нейровоспаления и микроглиальной активации, что подтверждает его потенциал в качестве адъювантного нейропротекторного средства при болезни Паркинсона [37].
С учетом особенностей механизма действия наиболее перспективным является профилактическое применение ресвератрола на ранних стадиях БП и у лиц из группы риска (носителей мутаций в генах LRRK2 или SNCA). Его способность модулировать ключевые патогенетические механизмы (окислительный стресс, нейровоспаление, аутофагию) может отсрочить начало или замедлить прогрессирование заболевания.
Оценивался эффект ресвератрола у мышей с моделью MPTP-индуцированной болезни Паркинсона и в культурах нейронов. Терапия ресвератролом способствовала увеличению количества клеток, снижению транскрипции длинной некодирующей РНК MALAT1, что приводило к повышению miR-129 и снижению уровня α-синуклеина, таким образом снижался апоптоз нейронов [38]. Для людей предлагается использовать биомаркеры (например, уровень олигомеров α-синуклеина в спинномозговой жидкости) для отбора пациентов в группы профилактики. Однако отсутствие стандартизированных протоколов и данных о долгосрочной безопасности ограничивают внедрение такой стратегии.
Для преодоления низкой биодоступности и улучшения доставки ресвератрола в ЦНС разрабатываются инновационные подходы. Инкапсуляция в липосомы и наночастицы увеличивает стабильность ресвератрола и его проникновение через гематоэнцефалический барьер. На модели БП у грызунов ресвератрол в составе нанокапсул лучше проникал в ткань мозга по сравнению со свободной формой [29]. Помимо липосом разрабатываются и другие нанотехнологические системы – полимерные, мицеллярные и твердо-липидные наночастицы, которые увеличивают стабильность соединения и пролонгируют его циркуляцию в крови. Особое внимание уделено поверхностной модификации наночастиц лигандами, такими как трансферрин или аполипопротеин E, что облегчает транспорт через гематоэнцефалический барьер посредством рецептор-опосредованного эндоцитоза. Кроме того, обсуждаются интраназальные формы доставки, обеспечивающие прямой перенос ресвератрола из носовой полости в ЦНС, минуя системный метаболизм [34]. Также было показано, что диметилированный аналог ресвератрола (птеростильбен) изначально обладает большей биодоступностью (80 % в сравнении с 1 % у ресвератрола) и сродством к липидам, что улучшает распределение в мозге. В доклинических работах птеро-стильбен снижал потерю дофаминергических нейронов на 50 % при дозе 5 мг/кг [31].
Несмотря на обнадеживающие доклинические данные, применение ресвератрола при БП сталкивается с рядом ограничений. Существуют противоречивые данные о ней-ропротекторной эффективности в разных экспериментальных моделях. Например, в некоторых исследованиях ресвератрол демонстрировал значительное снижение потери дофаминергических нейронов [2], тогда как в других его эффекты были минимальны, что может быть связано с различиями в дозировках, длительности лечения или выборе нейротоксинов.
Известно, что метаболизм и фармакокинетика ресвератрола у грызунов и человека существенно различаются. Например, период полувыведения у мышей составляет 1–2 ч, а у людей - до 14 ч, что затрудняет экстраполяцию эффективных доз [27].
Большинство исследований на людях носят пилотный характер с малой выборкой (менее 50 участников) и отсутствием долгосрочного наблюдения. Это не позволяет сделать однозначные выводы о клинической значимости эффектов. Для внедрения ресвератрола в клиническую практику необходимы многоцентровые рандомизированные контролируемые испытания продолжительностью не менее 2–5 лет для оценки влияния ресвератрола на прогрессирование БП, включая моторные и немоторные симптомы, стратификацию пациентов по стадии заболевания, генетическому профилю (например, носители мутаций в GBA или LRRK2) и коморбидностям (диабет, сердечно-сосудистые заболевания). Это позволит оптимизировать дозы и режимы приема. Перспективными являются исследования синергетического действия ресвератрола с другими нейропротекторами (например, экзенатидом) или методами нейромодуляции (глубокая стимуляция мозга), тестирование наночастиц, пегилированных форм и пролекарств для повышения биодоступности и преодоления гематоэнцефалического барьера [34]. Представляется целесообразным внедрение объективных маркеров эффективности, таких как уровень олигомеров α-синуклеина в спинномозговой жидкости, или показатели нейровоспаления по данным ПЭТ-визуализации [23].
ОБСУЖДЕНИЕ И ЗАКЛЮЧЕНИЕ
Таким образом, потенциал ресвератрола в комплексной терапии БП заключается в его способности дополнять существующие методы лечения. Ресвератрол, по данным доклинических исследований, демонстрирует многогранное нейропротекторное действие, направленное на ключевые патогенетические механизмы БП. Его способность подавлять окислительный стресс через активацию Nrf2-пути, ингибировать нейровоспаление посредством блокады NF-κB, улучшать митохондриальную биоэнергетику и стимулировать аутофагию для клиренса а-синуклеина делает его уникальным кандидатом для терапии нейродегенеративных заболеваний [39]. Активация сиртуинов дополнительно усиливает нейропротекцию, модулируя апоптоз и репарацию ДНК. Как адъювант к леводопе ресвератрол может снижать дозы последней, минимизируя моторные осложнения, а профилактическое применение на ранних стадиях способно замедлить прогрессирование заболевания. Однако успех этой стратегии зависит от преодоления ограничений, таких как низкая биодоступность и межвидовые различия в метаболизме. Инновационные подходы – наноформы, аналоги (птеростильбен) и комбинации с синергистами – открывают новые возможности для доставки соединения в ЦНС.
Ключевым условием трансляции доклинических данных в клиническую практику является подтверждение эффективности у человека. Проведение масштабных рандомизированных контролируемых исследований, разработка персонализированных схем лечения (с учетом генетического профиля и коморбидностей) и внедрение биомаркеров для мониторинга эффективности станут основой для реализации потенциала ресвератрола. Несмотря на существующие препятствия, многокомпонентное действие ресвератрола и благоприятный профиль безопасности подтверждают перспективность его дальнейшего изучения для терапии болезни Паркинсона.


