Ретроспективный анализ 563 эмбриологических протоколов криоциклов: влияние компетенции ооцитов и генетического скрининга эмбрионов человека на результаты витрификации
Автор: Шурыгина Оксана Викторовна, Иванова Ольга Викторовна, Юхимец Сергей Николаевич, Юлдашева Сурая Зарифовна, Русаков Дмитрий Юрьевич, Кулакова Олеся Викторовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.28, 2020 года.
Бесплатный доступ
Достижения фундаментальной науки в последнее время получили наиболее широкое распространение в области репродуктивной медицины. Биология развития человека во многом стала понятной и управляемой благодаря новым технологиям. Часть раннего эмбриогенеза человека совершенно предсказуемо воспроизводится в лабораториях вспомогательных репродуктивных технологий. Тем не менее, несмотря на все достижения, успех рождения здорового ребенка не превышает 30% от начатых циклов. Именно поэтому идет постоянный поиск новых методик, их комбинаций для достижения лучших результатов и отработки стандартных протоколов ведения пациентов с бесплодием. Целью работы является анализ целесообразности выполнения генетического скрининга эмбрионов «Next generation sequencing» (далее - NGS) и сравнительный анализ эффективности использования донорских и собственных ооцитов при переносе одного эмбриона в криоциклах. Нами проанализировано 536 криоциклов. Было выделено 4 группы пациентов с переносом одного эмбриона (SET - single embryo transfer): 1-я группа - циклы с проведением NGS тестирования, в которых для отбора на перенос были взяты эмбрионы с генетически эуплоидным статусом с использованием собственных ооцитов (n=20); 2-я группа - циклы с переносом одного эмбриона без применения NGS и использованием собственных ооцитов (n=446); 3-я группа - циклы без применения NGS, с использованием донорских ооцитов (n=8). Группы 1, 2 и 3 имели сопоставимый возраст (34,1 - 34,3 - 34,6 лет соответственно). В связи с малочисленностью 3-й группы была взята еще одна (4-я) группа наблюдения (циклы без применения NGS, с использованием донорских ооцитов, n=62), но без возрастных ограничений, в которой средний возраст пациентов составил 42,3 года. При анализе частоты выживаемости она была значимо ниже в группе с использованием донорских клеток (3 группы), чем в группах 1 и 2 с собственными клетками (84,62% против 100%, p=0,060 и 91,96%, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ооциты, витрификация эмбрионов, генетический скрининг
Короткий адрес: https://sciup.org/143177430
IDR: 143177430 | DOI: 10.20340/mv-mn.2020.28(1)51-56
Текст научной статьи Ретроспективный анализ 563 эмбриологических протоколов криоциклов: влияние компетенции ооцитов и генетического скрининга эмбрионов человека на результаты витрификации
Введение . Вспомогательные репродуктивные технологии (далее - ВРТ) наиболее убедительно демонстрируют успехи фундаментальной науки в практической медицине. Современные технологии отбора гамет и эмбрионов, оплодотворение in vitro, продленное культивирование, time-lapse технология, криоконсервация биологического материала позволяют при наличии разных форм бесплодия у пациентов достигать наступления беременности и приводят к рождению здоровых детей [1-5]. В настоящее время по разным данным, в мире насчитывается от 8 до 10 миллионов рожденных детей [2, 4, 6]. Но, несмотря на все успехи, только 30% начатых циклов ВРТ заканчиваются рождением ребенка. Именно поэтому идет постоянный поиск новых инвазивных и не инвазивных методов отбора наиболее перспективных к имплантации эмбрионов. Современная технология NGS – Next Generation Sequencing – метод прямого анализа генома эмбриона, позволяет проводить скрининг всех 46 хромосом на структурные перестройки и количественные изменения, исключив эмбрионы с генетическими нарушениями для последующего переноса. Многочисленные исследования последних лет приводят убедительные данные преимущества генетического скрининга эмбрионов на анэуплоидии при отборе эмбрионов для переноса в полость матки, особенно у пациентов старше 35 лет [7-9]. По данным литературы в ооцитах женщины после 35 лет возрастает уровень структурных и количественных аномалий хромосомного аппарата. Именно по этой причине частота наступления беременности в этой возрастной группе крайне низкая [8, 10]. В связи с этим рекомендуется использование донорских ооцитов в соответствии с Приказом Министерства здравоохранения РФ от 30 августа 2012 г. N 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [11].
Цель исследования : анализ целесообразности выполнения генетического скрининга эмбрионов (Next Generation Sequencing - NGS) и сравнительный анализ эффективности использования донорских и собственных ооцитов при переносе одного эмбриона в криоциклах.
Материалы и методы исследования. Проведен ретроспективный анализ криопротоколов циклов, проведенных в ЗАО «Медицинская компания ИДК». Для исследования были выбраны 4 группы пациентов с переносом одного эмбриона (SET – single embryo transfer): циклы с проведением NGS тестирования, в которых для отбора на перенос были взяты эмбрионы с генетически эуплоидным статусом с использованием собственных ооцитов (1 группа, n=20); циклы с переносом одного эмбриона без применения
NGS и использованием собственных ооцитов (2 группа, n=446); циклы без применения NGS, с использованием донорских ооцитов (3 группа, n=8). 1, 2 и 3 группы имели сопоставимый возраст (34,1 - 34,3 - 34,6 лет). 4 группа наблюдения (циклы без применения NGS, с использованием донорских ооцитов, n=62) была выделена дополнительно, в связи с малочисленностью 3-й группы, средний возраст пациентов составил 42,3 года. Всего проанализировано 536 криоциклов.
В работе были использованы эмбрионы человека, исследование которых было проведено с соблюдением международных этических и правовых норм обращения с эмбрионами человека [ст. 18 Конвенции Совета Европы о защите прав человека и достоинства человеческого существа при использовании достижений биологии и медицины, 1997]. Использование в научных исследованиях эмбрионов человека было разрешено Комитетом по биоэтике при Самарском государственном медицинском университете (выписка из протокола № 116 от 3.10.2018 г.).
Для оценки структуры ооцитов и эмбрионов был использован морфологический метод оценки качества эмбрионов с применением инвертированного микроскопа OlympusIX-73 (Япония) и стереомикроскоп Nikon SMZ-1000 (Япония). Витрификация эмбрионов осуществлялась в соответствии с протоколом замораживания/оттаивания завода-производителя (Irvine Scientific, USA). Для оценки жизнеспособности эмбриона проводили его морфологическую оценку сразу после размораживания (рис. 1) и через 2 часа после размораживания (рис. 2). На перенос были взяты эмбрионы, у которых количество не поврежденных клеток составляло более 50%.
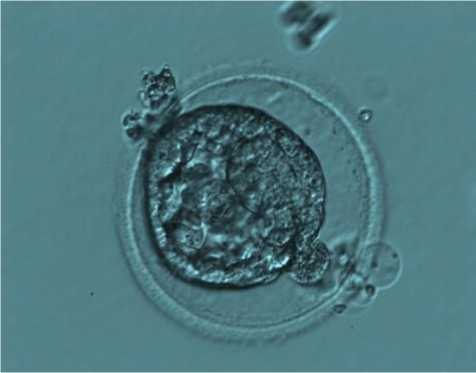
Рис. 1. Эмбрион человека 5-х суток развития, стадия сколлапсированной бластоцисты человека, сразу после размораживания. Ув.: х200.
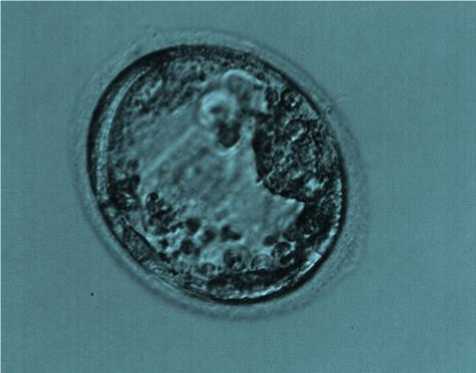
Рис. 2. Эмбрион человека 5-х суток развития, стадия бластоцисты человека через 2 часа после после размораживания. Ув.: х200.
Биопсию эмбрионов проводили на 5-6 сутки доимплантационного развития эмбрионов. Для биопсии клеток трофобласта были отобраны бластоцисты категории не менее 3ВВ в соответствии с оценкой по системе Gardner et Schoolcraft [12].
Статистическую обработку результатов выполняли на компьютере в среде статистических вычислений R (Rv.3.5.3, Studiov.1.1.463), первичный ввод данных производили с помощью электронных таблиц MS Excel. Использовали методы описательной статистики, тесты для сравнения пропорций, в том числе точный биноминальный для малых выборок и одновыборочный тест пропорций с коррекцией непрерывности для больших выборок. Контрольными точками были определены: частота выживаемости эмбрионов после витрификации, частота положительного выявления хорионического гонадотропина человека ХГЧ(+) в крови, частота наступления беременности (ЧНБ) и частота имплантации (ЧИ) у пациентов во всех исследованных группах.
Результаты и обсуждение . В предыдущих публикациях нами были описаны результаты витрификации эмбрионов в зависимости от уровня их организации, корреляция между стадией развития бластоцисты и уровнем выживаемости, а также ЧНБ и ЧИ [1]. Для оценки влияния витрификации на развивающиеся эмбрионы, подвергающиеся предварительной биопсии эмбриона с забором 3-5 клеток трофобласта, проанализированы результаты выживаемости бластоцист. Биопсия эмбрионов сама по себе является инвазивной процедурой, имеющей риски его повреждения и остановки их в развитии. Полученные в ходе исследования данные приведены в таблице 1.
Таблица 1
Показатели выживаемости эмбрионов и клинической эффективности программ ВРТ
|
Группа |
n |
Средний возраст |
Выживаемость |
Различия |
ХГЧ(+) |
Различия |
ЧНБ |
Различия |
ЧИ |
Различия |
|
1 |
20 |
34,10 |
100,00 |
* 3 (p=0,060) |
60,00 |
60,00 |
* 2 (p=0,032) |
60,00 |
* 2 (p=0,049) |
|
|
2 |
446 |
34,34 |
91,96 |
** 3 (p<0,001) |
41,03 |
35,20 |
36,36 |
|||
|
3 |
8 |
34,62 |
84,62 |
62,50 |
** 2 (p<0,001) |
62,50 |
** 2 (p<0,001) |
62,50 |
** 2 (p<0,001) |
|
|
4 |
62 |
42,27 |
92,94 |
62,90 |
** 2 (p<0,001) |
58,06 |
** 2 (p<0,001) |
56,45 |
** 2 (p<0,001) |
Примечание: * - в столбце различия указан номер группы, с которой имеются статистически значимые различия
Как видно из таблицы, частота выживаемости эмбрионов в 1 группе составила 100%. Это свидетельствует о том, что витрификация не ухудшает качество и жизнеспособность эмбриона после биопсии. Максимальная выживаемость может быть также связана с предварительной селекцией и корректным отбором эмбрионов для биопсии. При сопоставлении данных по выживаемости эмбрионов мы получили статистически значимые отличия между 1-й и 3-й группами, а также между 2-й и 3-й группами. Таким образом, выживаемость в группе с использованием донорских клеток (3) была значимо ниже, чем в группах с собственными клетками (1 и 2). Возраст реципиентов в группах (3 и 4) с донорскими клетками на частоту выживаемости не влиял. По результатам ХГЧ(+) -наиболее низкие показатели были получены во 2-й группе (с использованием собственного генетического материала без проведения генетического скрининга). Значимо различаются данные между 2-й и 3-й, 2-й и 4-й группами.
По показателям ЧНБ и ЧИ обнаружены сопоставимые показатели в 1-й, 3-й и 4-й группах. Это свидетельствует о том, что генетический скрининг позволяет получить при использовании собственных ооцитов сопоставимые клинические результаты с группами, в которых были использованы донорские ооциты (вне зависимости от возраста реципиентов). Кроме того, этот факт является дополнительным доказательством определяющей роли компетенции ооцита в реализации репродуктивного потенциала.
Статистически значимые отличия по ЧНБ и ЧИ демонстрируют данные между 1-й и 2-й группами (почти в 2 раза), что дополнительно показывает преимущества генетического скрининга и эффективность переноса эуплоидного эмбриона в полость матки при использовании собственного генетического материала. Статистически значимая разница клинических показателей 2-й и 3-й групп позволяет сделать очевидный вывод о преимуществе применения донорского материала по сравнению с использованием собственного, без сопутствующего генетического тестирования на анеуплоидии в одной и той же возрастной группе. Клинические показатели эффективности криопротоколов (частота ХГЧ (+), ЧНБ, ЧИ) показывают преимущества переносов после NGS и в группах с использованием донорских ооцитов.
Заключение . Таким образом, комплексный анализ влияния компетенции ооцитов, генетического скрининга и витрификации на частоту выживаемости эмбрионов, клинические показатели у пациентов, позволяет сделать следующие выводы. Процесс витрификации не оказывает негативного влияния на качество и жизнеспособность эмбрионов, в том числе и после проведенной биопсии эмбрионов, а качество ооцитов, их уровень плоидности являются определяющими прогностическими факторами наступления беременности. Генетический скрининг на анеуплоидии значительно улучшает клинические показатели и результаты, делая их сопоставимыми с аналогичными у пациентов с использованием донорских ооцитов.
Авторы сообщают об отсутствии каких-либо конфликтов интересов при планировании, выполнении, финансировании и использовании результатов настоящего исследования.
Список литературы Ретроспективный анализ 563 эмбриологических протоколов криоциклов: влияние компетенции ооцитов и генетического скрининга эмбрионов человека на результаты витрификации
- Ivanova OV, Shurygina OV, Rusakov DYu, Bykova TV, Petrova AA, Yukhimets SN, Kulakova OV, Yuldasheva SZ. Kriokonservatsiya biologicheskogo materiala cheloveka v praktike embriologicheskoy laboratorii. Morfologicheskie Vedomosti - Morphological Newsletter. 2019;27(3):46-50.
- Makarova NP. Avtoreferat diss… Morfologicheskie i molekulyarno- biologicheskie osobennosti postovulyatornykh ootsitov i ikh rol' v preimplantatsionnom razvitii embrionov cheloveka. 2019:46.
- Ciepiela P, Dulęba AJ, Kario A, Chełstowski K, Branecka-Woźniak D, Kurzawa R. Oocyte matched follicular fluid anti-Müllerian hormone is an excellent predictor of live birth after fresh single embryo transfer Hum Reprod. 2019;34(11):2244-2253.
- Ernstad EG, Spangmose AL, Opdahl S, Romundstad LB, Tiitinen A, Gissler M, Wennerholm U, Pinborg A, Bergh T, Malchau SS. Perinatal and maternal outcome after vitrification of blastocysts: a Nordic study in singletons from the CoNARTaS group Hum Reprod. 2019;34(11):2282-2289.
- Hwang SS, Dukhovny D, Gopal D, Cabral H, Diop H, Coddington CC, Stern JE. Health outcomes for Massachusetts infants after fresh versus frozen embryo transfer Fertil Steril. 2019;112(5):900-907.
- Scaravelli G, Levi-Setti PE, Livi C, La Sala G, Ubaldi FM, Greco E, Coccia ME., Borini A, Revelli A, Ricci G, Vigiliano V, De Luca R, Bolli S, Rienzi L. Contribution of cryopreservation to the cumulative live birth rate: a large multicentric cycle-based data analysis from the Italian National Registry J Assist Reprod Genet. 2019;36(11):2287-2295. https://link.springer.com/article/10.1007/s10815-019-01566-y.
- Paulson RJ. Outcome of in vitro fertilization cycles with preimplantation genetic testing for aneuploidies: let’s be honest with one another Fertil Steril. 2019;112(6):1013-1014 https://www.fertstert.org/article/S0015-0282(19)32541-5/fulltext.
- Sacchi M, Albani E, Cesana A, Smeraldi A, Parini V, Fabiani M, Poli M, Capalbo A, Levi-Setti PE. Preimplantation Genetic Testing for Aneuploidy Improves Clinical, Gestational, and Neonatal Outcomes in Advanced Maternal Age Patients Without Compromising Cumulative Live-Birth Rate J Assist Reprod Genet. 2019;36(12):2493-2504. https://link.springer.com/article/10.1007/s10815-019-01609-4.
- He H, Jing S, Fu Lu C, Qiu TanY, Li LuoK, Ping Zhang S, Gong F, Xiu Lu G, LinG. Neonatal outcomes of live births after blastocyst biopsy in preimplantation genetic testing cycles: a follow-up of 1,721 children FertilSteril. 2019;112(1):82-88. https://www.fertstert.org/article/S0015-0282(19)30249-3/fulltext.
- Zhang WY, Versen-Höynck F, Kapphahn KI, Fleischmann RR, Zhao Q, Baker VL. Maternal and neonatal outcomes associated with trophectoderm biopsy FertilSteril. 2019;112(2):283-290. https://www.fertstert.org/article/S0015-0282(19)30316-4/fulltext.
- Carrasquillo RJ, Kohn TP, Cinnioglu C, Rubio C, Simon C, Ramasamy R, Al-Asmar N. Advanced paternal age does not affect embryo aneuploidy following blastocyst biopsy in egg donor cycles J Assist Reprod Genet. 2019;36(3):2039-2045. https://link.springer.com/article/10.1007/s10815-019-01549-z.
- Gardner DK, Schoolcraft WB. In vitro culture of human blastocysts. Toward Reproductive Certainty: Fertility and Genetics Beyond. 1999;(11):378-388.


