Ретроспективный анализ отдаленных результатов лечения больных лимфомами кожи низкой степени злокачественности
Автор: Тарасов Виталий Вячеславович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Онкология
Статья в выпуске: 1 т.7, 2011 года.
Бесплатный доступ
В лечении лимфом кожи низкой степени злокачественности большую важность имеет назначение специфической химиотерапии (цитостатиков). С целью изучения отдаленных результатов лечения цитостатиками лимфом кожи низкой степени злокачественности (ПК НСЗ) проведено ретроспективное изучение выживаемости больных Т-клеточными эпидермо-тропными лимфомами кожи при использовании специфической терапии и без нее. Проведен сравнительный анализ выживаемости в двух группах больных: 40 пациентов, получавших цитостатики, и 32 пациента, никогда не получавших химиотерапии. В результате выявлено снижение уровня выживаемости, повышение летальности от ПК НСЗ в группе получавших цитостатики. Полученные результаты позволяют с определенной долей уверенности комментировать влияние цитостатической терапии на выживаемость больных ЛК НСЗ
Анализ выживаемости, лимфома кожи, цитостатики
Короткий адрес: https://sciup.org/14917224
IDR: 14917224
Текст научной статьи Ретроспективный анализ отдаленных результатов лечения больных лимфомами кожи низкой степени злокачественности
-
1Введение. Лимфомы кожи низкой степени злокачественности – это группа злокачественных лимфопролиферативных заболеваний, возникающих первично в коже. Наиболее часто встречающимся представителем этой группы являются Т-клеточные эпидермотропные лимфомы из малых церебри-формных лимфоцитов, или грибовидный микоз (ГМ).
Термин «грибовидный микоз» впервые был введен Алибером, описавшим в 1832 г. заболевание, ныне именуемое классической формой ГМ. Согласно классификации лимфом кожи И.М. Разнатовского 1987 г. [1, 2] он относится к Т-клеточным лимфомам кожи низкой степени злокачественности, сопровождающимся полиморфноклеточной тканевой реакцией на пролиферацию опухолевых клеток. В соответствии с пересмотренной Европейско-американской классификацией лимфом 1994 г. (REAL) и классификацией лимфоидных неоплазий ВОЗ (1999 г.), разработанной Международной группой изучения лимфом (ILSG) [3-5], под термином ГМ объединены все Т-клеточные лимфомы кожи из периферических (зрелых) клеток, проявляеющиеся пролиферацией первично в коже малых церебриформных лимфоцитов, обладающих тропностью к эпидермису.
patients with skin lymphomas of low degree malignancy.
Характерным для ГМ является многообразие клинических вариантов. Ранними кожными проявлениями при ГМ могут быть пятна, бляшки, опухоли, эритродермия. При этом возможно наличие у одного пациента нескольких указанных типов поражения кожи одновременно или, что более характерно, смена о-дних высыпаний другими по мере прогрессирования заболевания [6]. Дебют высыпаний чаще представлен пятнистыми и пятнисто-бляшечными умеренно шелушащимися элементами. Наряду с выделением клинических вариантов, при ГМ по общим принципам онкологии оценивают распространенность неоплазии в органах и тканях и клиническую стадию опухолевого процесса [6, 7] (таблица).
В лечении больных лимфомами кожи низкой степени злокачественности в настоящее время используется много методов, в основе которых лежат разные механизмы воздействия на организм человека и опухолевую ткань. Принципиально все методы лечения ГМ могут быть разделены на 1) иммуносупрессивную терапию (цитостатики, глюкокортикостероиды); 2) стимулирующую и общеукрепляющую терапию (витамины и микроэлементы, биогенные стимуляторы, иммуностимуляторы); 3) локальное воздействие на опухолевую ткань (наружное применение кортикостероидов и цитостатиков, лучевая терапия, хирургическое лечение) [2, 6-8].
Распространенность и клиническая стадия опухолевого процесса при грибовидном микозе
|
TNMB-классификация |
Описание |
|
Т (опухоль) Т1 |
Ограниченые пятна и бляшки (< 10% общей поверхности кожи) |
|
Т2 |
Распространенные пятна и бляшки (> 10% общей поверхности кожи) |
|
Т3 |
Опухоли |
|
Т4 |
Генерализованная эритродермия |
|
Ν (лимфатические узлы) Ν0 |
Лимфатические узлы клинически не вовлечены |
|
Ν1 |
Лимфатические узлы увеличены, гистологически не вовлечены (реактивный и дер-матопатический лимфаденит) |
|
Ν2 |
Лимфатические узлы клинически не вовлечены, гистологически вовлечены |
|
Ν3 |
Лимфатические узлы увеличены и гистологически вовлечены |
|
M (внутренние органы) M0 |
Внутренние органы не вовлечены |
|
M1 |
Внутренние органы вовлечены |
|
В (кровь) В0 |
Атипичные (Сезари) клетки не циркулируют в крови (< 5% общих лимфоцитов) |
|
В1 |
Атипичные (Сезари) клетки циркулируют в крови (> 5% общих лимфоцитов) |
|
Клиническая стадия |
Распространенность |
|
IA |
T1 N0 M0 |
|
IB |
T2 N0 M0 |
|
IIA |
T1-2 N1 M0 |
|
IIB |
T3 N0-1 M0 |
|
IIIA |
T4 N0 M0 |
|
IIIB |
T4 N1 M0 |
|
IVA |
T1-4 N2-3 M0 |
|
IVB |
T1-4 N0-3 M1 |
Иммуносупрессивная терапия может применяться местно и системно. Для локального лечения наиболее часто используются кортикостероидные мази, мази с цитостатиками – проспидином, циклофос-фаном. Системная иммуносупрессивная терапия принципиально может быть разделена на моно- и полихимиотерапию. Для монотерапии наиболее часто используется проспидин в различных разовых и курсовых дозах, реже используется циклофосфан, иногда применяются глюкокортикостероиды системно. Полихимиотерапия проводится по стандартизированным схемам с применением различных комбинаций проспидина, циклофосфана, метотрексата, других цитостатиков, глюкокортикостероидов.
Локальное воздействие на опухолевую ткань помимо подавляющих воспаление средств и цитостатиков включает хирургическое лечение единичных очагов, физическое воэдействие на очаги поражения с помощью разных видов лучевой терапии, фотохимиотерапии.
Иммуностимулирующее и общеукрепляющее лечение ЛК НСЗ подразумевает воздействие на организм человека с целью стимулировать собственные механизмы противоопухолевой защиты, для чего ранее широко применялись витамины, микроэлементы, биогенные стимуляторы, иммуномодуляторы и стимуляторы, а также стимуляторы неспецифической резистентности.
Одной из сложных задач в лечении больных злокачественными лимфопролиферативными заболеваниями кожи является решение вопроса о целесообразности применения специфической химиотерапии. В настоящее время растут требования к доказательствам эффективности лечения заболевания. Поэтому в качестве аргументов «за» и «против» при подборе конкретного метода терапии важно использовать не только сведения о его эффективности в достижении ремиссии, но и имеющуюся информацию о влиянии лечения на отдалённый прогноз заболевания, в том числе на общую выживаемость пациентов и выживаемость от конкретного заболевания [9]. Высокая токсичность цитостатической терапии, с одной стороны, и накопленные знания об относительно доброкачественном, длительном течении ЛК НСЗ (в частности, грибовидного микоза) даже без лечения – с другой, определяют важность решения этой задачи на данном этапе изучения лимфом кожи.
Методы. С целью изучения влияния цитостатической терапии на выживаемость больных ГМ нами было проведено ретроспективное статистическое исследование отдаленных результатов лечения при помощи анализа выживаемости моментным методом Каплана–Мейера [6, 9]. Указанный метод специально разработан для изучения выживаемости, он учитывает неизбежное выбывание пациентов в ходе исследования, позволяет включать новых пациентов в исследование на всем его протяжении. Поэтому подобный вид ретроспективных исследований ещё называют проспективными.
В группу для исследования было включено 72 пациента (38 мужчин, 34 женщины). Все больные имели полностью прослеженный катамнез, гистологически подтвержденный диагноз Т-клеточной лимфомы кожи низкой степени злокачественности и наблюдались в клинике кожных и венерических болезней Военно-медицинской академии и других лечебных учреждениях г. Санкт-Петербурга в период с 1965 по 2004 г. Дебют заболевания у пациентов происходил в период с 1943 по 1991 гг. При этом обязательным условием для включения в группу был факт начала заболевания с ограниченных пятен и бляшек, что соответствует IA-стадии Т-клеточной эпидермотропной лимфомы (T1N0M0B0). В процессе наблюдения за группой клинические проявления изменялись, и на момент окончания исследования распределение пациентов по клиническим формам было следующим: пятнисто-бляшечная – 25, классическая (Алибера– Базена) – 12, пойкилодермическая – 18, эритродер-мическая – 15, синдром Сезари – 2.
Представленная выборка была разделена на 2 группы. Принцип, лежащий в основе разделения: факт применения цитостатиков у каждого конкретного больного.
I группа: 40 пациентов, получавших от 1 до 8 курсов специфической химиотерапии (преимущественно проспидином). Из них у 20 применялись также глюкокортикоиды наружно и внутрь и у 9 – локальная рентгенотерапия. Средний возраст больных в группе на момент начала исследования составил 40,4 года.
II группа: 32 пациента, никогда не получавших цитостатики, у которых применялись различные комбинации витаминотерапии, гормонотерапии, иммуностимулирующей и лучевой терапии. Средний возраст в группе составил 41,6 года.
В ходе изучения катамнеза было установлено, что в обеих группах лечение начиналось на одной и той же клинической стадии – ограниченных пятен и бляшек (T1N0M0B0). При этом активность процесса и степень дифференцировки опухолевых клеток (использовались гистологические критерии) у пациентов в группе I и в группе II на момент начала лечения были приблизительно одинаковы.
Оценка выживаемости в указанных группах производилась четырьмя различными методами:
-
1. Оценка выживаемости в процентах. Вычисляется с помощью моментного метода Каплана–Мейера: графически отображается с помощью «кривых выживаемости». Точкой отсчета для определения выживаемости служит установленная дата начала заболевания. Для математического подтверждения различия между двумя кривыми вводится специальный математический индекс: показатель отношения смертности Ψ («пси») [9], позволяющий утверждать, что две кривые выживаемости отличны друг от друга; Ψ=lnS2 (∞)/lnS1 (∞), где S1 (∞) и S2 (∞) – выживаемость в I и II группах к концу наблюдения. Для определения значимости различий двух кривых выживаемости использован специальный логранговый критерий (z), учитывающий выбывание пациентов из-под наблюдения в ходе исследования. Для компенсации явлений дискретности (устранения излишней «мягкости» критерия) применяется поправка Йейтса [9].
-
2. Построение медианы выживаемости – обобщенного показателя, измеряющегося в единицах
-
3. Оценка 5- и 10-летней выживаемости в группах с момента начала наблюдения. Показатель вычисляется в процентах, определяются стандартная ошибка и 95%-ные доверительные интервалы.
-
4. Оценка летальности в группах от лимфомы кожи в абсолютных числах и процентах с последующим сравнением полученного показателя в двух группах.
времени и отражающего минимальное время, в которое выживаемость составляет менее 50%. Иными словами, медиана выживаемости – это время, до которого доживает половина исследуемой выборки. Указанный показатель определяется для каждой группы.
Результаты.
-
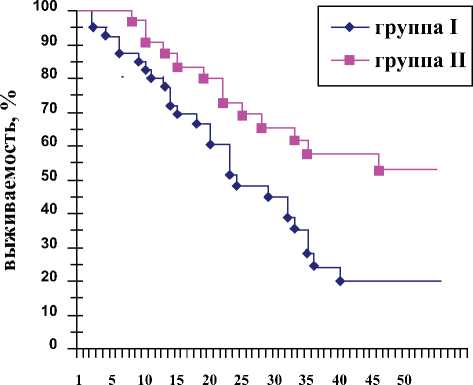
1. Выживаемость пациентов с момента начала заболевания в группе II лучше, чем в группе I (рис. 1); Ψ<1, что подтверждает выявленное различие выживаемости в двух группах; z (с поправкой Йейтса) = 2,547, что соответствует P<0,05.
-
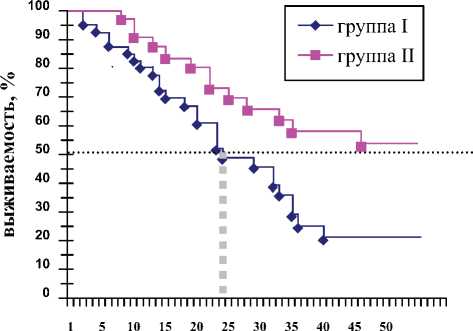
2. Медиана выживаемости в группе I составила 24 года, в группе II медиана выживаемости не определяется, так как за время наблюдения за группой умерло менее половины наблюдаемых (рис. 2).
-
3. В группе I 5-летняя выживаемость составила 92,5±7,2 %; 10-летняя выживаемость составила: 82,5±11,3%.
-
4. За время наблюдения в группе I от лимфомы кожи умерло 14 человек. В группе II от ЛК умерло 4 пациента. Таким образом, летальность от ЛК составила: в группе I 35%; в группе II 12,5%. P<0,05.
время, лет
Рис. 1. Выживаемость больных в исследуемых группах с момента первых клинических проявлений
время, лет
Рис. 2. Медиана выживаемости в исследуемых группах
В группе II 5-летняя выживаемость составила 100%; 10-летняя выживаемость составила 90,6±8,4%.
Обсуждение. Анализ выживаемости – особый вид статистических медицинских исследований. Его особенности: длительный срок наблюдения пациентов (от начала болезни до смерти), включение новых больных в исследование на всем его протяжении, необходимость закончить эксперимент до наступления исхода (смерти) у всех наблюдаемых, неизбежное выбывание из-под наблюдения части пациентов в ходе исследования. При этом истинная продолжительность болезни и жизни выживших к концу исследования остается неизвестной. Очевидно, что к анализу выживаемости не применимы обычные способы оценки различий, рассчитанные на наличие полных исчерпывающих данных. Поэтому в данной работе нами использовался специальный статистический метод, разработанный для исследований выживаемости и учитывающий указанные особенности подобных исследований. Это моментный метод Каплана – Мейера, который позволяет получать достоверные результаты, оценивать статистическую значимость различий выживаемости в изучаемых группах, несмотря на включение новых пациентов и выбывание части наблюдаемых в ходе исследования.
При подборе больных для исследования основной задачей было создать однородную, статистически корректную выборку. В группу для исследования включались больные с наиболее распространенной формой Т-клеточной лимфомы кожи низкой степени злокачественности, клинически и гистологически подтверждённой эпидермотропной лимфомой из малых церебриформных лимфоцитов. Как было отмечено, в соответствии с основными современными классификационными системами все клинические варианты эпидермотропной лимфомы кожи из малых церебриформных лимфоцитов соответствуют диагнозу «грибовидный микоз». Именно это положение принято нами за основу при выработке методики сбора и обработки полученных данных. Поэтому в группу для исследования могли включаться больные с разными клиническими формами ГМ. При этом у всех наблюдаемых заболевание начиналось с ограниченных пятен и бляшек (IA-стадия, T1N0M0B0). Однородность выборки достигалась принятием за точку отсчета выживаемости именно этой стадии болезни. Разделение в ходе исследования пациентов на клинически разные подгруппы рассматривается нами как индивидуальная особенность опухолевой прогрессии, обусловленная комплексом сопутствующих факторов: состоянием сопротивляемости макроорганизма пролиферации опухолевых клеток, проводимым лечением и др., и, следовательно, не нарушает нозологической однородности группы. Опыт исследования выживаемости больных T.H. Kim и соавт. [6] оправдывает подобный унитарный подход к формированию выборки.
Разделение больных на две группы осуществлялось на основании только одного фактора – факта применения цитостатической терапии, чем обеспечивалось выполнение еще одного обязательного условия – случайности выборки. Первичность же повышения активности процесса по отношению к назначению цитостатиков, а также более выраженное снижение дифференцировки опухолевых клеток в группе I на момент начала лечения выявлены не были.
Заключение. Результаты нашего исследования, проведенного четырьмя различными методами оценки выживаемости, позволяют сделать вывод о том, что цитостатическая терапия отрицательно повлияла на продолжительность жизни больных лимфомами кожи низкой степени злокачественности в изученной группе. Проведенный ретроспективный анализ выживаемости выявил отчетливую закономерность во влиянии проводимой терапии на отдаленные результаты лечения и выживаемость пациентов, что может послужить достаточным базисом для выработки обоснованной тактики лечения больных изученной патологией.
Список литературы Ретроспективный анализ отдаленных результатов лечения больных лимфомами кожи низкой степени злокачественности
- Разнатовский И.М. Диагностика лимфопролифератив-ных заболеваний в госпитале. Л.: ВМедА, 1984. С. 32.
- Разнатовский И.М., Ястребов В.В. Лимфомы кожи. СПб.: С.-Петерб.ГМУ им. И.П. Павлова, 1997. С. 56.
- Новик А.А. Классификация злокачественных лимфом (рекомендации ВОЗ). СПб.: ЭЛБИ, 2000. С. 126.
- A revised European-American classification of limphoid neoplasms: a proposal from the International Lymphoma Study Group/N.L. Harris, E.S. Jaffe, H. Stein [et al.]//Blood. 1994. №84. P. 1361-1392.
- World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: reaport of the Clinical Advisory Committee meeting/N.L. Harris, E.S. Jaffe, J. Diebold [etal.]//J. Clin. Oncol. 1999. № 17. P. 3835-3849.
- Clinical stage IA (limited patch and plaque) mycosis fungoides/T.H. Kim, R.A. Jensen, G.L. Watanabe [et al.]//Arch. Dermatol. 1996. № 132. P. 1309-1313.
- Diamandidou E. Cohen PR., Kurzrock R. Mycosis fungoides and Sezary syndrome//Blood. 1996. № 88. P. 2385-2409.
- New perspectives in experimental and clinical research for cutaneous T-cell lymphomas/G. Burg, A. Haffner, R. Boni [et al.]//Recent Results in Cancer Research. 1995. № 139. P. 225-237.
- Glanz S.A. Primer of biostatistics. Inc, N.Y.: Mc GRAW-HILL, 1994.


