Резистентность к терапии препаратами ацетилсалициловой кислоты: факторы риска, механизмы, методы диагностики
Автор: Лукьянец К.Ю., Пчелин И.Ю.
Журнал: Juvenis scientia @jscientia
Рубрика: Обзорные статьи
Статья в выпуске: 2 т.6, 2020 года.
Бесплатный доступ
Ацетилсалициловая кислота (аспирин) является самым распространённым препаратом, используемым для вторичной профилактики атеротромботических событий при сердечно-сосудистых заболеваниях. Соответственно, проблему эффективности терапии аспирином следует считать одной из центральных в кардиологии. Остаётся актуальным вопрос персонализации антиагрегантной терапии, поскольку убедительные данные в пользу применения аспирина с целью первичной профилактики в общей популяции отсутствуют. В настоящем обзоре проанализированы данные последних лет о проблеме резистентности к аспирину. Обсуждаются потенциальные механизмы невосприимчивости к аспирину, возможное влияние генетических факторов на клиническую эффективность антиагрегантной терапии, вопросы стандартизации методов и критериев диагностики резистентности к аспирину, а также возможности её преодоления. Проанализированы данные о клиническом и прогностическом значении 11-дегидротромбоксана В2 как одного из наиболее перспективных маркеров тромбоксан-зависимой активации тромбоцитов.
Ацетилсалициловая кислота, аспирин, резистентность к аспирину, тромбоциты, антиагреганты, 11-дегидротромбоксан в2, 11-dehydrothromboxane в2
Короткий адрес: https://sciup.org/14115954
IDR: 14115954
Текст обзорной статьи Резистентность к терапии препаратами ацетилсалициловой кислоты: факторы риска, механизмы, методы диагностики
Введение. Ацетилсалициловая кислота (аспирин) – это один из наиболее широко используемых в мире и хорошо изученных препаратов. Положительные эффекты применения низких доз аспирина у пациентов с острым коронарным синдромом, хронической ишемической болезнью сердца, перенесённым инфарктом миокарда, острым нарушением мозгового кровообращения и транзиторными ишемическими атаками подтверждены более чем в 200 исследованиях, включающих более 200 тысяч пациентов [1, 2]. Использование аспирина в качестве вторичной профилактики у пациентов группы высокого риска уменьшает вероятность возникновения серьёзных сердечно-сосудистых событий на 25% [3].
В последнее время стало появляться всё больше сведений об использовании аспирина в качестве первичной профилактики сердечно-сосудистых заболеваний, но данные об эффективности такой терапии весьма противоречивы, поскольку нередко риск кровотечений перевешивает пользу [1, 4].
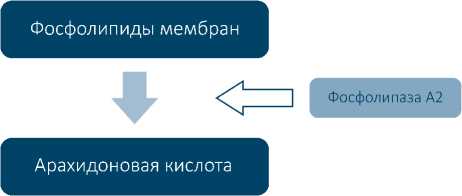
Аспирин оказывает влияние, главным образом, на биосинтез циклических простаноидов, а именно тромбоксана А2, ингибируя фермент циклооксигеназу (ЦОГ), катализирующий первый этап образования сигнальных молекул семейства эйкозаноидов, которые являются производными арахидоновой кислоты – жирной кислоты с 20 атомами углерода (см. рисунок 1) [5, 6].
В дальнейшем были клонированы и охарактеризованы две формы фермента – циклооксигеназа-1 и циклооксигеназа-2. Рас- пределение по тканям и уровень экспрессии этих двух ферментов различны: циклооксигеназа-1 является конститутивным ферментом и экспрессируется во многих тканях, тогда как активность циклооксигеназы-2 индуцируется при развитии воспаления после повреждения тканей [6].
Аспирин ацетилирует остаток серина-529 и необратимо блокирует активность циклооксигеназы-1, тем самым прекращая продукцию тромбоксана А2 в тромбоците на весь срок жизни этого форменного элемента крови [6].
Тем не менее, у части пациентов, получающих терапию аспирином, всё же развиваются атеротромботические события. В процессе изучения данного явления в научной литературе появилось понятие «резистентность к аспирину», которое означает неспособность аспирина снижать выработку тромбоксана А2 и тем самым ингибировать активацию и агрегацию тромбоцитов [7]. Однако, под термином «резистентность» в одних случаях подразумевают клиническую устойчивость к терапии аспирином, а в других – лабораторную (или биохимическую) [8]. Так, под лабораторной резистентностью подразумевается неспособность аспирина ингибировать тром-боксан-зависимые функции тромбоцитов по данным какого-либо из лабораторных тестов. Соответственно, с фармакологической точки зрения резистентность к аспирину означает отсутствие ожидаемого ингибирования тромбоцитарной ЦОГ-1 и снижения продукции тромбоцитарного тромбоксана А2 [7, 8].
Weber et al. предложили классификацию лабораторной резистентности к аспирину,
5-липоксигеназа


Простагландин Н2

Специфические синтазы
Простациклин
Тромбоксан А2

Простагландин D2

Простагландин Е2

Простагландин F2a


тромбоцитов Т почечного
кровотока

Рисунок 1. Схема биосинтеза эйкозаноидов (по J. Saad, D. Mathew, с изменениями) *ЦОГ – циклооксигеназа, 5-HPETE – 5-гидропероксиэйкозатетраеновая кислота.
которая различает фармакокинетическую резистентность (аспирин in vitro полностью блокирует вызванную коллагеном агрегацию тромбоцитов и образование тромбоксана, при этом приём аспирина перорально полностью выработку тромбоксана не подавляет), фармакодинамическую резистентность (ни in vitro , ни при пероральном приёме аспирин полностью не блокирует вызванную коллагеном агрегацию тромбоцитов и образование тромбоксана) и псевдоустойчивость (низкие дозы коллагена вызывают агрегацию тромбоцитов in vitro , несмотря на полный блок производства тромбоксана) [7, 9].
Понятие «клиническая устойчивость к аспирину» (или «неэффективность лечения аспирином») относится преимущественно к клиническим результатам лечения, то есть означает неспособность стандартных антиагрегантных доз аспирина предотвращать тромбоз и соответствующие сердечнососудистые события ишемического генеза [7, 8]. Однако, стимулировать агрегацию тромбоцитов и развитие тромбоза может не только тромбоксан А2, но и АДФ, что делает термин «неэффективность лечения аспирином» не вполне корректным. Поэтому некоторые авторы предлагают более нейтральное понятие «невосприимчивость к аспирину», которое может использоваться до уточнения причин неудачи лечения аспирином [7].
Факторы, повышающие риск неэффективности лечения аспирином. Существует множество причин, по которым аспирин может не подавлять выработку тромбоксана А2, активацию и агрегацию тромбоцитов, что означает лабораторную резистентность к аспирину, и ещё больше причин, по которым профилактика атеротромботических сердечно-сосудистых событий с использованием аспирина может оказаться неэффективной [7].
Так, низкий комплаенс является одной из часто встречающихся причин выявления лабораторных признаков устойчивости к аспирину и неэффективности лечения аспирином [7, 10, 11]. До 40% пациентов с сердечнососудистыми заболеваниями не соблюдают режим приёма аспирина, однако нередко врачи игнорируют эту проблему [7, 11]. В связи с этим необходимо подробно объяснять пациентам значение антиагрегантной терапии и риски, ассоциированные с нерегулярным приёмом препарата.
Помимо активации тромбоцитов путём стимуляции рецепторов тромбоксана А2, существуют альтернативные пути активации, включающие стимуляцию гликопротеинов мембраны тромбоцитов (тромбоцитарных рецепторов) коллагеном (GPIa/IIa), фактором фон Виллебранда (GP Ib/V/IX), АДФ, тромбином и эпинефрином [7, 10]. По данным исследования Hally et al., одним из функциональных путей постинфарктной активации тромбоцитов является активация через Toll-подобные рецепторы 2/1, которая не блокируется стандартной антиагрегантной терапией [12].
Однонуклеотидные полиморфизмы генов ЦОГ-1, ЦОГ-2 и рецепторов тромбоцитов могут модифицировать ответ тромбоцитов на терапию аспирином [13]. Некоторые эпидемиологические исследования свидетельствуют о том, что около трети случаев лабораторной устойчивости к аспирину генетически детерминированы [14]. Резистентность к аспирину может быть связана с вариабельностью генов гликопротеинов мембраны тромбоцитов (полиморфизм гена PlA1/A2, кодирующего гликопротеин IIIa; полиморфизм гена гликопротеина Ia/IIa С807Т в гомозиготной форме, который ассоциирован с повышенной плотностью рецептора тромбоцитов, связывающего коллаген), а также генов рецептора АДФ P2Y1 (A1622G, С893С) и P2Y12 (H1/H2) [13-18]. В генах, вовлечённых в пути биосинтеза тромбоксана, были идентифицированы сотни однонуклеотидных полиморфизмов, однако их влияние на лабораторную устойчивость к аспирину ещё не до конца изучено. Исследование влияния генетических факторов на клиническую эффективность антиагрегантной терапии представляется ещё более сложной задачей [16].
Некоторые лекарства могут конкурировать с аспирином за циклооксигеназный сайт (один из активных центров ЦОГ-1); из них чаще всего используются нестероидные противовоспалительные препараты, такие как ибупрофен и напроксен, имеющие in vitro более высокое сродство к ЦОГ-1 по сравнению с другими представителями группы неселективных НПВП [7, 19]. Механизм ингибирования ЦОГ-1 нестероидными противовоспалительными препаратами, в отличие от ацетилсалициловой кислоты, основан на образовании связи с гуанидиновой группой остатка аргинина-120, обеспечивающей обратимое ингибирование фермента. При этом циклооксигеназный сайт становится временно недоступным для аспирина, который способен необратимо ингибировать ЦОГ-1. Таким образом, совместный приём нестероидных противовоспалительных препаратов с аспирином может снизить эффективность профилактики сердечно-сосудистых событий [7, 19-21].
Продолжительность обратимого ингибирования агрегации тромбоцитов нестероидными противовоспалительными препаратами напрямую связана с их периодом полувыведения. Так, для напроксена характерен период полувыведения 12-17 часов, и в течение длительного времени он сохраняет обратимую связь с ЦОГ-1, препятствуя связыванию аспирина с циклооксигеназным сайтом [22, 23]. R(-) и S(+) энантиомеры ибупрофена конкурируют за циклооксигеназный сайт, при этом S(+) энантиомер имеет более высокое сродство к ЦОГ-1, являясь фармакологически более активным в отношении ингибирования синтеза простагландинов и тромбоксана А2. Однако ибупрофен обладает коротким периодом полувыведения (в среднем, от 2 до 4 часов), что позволяет избежать его негативного влияния на антиагрегантный эффект ацетилсалициловой кислоты при приёме аспирина за несколько часов до приёма ибупрофена [20, 23-26].
Также существует гипотеза, что ингибирование ЦОГ-2 нестероидными противовоспалительными препаратами за счёт связывания с гуанидиновой группой остатка аргинина-106 подавляет синтез простациклина (простагландина I2), обладающего сосудорасширяющими, противовоспалительными и мощными антиагрегантными свойствами [19, 21, 22, 27].
Ацетилсалициловая кислота – слабокислый препарат, который всасывается через слизистую оболочку желудка и тонкой кишки путём пассивной диффузии в липофильном состоянии. Пиковые концентрации в плазме достигаются через 30-40 минут при приёме растворимого аспирина и в течение 3-4 часов при приёме препарата с кишечнорастворимой оболочкой; при абсорбции аспирин частично гидролизуется эстеразами слизистой оболочки желудочно-кишечного тракта до салициловой кислоты, метаболита, неактивного в отношении тромбоцитов [7, 10, 28]. При терапии ингибиторами протонной помпы происходит снижение выработки соляной кислоты и повышение рН выше уровня константы диссоциации ацетилсалициловой кислоты (3,5), что переводит аспирин в ионизированное состояние, снижая его липофильность и, следовательно, его абсорбцию [10, 29].
Кишечнорастворимая оболочка заметно замедляет абсорбцию аспирина и достижение максимальной концентрации аспирина в плазме, делая этот процесс более изменчивым, что лабораторно может проявляться как резистентность к аспирину в связи со снижением его антиагрегантного действия на тром- боциты, однако данные о роли этого фактора очень противоречивы [30-32].
Гипергликемия и избыточная масса тела также вносят вклад в развитие резистентности к аспирину. Так, в одном из исследований было показано, что вероятность резистентности к аспирину повышена при уровне HbA1c≥8% и наличии ожирения (ИМТ≥30 кг/м2) [33]. При сахарном диабете, наряду с повышением оборота тромбоцитов, происходит гликирование белков на поверхности тромбоцитов, что способствует их адгезии за счёт снижения текучести мембраны. В условиях гиперосмолярности активируется экспрессия тромбоцитами GPIIb/IIIa и P-селек-тина [34]. По данным Knebel et al., у больных сахарным диабетом на фоне гипергликемии снижается экспрессия рецепторов простациклина на поверхности тромбоцитов, что может также способствовать их повышенной реактивности [35, 36]. Ещё одной возможной причиной неэффективности лечения аспирином больных сахарным диабетом является диабетическая гастроэнтеропатия и связанное с ней нарушение абсорбции лекарств, в том числе и аспирина [37-38].
Ожирение ассоциировано с повышением оборота тромбоцитов и их избыточной активацией, при этом увеличение массы тела, избыток жировой ткани и связанные с этим изменения в объёме распределения и функции печени могут заметно влиять на биодоступность липофильного аспирина [39-41]. Метаанализ результатов 10 исследований, проведенный Rothwell et al., показал, что эффективность первичной профилактики сердечно-сосудистых событий с использованием низких доз аспирина зависит от роста и массы тела пациентов. Так, низкие дозы аспирина (75-100 мг в сутки) статистически значимо снижали риск сердечно-сосудистых событий у пациентов массой тела 50-69 кг и не оказывали такого эффекта у пациентов с более высокой массой тела. Напротив, преимущества применения высоких доз аспирина (не менее 300 мг в сутки) были показаны только в груп- пе пациентов весом 70 кг и более [41]. При этом подчёркивается, что неэффективность применения аспирина связана, скорее, со снижением биодоступности, чем с усилением активации тромбоцитов, что подтверждается несколько большей потерей эффекта при использовании аспирина в кишечнорастворимой оболочке по сравнению с приёмом аспирина стандартного высвобождения пациентами с массой тела 70 кг и более [41].
При всех состояниях, ассоциированных с высоким оборотом тромбоцитов (шунтирование коронарных артерий, острый или хронический инфекционный процесс, воспаление), низкие дозы аспирина не способны подавлять ЦОГ-1 в свежих тромбоцитах, которые непрерывно и быстро высвобождаются в кровоток в стрессовых условиях, что приводит к более высокой реактивности тромбоцитов [7, 10].
Роль фракции циркулирующих незрелых тромбоцитов как предиктора устойчивости к аспирину активно обсуждается в контексте эффективности применения аспирина для профилактики артериальных и венозных тромбозов при эссенциальной тромбоци-темии и других Ph-негативных миелопролиферативных заболеваниях [42]. В частности, было показано, что увеличение количества незрелых тромбоцитов ассоциировано с повышением риска тромбозов независимо от уровня тромбоцитоза; более того, при наличии мутации гена JAK2 V617F количество незрелых тромбоцитов и, соответственно, риск тромбозов значительно выше [42, 43]. Было установлено, что при эссенциальной тромбоцитемии приём 100 мг аспирина два раза в день значимо снижает реактивность тромбоцитов по сравнению с приёмом 100 или 200 мг аспирина один раз в день [44]. Это даёт основание предполагать, что при состояниях, ассоциированных с высоким оборотом тромбоцитов, более рациональным способом преодоления устойчивости к аспирину должно являться изменение интервала дозирования препарата, а не изменение его дозы, то есть при одинаковой суточной дозе аспирина деление её на два приёма будет способствовать снижению риска развития резистентности [44].
Методы исследования тромбоксан-зави-симой функции тромбоцитов. В современном представлении тромбоциты участвуют не только в процессах гемостаза, но и в развитии воспаления, формировании иммунитета, заживлении ран, ремоделировании сосудов плода, процессе роста опухолей и их метастазирования [45-48]. Из-за многочисленных путей активации тромбоциты являются сложным объектом для изучения, и для оценки разнообразия реакций тромбоцитов требуются специфические методы. Так как тромбоциты являются ключевым звеном атеротромбоза, оценка тромбоксан-зависимой функции тромбоцитов всё чаще используется для мониторинга эффективности антиагрегантов в отношении подавления образования патологического тромба, а также для выявления пациентов с повышенным риском сердечно-сосудистых событий ишемического генеза или кровотечений [45, 49]. Широкое использование антиагрегантов, включая аспирин, неизбежно сопряжено с повышением частоты кровотечений, в том числе фатальных, во время хирургических процедур и у больных, получивших травмы, сопровождающиеся повреждением сосудов. Необходимость быстрой оценки функции тромбоцитов у постели больного привела к разработке ряда относительно простых в использовании функциональных методов, которые могут применяться вдали от специализированных клинических или исследовательских лабораторий, выполняющих технически сложные тесты [45, 49].
Все методы исследования тромбоксан-зависимой функции тромбоцитов можно разделить на две группы: непосредственно оценивающие функции тромбоцитов in vitro с использованием цельной крови или плазмы, богатой тромбоцитами, и основанные на измерении уровня тромбоксана А2, а также его метаболитов в крови и моче. Преимущества и недостатки методов исследования эффективности антиагрегантного действия аспирина in vitro представлены в таблице 1.
Тромбоксан А2 является биологически активным и клинически значимым протром-ботическим метаболитом, и логично было бы оценивать его уровень с помощью соответствующего лабораторного теста, однако прямое измерение уровня тромбоксана А2 клинически неосуществимо, поскольку его напряжённый бициклический оксетан-ацеталь-ный фрагмент быстро подвергается водной нуклеофильной атаке in vivo с образованием тромбоксана В2 [50]. Поскольку уровень тромбоксана В2 в сыворотке крови напрямую зависит от активности мишени аспирина ЦОГ-1, он может косвенно отражать эффективность терапии аспирином. Однако данный показатель не является прямым маркером собственно агрегации тромбоцитов. Кроме того, концентрация тромбоксана В2 может повышаться из-за активации тромбоцитов ex vivo во время сбора и обработки крови, а метод её определения достаточно трудоемкий и малодоступный [6, 50]. Тромбоксан В2, в свою очередь, активно метаболизируется путём β-окисления и дегидрирования [6, 50]. Один из его метаболитов, 11-дегидротромбоксан В2, термодинамически стабильный и биологически инертный простаноид, секретируется в мочу, что позволяет использовать его для оценки эффективности антиагрегантного действия аспирина [6].
11-дегидротромбоксан В2 в моче: способы определения, преимущества и недостатки метода. Определение 11-де-гидротромбоксана В2 методом газовой хроматографии-масс-спектрометрии даёт наиболее точные результаты, однако имму-нохимический анализ также может быть надёжным при адекватной подготовке образцов [35]. Иммуноферментный анализ обладает эквивалентной или, по некоторым данным, более высокой чувствительностью, чем радиоиммуноанализ [51].
Первая коммерческая тест-система (ASPIRINcheck® by Esoterix Inc., Austin, TX, USA) была основана на иммунофермент-ном анализе с использованием кроличьих поликлональных первичных антител против 11-дегидротромбоксана В2 с последующей нормализацией значений по концентрации креатинина в моче. На смену ей пришла тест-система второго поколения (AspirinWorksTest® by Corgenix Medical Corp., Broomfield, CO, USA), основанная на иммуно-ферментном анализе с использованием мышиных моноклональных первичных антител против 11-дегидротромбоксана В2 [6, 51, 52].
Средний уровень 11-дегидротромбокса-на В2, измеренный с использованием моноклональных антител, выше по сравнению с результатом, полученным при применении поликлональных антител [856 vs. 399 пг/мг креатинина]. Это расхождение обусловлено преимущественно перекрёстной реактивностью моноклонального антитела с 11-деги-дро-2,3-динор-тромбоксаном B2 [51].
Иммуноферментный анализ имеет значительные преимущества перед классическим радиоиммуноанализом. К ним относятся, прежде всего, возможность выполнения в полуавтоматическом режиме, отсутствие сложностей, связанных с необходимостью работы с радиоактивными веществами, и высокая чувствительность [35]. Следовательно, измерение 11-дегидротромбоксана B2 в образцах мочи с помощью иммуноферментного анализа является наиболее удобным методом количественной оценки системной генерации тромбоксана А2.
В целом, независимо от используемого метода, неинвазивное измерение экскреции метаболитов тромбоксана с мочой обеспечивает биохимическое доказательство тромбок-сан-зависимой активации тромбоцитов, что позволяет избежать артефактов, связанных с активацией тромбоцитов во время и после забора крови [35].
Повышение концентрации 11-деги-дротромбоксана В2 (стабильного и неактив-
Таблица 1
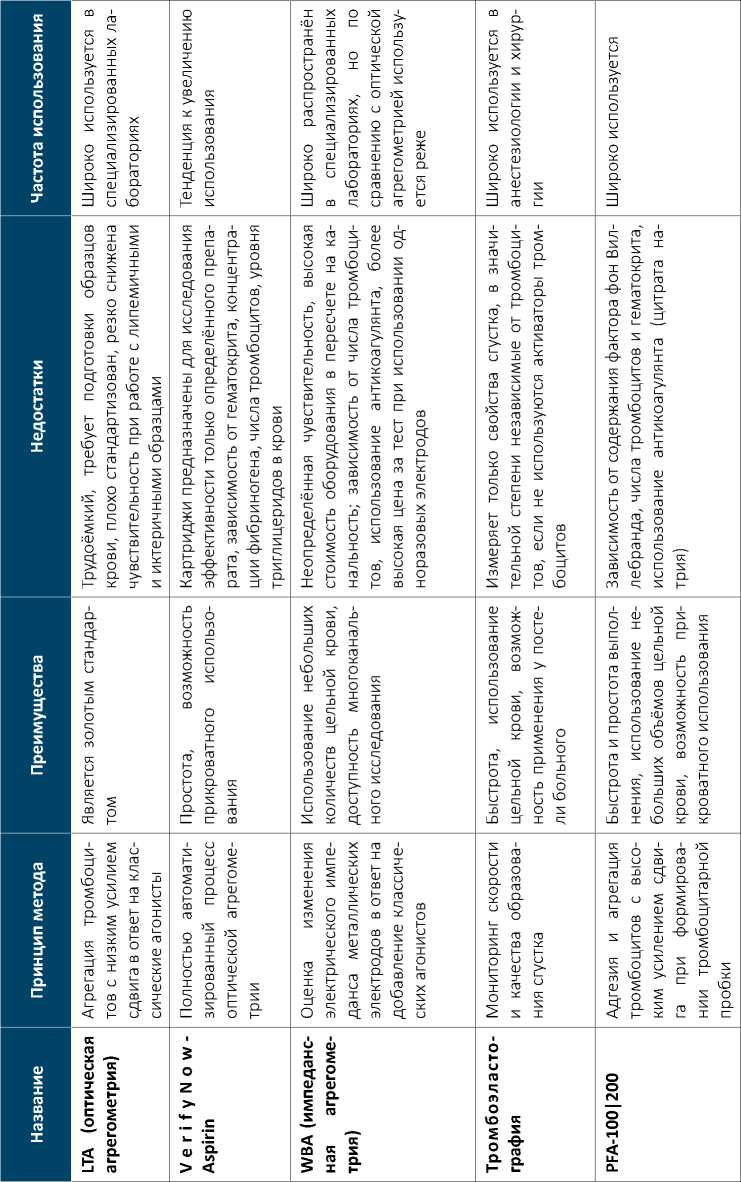
ного метаболита тромбоксана А2) на фоне терапии аспирином свидетельствует о продолжающейся продукции тромбоксана тромбоцитами и ассоциировано с повышенным риском сердечно-сосудистых событий [5].
Факторы, ассоциированные с высокими концентрациями 11-дегидротромбокса-на В2 в моче. Увеличение возраста, принадлежность к женскому полу, заболевания периферических артерий в анамнезе, курение, применение ингибиторов ангиотензин-превращающего фермента и пероральных сахароснижающих препаратов ассоциированы с высокими концентрациями 11-деги-дротромбоксана В2 в моче, в то время как применение аспирина в дозе 150 мг/сутки и более, лечение нестероидными противовоспалительными средствами, длительное лечение статинами, наоборот, ассоциированы с более низкими концентрациями [53].
Существующие данные о том, что женский пол является предиктором повышенной концентрации 11-дегидротромбоксана В2 в моче, что косвенно отражает усиление активации тромбоцитов in vivo, согласуются с данными о том, что реактивность тромбоцитов на фоне терапии аспирином у женщин выше, чем у мужчин. При этом предполагается, что менопауза, прием оральных контрацептивов или заместительная гормональная терапия эстрогенами оказывают минимальный эффект на изменение реактивности тромбоцитов [54].
Усиленное перекисное окисление липидов и активация тромбоцитов при ожирении обусловлены действием медиаторов воспаления, уровень которых коррелирует с выраженностью абдоминального ожирения [55]. Висцеральное ожирение у женщин ассоциировано с высокими концентрациями 11-дегидротромбоксана В2 и 8-изо-PGF2α в моче, при этом у женщин с гиноидным ожирением концентрации этих веществ в моче существенно ниже [55, 56].
Повышенный уровень холестерина липопротеинов низкой плотности (ЛПНП) представляет собой один из наиболее важных факторов риска сердечно-сосудистой заболеваемости и смертности. Гиперхолестеринемия ассоциирована с гиперкоагуляцией, что подтверждается высокой скоростью образования тромбина и повышенными уровнями фибриногена и фактора VIIc, находящимися в прямой корреляции с уровнем холестерина ЛПНП. Кроме того, в условиях гиперхолестеринемии подавляется экспрессия NO-синтазы и снижается продукция NO, что приводит к эндотелиальной дисфункции и повышению экспрессии молекул адгезии [57]. Однако основным звеном патогенеза протромботического состояния, характерного для пациентов с нарушениями липидного обмена, вероятно, является активация тромбоцитов. Высокая концентрация холестерина ЛПНП ассоциирована с повышением плотности α2-адренорецепто-ров на поверхности тромбоцитов, изменением содержания фосфолипидов и холестерина в их мембране, а также с увеличением концентрации кальция в цитоплазме [57].
Гиперреактивность тромбоцитов при гиперлипидемии также связана с повышенной чувствительностью к некоторым физиологическим агонистам, например, к тромбину, что опосредуется связыванием апоВ-100 с рецептором на мембране тромбоцита. При этом повышение концентрации 11-дегидротром-боксана В2 в моче может быть связано с усиленным биосинтезом тромбоксана А2 тромбоцитами [58].
Гипергомоцистеинемия вследствие гомозиготного дефицита цистатионин-β-синта-зы (CBS) характеризуется высокой частотой ранних атеротромботических сосудистых заболеваний [59]. Экскреция 11-дегидротром-боксана B2 с мочой у пациентов с дефицитом цистатионин-β-синтазы значительно выше, чем в общей популяции, независимо от наличия других факторов риска сердечно-сосудистых заболеваний или атеросклеротического поражения сосудов [59].
Полиморфизм гена метилтетрагидрофола-тредуктазы C677T (MTHFR+) является наиболее частой наследственной причиной лёгкой и умеренной гипергомоцистеинемии [60]. Замена аланина на валин в 222 позиции кодируемого белка в случае гомозиготности (MTHFR +/+) приводит к выработке термолабильной формы фермента с резко сниженной каталитической активностью и, как следствие, к повышению сывороточной концентрации гомоцистеина, однако примерно у 50% носителей (MTHFR +/+) гипергомоцистеинемия не проявляется [61]. Инсерция 68 пар нуклеотидов в позицию 844 в гене СBS (СBSins+) является достаточно распространённым полиморфизмом в некоторых странах (около 7% в Италии, несколько выше – в США и Северной Европе). Сама по себе она мало влияет на уровень гомоцистеина в плазме крови, однако может усиливать гипергомоцистеине-мию у носителей гомозиготной мутации гена MTHFR [60, 62]. Считается, что окислительные модификации липидов клеточной мембраны и циркулирующих липопротеинов, вызванные активными формами кислорода, играют ключевую роль в тромбогенных и атерогенных механизмах, ассоциированных с гомоцистеином [60]. В исследовании M.N. DiMinno et al. концентрация 11-дегидротромбоксана В2 в моче при проведении нагрузочного теста с метионином в дозе 100 мг/кг была сопоставима при всех вариантах генотипа (MTHFR–/ CBSins–, MTHFR–/CBSins+, MTHFR+/CBSin– и MTHFR+/CBSins+), при этом достижение максимального уровня метаболита в моче происходило после 4 часов с момента введения метионина; кроме того, у лиц с более высокой базальной концентрацией 11-деги-дротромбоксана В2 в моче наблюдались более высокие концентрации метаболита через 4 и 8 часов после введения метионина [60]. Ги-пергомоцистеинемия, связанная с наличием полиморфизма гена MTHFRC677Т (MTHFR+/+), ассоциирована с повышением концентрации 11-дегидротромбоксана В2 в моче [61], одновременно с этим являясь одним из факторов риска развития ишемической болезни сердца, особенно в условиях дефицита фолиевой кислоты [63].
Постпрандиальная гипергликемия является фактором риска сердечно-сосудистых осложнений сахарного диабета 2 типа. Механизмы, посредством которых изменения гликемии в постпрандиальном периоде усиливают активацию тромбоцитов, могут включать оксида-тивный стресс и эндотелиальную дисфункцию [35, 64]. Пиковое повышение уровня глюкозы в крови стимулирует биосинтез тромбоксана А2, что согласуется с данными о повышении концентрации 11-дегидротромбоксана В2 в моче на фоне острой кратковременной гипергликемии у больных сахарным диабетом 2 типа [35, 65]. Острая гипергликемия вызывает активацию тромбоцитов в условиях высокого напряжения сдвига, что отражается в резком увеличении экскреции с мочой 11-дегидротромбоксана B2 [35, 66].
Хотя повышенный риск сердечно-сосудистых заболеваний характерен для сахарного диабета как 1 типа, так и 2 типа, патофизиология раннего атеротромбоза при сахарном диабете 1 типа менее понятна [35, 67]. Так, биосинтез тромбоксана А2 у больных сахарным диабетом 1 типа происходит более интенсивно по сравнению со здоровыми людьми, при этом у женщин с сахарным диабетом 1 типа концентрации 11-дегидротромбоксана В2 в моче выше, чем у мужчин. Микроальбуминурия является независимым предиктором высоких концентраций 11-дегидротромбок-сана В2 в моче при сахарном диабете 1 типа [35, 68].
В исследовании Santilli et al., сравнившем тромбоксан-зависимую активацию тромбоцитов в трёх группах (при нарушении толерантности к глюкозе, сахарном диабете, диагностированном менее 12 месяцев, и сахарном диабете, диагностированном 12 месяцев назад и более), получены данные о повышенной экскреции 11-дегидротромбоксана В2 с мочой во всех трёх группах, при этом концентрации 11-дегидротромбоксана В2 были сопоставимы у пациентов с нарушением толерантности к глюкозе и сахарным диабетом 2 типа вне зависимости от продолжительности заболевания [69]. Кроме того, наблюдение за пациентами в течение 36 месяцев показало, что для больных с нарушением толерантности к глюкозе было характерно более выраженное повышение концентрации метаболитов тромбоксана в моче в динамике по сравнению с больными сахарным диабетом, даже при исключении влияния демографических, антропометрических и лабораторных факторов (уровень гликемии натощак, HbA1c, инсулин и количество тромбоцитов) [69]. Уровень 11-дегидротромбоксана В2 в моче, который оценивался в начале исследования и в течение длительного периода наблюдения, не был взаимосвязан с гликемическим контролем и колебаниями концентрации глюкозы ни в одной из исследуемых групп. Не наблюдалось никакой связи между экскрецией 11-дегидротромбоксана В2 и 2-часовыми вариациями глюкозы после еды, что, таким образом, свидетельствует против гипотезы о влиянии пикового повышения концентрации глюкозы на биосинтез тромбоксана A2 тромбоцитами [69].
У пациентов с эссенциальной гипертензией уровень 11-дегидротромбоксана В2 в моче выше, чем у пациентов с нормальным артериальным давлением [70]. Также было показано, что повышенная экскреция 11-деги-дротромбоксана В2 наблюдается у пациентов с длительно существующей гипертонической ретинопатией [71]. Как и при сахарном диабете, микроальбуминурия при гипертензии является фактором, ассоциированным с высокими концентрациями метаболитов тромбоксана [72].
Курение сигарет является доказанным фактором риска атеросклероза аорты и периферических артерий, который лежит в основе развития ишемической болезни сердца, цереброваскулярной болезни и других сердечно-сосудистых заболеваний [35]. Механизмы индуцированных курением сердечно-сосудистых заболеваний многочисленны и включают развитие эндотелиальной дисфункции, нерегулируемого провоспалительного ответа и оксидативного стресса [35]. Курение сигарет может повышать риск инфекций и стимулировать высвобождение гистамина из тучных клеток [73]. Компоненты сигаретного дыма также стимулируют образование активных форм кислорода, провоспалительных цитокинов и экспрессию гена ЦОГ-2 в клетках эндотелия, усиливая процессы ремоделирования сосудов [74, 75]. Было показано, что концентрация 11-дегидротромбоксана В2 в моче у курящих пациентов примерно на 40% выше по сравнению с людьми, которые никогда не курили, что, вероятно, обусловлено совокупностью вышеописанных неблагоприятных эффектов сигаретного дыма [76]. В исследовании D. Oliveri et al. оценивали ряд маркеров потенциального вреда, относящихся к заболеваниям, ассоциированным с курением обычных сигарет и электронных сигарет, при этом 11-дегидротромбоксан В2 был выбран как биомаркер, связанный с активацией тромбоцитов. В ходе исследования было показано, что у людей, использующих электронные сигареты, уровень 11-дегидротром-боксана В2 был на 29% ниже, чем у курящих обычные сигареты [77].
Высокие концентрации метаболитов тромбоксана А2 в моче наблюдаются у пациентов с эссенциальной тромбоцитемией (ЭТ) и истинной полицитемией (ИП), не получающих терапию. Так, концентрации 11-дегидротром-боксана В2 в моче у пациентов с истинной полицитемией и эссенциальной тромбоците-мией без лечения сопоставимы с концентрациями этого метаболита при нестабильной стенокардии. В то же время они выше, чем при других состояниях, характеризующихся высоким риском сердечно-сосудистых осложнений (висцеральное ожирение, сахарный диабет 2 типа, транзиторная ишемическая атака, ишемический инсульт, стабильная ИБС и т.д.) [42-44]. Следует отметить, что острый коронарный синдром является самым часто встречающимся артериальным тромботическим событием до постановки диагноза ИП [78]. В целом, риск артериальных и веноз- ных тромбозов составляет при ИП от 1,1% до 4,9%, при ЭТ – от 1,3% до 6,6% в год, инфаркта миокарда при ИП– от 0,1% при применении аспирина до 0,9% в год без приёма антиагре-гантов, при ЭТ – от 0,3% до 1% в год, ишемического инсульта при ИП – 0,2-1% в год, при ЭТ – 0,4-0,6%, смерти от сердечно-сосудистых осложнений при ИП – 0,43-0,72%, при ЭТ – до 0,47% [42, 78-81].
Хронический воспалительный процесс, возникающий при аутоиммунных заболеваниях, также усиливает биосинтез тромбоксана А2 и является одним из звеньев развития ате-ротромбоза. Так, установлено, что повышенная экскреция 11-дегидротромбоксана B2 характерна для пациентов с ревматоидным артритом [82], системной красной волчанкой и наличием антифосфолипидных антител [83] и больных с воспалительными заболеваниями кишечника [84]. При этом показано, что пациенты с воспалительными заболеваниями кишечника, у которых экскреция 11-деги-дротромбоксана В2 в моче превышает 2000 пг/мг креатинина, имеют также и более высокие показатели активности воспалительного процесса [84].
Влияние терапевтических воздействий на уровень 11-дегидротромбоксана В2 в моче. Ядросодержащие клетки, такие как моноциты и клетки эндотелия сосудов, могут обеспечивать тромбоциты простагландином Н2, тем самым обходя тромбоцитарную ЦОГ-1, или могут использовать простагландин Н2 для синтеза собственного тромбоксана А2, поскольку в них также продуцируется тромбоксан-синта-за [85]. Арахидоновая кислота преобразуется в простагландин Н2 в реакции, катализируемой ЦОГ-1 и ЦОГ-2. Низкие дозы ацетилсалициловой кислоты ингибируют тромбоцитарную ЦОГ-1 на весь период жизни тромбоцита, но ядросодержащие клетки могут восстанавливать синтез ЦОГ-1. Вследствие этого ядросодержащие клетки могут являться источниками простагландина H2 даже при лечении низкими дозами аспирина, также они могут синтезировать простагландин Н2, используя ЦОГ-2 [85].
В то время как ЦОГ-1 блокируется по меньшей мере на 95% при терапии низкими дозами аспирина, ингибирование ЦОГ-2 происходит при применении более высоких доз или лечении НПВП, обладающими способностью ингибировать ЦОГ-2. Впрочем, не существует доказательств, что снижение концентрации 11-дегидротромбоксана В2 в моче с помощью более высоких доз аспирина позволяет уменьшить риск сердечно-сосудистых событий. Ингибирование ЦОГ-2 приводит также к снижению синтеза простациклина эндотелиальными клетками и оказывает неблагоприятное влияние на артериальное давление и функцию почек, что может объяснить, почему и неселективные, и ЦОГ-2-селективные НПВП повышают риск сердечно-сосудистых событий [86-89].
Следует учитывать, что при снижении концентрации 11-дегидротромбоксана В2 в моче, достигнутом применением высоких доз ацетилсалициловой кислоты, потенциальная польза терапии может быть нивелирована увеличением риска кровотечений. При этом нет доказательств того, что повышение дозы аспирина позволит существенно снизить сердечно-сосудистый риск [90]. Кроме того, корреляции между уровнем 11-дегидротром-боксана В2 в моче и риском развития кровотечений не выявлено [53].
Механизм снижения концентрации 11-де-гидротромбоксана В2 в моче у пациентов, принимающих статины, не вполне ясен, но, возможно, этот эффект статинов опосредуется их влиянием на эндотелиальные клетки, а именно на синтез в них изопреноидов, которые являются субстратами для посттрансляционной модификации многочисленных внутриклеточных белков, включая ГТФ-связывающие белки [57, 58]. Влияние статинов на функции тромбоцитов может осуществляться и через активацию эндотелиальной NO-синтазы, что приводит к увеличению концентрации NO, продукция которого подавляет экспрессию тканевого фактора в эндотелиальных клетках. Уменьшение экспрессии тканевого фактора на фоне приёма статинов в свою очередь снижает образование тромбина, сильного агониста агрегации тромбоцитов. Также антитромбоцитарная активность статинов может быть связана с уменьшением содержания холестерина в мембране тромбоцитов [58].
В исследовании Notarbartolo et al. лечение симвастатином в дозе, снижающей уровень холестерина ЛПНП на 30-40% у пациентов с гиперхолестеринемией IIa типа, привело к нормализации повышенной агрегации тромбоцитов ex vivo и снижению экскреции 11-дегидротромбоксана В2 с мочой на 50% по сравнению с плацебо, при этом изменение экскреции коррелировало со снижением общего холестерина, холестерина ЛПНП и аполипопротеина В [58].
В группе женщин с нарушением чувствительности к инсулину на фоне висцерального ожирения улучшение чувствительности к инсулину, достигнутое с помощью трёхнедельного применения пиоглитазиона, было ассоциировано со значимым снижением концентрации 11-дегидротромбоксана В2 в моче без изменения массы тела. Эти данные подтверждают гипотезу о том, что резистентность к инсулину является основной детерминантой активации тромбоцитов при ожирении у женщин [56].
У женщин с ожирением наблюдалось статистически значимое снижение уровня 11-дегидротромбоксана В2 после успешного снижения массы тела на фоне 12-недельной диетотерапии со среднесуточной калорийностью рациона менее 1200 ккал [55, 56].
У пациентов с ожирением, перенесших лапароскопическое регулируемое бандажи-рование желудка, спустя 6 и 12 месяцев после оперативного вмешательства отмечалось снижение концентрации 11-дегидротромбок-сана В2 в моче с 1443 до 715 и 564 пг/мг креатинина, соответственно [91].
Прогностическое значение уровня 11-де-гидротромбоксана В2. Учитывая стабильность экскреции 11-дегидротромбоксана В2
с мочой при сахарном диабете, этот неинвазивный биомаркер активации тромбоцитов представляется подходящим для тестирования в качестве предиктора сосудистых событий в течение длительного периода наблюдения в этой клинической группе [69].
В исследовании McCullough et al. было обнаружено, что риск смерти пациентов со стабильной ИБС увеличивался пропорционально повышению концентрации 11-дегидротром-боксана В2 в моче, даже после исключения влияния возраста, функции почек, фракции выброса левого желудочка и сопутствующих заболеваний [92].
В исследовании CHARISMA (The Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance), пациенты, принимавшие аспирин в дозе 150 мг в сутки и более, имели более низкие концентрации 11-дегидротромбоксана В2 в моче, чем пациенты, принимавшие менее 100 мг в сутки или принимавшие от 100 до 149 мг в сутки, однако существенных различий между двумя группами с более низкими дозами аспирина обнаружено не было.
Концентрации 11-дегидротромбоксана В2 в пределах верхнего квартиля у пациентов с высоким риском сердечно-сосудистых событий, получавших аспирин в дозировках от 75 до 162 мг/сутки, были ассоциированы с повышением вероятности развития сердечно-сосудистых событий (инфаркт миокарда, инсульт, смерть от сердечно-сосудистых заболеваний).
Применение аспирина совместно с клопи-догрелем не приводило к снижению концентрации 11-дегидротромбоксана В2 в моче по сравнению с применением аспирина совместно с плацебо и не уменьшало риск возникновения сердечно-сосудистых событий у пациентов с высокими концентрациями 11-дегидротромбоксана В2 в моче [53].
В исследовании LTIMI (Leukotrienes and Thromboxane In Myocardial Infarction) у пациентов с наиболее выраженным снижением фракции выброса левого желудочка (<30%) во время острого инфаркта миокарда вы- являлись наиболее высокие концентрации 11-дегидротромбоксана В2 в моче. Уровень 11-дегидротромбоксана В2 в моче при поступлении также был предиктором фракции выброса левого желудочка (ФВЛЖ) у пациентов при обследовании через 1 год: концентрация биомаркера в моче была выше у пациентов с сниженной ФВЛЖ по сравнению с теми, кто имел нормальные значения данного показателя. При этом уровни 11-деги-дротромбоксана В2 в образцах мочи, взятых через 1 месяц и через 1 год после острого инфаркта миокарда с ФВЛЖ не коррелировали. Кроме того, высокие концентрации 11-деги-дротромбоксана В2 в моче при поступлении в стационар были ассоциированы с высокой кумулятивной частотой сердечно-сосудистых событий за 1 год наблюдения [93].
Заключение. На сегодняшний день понятия резистентности к аспирину, неэффективности лечения аспирином и невосприимчивости к нему активно обсуждаются в научной литературе и не имеют общепринятых опреде-
ЛИТЕРАТУРА лений. Известны многочисленные факторы риска, способствующие развитию резистентности, но их клиническое значение требует дальнейшего исследования.
Данные о распространённости резистентности к терапии аспирином противоречивы в связи с неоднородностью клинических групп, используемых лабораторных методов и критериев диагностики, поэтому актуальным вопросом остаётся изучение сопоставимости результатов различных методов, используемых для оценки тромбоксан-зависимой функции тромбоцитов, а также стандартизация методов и критериев диагностики.
Результаты клинических исследований показывают, что уровень 11-дегидротромбокса-на В2 в моче обладает самостоятельным прогностическим значением в отношении риска сердечно-сосудистых событий, что позволяет предполагать возможность использования данного маркера для стратификации риска и разработки персонализированных подходов к антиагрегантной терапии.
-
1. Antithrombotic Trialists’ (ATT) Collaboration, Baigent C, Blackwell L, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials . Lancet. 2009 ;373(9678):1849-1860. DOI: 10.1016/S0140-6736(09)60503-1.
-
2. Gaziano JM, Brotons C, Coppolecchia R, et al. Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial . Lancet. 2018 ;392(10152):1036-1046. DOI: 10.1016/S0140-6736(18)31924-X.
-
3. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients . BMJ. 2002;324(7329):71-86. DOI: 10.1136/bmj.324.7329.71.
-
4. Christiansen M, Grove EL, Hvas AM. Primary Prevention of Cardiovascular Events with Aspirin: Toward More Harm than Benefit-A Systematic Review and Meta-Analysis . Semin Thromb Hemost. 2019 ;45(5):478-489. DOI: 10.1055/s-0039-1687905.
-
5. Eikelboom JW, Hirsh J, Weitz JI, et al. Aspirin-resistant thromboxane biosynthesis and the risk of myocardial infarction, stroke, or cardiovascular death in patients at high risk for cardiovascular events. Circulation. 2002 ;105(14):1650-1655. DOI: 10.1161/01.CIR.0000013777.21160.07.
-
6. Awtry EH, Loscalzo J. Aspirin . Circulation. 2000 ;101(10):1206-1218. DOI: 10.1161/01.cir.101.10.1206.
-
7. Hankey GJ, Eikelboom JW. Aspirin resistance. Lancet. 2006 ;367(9510):606-617. DOI: 10.1016/s0140-6736(06)68040-9.
-
8. Bhatt DL, Topol EJ. Scientific and therapeutic advances in antiplatelet therapy . Nat. Rev. Drug Discov. 2003 ; 2:15-28. DOI: 10.1038/nrd985.
-
9. Weber AA, Przytulski B, Schanz A, et al. Towards a definition of aspirin resistance: a typological approach . Platelets. 2002 ;13(1):37-40. DOI: 10.1080/09537100120104890.
-
10. Floyd CN, Ferro A. Mechanisms of aspirin resistance . Pharmacol Ther. 2014 ;141(1):69-78. DOI: 10.1016/j. pharmthera.2013.08.005.
-
11. Schwartz KA. Aspirin resistance: a clinical review focused on the most common cause, noncompliance . Neurohospitalist. 2011 ;1(2):94-103. DOI: 10.1177/1941875210395776.
-
12. Hally KE, La Flamme AC, Larsen PD, Harding SA. Platelet Toll-like receptor (TLR) expression and TLR-mediated platelet activation in acute myocardial infarction . Thromb Res. 2017 ;158:8-15. DOI: 10.1016/j. thromres.2017.07.031.
-
13. Cambria-Kiely JA, Gandhi PJ. Aspirin resistance and genetic polymorphisms . J Thromb Thrombolysis. 2002 ;14(1):51-58. DOI: 10.1023/a:1022066305399.
-
14. O’Donnell CJ, Larson MG, Feng D, et al. Genetic and environmental contributions to platelet aggregation: the Framingham heart study . Circulation. 2001 ;103(25):3051-3056. DOI: 10.1161/01.cir.103.25.3051.
-
15. Li Q, Chen BL, Ozdemir V, et al. Frequency of genetic polymorphisms of COX1, GPIIIa and P2Y1 in a Chinese population and association with attenuated response to aspirin . Pharmacogenomics. 2007 ;8(6):577-586. DOI: 10.2217/14622416.8.6.577.
-
16. Goodman T, Ferro A, Sharma P. Pharmacogenetics of aspirin resistance: a comprehensive systematic review . Br J Clin Pharmacol. 2008 ;66(2):222-232. DOI: 10.1111/j.1365-2125.2008.03183.x
-
17. Würtz M, Kristensen SD, Hvas AM, et al. Pharmacogenetics of the antiplatelet effect of aspirin . Curr Pharm Des. 2012 ;18(33):5294-5308. DOI: 10.2174/138161212803251907.
-
18. Weng Z, Li X, Li Y, et al. The association of four common polymorphisms from four candidate genes (COX-1, COX-2, ITGA2B, ITGA2) with aspirin insensitivity: a meta-analysis . PLoS One. 2013 ;8(11):e78093. DOI: 10.1371/journal.pone.0078093.
-
19. Patrignani P, Tacconelli S, Bruno A, et al. Managing the adverse effects of nonsteroidal anti-inflammatory drugs . Expert Rev Clin Pharmacol. 2011 ;4(5):605-621. DOI: 10.1586/ecp.11.36.
-
20. Gengo FM, Rubin L, Robson M, et al. Effects of Ibuprofen on the Magnitude and Duration of Aspirin’s Inhibition of Platelet Aggregation: Clinical Consequences in Stroke Prophylaxis . J Clin Pharmacol. 2008 ;48: 117-122. DOI: 10.1177/0091270007310379.
-
21. Greig GM, Francis DA, Falgueyret JP, et al. The interaction of arginine 106 of human prostaglandin G/H synthase-2 with inhibitors is not a universal component of inhibition mediated by nonsteroidal antiinflammatory drugs . Mol Pharmacol. 1997 ;52(5):829-838. DOI: 10.1124/mol.52.5.829.
-
22. Angiolillo DJ, Weisman SM. Clinical Pharmacology and Cardiovascular Safety of Naproxen . Am J Cardiovasc Drugs. 2017 ;17(2):97-107. DOI: 10.1007/s40256-016-0200-5.
-
23. Elliott MA. The Aspirin-NSAID Interaction: More Data, But a Lack of Clarity Remains . J Am Coll Cardiol. 2018 ; 71(16):1752-1754 DOI: 10.1016/j.jacc.2018.02.034.
-
24. Rainsford KD. Ibuprofen: pharmacology, efficacy and safety . Inflammopharmacol. 2009 ;17:275-342 DOI: 10.1007/s10787-009-0016-x.
-
25. MacDonald TM, Wei L. Is there an Interaction between the Cardiovascular Protective Effects of Low-Dose Aspirin and Ibuprofen? Basic Clin Pharmacol Toxicol. 2006 ;98:275-280. DOI: 10.1111/j.1742-7843.2006. pto_371.x.
-
26. Catella-Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin . N Engl J Med. 2001 ;345:1809-17. DOI: 10.1056/NEJMoa003199.
-
27. Poorani R, Bhatt AN, Dwarakanath BS, et al. COX-2, aspirin and metabolism of arachidonic, eicosapentaenoic and docosahexaenoic acids and their physiological and clinical significance . Eur J Pharmacol. 2016 ;785:116-132. DOI: 10.1016/j.ejphar.2015.08.049.
-
28. Charlot M, Grove EL, Hansen PR, et al. Proton pump inhibitor use and risk of adverse cardiovascular events
in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study . BMJ. 2011 ;342:d2690. DOI: 10.1136/bmj.d2690.
-
29. Giraud MN, Sanduja SK, Felder TB, et al. Effect of omeprazole on the bioavailability of unmodified and phospholipid-complexed aspirin in rats . Aliment Pharmacol Ther. 1997 ;11:899-906. DOI: 10.1046/j.1365-2036.1997.00216.x.
-
30. Bhatt DL, Grosser T, Dong JF, et al. Enteric Coating and Aspirin Nonresponsiveness in Patients With Type 2 Diabetes Mellitus . J Am Coll Cardiol. 2017 ;69(6):603-612. DOI: 10.1016/j.jacc.2016.11.050.
-
31. Haastrup PF, Grønlykke T, Jarbøl DE. Enteric coating can lead to reduced antiplatelet effect of low-dose acetylsalicylic acid . Basic Clin Pharmacol Toxicol. 2015 ;116(3):212-215. DOI: 10.1111/bcpt.12362.
-
32. Cox D, Fitzgerald DJ. Lack of Bioequivalence Among Low-dose, Enteric-coated Aspirin Preparations . Clin. Pharmacol Ther. 2018 ;103(6):1047-1051. DOI: 10.1002/cpt.874.
-
33. Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies . Cardiovasc Diabetol. 2018 ;17(1):121. DOI: 10.1186/s12933-018-0763-3.
-
34. Ferretti G, Rabini RA, Bacchetti T, et al. Glycated low-density lipoproteins modify platelet properties: a compositional and functional study . J Clin Endocrinol Metab. 2002 ;87:2180-4. DOI: 10.1210/jcem.87.5.8466.
-
35. Simeone P, Boccatonda A, Liani R, Santilli F. Significance of urinary 11-dehydro-thromboxane B2 in age-related diseases: Focus on atherothrombosis . Ageing Res Rev. 2018 ;48:51-78. DOI: 10.1016/j.arr.2018.09.004.
-
36. Knebel SM, Sprague RS, Stephenson AH. Prostacyclin receptor expression on platelets of humans with type 2 diabetes is inversely correlated with hemoglobin A1c levels . Prostaglandins Other Lipid Mediat. 2015 ;116-117:131-135. DOI: 10.1016/j.prostaglandins.2014.12.002.
-
37. Koch KL, Calles-Escandón J. Diabetic Gastroparesis . Gastroenterol Clin North Am. 2015 ;44(1):39-57. DOI: 10.1016/j.gtc.2014.11.005.
-
38. Vanormelingen C, Tack J, Andrews CN. Diabetic gastroparesis . Br Med Bull. 2013 ;105:213-230. DOI: 10.1093/bmb/ldt003
-
39. Patrono C, Rocca B. Measurement of Thromboxane Biosynthesis in Health and Disease . Front Pharmacol. 2019 ;10:1244. DOI: 10.3389/fphar.2019.01244.
-
40. Rocca B, Fox KAA, Ajjan RA, et al. Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis . Eur Heart J. 2018 ;39(19):1672-1686f. DOI: 10.1093/eurheartj/ehy066.
-
41. Rothwell PM, Cook NR, Gaziano JM, et al. Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials . Lancet. 2018 ;392(10145):387-399. DOI: 10.1016/S0140-6736(18)31133-4.
-
42. Patrono C, Rocca B, De Stefano V. Platelet activation and inhibition in polycythemia vera and essential thrombocythemia . Blood. 2013 ;121 (10):1701-1711. DOI: 10.1182/blood-2012-10-429134.
-
43. Arellano-Rodrigo E, Alvarez-Larrán A, Reverter JC, et al. Platelet turnover, coagulation factors, and soluble markers of platelet and endothelial activation in essential thrombocythemia: relationship with thrombosis occurrence and JAK2 V617F allele burden . Am J Hematol. 2009 ;84(2):102-108. DOI: 10.1002/ajh.21338.
-
44. Pascale S, Petrucci G, Dragani A, et al. Aspirin-insensitive thromboxane biosynthesis in essential thrombocythemia is explained by accelerated renewal of the drug target . Blood. 2012 ;119(15):3595-3603. DOI: 10.1182/blood-2011-06-359224.
-
45. Lordkipanidzé M. Platelet Function Tests . Semin Thromb Hemost. 2016 ;42(03):258-267. DOI: 10.1055/s-0035-1564834.
-
46. Nurden AT. Platelets, inflammation and tissue regeneration . Thromb Haemost. 2011 ;105 Suppl 1:S13-S33 DOI: 10.1160/THS10-11-0720.
-
47. McFadyen JD, Kaplan ZS. Platelets are not just for clots . Transfus Med Rev. 2015 ;29(2):110-119 DOI: 10.1016/j.tmrv.2014.11.006.
-
48. Hvas AM, Grove EL. Platelet Function Tests: Preanalytical Variables, Clinical Utility, Advantages, and Disadvantages . Methods Mol Biol. 2017 ;1646:305-320 DOI: 10.1007/978-1-4939-7196-1_24.
-
49. Gawaz M, Langer H, May AE. Platelets in inflammation and atherogenesis . J Clin Invest. 2005 ;115(12):3378-3384 DOI: 10.1172/JCI27196.
-
50. Roberts LJ 2nd, Sweetman BJ, Oates JA. Metabolism of thromboxane B2 in man. Identification of twenty urinary metabolites . J Biol Chem. 1981 ;256(16):8384-93. PMID: 7263660.
-
51. Olson MT, Kickler TS, Lawson JA, et al. Effect of assay specificity on the association of urine 11-dehydro thromboxane B2 determination with cardiovascular risk . J Thromb Haemost. 2012 ;10(12):2462-2469. DOI: 10.1111/jth.12026.
-
52. Geske FJ, Guyer KE, Ens G. AspirinWorks: a new immunologic diagnostic test for monitoring aspirin effect . Mol Diagn Ther. 2008 ;12(1):51-54. DOI: 10.1007/BF03256268.
-
53. Eikelboom JW, Hankey GJ, Thom J, et al. Incomplete inhibition of thromboxane biosynthesis by acetylsalicylic acid: determinants and effect on cardiovascular risk . Circulation. 2008 ;118(17):1705-1712. DOI: 10.1161/ CIRCULATIONAHA.108.768283.
-
54. Becker DM, Segal J, Vaidya D, et al. Sex Differences in Platelet Reactivity and Response to Low-Dose Aspirin Therapy . JAMA. 2006 ;295(12):1420-1427. DOI: 10.1001/jama.295.12.1420.
-
55. Davì G, Guagnano MT, Ciabattoni G, et al. Platelet activation in obese women: role of inflammation and oxidant stress . JAMA. 2002 ;288(16):2008-2014. DOI: 10.1001/jama.288.16.2008.
-
56. Basili S, Pacini G, Guagnano MT, et al. Insulin resistance as a determinant of platelet activation in obese women . J Am Coll Cardiol. 2006 ;48(12):2531-2538. DOI: 10.1016/j.jacc.2006.08.040.
-
57. Ferroni P, Basili S, Santilli F, Davì G. Low-density lipoprotein-lowering medication and platelet function . Pathophysiol Haemost Thromb. 2006 ;35(3-4):346-354. DOI: 10.1159/000093226.
-
58. Notarbartolo A, Davì G, Averna M, et al. Inhibition of thromboxane biosynthesis and platelet function by simvastatin in type IIa hypercholesterolemia . Arterioscler Thromb Vasc Biol. 1995 ;15(2):247-251. DOI: 10.1161/01.atv.15.2.247.
-
59. Dragani A, Falco A, Santilli F, et al. Oxidative stress and platelet activation in subjects with moderate hyperhomocysteinaemia due to MTHFR 677 C→T polymorphism . Thromb. Haemost 2012 ;108(09):533-542. DOI: 10.1160/th11-12-0899.
-
60. Di Minno MN, Pezzullo S, Palmieri V, et al. Genotype-independent in vivo oxidative stress following a methionine loading test: maximal platelet activation in subjects with early-onset thrombosis . Thromb Res. 2011 ;128(4):e43-e48. DOI: 10.1016/j.thromres.2011.05.017.
-
61. Abhinand PA, Manikandan M, Mahalakshmi R, Ragunath PK. Meta-analysis study to evaluate the association of MTHFR C677T polymorphism with risk of ischemic stroke . Bioinformation. 2017 ;13(6):214-219. DOI: 10.6026/97320630013214.
-
62. De Franchis R, Fermo I, Mazzola G, et al. Contribution of the cystathionine beta-synthase gene (844ins68) polymorphism to the risk of early-onset venous and arterial occlusive disease and of fasting hyperhomocysteinemia . Thromb Haemost. 2000 ;84(4):576-82. PMID: 11057853.
-
63. Klerk M, Verhoef P, Clarke R, et al. MTHFR 677C→T Polymorphism and Risk of Coronary Heart Disease: A Meta-analysis . JAMA. 2002 ;288(16):2023-2031. DOI: 10.1001/jama.288.16.2023.
-
64. Ferroni P, Basili S, Falco A, Davì G. Platelet activation in type 2 diabetes mellitus . J Thromb Haemost. 2004 ;2(8):1282-1291. DOI: 10.1111/j.1538-7836.2004.00836.x.
-
65. Ha H, Lee HB. Oxidative stress in diabetic nephropathy: basic and clinical information . Curr Diab Rep. 2001 ;1(3):282-287. DOI: 10.1007/s11892-001-0047-1.
-
66. Davì G, Ciabattoni G, Consoli A, et al. In vivo formation of 8-iso-prostaglandin f2alpha and platelet activation in diabetes mellitus: effects of improved metabolic control and vitamin E supplementation . Circulation. 1999 ;99(2):224-229. DOI: 10.1161/01.cir.99.2.224.
-
67. De Ferranti SD, de Boer IH, Fonseca V, et al. Type 1 diabetes mellitus and cardiovascular disease: a scientific statement from the American Heart Association and American Diabetes Association . Circulation. 2014 ;130(13):1110-1130. DOI: 10.1161/CIR.0000000000000034.
-
68. Zaccardi F, Rizzi A, Petrucci G, et al. In Vivo Platelet Activation and Aspirin Responsiveness in Type 1 Diabetes . Diabetes. 2016 ;65(2):503-509. DOI: 10.2337/db15-0936.
-
69. Santilli F, Zaccardi F, Liani R, et al. In vivo thromboxane-dependent platelet activation is persistently enhanced in subjects with impaired glucose tolerance . Diabetes Metab Res Rev. 2020 ;36(2):e3232. DOI: 10.1002/ dmrr.3232.
-
70. Dołegowska B, Błogowski W, Kedzierska K, et al. Platelets arachidonic acid metabolism in patients with essential hypertension . Platelets. 2009 ;20(4):242-249. DOI: 10.1080/09537100902849836.
-
71. Minuz P, Patrignani P, Gaino S, et al. Determinants of platelet activation in human essential hypertension . Hypertension. 2004 ;43(1):64-70. DOI: 10.1161/01.HYP.0000105109.44620.1B.
-
72. Guagnano MT, Ferroni P, Santilli F, et al. Determinants of platelet activation in hypertensives with microalbuminuria . Free Radic Biol Med. 2009 ;46(7):922-927. DOI: 10.1016/j.freeradbiomed.2009.01.005.
-
73. Barua RS, Sharma M, Dileepan KN. Cigarette Smoke Amplifies Inflammatory Response and Atherosclerosis Progression Through Activation of the H1R-TLR2/4-COX2 Axis . Front Immunol. 2015 ;6:572. DOI: 10.3389/ fimmu.2015.00572.
-
74. Barbieri SS, Zacchi E, Amadio P, et al. Cytokines present in smokers’ serum interact with smoke components to enhance endothelial dysfunction . Cardiovascular Research. 2011 ;90(3),475-483. DOI: 10.1093/cvr/cvr032.
-
75. Barbieri SS, Weksler BB. Tobacco smoke cooperates with interleukin-1beta to alter beta-catenin trafficking in vascular endothelium resulting in increased permeability and induction of cyclooxygenase-2 expression in vitro and in vivo . FASEB J. 2007 ;21(8):1831-1843. DOI: 10.1096/fj.06-7557com.
-
76. Lowe FJ, Gregg EO, McEwan M. Evaluation of biomarkers of exposure and potential harm in smokers, former smokers and never-smokers . Clin Chem Lab Med. 2009 ;47(3):311-320. DOI: 10.1515/cclm.2009.069.
-
77. Oliveri D, Liang Q, Sarkar M. Real-World Evidence of Differences in Biomarkers of Exposure to Select Harmful and Potentially Harmful Constituents and Biomarkers of Potential Harm between Adult E-Vapor Users and Adult Cigarette Smokers . Nicotine Tob Res. 2019 ;ntz185. DOI: 10.1093/ntr/ntz185.
-
78. Cerquozzi S, Barraco D, Lasho T, et al. Risk factors for arterial versus venous thrombosis in polycythemia vera: a single center experience in 587 patients . Blood Cancer J. 2017 ;7(12):662. DOI: 10.1038/s41408-017-0035-6.
-
79. Passamonti F, Rumi E, Pungolino E, et al. Life expectancy and prognostic factors for survival in patients with polycythemia vera and essential thrombocythemia . Am J Med. 2004 ;117(10):755-761. DOI: 10.1016/j. amjmed.2004.06.032.
-
80. Carobbio A, Thiele J, Passamonti F, et al. Risk factors for arterial and venous thrombosis in WHO-defined essential thrombocythemia: an international study of 891 patients . Blood. 2011 ;117(22):5857-5859. DOI: 10.1182/blood-2011-02-339002.
-
81. Marchioli R, Finazzi G, Landolfi R, et al. Vascular and neoplastic risk in a large cohort of patients with polycythemia vera . J Clin Oncol. 2005 ;23(10):2224-2232. DOI: 10.1200/JCO.2005.07.062.
-
82. Ferrante E, Vazzana N, Santilli F, et al. Determinants of thromboxane biosynthesis in rheumatoid arthritis: Role of RAGE and oxidant stress . Free Radic Biol Med. 2010 ;49(5):857-864. DOI: 10.1016/j. freeradbiomed.2010.06.009.
-
83. Ferro D, Basili S, Roccaforte S, et al. Determinants of enhanced thromboxane biosynthesis in patients with systemic lupus erythematosus . Arthritis Rheum. 1999 ;42(12):2689-2697. DOI: 10.1002/1529-0131(199912)42:12<2689::AID-ANR27>3.0.CO;2-X.
-
84. Di Sabatino A, Santilli F, Guerci M, et al. Oxidative stress and thromboxane-dependent platelet activation in inflammatory bowel disease: effects of anti-TNF-α treatment . Thromb Haemost. 2016 ;116(3):486-495. DOI: 10.1160/TH16-02-0167.
-
85. Maclouf J, Folco G, Patrono C. Eicosanoids and iso-eicosanoids: constitutive, inducible and transcellular biosynthesis in vascular disease . Thromb Haemost. 1998 ;79:691-705. PMID: 9569176.
-
86. Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors . JAMA. 2001 ;286(8):954-959. DOI: 10.1001/jama.286.8.954.
-
87. McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2 . JAMA. 2006 ; 296(13):1633-1644. DOI: 10.1001/jama.296.13.jrv60011.
-
88. Kearney PM, Baigent C, Godwin J, et al. Do selective cyclo-oxygenase-2 inhibitors and traditional nonsteroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials . BMJ. 2006 ;332(7553):1302-1308. DOI: 10.1136/bmj.332.7553.1302.
-
89. Bhatt DL. NSAIDS and the risk of myocardial infarction: do they help or harm? Eur Heart J. 2006 ; 27(14):1635-1636. DOI: 10.1093/eurheartj/ehl090.
-
90. Campbell CL, Smyth S, Montalescot G, Steinhubl SR. Aspirin Dose for the Prevention of Cardiovascular Disease: A Systematic Review . JAMA. 2007 ;297(18):2018-2024. DOI: 10.1001/jama.297.18.2018.
-
91. Santilli F, Guagnano MT, Innocenti P, et al. Pentraxin 3 and Platelet Activation in Obese Patients After Gastric Banding . Circ J. 2016 ;80(2):502-511. DOI: 10.1253/circj.CJ-15-0721.
-
92. McCullough PA, Vasudevan A, Sathyamoorthy M, et al. Urinary 11-Dehydro-Thromboxane B2 and Mortality in Patients With Stable Coronary Artery Disease . Am J Cardiol. 2017 ;119(7):972-977. DOI: 10.1016/j. amjcard.2016.12.004.
-
93. Szczeklik W, Stodółkiewicz E, Rzeszutko M, et al. Urinary 11-Dehydro-Thromboxane B2 as a Predictor of Acute Myocardial Infarction Outcomes: Results of Leukotrienes and Thromboxane In Myocardial Infarction (LTIMI) Study . J Am Heart Assoc. 2016 ;5(8):e003702. DOI: 10.1161/JAHA.116.003702.
Список литературы Резистентность к терапии препаратами ацетилсалициловой кислоты: факторы риска, механизмы, методы диагностики
- Antithrombotic Trialists' (ATT) Collaboration, Baigent C, Blackwell L, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373(9678):1849-1860. DOI: 10.1016/S0140-6736(09)60503-1
- Gaziano JM, Brotons C, Coppolecchia R, et al. Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial. Lancet. 2018;392(10152):1036-1046. DOI: 10.1016/S0140-6736(18)31924-X
- Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002;324(7329):71-86. DOI: 10.1136/bmj.324.7329.71
- Christiansen M, Grove EL, Hvas AM. Primary Prevention of Cardiovascular Events with Aspirin: Toward More Harm than Benefit-A Systematic Review and Meta-Analysis. Semin Thromb Hemost. 2019;45(5):478-489. DOI: 10.1055/s-0039-1687905
- Eikelboom JW, Hirsh J, Weitz JI, et al. Aspirin-resistant thromboxane biosynthesis and the risk of myocardial infarction, stroke, or cardiovascular death in patients at high risk for cardiovascular events. Circulation. 2002;105(14):1650-1655. DOI: 10.1161/01.CIR.0000013777.21160.07
- Awtry EH, Loscalzo J. Aspirin. Circulation. 2000;101(10):1206-1218.
- DOI: 10.1161/01.cir.101.10.1206
- Hankey GJ, Eikelboom JW. Aspirin resistance. Lancet. 2006;367(9510):606-617.
- DOI: 10.1016/s0140-6736(06)68040-9
- Bhatt DL, Topol EJ. Scientific and therapeutic advances in antiplatelet therapy. Nat. Rev. Drug Discov. 2003; 2:15-28.
- DOI: 10.1038/nrd985
- Weber AA, Przytulski B, Schanz A, et al. Towards a definition of aspirin resistance: a typological approach. Platelets. 2002;13(1):37-40.
- DOI: 10.1080/09537100120104890
- Floyd CN, Ferro A. Mechanisms of aspirin resistance. Pharmacol Ther. 2014;141(1):69-78.
- DOI: 10.1016/j.pharmthera.2013.08.005
- Schwartz KA. Aspirin resistance: a clinical review focused on the most common cause, noncompliance. Neurohospitalist. 2011;1(2):94-103.
- DOI: 10.1177/1941875210395776
- Hally KE, La Flamme AC, Larsen PD, Harding SA. Platelet Toll-like receptor (TLR) expression and TLR-mediated platelet activation in acute myocardial infarction. Thromb Res. 2017;158:8-15.
- DOI: 10.1016/j.thromres.2017.07.031
- Cambria-Kiely JA, Gandhi PJ. Aspirin resistance and genetic polymorphisms. J Thromb Thrombolysis. 2002;14(1):51-58. DOI: 10.1023/a:1022066305399.
- O'Donnell CJ, Larson MG, Feng D, et al. Genetic and environmental contributions to platelet aggregation: the Framingham heart study. Circulation. 2001;103(25):3051-3056.
- DOI: 10.1161/01.cir.103.25.3051
- Li Q, Chen BL, Ozdemir V, et al. Frequency of genetic polymorphisms of COX1, GPIIIa and P2Y1 in a Chinese population and association with attenuated response to aspirin. Pharmacogenomics. 2007;8(6):577-586.
- DOI: 10.2217/14622416.8.6.577
- Goodman T, Ferro A, Sharma P. Pharmacogenetics of aspirin resistance: a comprehensive systematic review. Br J Clin Pharmacol. 2008;66(2):222-232.
- DOI: 10.1111/j.1365-2125.2008.03183.x
- Würtz M, Kristensen SD, Hvas AM, et al. Pharmacogenetics of the antiplatelet effect of aspirin. Curr Pharm Des. 2012;18(33):5294-5308.
- DOI: 10.2174/138161212803251907
- Weng Z, Li X, Li Y, et al. The association of four common polymorphisms from four candidate genes (COX-1, COX-2, ITGA2B, ITGA2) with aspirin insensitivity: a meta-analysis. PLoS One. 2013;8(11):e78093.
- DOI: 10.1371/journal.pone.0078093
- Patrignani P, Tacconelli S, Bruno A, et al. Managing the adverse effects of nonsteroidal anti-inflammatory drugs. Expert Rev Clin Pharmacol. 2011;4(5):605-621.
- DOI: 10.1586/ecp.11.36
- Gengo FM, Rubin L, Robson M, et al. Effects of Ibuprofen on the Magnitude and Duration of Aspirin's Inhibition of Platelet Aggregation: Clinical Consequences in Stroke Prophylaxis. J Clin Pharmacol. 2008;48: 117-122.
- DOI: 10.1177/0091270007310379
- Greig GM, Francis DA, Falgueyret JP, et al. The interaction of arginine 106 of human prostaglandin G/H synthase-2 with inhibitors is not a universal component of inhibition mediated by nonsteroidal anti-inflammatory drugs. Mol Pharmacol. 1997;52(5):829-838.
- DOI: 10.1124/mol.52.5.829
- Angiolillo DJ, Weisman SM. Clinical Pharmacology and Cardiovascular Safety of Naproxen. Am J Cardiovasc Drugs. 2017;17(2):97-107.
- DOI: 10.1007/s40256-016-0200-5
- Elliott MA. The Aspirin-NSAID Interaction: More Data, But a Lack of Clarity Remains. J Am Coll Cardiol. 2018; 71(16):1752-1754
- DOI: 10.1016/j.jacc.2018.02.034
- Rainsford KD. Ibuprofen: pharmacology, efficacy and safety. Inflammopharmacol. 2009;17:275-342
- DOI: 10.1007/s10787-009-0016-x
- MacDonald TM, Wei L. Is there an Interaction between the Cardiovascular Protective Effects of Low-Dose Aspirin and Ibuprofen? Basic Clin Pharmacol Toxicol. 2006;98:275-280.
- DOI: 10.1111/j.1742-7843.2006.pto_371.x
- Catella-Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med. 2001;345:1809-17.
- DOI: 10.1056/NEJMoa003199
- Poorani R, Bhatt AN, Dwarakanath BS, et al. COX-2, aspirin and metabolism of arachidonic, eicosapentaenoic and docosahexaenoic acids and their physiological and clinical significance. Eur J Pharmacol. 2016;785:116-132.
- DOI: 10.1016/j.ejphar.2015.08.049
- Charlot M, Grove EL, Hansen PR, et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ. 2011;342:d2690.
- DOI: 10.1136/bmj.d2690
- Giraud MN, Sanduja SK, Felder TB, et al. Effect of omeprazole on the bioavailability of unmodified and phospholipid-complexed aspirin in rats. Aliment Pharmacol Ther. 1997;11:899-906.
- DOI: 10.1046/j.1365-2036.1997.00216.x
- Bhatt DL, Grosser T, Dong JF, et al. Enteric Coating and Aspirin Nonresponsiveness in Patients With Type 2 Diabetes Mellitus. J Am Coll Cardiol. 2017;69(6):603-612.
- DOI: 10.1016/j.jacc.2016.11.050
- Haastrup PF, Grønlykke T, Jarbøl DE. Enteric coating can lead to reduced antiplatelet effect of low-dose acetylsalicylic acid. Basic Clin Pharmacol Toxicol. 2015;116(3):212-215.
- DOI: 10.1111/bcpt.12362
- Cox D, Fitzgerald DJ. Lack of Bioequivalence Among Low-dose, Enteric-coated Aspirin Preparations. Clin. Pharmacol Ther. 2018;103(6):1047-1051.
- DOI: 10.1002/cpt.874
- Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies. Cardiovasc Diabetol. 2018;17(1):121.
- DOI: 10.1186/s12933-018-0763-3
- Ferretti G, Rabini RA, Bacchetti T, et al. Glycated low-density lipoproteins modify platelet properties: a compositional and functional study. J Clin Endocrinol Metab. 2002;87:2180-4.
- DOI: 10.1210/jcem.87.5.8466
- Simeone P, Boccatonda A, Liani R, Santilli F. Significance of urinary 11-dehydro-thromboxane B2 in age-related diseases: Focus on atherothrombosis. Ageing Res Rev. 2018;48:51-78.
- DOI: 10.1016/j.arr.2018.09.004
- Knebel SM, Sprague RS, Stephenson AH. Prostacyclin receptor expression on platelets of humans with type 2 diabetes is inversely correlated with hemoglobin A1c levels. Prostaglandins Other Lipid Mediat. 2015;116-117:131-135.
- DOI: 10.1016/j.prostaglandins.2014.12.002
- Koch KL, Calles-Escandón J. Diabetic Gastroparesis. Gastroenterol Clin North Am. 2015;44(1):39-57.
- DOI: 10.1016/j.gtc.2014.11.005
- Vanormelingen C, Tack J, Andrews CN. Diabetic gastroparesis. Br Med Bull. 2013;105:213-230.
- DOI: 10.1093/bmb/ldt003
- Patrono C, Rocca B. Measurement of Thromboxane Biosynthesis in Health and Disease. Front Pharmacol. 2019;10:1244.
- DOI: 10.3389/fphar.2019.01244
- Rocca B, Fox KAA, Ajjan RA, et al. Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis. Eur Heart J. 2018;39(19):1672-1686f.
- DOI: 10.1093/eurheartj/ehy066
- Rothwell PM, Cook NR, Gaziano JM, et al. Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials. Lancet. 2018;392(10145):387-399.
- DOI: 10.1016/S0140-6736(18)31133-4
- Patrono C, Rocca B, De Stefano V. Platelet activation and inhibition in polycythemia vera and essential thrombocythemia. Blood. 2013;121 (10):1701-1711.
- DOI: 10.1182/blood-2012-10-429134
- Arellano-Rodrigo E, Alvarez-Larrán A, Reverter JC, et al. Platelet turnover, coagulation factors, and soluble markers of platelet and endothelial activation in essential thrombocythemia: relationship with thrombosis occurrence and JAK2 V617F allele burden. Am J Hematol. 2009;84(2):102-108.
- DOI: 10.1002/ajh.21338
- Pascale S, Petrucci G, Dragani A, et al. Aspirin-insensitive thromboxane biosynthesis in essential thrombocythemia is explained by accelerated renewal of the drug target. Blood. 2012;119(15):3595-3603.
- DOI: 10.1182/blood-2011-06-359224
- Lordkipanidzé M. Platelet Function Tests. Semin Thromb Hemost. 2016;42(03):258-267.
- DOI: 10.1055/s-0035-1564834
- Nurden AT. Platelets, inflammation and tissue regeneration. Thromb Haemost. 2011;105 Suppl 1:S13-S33
- DOI: 10.1160/THS10-11-0720
- McFadyen JD, Kaplan ZS. Platelets are not just for clots. Transfus Med Rev. 2015;29(2):110-119
- DOI: 10.1016/j.tmrv.2014.11.006
- Hvas AM, Grove EL. Platelet Function Tests: Preanalytical Variables, Clinical Utility, Advantages, and Disadvantages. Methods Mol Biol. 2017;1646:305-320
- DOI: 10.1007/978-1-4939-7196-1_24
- Gawaz M, Langer H, May AE. Platelets in inflammation and atherogenesis. J Clin Invest. 2005;115(12):3378-3384
- DOI: 10.1172/JCI27196
- Roberts LJ 2nd, Sweetman BJ, Oates JA. Metabolism of thromboxane B2 in man. Identification of twenty urinary metabolites. J Biol Chem. 1981;256(16):8384-93. PMID:
- ISBN: 7263660
- Olson MT, Kickler TS, Lawson JA, et al. Effect of assay specificity on the association of urine 11-dehydro thromboxane B2 determination with cardiovascular risk. J Thromb Haemost. 2012;10(12):2462-2469.
- DOI: 10.1111/jth.12026
- Geske FJ, Guyer KE, Ens G. AspirinWorks: a new immunologic diagnostic test for monitoring aspirin effect. Mol Diagn Ther. 2008;12(1):51-54.
- DOI: 10.1007/BF03256268
- Eikelboom JW, Hankey GJ, Thom J, et al. Incomplete inhibition of thromboxane biosynthesis by acetylsalicylic acid: determinants and effect on cardiovascular risk. Circulation. 2008;118(17):1705-1712.
- DOI: 10.1161/CIRCULATIONAHA.108.768283
- Becker DM, Segal J, Vaidya D, et al. Sex Differences in Platelet Reactivity and Response to Low-Dose Aspirin Therapy. JAMA. 2006;295(12):1420-1427.
- DOI: 10.1001/jama.295.12.1420
- Davì G, Guagnano MT, Ciabattoni G, et al. Platelet activation in obese women: role of inflammation and oxidant stress. JAMA. 2002;288(16):2008-2014.
- DOI: 10.1001/jama.288.16.2008
- Basili S, Pacini G, Guagnano MT, et al. Insulin resistance as a determinant of platelet activation in obese women. J Am Coll Cardiol. 2006;48(12):2531-2538.
- DOI: 10.1016/j.jacc.2006.08.040
- Ferroni P, Basili S, Santilli F, Davì G. Low-density lipoprotein-lowering medication and platelet function. Pathophysiol Haemost Thromb. 2006;35(3-4):346-354.
- DOI: 10.1159/000093226
- Notarbartolo A, Davì G, Averna M, et al. Inhibition of thromboxane biosynthesis and platelet function by simvastatin in type IIa hypercholesterolemia. Arterioscler Thromb Vasc Biol. 1995;15(2):247-251.
- DOI: 10.1161/01.atv.15.2.247
- Dragani A, Falco A, Santilli F, et al. Oxidative stress and platelet activation in subjects with moderate hyperhomocysteinaemia due to MTHFR 677 C→T polymorphism. Thromb. Haemost 2012;108(09):533-542.
- DOI: 10.1160/th11-12-0899
- Di Minno MN, Pezzullo S, Palmieri V, et al. Genotype-independent in vivo oxidative stress following a methionine loading test: maximal platelet activation in subjects with early-onset thrombosis. Thromb Res. 2011;128(4):e43-e48.
- DOI: 10.1016/j.thromres.2011.05.017
- Abhinand PA, Manikandan M, Mahalakshmi R, Ragunath PK. Meta-analysis study to evaluate the association of MTHFR C677T polymorphism with risk of ischemic stroke. Bioinformation. 2017;13(6):214-219.
- DOI: 10.6026/97320630013214
- De Franchis R, Fermo I, Mazzola G, et al. Contribution of the cystathionine beta-synthase gene (844ins68) polymorphism to the risk of early-onset venous and arterial occlusive disease and of fasting hyperhomocysteinemia. Thromb Haemost. 2000;84(4):576-82. PMID:
- ISBN: 11057853
- Klerk M, Verhoef P, Clarke R, et al. MTHFR 677C→T Polymorphism and Risk of Coronary Heart Disease: A Meta-analysis. JAMA. 2002;288(16):2023-2031.
- DOI: 10.1001/jama.288.16.2023
- Ferroni P, Basili S, Falco A, Davì G. Platelet activation in type 2 diabetes mellitus. J Thromb Haemost. 2004;2(8):1282-1291.
- DOI: 10.1111/j.1538-7836.2004.00836.x
- Ha H, Lee HB. Oxidative stress in diabetic nephropathy: basic and clinical information. Curr Diab Rep. 2001;1(3):282-287.
- DOI: 10.1007/s11892-001-0047-1
- Davì G, Ciabattoni G, Consoli A, et al. In vivo formation of 8-iso-prostaglandin f2alpha and platelet activation in diabetes mellitus: effects of improved metabolic control and vitamin E supplementation. Circulation. 1999;99(2):224-229.
- DOI: 10.1161/01.cir.99.2.224
- De Ferranti SD, de Boer IH, Fonseca V, et al. Type 1 diabetes mellitus and cardiovascular disease: a scientific statement from the American Heart Association and American Diabetes Association. Circulation. 2014;130(13):1110-1130.
- DOI: 10.1161/CIR.0000000000000034
- Zaccardi F, Rizzi A, Petrucci G, et al. In Vivo Platelet Activation and Aspirin Responsiveness in Type 1 Diabetes. Diabetes. 2016;65(2):503-509.
- DOI: 10.2337/db15-0936
- Santilli F, Zaccardi F, Liani R, et al. In vivo thromboxane-dependent platelet activation is persistently enhanced in subjects with impaired glucose tolerance. Diabetes Metab Res Rev. 2020;36(2):e3232.
- DOI: 10.1002/dmrr.3232
- Dołegowska B, Błogowski W, Kedzierska K, et al. Platelets arachidonic acid metabolism in patients with essential hypertension. Platelets. 2009;20(4):242-249.
- DOI: 10.1080/09537100902849836
- Minuz P, Patrignani P, Gaino S, et al. Determinants of platelet activation in human essential hypertension. hypertension. 2004;43(1):64-70.
- DOI: 10.1161/01.HYP.0000105109.44620.1B
- Guagnano MT, Ferroni P, Santilli F, et al. Determinants of platelet activation in hypertensives with microalbuminuria. Free Radic Biol Med. 2009;46(7):922-927.
- DOI: 10.1016/j.freeradbiomed.2009.01.005
- Barua RS, Sharma M, Dileepan KN. Cigarette Smoke Amplifies Inflammatory Response and Atherosclerosis Progression Through Activation of the H1R-TLR2/4-COX2 Axis. Front Immunol. 2015;6:572.
- DOI: 10.3389/fimmu.2015.00572
- Barbieri SS, Zacchi E, Amadio P, et al. Cytokines present in smokers' serum interact with smoke components to enhance endothelial dysfunction. Cardiovascular Research. 2011;90(3),475-483.
- DOI: 10.1093/cvr/cvr032
- Barbieri SS, Weksler BB. Tobacco smoke cooperates with interleukin-1beta to alter beta-catenin trafficking in vascular endothelium resulting in increased permeability and induction of cyclooxygenase-2 expression in vitro and in vivo. FASEB J. 2007;21(8):1831-1843.
- DOI: 10.1096/fj.06-7557com
- Lowe FJ, Gregg EO, McEwan M. Evaluation of biomarkers of exposure and potential harm in smokers, former smokers and never-smokers. Clin Chem Lab Med. 2009;47(3):311-320.
- DOI: 10.1515/cclm.2009.069
- Oliveri D, Liang Q, Sarkar M. Real-World Evidence of Differences in Biomarkers of Exposure to Select Harmful and Potentially Harmful Constituents and Biomarkers of Potential Harm between Adult E-Vapor Users and Adult Cigarette Smokers. Nicotine Tob Res. 2019;ntz185.
- DOI: 10.1093/ntr/ntz185
- Cerquozzi S, Barraco D, Lasho T, et al. Risk factors for arterial versus venous thrombosis in polycythemia vera: a single center experience in 587 patients. Blood Cancer J. 2017;7(12):662.
- DOI: 10.1038/s41408-017-0035-6
- Passamonti F, Rumi E, Pungolino E, et al. Life expectancy and prognostic factors for survival in patients with polycythemia vera and essential thrombocythemia. Am J Med. 2004;117(10):755-761.
- DOI: 10.1016/j.amjmed.2004.06.032
- Carobbio A, Thiele J, Passamonti F, et al. Risk factors for arterial and venous thrombosis in WHO-defined essential thrombocythemia: an international study of 891 patients. Blood. 2011;117(22):5857-5859.
- DOI: 10.1182/blood-2011-02-339002
- Marchioli R, Finazzi G, Landolfi R, et al. Vascular and neoplastic risk in a large cohort of patients with polycythemia vera. J Clin Oncol. 2005;23(10):2224-2232.
- DOI: 10.1200/JCO.2005.07.062
- Ferrante E, Vazzana N, Santilli F, et al. Determinants of thromboxane biosynthesis in rheumatoid arthritis: Role of RAGE and oxidant stress. Free Radic Biol Med. 2010;49(5):857-864.
- DOI: 10.1016/j.freeradbiomed.2010.06.009
- Ferro D, Basili S, Roccaforte S, et al. Determinants of enhanced thromboxane biosynthesis in patients with systemic lupus erythematosus. Arthritis Rheum. 1999;42(12):2689-2697. :123.0.CO;2-X.
- DOI: 10.1002/1529-0131(199912)42
- Di Sabatino A, Santilli F, Guerci M, et al. Oxidative stress and thromboxane-dependent platelet activation in inflammatory bowel disease: effects of anti-TNF-α treatment. Thromb Haemost. 2016;116(3):486-495.
- DOI: 10.1160/TH16-02-0167
- Maclouf J, Folco G, Patrono C. Eicosanoids and iso-eicosanoids: constitutive, inducible and transcellular biosynthesis in vascular disease. Thromb Haemost. 1998;79:691-705. PMID:
- ISBN: 9569176
- Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA. 2001;286(8):954-959.
- DOI: 10.1001/jama.286.8.954
- McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA. 2006; 296(13):1633-1644.
- DOI: 10.1001/jama.296.13.jrv60011
- Kearney PM, Baigent C, Godwin J, et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ. 2006;332(7553):1302-1308.
- DOI: 10.1136/bmj.332.7553.1302
- Bhatt DL. NSAIDS and the risk of myocardial infarction: do they help or harm? Eur Heart J. 2006; 27(14):1635-1636.
- DOI: 10.1093/eurheartj/ehl090
- Campbell CL, Smyth S, Montalescot G, Steinhubl SR. Aspirin Dose for the Prevention of Cardiovascular Disease: A Systematic Review. JAMA. 2007;297(18):2018-2024.
- DOI: 10.1001/jama.297.18.2018
- Santilli F, Guagnano MT, Innocenti P, et al. Pentraxin 3 and Platelet Activation in Obese Patients After Gastric Banding. Circ J. 2016;80(2):502-511.
- DOI: 10.1253/circj.CJ-15-0721
- McCullough PA, Vasudevan A, Sathyamoorthy M, et al. Urinary 11-Dehydro-Thromboxane B2 and Mortality in Patients With Stable Coronary Artery Disease. Am J Cardiol. 2017;119(7):972-977.
- DOI: 10.1016/j.amjcard.2016.12.004
- Szczeklik W, Stodółkiewicz E, Rzeszutko M, et al. Urinary 11-Dehydro-Thromboxane B2 as a Predictor of Acute Myocardial Infarction Outcomes: Results of Leukotrienes and Thromboxane In Myocardial Infarction (LTIMI) Study. J Am Heart Assoc. 2016;5(8):e003702.
- DOI: 10.1161/JAHA.116.003702


