Результат использования венозного клапаносодержащего аллографта при реабилитации легочных артерий у новорожденного с атрезией легочной артерии и дефектом межжелудочковой перегородки: клинический случай
Автор: Войтов Алексей Викторович, Омельченко А.Ю., Сойнов И.А., Ничай Н.Р., Горбатых А.В., Кулябин Ю.Ю., Архипов А.Н., Богачев-прокофьев А.В., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 2 т.22, 2018 года.
Бесплатный доступ
Лечение пациентов с атрезией легочной артерии и дефектом межжелудочковой перегородки, которые имеют гипоплазированное легочное русло, является актуальным. Мы представляем клинический случай пациента, которому выполнена паллиативная реконструкция пути оттока из правого желудочка в условиях индуцированной фибрилляции желудочков с использованием криосохраненного венозного клапаносодержащего аллографта с целью развития гипоплазированных артерий. В отечественной и зарубежной литературе мы не встречали подобных сообщений, где подробно описаны этапы операции и развития легочных артерий, подкрепленных демонстративным материалом. Данная процедура способствует равномерному развитию центрального легочного русла, успешному выполнению этапных эндоваскулярных вмешательств и подготовке к радикальной коррекции порока, а техника «короткого» искусственного кровообращения с индуцированной фибрилляцией желудочков, является безопасной и эффективной опцией для хирурга при данном типе операции. Мы считаем, что представленный клинический случай будет полезен в медицинской практике детским кардиохирургам, занимающимся проблемой реабилитации легочного русла.
Атрезия легочной артерии, индекс nakata, клинический случай, криосохраненный бедренный венозный аллографт, реабилитация легочного русла
Короткий адрес: https://sciup.org/142230599
IDR: 142230599 | DOI: 10.21688/1681-3472-2018-2-68-72
Текст научной статьи Результат использования венозного клапаносодержащего аллографта при реабилитации легочных артерий у новорожденного с атрезией легочной артерии и дефектом межжелудочковой перегородки: клинический случай
Стратегии лечения пациентов с атрезией легочной артерии и дефектом межжелудочковой перегородки разнообразны и зависят от степени гипоплазии истинных легочных артерий (ЛА). Наиболее популярным методом реабилитации истинных ЛА является паллиативная реконструкция пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки (ДМЖП). В зависимости от анатомии реконструкцию выполняют, используя трансанулярную заплату, сосудистые протезы или клапаносодержащие кондуиты и гомографты, которые имеют ограничения из-за отсутствия маленьких диаметров [1–3]. Р.А. Джонас с коллегами предложил решение данной проблемы, используя бедренный венозный клапаносодержащий аллографт [4, 5].
Представляем клинический случай реабилитации легочных артерий с помощью венозного клапаносодержащего аллографта. Описана техника имплантации в условиях «короткого» искусственного кровообращения и этапы развития легочного русла.
Клинический случай
Пациент К. в возрасте 9 сут., весом 2,85 кг поступил в отделение реанимации с диагнозом «атрезия легочной артерии, дефект межжелудочковой перегородки типа А (по Tchervenkov), дефект межпредсердной перегородки вторичного типа, открытый артериальный про-

Статья доступна по лицензии Creative Commons Attribution 4.0.
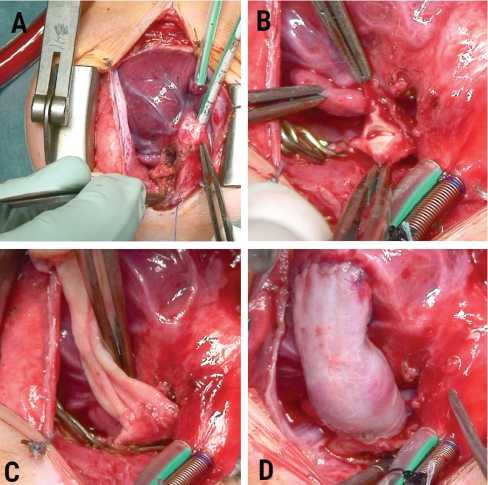
Рис. 1. Этапы реконструкции пути оттока венозным ал-лографтом: внешний вид гипоплазированных легочных артерий ( A ); артериотомный разрез на легочных артериях ( В ); дистальный анастомоз между венозным аллографтом и легочными артериями ( С ); заключительный вид операции ( D )
Fig. 1. Stages of right ventricular outflow tract reconstruction by using a vein allograft: view of hypoplastic pulmonary arteries ( A ); arteriotomy incision in pulmonary arteries ( B ); distal anastomosis between the vein allograft and pulmonary artery ( C ); final view of procedure ( D )
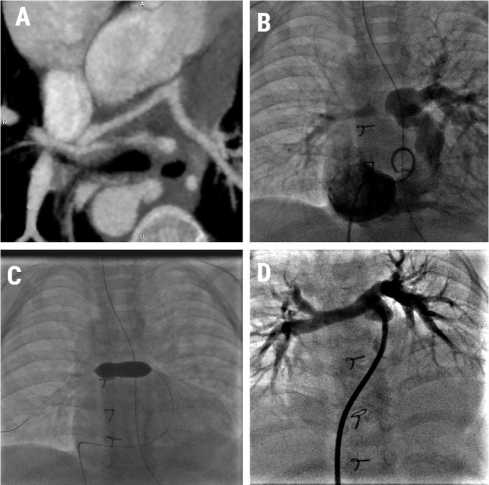
Рис. 2. Этапы развития легочного русла: компьютерная томограмма гипоплазированных легочных артерий ( А ); этапное эндоваскулярное вмешательство по поводу стеноза правой легочной артерии ( В, С ); легочные артерии перед радикальной операцией ( D )
Fig. 2. Stages of pulmonary arteries development: сomputed tomography of hypoplastic pulmonary arteries ( A ); balloon dilatation of right pulmonary artery stenosis ( B, C ); pulmonary arteries before complete repair ( D )
ток на инфузии вазапростана 10 нг/кг/мин». Диагноз установлен перинатально на 22-й нед. При общем осмотре диффузный цианоз кожных покровов, сатурация 69–74%. Одышка в покое до 50 в мин. По данным трансторакальной эхокардиографии, фракция выброса левого желудочка (ЛЖ) — 71%, конечный диастолический объем ЛЖ — 21,1 мл/м2, открытое овальное окно — 2 мм, субаортальный ДМЖП — 8 мм. Ствол легочной артерии отсутствует, правая ЛА — 2,8 мм, левая ЛА — 3 мм. Открытый артериальный проток диаметром 0,3 см. Для дифференциальной диагностики с другими врожденными пороками конотрункуса выполнена мультиспиральная компьютерная томография сердца, по данным которой выявлена атрезия выходного отдела правого желудочка, клапана и ствола легочной артерии. Открытый артериальный проток — 3,2 мм. Легочный ствол гипоплазиро-ван до 1 мм. Правая легочная артерия — 2,6 мм, нижнедолевая ветвь — 2 мм. Левая легочная артерия — 3,6
мм, нижнедолевая ветвь — 2,5 мм (см. рис. 2, А). Индекс Nakata — 78,4; индекс McGoon — 0,95.
Выполнена паллиативная реконструкция пути оттока из правого желудочка с использованием криосохраненно-го венозного клапаносодержащего аллографта. Доступ к сердцу и сосудам осуществлялся через срединную стернотомию. Последовательно выделены: извитой открытый артериальный проток внешним диаметром 4 мм, правая и левая легочные артерии по 3 мм (рис. 1, А). Ствол легочной артерии представлен фиброзным тяжом длиной около 8 мм. Аппарат искусственного кровообращения подключен по схеме: правое предсердие – восходящая аорта. Первым этапом сосудистыми клипами отжаты правая и левая легочные артерии, отсечен ствол легочной артерии от бифуркации. Выполнен разрез по передненижней поверхности легочных артерий длиной около 8 мм (рис. 1, В). Сформирован дистальный анастомоз между легочными артериями и венозным кондуитом 7 мм (рис. 1, С). Вторым этапом создан анастомоз между правым желудоч- ком и венозным гомографтом, индуцирована фибрилляция желудочков с целью сохранения коронарного кровотока и профилактики аэроэмболических осложнений (рис. 1, D). Продолжительность фибрилляции желудочков составила 10 мин, искусственного кровообращения — 21 мин.
Послеоперационный период протекал без осложнений. Искусственная вентиляция легких — 27 ч. Кардиотоническая поддержка в течение 30 ч. На 3-и сут. ребенок переведен в профильное отделение. Выписан из стационара на 18-е сут.
Через 4 мес. пациент поступил для оценки развития легочного русла. Состояние ребенка удовлетворительное, сатурация 80–92%. По данным эхокардиографии, пиковый градиент на правой легочной артерии — 45–48 мм рт. ст. Для оценки развития легочного русла выполнена мультиспиральная компьютерная томография сердца. Отмечена положительная динамика: рост легочно-артериальных индексов, индекс Nakata увеличился с 78,4 до 141,8; индекс McGoon — с 0,95 до 1,50, стеноз устья правой легочной артерии до 2,8 мм, отмечается гипоплазия основной ветви правой легочной артерии на всем протяжении до 3,8 мм, левая легочная артерия в устье 4,5 мм, на остальном протяжении до 6,5 мм (рис. 2, B). На следующие сутки выполнена баллонная ангиопластика устья правой легочной артерии баллоном 7 х 30 мм (Boston Scientific MustangTM) с положительным гемодинамическим результатом (рис. 2, C). Пациент выписан на 3-и сут.
В возрасте 8 мес. ребенок повторно поступил в клинику для радикальной коррекции. Сатурация при поступлении 87%. По данным эхокардиографии, фракция выброса ЛЖ — 82%, конечный диастолический объем ЛЖ — 31,4 мл/м2, открытое овальное окно — 2 мм, субаортальный ДМЖП — 10 мм. Для оценки легочного русла выполнена катетеризация сердца: индекс Nakata увеличился с 141,8 до 231,7, индекс McGoon — с 1,50 до 2,07. Размеры легочных артерий: правая легочная — в устье 5,2 мм, далее расширяется до 6,8 мм; левая легочная — около 7–8 мм на всем протяжении (рис. 2, D). На следующие сутки выполнена радикальная операция. Внутрисердечная ревизия выявила субаортальный ДМЖП — 10 х 15 мм, открытое овальное окно — 2-3 мм. Демонтирован венозный аллографт. Трансвентрикулярным доступом закрыт дефект межжелудочковой перегородки заплатой из ксеноперикарда. Путь оттока из правого желудочка протезирован ксенокондуитом Contegra № 12. Овальное окно оставлено в качестве разгрузочной фистулы. Давление в правом желудочке 1/2 от системного. Время искусственного кровообращения — 82 мин, окклюзии аорты — 41 мин. Послеоперационный период протекал без осложнений. Длительность искусственной вентиляции легких — 16 ч. На 2-е сут. переведен в отделение, на 12-е выписан из соматического отделения.
Обсуждение
Проблема восстановления легочного кровотока у пациентов с атрезией ЛА и ДМЖП актуальна. Основной задачей реабилитации гипоплазированных легочных артерий является улучшение соматического состояния пациентов, увеличение легочного кровотока, устранение гипоксемии, увеличение нагрузки на левые отделы сердца, равномерное развитие ЛА и, как результат, возможность радикальной коррекции. Достигается это выполнением различных вариантов системно-легочных анастомозов или реконструкцией пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки [6].
В данном клиническом случае мы решили воздержаться от формирования системно-легочного анастомоза из политетрафторэтилена, так как это приводит к тромбозам, особенно у пациентов с выраженной гипоплазией ЛА, несимметричному развитию легочных артерий, деформации тонкостенных легочных артерий, что требует выполнения пластики легочных артерий при радикальной коррекции [7]. Мельбурнский шунт не является перспективным для таких пациентов из-за развития значительного стеноза правой легочной артерии в 40% случаев [4].
В мировой практике широко известна паллиативная реконструкция пути оттока из правого желудочка, для которой хирурги используют различные техники в зависимости от степени атрезии легочной артерии. При клапанной атрезии в некоторых центрах применяют радиочастотную перфорацию клапана легочной артерии либо трансанулярную пластику заплатой из аутоперикарда, обработанной глютаральдегидом. При атрезии ствола легочной артерии либо выраженной гипоплазии выполняют протезирование пути оттока бесклапанными сосудистыми протезами или клапаносодержащими ксенокондуитами и аллографтами. При паллиативной реконструкции пути оттока из правого желудочка осуществляют однонаправленный физиологический (венозный) ток крови, который способствует равномерному развитию легочного русла и уменьшает риск деформации ЛА. При этом отсутствует риск «обкрадывания» коронарного кровотока и ухудшения перфузии миокарда, что возможно при создании системно-легочных анастомозов, а также позволяет при необходи- мости активно применять эндоваскулярные вмешательства на легочно-артериальном русле [1, 6, 8]. В нашей практике мы используем технику «короткого» искусственного кровообращения и индуцированную фибрилляцию желудочков для сохранения коронарного кровообращения и снижения ишемически-реперфузи-онного повреждения миокарда, риска аэроэмболичес-ких осложнений, что обусловливает отсутствие неврологических осложнений после коррекции порока [5].
Заключение
Паллиативная реконструкция пути оттока из правого желудочка с использованием криосохраненного клапаносодержащего венозного аллографта маленького диаметра способствует равномерному развитию центрального легочного русла, успешному выполнению этапных эндоваскулярных вмешательств и подготовке к радикальной коррекции порока. Техника «короткого» искусственного кровообращения с индуцированной фибрилляцией желудочков, применяемой при формировании анастомоза между венозным аллографтом и правым желудочком, является безопасной и эффективной опцией для хирурга при данном типе операции.
Информированное согласие
Законный представитель (мама ребенка) дала письменное добровольное информированное согласие на использование медицинских данных, полученных в ходе лечения, в научных целях, а также их публикацию.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Результат использования венозного клапаносодержащего аллографта при реабилитации легочных артерий у новорожденного с атрезией легочной артерии и дефектом межжелудочковой перегородки: клинический случай
- Джонас Р.А. Хирургическое лечение врожденных пороков сердца. Пер. с англ. под редакцией М.В. Борискова. М.: ГОЭТАР-Медиа, 2017. C. 420-440.
- Омельченко А.Ю., Сойнов И.А., Горбатых Ю.Н., Кулябин Ю.Ю., Горбатых А.В., Ничай Н.Р., Войтов А.В., Богачев-Прокофьев А.В. Дисфункция правого желудочка у пациентов после коррекции тетрады фалло: все ли вопросы решены? Хирургия. Журнал им. Н.И. Пирогова. 2017; (6): 84-90. DOI: 10.17116/hirurgia2017684-90
- Сойнов И.А., Журавлева И.Ю., Кулябин Ю.Ю., Ничай Н.Р., Афанасьев А.В., Алешкевич Н.П., Богачев-Прокофьев А.В., Караськов А.М. Клапансодержащие кондуиты в детской кардиохирургии. Хирургия. Журнал им. Н.И. Пирогова. 2018; (1): 75-81. DOI: 10.17116/hirurgia2018175-81
- Sinha P., Talwar S., Moulick A., Jonas R. Right ventricular outflow tract reconstruction using a valved femoral vein homograft. J. Thorac Cardiovasc Surg. 2010; 139(1): 226-228. 10.1016/j. jtcvs.2008.10.018 DOI: 10.1016/j.jtcvs.2008.10.018
- Зубрицкий А.В., Наберухин Ю.Л., Архипов А.Н., Горбатых Ю.Н., Ничай Н.Р., Кулябин Ю.Ю., Павлушин П.М., Богачев-Прокофьев А.В. Дисфункция синусового узла после коррекции частичного аномального дренажа правых легочных вен: проспективное рандомизированное исследование. Анналы аритмологии. 2017; 14(4): 180-189. DOI: 10.15275/annaritmol.2017.4.1
- Горбатых Ю.Н., Синельников Ю.С., Курыгина С.В., Лейкехман А.В., Прозоров И.В., Жалнина Е.В. Случай реконструкции пути оттока из правого желудочка без пластики дефекта межжелудочковой перегородки у новорожденного пациента с атрезией легочной артерии и дефектом межжелудочковой перегородки. Патология кровообращения и кардиохирургия. 2006; 10(2): 89-92.
- d'Udekem Y., Alphonso N., Norgaard M.A., Cochrane A.D., Grigg L.E., Wilkinson J.L., Brizard C.P. Pulmonary atresia with ventricular septal defects and major aortopulmonary collateral arteries: Unifocalization brings no longterm benefits. J. Thorac Cardiovasc Surg. 2005; 130(6): 1496-502. PMID: 16307989. DOI: 10.1016/j.jtcvs.2005.07.034
- Schiller O., Sinha P., Zurakowski D., Jonas R.A. Reconstruction of right ventricular outflow tract in neonates and infants using valved cryopreserved femoral vein homografts. J. Thorac Cardiovasc Surg. 2014; 147(3): 874-9. PMID: 24342904. DOI: 10.1016/j.jtcvs.2013.11.006


