Результативность синхронизации полового цикла у ярок (Ovis aries L.) романовской породы в зависимости от схемы гормональной стимуляции и сезона года
Автор: Луканина В.А., Чинаров Р.Ю., Сингина Г.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Проблемы репродукции
Статья в выпуске: 2 т.58, 2023 года.
Бесплатный доступ
Синхронизация полового цикла у овец - важный элемент программ воспроизводства, в том числе основанных на использовании вспомогательных репродуктивных технологий. Многообразие пород овец, различия природно-климатических условий зон разведения, особенности гормонального статуса животных не позволяют подобрать универсальный протокол управления половыми циклами. В настоящей работе впервые проведен сравнительный анализ двух схем гормональной стимуляции охоты, предполагающих либо две последовательные инъекции простагландина F2a (схема 1), либо первоначально инъекцию гонадотропного рилизинг-гормона с последующей обработкой простагландином F2a (схема 2). Цель работы заключалась в определении эффективности разных схем синхронизации полового цикла (ПЦ) у овец романовской породы по сезонам года. Исследования проводили на половозрелых ярках ( n = 160). Животные 1-й группы ( n = 121) подвергались гормональной обработке по схеме 1, предусматривающей 2-кратную инъекцию клопростенола (125 мкг на инъекцию) за 13 и 2 сут до предполагаемой даты прихода в охоту. На животных 2-й группы ( n = 39) применяли схему 2, включающую инъекции 15 мкг ацетата люлиберина и 125 мкг клопростенола соответственно за 9 и 2 сут до прихода в охоту. Кроме того, у овец 1-й группы оценивали результативность синхронизации ПЦ по сезонам: осень-зима ( n = 73) и весна-лето ( n = 48), а также по пяти временным периодам: сентябрь-октябрь ( n = 24), ноябрь-декабрь ( n = 26), январь-февраль ( n = 23), март-апрель ( n = 32) и май-июнь ( n = 16). Эффективность гормональной обработки оценивали у всех животных на основании их прихода в охоту через 24 и 48 ч после последней инъекции. У части животных, проявивших признаки охоты ( n = 80), через 96 ч после выявления охоты визуально оценивали состояние яичников на наличие желтых тел (ЖТ), используя лапаротомию или лапароскопию. Дисперсионный анализ показал достоверное влияние схемы гормональной обработки ( F = 5,21, p = 0,024), а также сезона ( F = 13,82, p = 0,0003) на процент ярок, пришедших в охоту. Среднее число ЖТ было подвержено большей изменчивости в связи с календарным годом проводимых исследований (p ≤ 0,05) и сезоном года (p ≤ 0,01), но схема обработки не имела значимого влияния на этот показатель. При использовании схемы 1 отмечали тенденцию повышения доли животных, пришедших в охоту, по сравнению со схемой 2 (80,17 % против 66,67 %). Вместе с тем при использовании схемы 2 ЖТ выявлялись у всех ярок, проявляющих признаки охоты, в то время как применение схемы 1 приводило к образованию ЖТ у 90,77 % ярок (р ≤ 0,05). Установлена более высокая результативность синхронизации ПЦ у овец в осенне-зимний период по сравнению с весенне-летним: доля ярок, пришедших в охоту, составила 92,50 % против 64,58 % (р ≤ 0,01), среднее число ЖТ у ярок, пришедших в охоту, равнялось 2,02 против 1,28 (р ≤ 0,01), среднее число ЖТ у ярок, имеющих желтые тела, - 2,18 против 1,62 (р ≤ 0,05). Анализ по 2-месячным периодам выявил относительную стабильность этих показателей в течение всего осенне-зимнего периода, после чего они снижались в марте-апреле и достигали минимальных значений в мае-июне. Таким образом, для стимуляции охоты у овец романовской породы целесообразно использовать две последовательные инъекции клопростенола (за 13 и 2 сут до предполагаемой даты наступления охоты), при этом эффективность метода выше в осенне-зимний сезон, после чего реакция животных на гормональную обработку снижается.
Овцы, романовская порода, гормональные препараты, простагландин f2a, стимуляция охоты, овариальная функция
Короткий адрес: https://sciup.org/142238884
IDR: 142238884 | УДК: 636.3.035:57.017.53:619 | DOI: 10.15389/agrobiology.2023.2.333rus
Текст научной статьи Результативность синхронизации полового цикла у ярок (Ovis aries L.) романовской породы в зависимости от схемы гормональной стимуляции и сезона года
Синхронизация полового цикла (ПЦ) у овец — один из способов повысить эффективность реализации репродуктивного потенциала самок и оптимизировать программы воспроизводства (1). Так как результативность синхронизации в большинстве случаев оценивают по наиболее выраженному признаку — наступлению охоты, часто используют выражение «синхронизация охоты». Синхронизация охоты способна нивелировать влияние сезонных факторов на воспроизводство овец, что позволяет удлинить сезон
∗ Работа выполнена при финансовой поддержке Минобрнауки России (тема 0445-2021-0004).
размножения и планировать ягнение овцематок в заранее определенный период времени в течение всего года (2-4). Это дает возможность получать до 2-3 окотов за 2 года, что повышает экономическую эффективность овцеводства (1, 5).
Синхронизация полового цикла приобретает особую актуальность в связи с развитием вспомогательных репродуктивных технологий (6), включая искусственное осеменение, получение эмбрионов in vitro, клонирование, трансплантацию эмбрионов (7-9). Для синхронизации полового цикла применяют биологические, гормональные и комбинированные методы.
Описан биологический метод стимуляции эструса вне сезона размножения при мультисенсорном контакте овцематок с баранами, получивший название «эффект самца» (10). Такая многофакторная стимуляция задействует обонятельные, тактильные и зрительные рецепторы самок. Стимуляция охоты основана на изменении частоты пульсаций секреции гонадотропного релизинг-гормона (ГнРГ) и повышении секреции лютеинизирующего гормона (ЛГ). При первой овуляции, которая происходит через 23 сут после контакта ярок с баранами, проявления признаков охоты часто отсутствуют («тихая охота»), а фертильность овцематок остается низкой. Основной фактор, ограничивающий использование этого биологического метода, — пониженная оплодотворяемость овец в первом цикле и снижение результативности синхронизации в последующих циклах. Отмечалось, что эффективность указанного метода повышается при искусственном продлении светового периода в течение двух предыдущих месяцев, в результате чего охота наступала у 99 % самок (11). Еще один прием, обеспечивающий повышение результативности «эффекта самца», — обработка самок 20 мг прогестерона при вводе баранов в стадо (12). Биологические методы стимуляции полового цикла у овец представляют значительный интерес, так как не требуют обработки гормональными препаратами.
Гормональные препараты при оптимальной схеме применения могут обеспечить более высокую результативность синхронизации полового цикла. Существуют различные схемы, основанные на использовании прогестогеновых препаратов, простагландина F2 α (ПГF2 α ) и его структурных аналогов. Выбор схемы зависит от породы овец, сезона, физиологического состояния животного (13). При синхронизации в сезон размножения, как правило, применяют простагландины, для которых мишенью служит функциональное желтое тело, вне сезона размножения — комплексные схемы на основе прогестерона с последующим введением хорионического гонадотропина лошадей (лХГ) и ГнРГ (1, 14, 15).
Синтетические прогестагены, которые выступают в качестве про-лонгаторов лютеиновой фазы полового цикла, можно вводить перорально, интравагинально или подкожно в виде болюсов. Пероральный способ наименее трудоемкий. Препарат смешивают с солью или растворяют в этиловом спирте и добавляют в корм. Животным скармливают препарат в течение 810 сут. Однако этот способ не гарантирует полного потребления необходимой дозы всеми животными (16).
Широкое распространение вне зависимости от сезона получили прогестогеновые интравагинальные губки, пропитанные спиртовыми или пропиленгликолевыми растворами препаратов на основе прогестерона (P4), флуорогестон-ацетата (FGA) и медроксипрогестерон-ацетата (MPA) (17). Губку помещают во влагалище самок на 10-14 сут, после чего животным подкожно вводят лХГ. Признаки охоты проявляются через 24-48 ч у 90 % особей (18-21). Изучение возможности повысить эффективность интрава- гинальных губок, содержащих прогестагены, в сочетании с подкожновми имплантами мелатонина показало (22), что в группе, получавшей мелатонин, оплодотворяемость самок составила 60,4 % против 32,6 % в контрольной группе. Положительный эффект мелатонина в сочетании с прогестагенами и лХГ также отмечен у овец породы Awassi при стимуляции охоты в анэст-ральный период (23). Установлено, что мелатонин проявляет положительный эффект совместно с прогестагенами и лХГ, но без других препаратов не стимулирует охоту (24).
Эффективны и безопасны для здоровья животных прогестагенновые препараты в виде болюсов (25). С помощью специального аппликатора болюс, содержащий действующее вещество, вводят подкожно в ухо на 8-12 сут. Одновременно делают инъекцию синтетического аналога прогестерона — норгестамета (1,5 мг) и эстрадиола (1,9 мг). По прошествии 8-12 сут имплантат извлекают и делают инъекцию лХГ. При такой схеме в течении 24 ч у 95-100 % животных наблюдались признаки охоты, а оплодотворяемость свежей спермой составила 85-95 % (26). В исследованиях Z. Mekuriaw с со-авт. (27) болюсы сочетали с инъекцией 300-400 МЕ лХГ и 50 мкг клопро-стенола за 48 ч до удаления имплантата. Наступление охоты зарегистрировали у 65-95 % животных при оплодотворяемости 50-90 % (27).
Для синхронизации охоты в течение сезона размножения (осень— зима; продолжительность периода зависит от породы овец) применяют препараты, содержащие простагландин F2 α и его синтетические аналоги. Экзогенный простагландин F2 α не оказывает влияния на цикличность у овцы в отсутствие желтого тела, то есть во время лютеиновой фазы полового цикла. Поэтому препараты на основе простагландина F2 α более эффективны в период полового сезона, в течение которого по крайней мере у части овец в стаде имеются желтые тела. Для синхронизации полового цикла животным 2-кратно инъецируют препарат на основе простагландина F2 α с интервалом 8-12 сут (28). Охота наступает через 48-60 ч после последней инъекции. Эффективность этого метода может достигать 100 %. В исследованиях, проведенных нами ранее на малой выборке овец романовской породы, была показана большая результативность схемы, основанной на 2-кратной инъекции простагландина F2 α , по сравнению с комбинированным применением гонадотропного релизинг-гормона и простагландина F2 α : доля животных, пришедших в охоту, составила соответственно 100 и 50 % (29).
Многообразие пород овец и различия природно-климатических условий в зонах разведения не позволяют подобрать универсальный протокол синхронизации. Кроме того, действие гормональных препаратов на репродуктивную систему самок может проявляться по-разному в зависимости от исходного функционального состояния репродуктивных органов и гормонального статуса. Так, эффективность гормональной стимуляции половых циклов у овец в начале сезона размножения значительно ниже, чем в его конце; у лактирующих самок эффективность стимуляции ниже, чем у не кормящих животных. При неправильном применении гормональных препаратов или плохо подобранной дозировке могут наблюдаться негативные последствия (30, 31). Поэтому выбор оптимальной схемы гормональной обработки — важнейший элемент вспомогательных репродуктивных технологий в овцеводстве.
В настоящей работе впервые проведен сравнительный анализ эффективности двух схем гормональной стимуляции охоты, предполагающих либо две последовательные инъекции простагландина F2α, либо первоначально инъекцию гонадотропного рилизинг-гормона с последующей обра- боткой овец простагландином F2α. Применение первой схемы обеспечивало лучший ответ на синхронизацию в отношении доли животных, пришедших в охоту. Установлена более высокая результативность синхронизации полового цикла в осенне-зимний период по сравнению с весенне-летним периодом при использовании обеих схем.
Цель работы заключалась в определении эффективности разных схем синхронизации полового цикла у овец романовской породы по сезонам года.
Методика . Исследование проводили на половозрелых ярках романовской породы в возрасте 1,5-2 лет ( n = 160, ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года). За экспериментальный период каждое животное использовали только один раз. Ярок содержали в загонах под навесами группами по 15-20 гол. отдельно от баранов. В зимний период ярки получали сено-концентратный рацион в соответствии с нормами потребностей породы. В летний период животные находились на пастбище и дополнительно получали концентраты. Все животные имели неограниченный доступ к минеральной соли и воде.
Животных разделили на две группы. В 1-й группе ( n = 121) ярок подвергали гормональной обработке по схеме 1, предусматривающей 2-кратную инъекцию аналога простогландина — клопростенола (Эстрофан, «Bi-oveta», Чехия) в количестве 125 мкг на инъекцию за 13 сут ( - 13 сут) и 2 сут ( - 2 сут) до предполагаемой даты прихода животных в охоту (0 сут). На животных 2-й группы ( n = 39) применяли схему 2, включающую инъекцию 15 мкг гонадотропина люлиберина ацетата (Сурфагон, «Мосагроген», Россия) на - 9 сут и инъекцию 125 мкг клопростенола на - 2 сут.
Эффективность схем гормональной стимуляции оценивали у всех ярок на основании прихода в охоту, а также визуального выявления желтых тел (ЖТ) в яичниках у части особей с признаками охоты ( n = 67 и n = 13 соответственно для 1-й и 2-й групп). Приход в охоту определяли с помощью вазоэктомированного барана-пробника через 24 и 48 ч после последней инъекции. Овариальную функцию (наличие и число ЖТ в яичниках) оценивали с помощью лапаротомии или лапароскопии с использованием эндоскопического оборудования («Karl Storz SE & Co. KG», Германия) через 96 ч с момента последней инъекции.
Результативность синхронизации полового цикла определяли по следующим критериям: доля ярок, пришедших в охоту, от общего числа подвергшихся гормональной обработке; доля ярок, имеющих ЖТ, от общего числа проявивших признаки охоты; среднее число ЖТ в расчете на одно животное с признаками охоты; среднее число ЖТ в расчете на одно животное, имеющее ЖТ. Для каждой группы животных рассчитывали эти показатели за весь период эксперимента. Влияние сезонов осень—зима (сентябрь-февраль) и весна—лето (март-июль) исследовали у овец 1-й группы (соответственно n = 73 и n = 48). Для более детального анализа сравнивали показатели по пяти временным периодам: сентябрь-октябрь ( n = 24), ноябрь-декабрь ( n = 26), январь-февраль ( n = 23), март-апрель ( n = 32) и май-июнь ( n = 16).
Для определения статистической значимости влияния исследуемых факторов (схема гормональной обработки, сезон и период года) на изменчивость показателей результативности синхронизации ПЦ использовали двухфакторный дисперсионный анализ без взаимодействия (ввиду неполного ранга модели) с применением программы STATISTICA 10 («StatSoft,
Inc.», США) по следующему уравнению:
у jilk = µ + year j + scheme i + season l + animal k + e jilk , где year j — фиксированный эффект года проведения исследований ( j — 2020-2023 годы); scheme i — фиксированный эффект i -й схемы гормональной обработки ( i — 1 и 2); season l — фиксированный эффект l -го сезона ( l — осень—зима, весна—лето); animal k — рандомизированный эффект k -го животного; e jilk — остаточный (рандомизированный) эффект модели уравнения. Для расчета независимого распределения событий по доле ярок, пришедших в охоту, в связи с влиянием факторов использовали непараметрический тест по χ 2 по Пирсону. Для оценки силы влияния факторов на результативность синхронизации овец в экспериментальных группах определяли среднеарифметические значения ( М ) и ошибку средней (±SEM). Статистическую значимость различий среднеарифметических значений оценивали на основании t -критерия Стьюдента. Результаты считали высокодостоверными при р ≤ 0,001, достоверными — при р ≤ 0,01 и р ≤ 0,05.
Результаты . Дизайн эксперимента иллюстрирует рисунок 1:
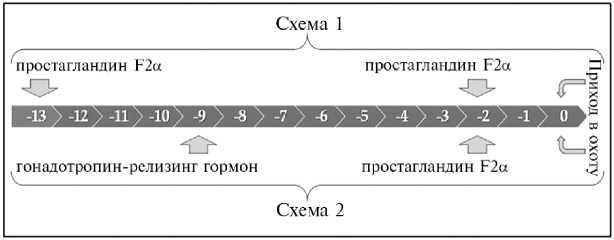
Рис. 1. Схемы гормональной синхронизации полового цикла у 1,5-2-месячных ярок романовской породы, тестируемых в эксперименте ( n = 160, ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года). Временная шкала — сутки до прихода в охоту.
Результаты дисперсионного анализа по определению значимости влияния исследуемых факторов (год, схема гормональной обработки, сезон) на изменчивость изучаемых показателей результативности синхронизации полового цикла овец приведены в таблице 1.
1. Результаты двухфакторного дисперсионного анализа показателей синхронизации полового цикла у 1,5-2-месячных ярок романовской породы в зависимости от года, схемы гормональной обработки и сезона ( n = 160, ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года)
t Влияние фактора статистически значимо при p ≤ 0,10.
*, ** и *** Влияние фактора статистически значимо соответственно при p ≤ 0,05; p ≤ 0,01 и p ≤ 0,001
Для доли ярок, пришедших в охоту, было установлено достоверное влияние применяемой схемы гормональной обработки ( F = 5,21; p = 0,024), а также сезона года ( F = 13,82; p = 0,0003) (см. табл. 1). Коэффициент детерминации модели, который объяснял величину вариабельности по доле ярок между сравниваемыми группами факторов, составил 0,103, или 10,3 %.
Критерий χ 2 Пирсона показал, что разница по этому показателю также зависела от схемы синхронизации (p ≤ 0,05) и сезона года (p ≤ 0,01), что свидетельствует о сопряженности распределения событий прихода в охоту (есть/нет) и неприменимости нулевой гипотезы о взаимной независимости исследуемых факторов и результатов наблюдений. Фактор года исследований не оказывал влияние на распределение пороговых признаков ( F = 0,18; p = 0,910). Среднее число ЖТ было подвержено большей изменчивости в связи с календарным годом проводимых исследований (p ≤ 0,05) и сезоном года (p ≤ 0,01), при этом схема обработки значимо не повлияла на этот показатель. Увеличение коэффициента детерминации R2 (23,6 % против 10,3 %) указывало на то, что величина, характеризующая распределение варианс внутри групп в сравнении с общегрупповой изменчивостью, для среднего числа ЖТ была выше, чем для доли ярок, пришедших в охоту (см. табл. 1).
2. Влияние схемы гормональной обработки на результативность синхронизации полового цикла у 1,5-2-месячных ярок романовской породы ( M ±SEM, ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года)
|
Показатель |
Группа |
|
|
1-я |
2-я |
|
|
Число животных, n 1 |
121 |
39 |
|
Доля ярок, пришедших в охоту, % |
80,17±3,64 |
66,67±7,65 |
|
Число животных, n 2 |
67 |
13 |
|
Доля ярок, имеющих ЖТ1, % |
90,77±3,59* |
100 |
|
Среднее число ЖТ1 |
1,75±0,13 |
1,92±0,35 |
|
Среднее число ЖТ у прореагировавших животных2 |
1,98±0,11 |
1,92±0,35 |
Пр и м еч ани е. n 1 — число животных, подвергшихся синхронизации полового цикла, n 2 — число животных, подвергшихся синхронизации полового цикла, у которых проводили исследование на наличие желтых тел (ЖТ); 1 — показатель в расчете на число ярок, пришедших в охоту; 2 — показатель в расчете на число ярок, пришедших в охоту и имеющих ЖТ.
* Различия между группами статистически значимы при р ≤ 0,05.
Как следует из данных, представленных в таблице 2, схема 1 (1-я группа) оказалась результативнее схемы 2 (2-я группа) при сравнении доли животных, пришедших в охоту (80,17 против 66,67 %), однако обнаруженные различия можно рассматривать только в качестве тенденции. При использовании схемы 2 (2-я группа) ЖТ выявлялись у всех ярок с признаками охоты, в то время как применение схемы 1 приводило к образованию ЖТ у 90,77 % ярок (р ≤ 0,05). В варианте со схемой 2 отмечалась тенденция увеличения среднего числа ЖТ по сравнению с таковым для схемы 1 (+1,17) за счет того, что ЖТ выявили у всех ярок с признаками охоты. При определении среднего числа ЖТ у ярок, имеющих ЖТ, различия между группами нивелировались.
Данные, приведенные в таблице 3, показывают достоверное влияние сезона года на результативность синхронизации полового цикла у овец при оценке по доле ярок, пришедших в охоту. В осенне-зимний период значение этого показателя было на 25,83 % выше, чем в весенне-летний (92,50 против 64,58 %, р ≤ 0,01). Аналогичную зависимость по периодам года отмечали для доли ярок, имеющих ЖТ, от общего числа проявивших признаки охоты (+12,5 %), однако выявленные различия носили характер тенденции. Более детальный анализ, проведенный для 2-месячных периодов, показал, что доля животных, пришедших в охоту, была относительно высокой в период с сентября по февраль (88,5-91,7 %), после чего в марте-апреле она снижалась до 71,9 %. В мае-июне доля ярок, пришедших в охоту после гормональной обработки, составляла 50,0 % (рис. 2). Интересная закономерность проявилась в отношении желтых тел. Если в сентябре-декабре 100 % ярок, проявивших признаки охоты, имели в яичниках визуа- лизируемые ЖТ, то в последующие месяцы их доля снижалась: в январе-апреле — до 81,3-89,5 %, в мае-июне — всего до 50 %.
-
3. Влияние сезона на результативность синхронизации полового цикла у 1,5-2месячных ярок романовской породы при гормональной обработке по схеме 1 ( M ±SEM, ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года)
|
Показатель |
Сезон |
|
|
осень — зима |
весна — лето |
|
|
Число животных, n 1 |
73 |
48 |
|
Доля ярок, пришедших в охоту, % |
90,41±3,45** |
64,58±6,90 ** |
|
Число животных, n 2 |
42 |
25 |
|
Доля ярок, имеющих ЖТ1, % |
92,50±3,97 |
80,00±10,69 |
|
Среднее число ЖТ1 |
2,02±0,15 ** |
1,28±0,19** |
|
Среднее число ЖТ у прореагировавших животных2 |
2,18±0,16 * |
1,62±0,15* |
Пр и меч ани е. См. описание схемы 1 на рисунке 1. Сезон осень—зима включал период сентябрь-февраль, весна—лето — март-июль; n 1 — число животных, подвергшихся синхронизации полового цикла, n 2 — число животных, подвергшихся синхронизации полового цикла, у которых проводили исследование на наличия желтых тел (ЖТ); 1 — показатель в расчете на число ярок, пришедших в охоту; 2 — показатель в расчете на число ярок, пришедших в охоту и имеющих ЖТ.
*, ** Различия между группами статистически значимы соответственно при р ≤ 0,05 и р ≤ 0,01.
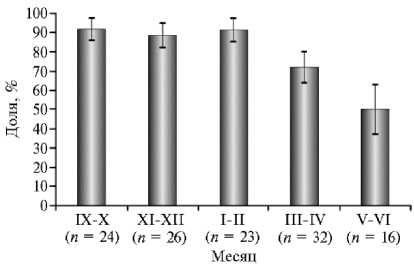
Рис. 2. Результативность синхронизации полового цикла у 1,5-2-месячных ярок романовской породы при гормональной обработке по схеме 1 и учете по 2-месячным интервалам: доля ярок, пришедших в охоту, от общего числа подвергшихся гормональной обработке, % ( M ±SEM; ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года). См. описание схемы 1 на рисунке 1.
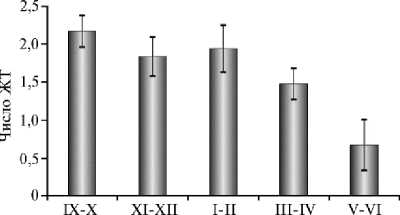
Мы установили достоверно большее число ЖТ у ярок, подвергшихся синхронизации полового цикла в осенне-зимний период, по сравнению с таковым в летне-весенний период (2,02 против 1,28, р ≤ 0,01), причем характер выявленных различий сохранялся и при расчете этого показателя для ярок, имеющих ЖТ (2,18 против 1,62, р ≤ 0,05) (см. табл. 3). Анализ изменения по 2-месячным периодам показал, что число ЖТ в среднем на одну ярку, пришедшую в охоту, больше в период с сентября по февраль — 1,832,17. В марте-апреле число идентифицированных ЖТ снижалось до 1,47, в мае-июне — опустилось до минимума за весь период эксперимента и составило 0,67 (рис. 3). Число ЖТ у ярок, пришедших в охоту и имеющих желтые тела, по указанным выше периодам года составило соответственно 1,83-2,38, 1,65 и 1,33.
(п = 12) (п = 14) (и = 16) (п = 19) (и = 6) Месяц
Рис. 3. Результативность синхронизации полового цикла у 1,5-2-месячных ярок романовской породы при гормональной обработке по схеме 1 и учете числа желтых тел (ЖТ) на одну ярку по 2-месячным интервалам: среднее число ЖТ в расчете на всех ярок, пришедших в охоту ( M ±SEM; ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Московская обл., с января 2021 года по декабрь 2022 года). См. описание схемы 1 на рисунке 1.
Классические протоколы синхронизации ПЦ у овец включают ин- травагинальное введение губки или интравагинального устройства, содержащего прогестерон (CIDR) и пропитанного флюрогестонацетатом или медроксипрогестероном, в сочетании с внутримышечной инъекцией гонадотропина сыворотки жеребой кобылы (ГСЖК) на дату охоты (20, 32). Также применяются различные варианты этого протокола (табл. 4), но в подавляющем большинстве случаев гормональная синхронизация эструса не дает 100 % результативности в отношении числа животных, пришедших в охоту: только при одной схеме из 25 проанализированных нами (см. табл. 4) все обработанные животные проявляли признаки охоты (20). В остальных вариантах результативность синхронизации в зависимости от используемой схемы и породы овец варьировала от 59,1 до 96,0 %. Также остается нерешенной проблема преодоления сезонности при гормональной стимуляции охоты у этого вида животных (26).
-
4. Результативность синхронизации полового цикла у разных пород овец в зависимости от схемы гормональной обработки
|
Схема — препарат/устройство (сутки относительно прогнозируемой даты прихода в охоту) |
Пришедшие в охоту, % от числа обработанных |
Порода |
Ссылка |
|
ПГF2 α ( - 13, - 2) |
80,17 |
Романовская |
Настоящая |
|
ГнРГ ( - 9), ПГ F2 α ( - 2) |
66,67 |
работа |
|
|
CIDR (с - 7 по 0) |
89 |
Саутдаун, рамбулье, колумбий- |
(19) |
|
CIDR (с - 7 по 0), ПГ F2 α (0) |
93 |
ская, суффолк ½ гемпшир, рома- |
|
|
CIDR (с - 14 по 0) |
93 |
новская ½ белый дорпер, романовская ½ катадин |
|
|
CIDR (с - 10 по 0) |
68 |
Бургская |
(19) |
|
CIDR (с - 19 по 0) CIDR(с - 6 по 0), ПГF2 α ( - 6), ГСЖК (0), ЭБ (+1) |
72 100 |
Дорпер |
(20) |
|
ПГ-губка (с - 14 по 0), ГСЖК (0) |
76,7 |
Лакон, сегурено, сегурено ½ ро- |
(21) |
|
ПГ-губка (с - 7 по 0), ПГF2 α ( - 7), ГСЖК (0) |
80 |
мановская |
|
|
ПГ-губка (с - 7 по 0), ГСЖК + ПГF2 α (0) |
90 |
||
|
ПГ-губка (с - 14 по 0), ГСЖК (0) |
80 |
||
|
ПГ-губка (с - 7 по 0) + ПГF2 α ( - 7), ГСЖК (0) |
79,2 |
||
|
ПГ-губка (с - 7 по 0), ГСЖК (0), ПГ F2 α (0) |
59,1 |
||
|
ПГ-губка (с - 13 по - 2), ПГF2 α ( - 4), ГнРГ (0) |
70 |
Китайская овца Ху |
(15) |
|
ПГ-губка (с - 13 по - 2), ПГF2a + ГСЖК) ( - 4) |
83,3 |
||
|
ПГ-губка (с - 13 по - 2), ПГF2 α + ГСЖК ( - 4), ГнРГ (0) |
86,7 |
||
|
ПГ-губка (с - 13 по 0), ПГF2 α ( - 1), ГнРГ (0) |
80 |
||
|
ПГ-губка (с - 13 по 0), ГнРГ (0) |
76,7 |
||
|
CIDR (с - 5 по 0) |
89 |
Колумбийская, гемпширская |
(33) |
|
CIDR (с - 5 по 0), ПГF2 α (0) |
77 |
||
|
GnRH ( - 5), CIDR (с - 5 по 0), ПГF2 α (0) |
75 |
||
|
CIDR (с - 5 по 0) |
78 |
Рогатый дорсет, катадин |
|
|
CIDR (с - 5 по 0), ПГF2 α (0) |
90 |
||
|
GnRH ( - 5), CIDR (с - 5 по 0), |
96 |
ПГF2 α (0)
Примечание. ГнРГ — гонадотропный регизинг-гормон, ГСЖК — гонадотропин сыворотки жеребой кобылы, ЭБ — эстрадиол-бензоат, ПГ F2 α — простагландин F2 α , ПГ-губка — прогестогеновая интравагинальная губка, CIDR — устройство для контролируемого внутреннего высвобождения препарата.
В отличие от описанных выше подходов, в настоящем исследовании для стимуляции ПЦ использовалась либо 2-кратная инъекция ПГF2 α за 13 и 2 сут до предполагаемой даты прихода животных в охоту (схема 1), либо инъекции ГнРГ за 9 сут и ПГF2 α — за 2 сут до наступления охоты (схема
-
2). Обе схемы гормональной обработки (хотя и в разной степени) показали эффективность при стимуляции эструса у половозрелых ярок (см. табл. 2, 3). Тем не менее в течение года (за исключением периода июль-август) средняя результативность для схемы 1 была выше, чем для схемы 2, и составила 80,17 %, что сопоставимо с традиционными протоколами (см. табл. 4). Кроме того, с сентября по декабрь 2-кратной введение ПГF2 α обеспечивало стимуляцию эструса у 100 % обработанных половозрелых ярок, что соответствовало результату при использовании CIDR в комбинации с ПГF2 α , ГСЖК и эстрадиол-бензоатом (20). Следует отметить, что эффективность схемы 1 снижалась лишь в летний период.
Итак, проведенные нами исследования по синхронизации полового цикла у овец романовской породы показали достоверное влияние применяемой схемы гормональной обработки ( F = 5,21; p = 0,024) и сезона года ( F = 13,82; p = 0,0003) на долю ярок, пришедших в охоту. Более высокую результативность по этому показателю обеспечивала схема, основанная на 2-кратной инъекции простагландина F2 α на - 13 и - 2 сут до предполагаемой даты прихода животных в охоту (0 сут), по сравнению со схемой, предусматривающей введение гонадотропного релизинг-гормона на - 9 сут и простагландина F2 α на - 2 сут (80,17 против 66,67 %). Вместе с тем при использовании второй схемы все ярки, проявившие признаки охоты, имели в яичниках желтые тела (ЖТ), тогда как при первой схеме их доля составила 90,77 % (р ≤ 0,05). Отмечена лучшая реакция животных на гормональную обработку в течение полового сезона: в осенне-зимний период (сентябрь-февраль) доля ярок, пришедших в охоту, среднее число ЖТ у ярок, пришедших в охоту, и среднее число ЖТ у ярок, имеющих ЖТ, были достоверно выше, чем в весенне-летний период (март-июль): соответственно 90,41 против 64,58 % (р ≤ 0,01); 2,02 против 1,28 (р ≤ 0,01) и 2,18 против 1,62 (р ≤ 0,05). Для синхронизации полового цикла у ярок романовской породы мы рекомендуем использование 2-кратной инъекции простагландина F2 α на - 13 и - 2 сут до предполагаемой даты прихода в охоту. По доле ярок, пришедших в охоту, эффективность предлагаемой нами схемы сопоставима с описанной другими авторами, а в ряде случаев превышает ее.
Список литературы Результативность синхронизации полового цикла у ярок (Ovis aries L.) романовской породы в зависимости от схемы гормональной стимуляции и сезона года
- Айбазов А.-М.М., Мамонтова Т., Коваленко Д., Губаханов М. Итоги и перспективы использования биотехнологических методов и приемов в воспроизводстве мелких жвачных. Сельскохозяйственный журнал, 2021, 14(1): 2687-1246 (doi: 10.25930/2687-1254/009.1.14.2021).
- Wei S., Chen S., Wei B., Liu Z., Bai T., Lin J. Estrus synchronization schemes and application efficacies in anestrus lanzhou fat-tailed ewes, Journal of Applied Animal Research, 2016, 44: 466-73 (doi: 10.1080/09712119.2015.1091350).
- Garoussi M.T., Mavadati O., Bahonar M., Ragh M.J. The effect of medroxyprogesterone acetate with or without eCG on conception rate of fat-tail ewes in out of breeding season. Tropical Animal Health and Production, 2020, 52(4): 1617-1622 (doi: 10.1007/s11250-019-02159-8).
- Hasani N., Ebrahimi M., Ghasemi-Panahi B., HosseinKhani A. Evaluating reproductive perfor-mance of three estrus synchronization protocols in Ghezel ewes. Theriogenology, 2018, 122: 9-13 (doi: 10.1016/j.theriogenology.2018.07.005).
- Rosasco S.L., Beard J.K., Hallford D.M., Summers A.F. Evaluation of estrous synchronization protocols on ewe reproductive efficiency and profitability. Animal Reproduction Science, 2019, 210: 106191 (doi: 10.1016/j.anireprosci.2019.106191).
- Зиновьева Н.А., Позябин С.В., Чинаров Р.Ю. Вспомогательные репродуктивные технологии: история становления и роль в развитии генетических технологий в скотоводстве. Сельскохозяйственная биология, 2020, 55(2): 225-242 (doi: 10.15389/agrobiology.2020.2.225rus).
- Menchaca A., Dos Santos-Neto P.C., Cuadro F., Souza-Neves M., Crispo M. From reproductive technologies to genome editing in small ruminants: an embryo's journey. Animal Reproduction, 2018, 15(Suppl. 1): 984-995 (doi: 10.21451/1984-3143-AR2018-0022).
- Li H., Wang G., Hao Z., Zhang G., Qing Y., Liu S., Qing L., Pan W., Chen L, Liu G., Zhao R., Jia B., Zeng L., Guo J., Zhao L., Zhao H., Lv C., Xu K., Cheng W., Li H., Zhao H.Y., Wang W., Wei H.J. Generation of biallelic knock-out sheep via gene-editing and somatic cell nuclear trans-fer. Scientific Reports, 2016, 6: 33675 (doi: 10.1038/srep33675).
- Paramio M.T., Izquierdo D. Recent advances in in vitro embryo production in small ruminants. Theriogenology, 2016, 86(1): 152-159 (doi: 10.1016/j.theriogenology.2016.04.027).
- Ungerfeld R., Ramos M.A., González-Pensado S.P. Ram effect: adult rams induce a greater reproductive response in anestrous ewes than yearling rams. Animal Reproduction Science, 2008, 103(3-4): 271-277 (doi: 10.1016/j.anireprosci.2006.12.013).
- Pellicer-Rubio M.T., Leboeuf B., Bernelas D., Forgerit Y., Pougnard J.L., Bonné J.L., Senty E., Breton S., Brun F., Chemineau P. High fertility using artificial insemination during deep anoes-trus after induction and synchronisation of ovulatory activity by the “male effect” in lactating goats subjected to treatment with artificial long days and progestogens. Animal Reproduction Sci-ence, 2008, 109(1-4): 172-188 (doi: 10.1016/j.anireprosci.2007.11.026).
- Lassoued N., Khaldi G., Cognié Y., Chemineau P., Thimonier J. Effet de la progestérone sur le taux d'ovulation et la durée du cycle ovarien induits par effet mâle chez la brebis Barbarine et la chèvre locale tunisienne [Effect of progesterone on ovulation length and duration of the ovarian cycle induced by the male effect in the Barbarine ewe and the local Tunisian goat]. Reproduction Nutrition Development, 1995, 35(4): 415-426 (doi: 10.1051/rnd:19950406).
- Abecia J.A., Forcada F., González-Bulnes A. Hormonal control of reproduction in small ruminants. Animal Reproduction Science, 2012, 130(3-4): 173-179 (doi: 10.1016/j.anireprosci.2012.01.011).
- Habeeb H.M.H., Anne Kutzler M. Estrus synchronization in the sheep and goat. The Veterinary Clinics of North America. Food Animal Practice, 2021, 37(1): 125-137 (doi: 10.1016/j.cvfa.2020.10.007).
- Yu X., Bai Y., Yang J., Zhao X., Zhang L., Wang J. Comparison of five protocols of estrous synchronization on reproductive performance of Hu sheep. Frontiers in Veterinary Science, 2022, 9: 843514 (doi: 10.3389/fvets.2022.843514).
- dos Santos-Neto P.C., García-Pintos C., Pinczak A., Menchaca A. Fertility obtained with dif-ferent progestogen intravaginal devices using short-term protocol for fixed-time artificial insemi-nation (FTAI) in sheep. Livestock Science, 2015, 182: 125-128 (doi: 10.1016/j.livsci.2015.11.005).
- Jordan K.M., Inskeep E.K., Knights M. Use of gonadotropin releasing hormone to improve reproductive responses of ewes introduced to rams during seasonal anestrus. Animal Reproduction Science, 2009, 116(3-4): 254-264 (doi: 10.1016/j.anireprosci.2009.02.006).
- Powell M.R., Kaps M., Lamberson W.R., Keisler D.H. Use of melengestrol acetate-based treat-ments to induce and synchronize estrus in seasonally anestrous ewes. Journal of Animal Science, 1996, 74(10): 2292-2302 (doi: 10.2527/1996.74102292x).
- Harl A.W. Comparison of short-term vs. long-term estrous synchronization protocols using CIDR devices in sheep and goats during and outside the natural breeding season. Kansas State University, 2014. Режим доступа: http://hdl.handle.net/2097/18288. Дата обращения 31.01.2023.
- Gonzalez E.C.G., Cruz U.M., Reyes L.A., Morales J.V.V., Perez R.V., Zuniga S, Ponce J.L. Parity of the Dorper sheep does not influence the reproductive and productive response when they are synchronized with an “ultra-short” protocol. Open Access Journal of Science, 2018, 2(3): 193-196 (doi: 10.15406/oajs.2018.02.00069).
- Martinez-Ros P., Gonzalez-Bulnes A., Garcia-Rosello E., Rios-Abellan A., Astiz S. Effects of short-term intravaginal progestagen treatment on fertility and prolificacy after natural breeding in sheep at different reproductive seasons. Journal of Applied Animal Research, 2019, 47(1): 201-205 (doi: 10.1080/09712119.2019.1599899).
- Laliotis V., Vosniakou A., Zafrakas A., Lymberopoulos A., Alifakiotis T. The effect of melatonin on lambing and litter size in milking ewes after advancing the breeding season with progestagen and PMSG followed by artificial insemination. Small Ruminant Research, 1998, 31(1): 79-81 (doi: 10.1016/S0921-4488(98)00108-4).
- Kridli R.T., Husein M.Q., Muhdi H.A., Al-Khazaleh J.M. Reproductive performance of hormo-nally-treated anestrous Awassi ewes. Animal Reproduction, 2006, 3(3): 347-352.
- Stellflug J.N., Rodriguez F., LaVoie V.A., Glimp H.A. Influence of simulated photoperiod alter-ation and induced estrus on reproductive performance of spring-born Columbia and Targhee ewe lambs. Journal of Animal Science, 1994, 72(1): 29-33 (doi: 10.2527/1994.72129x).
- Rutigliano H.M., Adams B.M., Jablonka-Shariff A., Boime I., Adams T.E. Effect of time and dose of recombinant follicle stimulating hormone agonist on the superovulatory response of sheep. Theriogenology, 2014, 82(3): 455-460 (doi: 10.1016/j.theriogenology.2014.05.010).
- Pampori A.Z., Ahmad Sheikh A., Aarif O., Hasin D., Ahmad Bhat I. Physiology of reproductive seasonality in sheep — an update. Biological Rhythm Research, 2020, 51(4): 586-598 (doi: 10.1080/09291016.2018.1548112).
- Mekuriaw Z., Assefa H., Tegegne A., Muluneh D. Estrus response and fertility of Menz and crossbred ewes to single prostaglandin injection protocol. Tropical Animal Health and Production, 2016, 48(1): 53-57 (doi: 10.1007/s11250-015-0919-z).
- Ramírez A.A., Villalvazo V.M.M., Arredondo E.S., Ramírez H.A.R., Sevilla H.M. D-Cloprostenol enhances estrus synchronization in tropical hair sheep. Tropical Animal Health and Pro-duction, 2018, 50(5): 991-996 (doi: 10.1007/s11250-018-1522-x).
- Луканина В.А., Чинаров Р.Ю., Тарадайник Н.П. Сравнительное исследование результа-тивности двух схем синхронизации половой охоты у овец. Зоотехния, 2021, 12: 31-33 (doi: 10.25708/ZT.2021.51.73.009).
- Ерохин А.С. Современные методы синхронизации эструса у овец. Овцы, козы, шерстяное дело, 2011, 4: 4-8.
- Choudhary K.K., Kavya K.M., Jerome A., Sharma R.K. Advances in reproductive biotechnolo-gies. Veterinary World, 2016, 9(4): 388-395 (doi: 10.14202/vetworld.2016.388-395).
- Martinez M.F., McLeod B., Tattersfield G., Smaill B., Quirke L.D., Juengel J.L. Successful induction of oestrus, ovulation and pregnancy in adult ewes and ewe lambs out of the breeding season using a GnRH+progesterone oestrus synchronisation protocol. Animal Reproduction Sci-ence, 2015, 155: 28-35 (doi: 10.1016/j.anireprosci.2015.01.010).
- Jackson C.G., Neville T.L., Mercadante V.R.G., Waters K.M., Lamb G.C., Dahlen C.R., Red-den R.R. Efficacy of various five-day estrous synchronization protocols in sheep. Small Ruminant Research, 2014, 120(1): 100-107 (doi: 10.1016/j.smallrumres.2014.04.004).


