Результаты двухэтапного эндопротезирования у пациентов с перипротезной инфекцией тазобедренного сустава (ретроспективное когортное исследование)
Автор: Тряпичников Александр Сергеевич, Камшилов Борис Викторович, Колотыгин Денис Анатольевич, Белокрылов Николай Михайлович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.28, 2022 года.
Бесплатный доступ
Введение. Перипротезная инфекция (ППИ) представляет собой серьезный вызов для травматологов-ортопедов. Двухэтапная ревизия с использованием спейсера, импрегнированного антибиотиком, является одним из самых распространенных методов лечения перипротезной инфекции. Цель. Оценить функциональные результаты второго этапа ревизионного эндопротезирования у пациентов с ППИ и определить выживаемость компонентов эндопротеза. Материалы и методы. Мы ретроспективно изучили результаты второго этапа лечения (удаление спейсера и установку эндопротеза) у 23 пациентов, поступивших в отделение за период 2016-2019 гг. Всем пациентам в ходе первого этапа лечения был установлен спейсер. Средний возраст пациентов составил 53,7 ± 2,2 года. Преобладали мужчины (91,3 %). Результаты. У троих пациентов возник рецидив инфекции за период наблюдения 44,4 ± 1,9 месяца. Эффективность ревизионного эндопротезирования, произведенного в качестве второго этапа лечения, составила 87 %. Оценка по Harris Hip Score до выполнения второго составляла 42,3 ± 2,5 балла, на момент последнего контрольного осмотра была статистически значимо выше - 78,32 ± 3,8 балла (p = 0,000052; Z - 4,04). Обсуждение. На успешность выполнения двухэтапного ревизионного эндопротезирования влияют факторы, связанные с коморбидностью пациента, патогенностью возбудителя, выявленного на первом этапе, а также особенностями используемых имплантов и хирургической тактики. Заключение. Выполнение второго этапа ревизионного эндопротезирования у пациентов, которым ранее был установлен спейсер с антибиотиком для лечения перипротезной инфекции, значительно улучшило их функциональное состояние. Выживаемость имплантов по Kaplan-Meier составила 77,5 %.
Перипротезная инфекция, двухэтапное ревизионное эндопротезирование, артикулирующий спейсер, преформированный спейсер
Короткий адрес: https://sciup.org/142234245
IDR: 142234245 | УДК: 616.728.2-089.843-77-022.7
Текст научной статьи Результаты двухэтапного эндопротезирования у пациентов с перипротезной инфекцией тазобедренного сустава (ретроспективное когортное исследование)
Перипротезная инфекция (ППИ) после тотального эндопротезирования тазобедренного сустава – это серьезный вызов для травматологов-ортопедов, а лечение представляет собой трудоемкий и дорогостоящий процесс. Целью лечения является попытка сохранить опороспособность конечности, эрадикация инфекции и восстановление функции сустава [1–3]. Наиболее распространенные варианты лечения ППИ – это одно-и двухэтапные ревизии (с использованием спейсера, импрегнированного антибактериальными препаратами). По современным данным, прогноз относительно контроля инфекции колеблется в диапазоне 84– 100 % [3–6]. Использование спейсера при двухэтапном ревизионном эндопротезировании тазобедренного су-
става обеспечивает более высокий уровень комфорта для пациента, чем простое удаление инфицированного импланта на первом этапе [3, 7–9].
Данные крупнейшего отечественного регистра свидетельствуют, что при септических ревизиях двухэтапный метод лечения применяется в 78 %, а одноэтапный в 13 % случаев [10]. Двухэтапные ревизии являются методом выбора у пациентов с системным характером инфекции, наличием свищевого хода, обширным гнойным поражением периартикулярных мягких тканей и высоковирулентным возбудителем [3, 11]. По мнению многих исследователей, установка спейсера с антибактериальными препаратами позволяет добиться эради-кации инфекции, а использование артикулирующего спейсера улучшает функциональные результаты и снижает число осложнений [9, 11].
Целью данного исследования была оценка функциональных результатов второго этапа ревизионного эндопротезирования у пациентов с ППИ и определение выживаемости компонентов эндопротеза.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе ретроспективного обзора были выявлены пациенты, поступившие в отделение для выполнения второго этапа лечения в период с 2016 по 2019 г. Все пациенты ранее получали лечение по поводу перипротезной инфекции, в ходе первого этапа лечения было выполнено удаление импланта, дебридмент и установка спейсе-ра. Пациенты, которым не был установлен спейсер на первом этапе, не были включены в исследование. Мы придерживались диагностических критериев ICM 2018, утвержденных на второй Международной конференции по скелетно-мышечной инфекции, для исключения ППИ перед выполнением второго этапа. Критерии исключения из исследования применялись в ходе предоперационного обследования и самой операции. Так, при выявлении признаков инфекционного воспаления тканей в процессе операции выполнялась переустановка спейсера, и данный пациент исключался из исследования. Таким образом в наше ретроспективное когортное исследование было включено 23 пациента, которые наблюдались в послеоперационном периоде не менее двух лет (рис. 1).
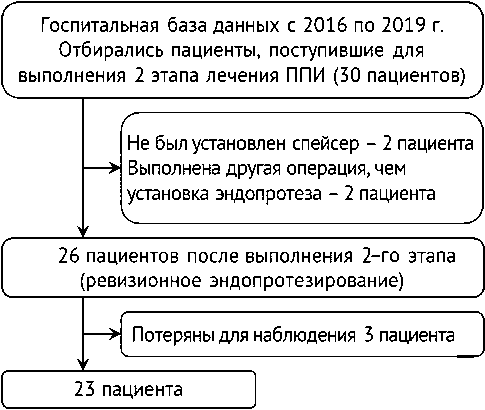
Рис. 1. Блок-схема дизайна исследования
В исследуемой когорте преобладали пациенты мужского пола – 91,3 %. Средний возраст пациентов составил 53,7 ± 2,2 года (min – 37; max – 78). Восемь пациентов (34,7 %) имели в анамнезе ранее выполненные ревизии по поводу ППИ. 14 операций было выполнено под спинноэпидуральной анестезией, у девяти пациентов применялся эндотрахеальный наркоз с катетеризацией эпидурального пространства. Основные демографические характеристики пациентов представлены в таблице 1.
Таблица 1
Основные демографические показатели пациентов
Примечание : ИМТ – индекс массы тела; АSA – американская ассоциация анестезиологов; ДПК – двенадцатиперстная кишка; ДИ – доверительный интервал; СОЭ – скорость оседания эритроцитов, СРБ – С-реактивный белок.
Рентгенологическая и функциональная оценка
До и после операции всем пациентам выполнялась рентгенография таза и тазобедренного сустава в двух проекциях. При необходимости дополнительной визуализации дефектов костной ткани применялась компьютерная томография. Для оценки стабильности компонентов эндопротеза во время последнего осмотра в послеоперационном периоде выполнялась рентгенография таза и тазобедренного сустава. Оценка клинико-функционального состояния пациентов проводилась по шкале Harris Hip Score (HHS).
Лечение
Перед поступлением на лечение диагностическая пункция была выполнена у всех пациентов, роста возбудителя выявлено не было. Интервал между первым и вторым этапом составлял в среднем 13,3 ± 1,9 месяца. Все операции были выполнены двумя бригадами хирургов.
Таблица 2
Данные о проведенных в ходе второго этапа реэндопротезированиях
|
Параметр |
Показатель |
|
Количество пациентов |
23 |
|
Длительность операции (минуты) |
214 ± 11 (min – 100; max – 315); ДИ (167; 221) |
|
Объем интраоперационной кровопотери (мл) |
788 ± 67 (min – 300;max – 1400); ДИ (650; 927) |
|
Гемотрансфузии |
9 пациентов |
|
Выявленный возбудитель |
St. Aureus + St. epidermidis – 1 (4,3 %) |
|
St. Iugdunensis – 1 (4,3 %) |
|
|
E. faecalis – 1 (4,3 %) |
|
|
Не выявлен – 20 (87 %) |
Для удаления спейсера, проведения дебридмента и установки ревизионного эндопротеза был использован прямой латеральный хирургический доступ. У 11 пациентов (48 %) в исследуемой группе в ходе первого этапа были установлены преформированные спейсеры. Артикулирующие (30,5 %) и неартикулирующие спейсеры (21,5 %) были установлены у семи и пяти больных соответственно. Материал, полученный в ходе оперативного вмешательства, отправлялся на микробиологическое исследование. У 16 пациентов (69,5 %) с целью реконструкции поврежденных структур и восполнения дефектов использовалась импакци-онная костная пластика и танталовые аугменты. Для классификации дефектов вертлужной впадины и бедра использовалась классификация Paprosky (табл. 3)
Таблица 3
Дефекты костей таза и бедренной кости
|
Параметр |
Исследуемая группа (23 пациента) |
|
Дефект костей вертлужной впадины (Paprosky) |
Type 1 – 2 пациента |
|
Type 2A – 4 пациента |
|
|
Type 2B – 7 пациентов |
|
|
Type 2C – 2 пациента |
|
|
Type 3A – 5 пациентов |
|
|
Type 3B – 3 пациента |
|
|
Дефект бедренной кости (Paprosky) |
Type 1 – 4 пациента |
|
Type 2 – 10 пациентов |
|
|
Type 3A – 7 пациентов |
|
|
Type 3B – 2 пациента |
Наблюдение после операции
Нам удалось проследить результаты лечения 23 пациентов, последний контрольный осмотр был проведен в срок от 26 до 56 месяцев (в среднем 44,4 ± 1,9 месяца; ДИ 38,7; 47,2). Во время осмотра и обследования определялся функциональный статус, выявлялись признаки асептической нестабильности, инфекции, регистрировались повторные вмешательства на данном суставе. Клинико-функциональное состояние пациентов оценивались при помощи опросника Harris Hip Score (HHS) до операции, затем через 1 год после операции либо во время последнего контрольного осмотра.
Статистика
Обработка данных выполнялась с использованием программы Statistica 13 (Statsoft, USA). Проверка данных на нормальность производилась с применением тестов Шапиро-Уилка и Колмогорова-Смирнова, в дальнейшем использовались методы непараметрической статистики. Для сравнения двух зависимых выборок использовался непараметрический критерий Вилкоксо-на. Критерий Манна-Уитни применялся для сравнения независимых выборок, а χ 2-тест – для категориальных переменных. Мы проанализировали выживаемость установленных в ходе второго этапа имплантов методом Каплана-Майера. Различия показателей считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ
Лечение было расценено успешным у пациентов в случаях, когда протез функционировал на момент последнего контрольного осмотра, а симптомы пери-протезной инфекции и асептической нестабильности отсутствовали. После операции рецидив инфекции был выявлен у трех пациентов (13 %). Во всех случаях пациенты получали лечение по протоколу двухэтапного ревизионного вмешательства, которое было успешно у одного больного. В двух других случаях окончательным исходом лечения была резекционная артропластика. Четверо пациентов умерло в послеоперационном периоде от причин, не связанных с су- ставной патологией. Таким образом, эффективность ревизионного эндопротезирования, произведенного в качестве второго этапа лечения, составила 87 %, а выживаемость имплантов по Kaplan-Meier – 77,5 % (рис. 2).
Мы выявили, что наличие у пациента вирусного гепатита «В» или «С» увеличивало вероятность рецидива (отношение шансов – 11,3; ДИ 0,76; 168). Также на вероятность повторной инфекции влиял возбудитель St. Aureus (p = 0,05) и септические ревизии в анамнезе (ОШ – 3,14; ДИ 0,28; 48,5). Повышение ИМТ более 30 (ОШ – 1,16; ДИ 0,088; 15,458) и длительность экс- судации из раны более 7 дней (ОШ – 0.93; ДИ 0,071; 12,137) не оказывали влияния на частоту рецидивов инфекции в данном исследовании.
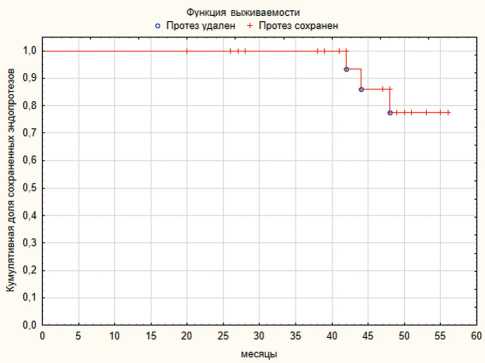
Рис. 2. Выживаемость установленных в ходе второго этапа эндопротезов по Каплану-Майеру – 77,5 %. Срок наблюдения 44,4 ± 1,9 месяца (min – 26; max – 56)
Перед выполнением второго этапа оценка по Харрису в исследуемой когорте была 42,3 ± 2,5 балла (min – 20, max – 65; ДИ 37,7; 47). После выполнения ревизионного эндопротезирования клинико-функциональное состояние пациентов статистически значимо улучшилось (p = 0,000052; Z – 4,04) и на момент последнего контрольного осмотра было оценено в среднем в 78,32 ± 3,8 балла (min – 34,5, max – 94,8; ДИ 70,1; 85,3).
Оценка по шкале Harris Hip Score у пациентов с установленными на первом этапе артикулирующими спейсе-рами была выше, чем у пациентов с неартикулирующими и преформированными спейсерами. После операции была выявлена статистически значимая разница (p = 0,045) между группами артикулирующих и преформированных спейсеров. Функциональные результаты после ревизион- ного эндопротезирования больных с артикулирующими спейсерами были не значимо выше результатов больных с неартикулирующими, но прослеживалась тенденция к статистической значимости (p = 0,052).
Таблица 4
Оценка по Harris Hip Score у пациентов до и после выполнения ревизионного эндопротезирования
|
Тип спейсера |
HHS до операции (баллы) |
HHS после операции (баллы) |
|
Преформированные спейсеры (11) |
44,4 ± 2 (min – 31; max – 65); ДИ (41; 50) |
70,1 ± 6,1 (min – 34,5; max – 94,8); ДИ (56,4; 84) |
|
Артикулирующие спейсеры (7) |
47,5 ± 2,6 (min – 40; max – 60); ДИ (41; 54) |
89,5 ± 2,12 (min – 80; max – 98); ДИ (56,4; 84) |
|
Неартикулирующие спейсеры (5) |
30,5 ± 3,5 (min – 20;max – 41); ДИ (20,9; 40,4) |
78,5 ± 4 (min – 62,8; max – 84,1); ДИ (67,3; 89,6) |
Повторные операции и осложнения
У 20 пациентов из 23, входивших в когорту, достигнут контроль инфекции. Кроме инфекционных осложнений были отмечены такие осложнения как интраоперационный перипротезный перелом бедра в двух случаях, а также два вывиха головки эндопротеза в раннем послеоперационном периоде. У обоих пациентов вывих был вправлен закрыто, у одного из них возник рецидив инфекции через 3 недели после ревизии. Для лечения троих больных с рецидивом инфекции применялась тактика двухэтапной ревизии, всем троим после удаления имплантов был установлен спейсер. При микробиологическом обследовании у данных пациентов был выявлен St. Aureus , у одного из них по-лимикробная инфекция ( St. Aureus и Kl. Pneumoniae ). Данные возбудители соответствовали тем, что были выявлены во время первого этапа лечения. В одном случае удалось успешно переустановить эндопротез, в остальных – окончательным результатом лечения была резекционная артропластика.
ОБСУЖДЕНИЕ
Данные мета-анализа 60 работ (3288 случаев) показывают, что частота реинфекции после двухэтапного эндопротезирования составляет 7,9 % [6]. Существует много факторов, которые влияют на успешность выполнения ревизионного эндопротезирования у пациентов, которым был установлен спейсер по поводу пери-протезной инфекции. В том числе факторы, связанные с коморбидностью пациента, патогенностью возбудителя, выявленного на первом этапе, а также особенностями используемых имплантов и хирургической тактики [13, 15–17].
По данным многих авторов, высокий индекс массы тела (ИМТ) увеличивает вероятность рецидивов инфекции [13, 18–20]. В некоторых работах не выявили такой взаимосвязи. Однако в нашем исследовании, как и в некоторых других [8], мы не выявили такой взаимосвязи. В данном исследовании на вероятность рецидива воспаления влияли ранее перенесенные септические ревизии и наличие у пациентов вирусного гепатита «B» или «С». Влияние хронического вирусного гепатита подтверждается и другими исследованиями, так, H.S. Bedair выявил, что пациенты, получавшие лечение по поводу вирусного гепатита, имели более низкую частоту периоперационных инфекций, чем пациенты, не получавшие противовирусного лечения [21, 22]. Наши результаты согласуются с данными L. Fagotti, который отмечал, что, если исходным возбудителем ППИ был St. Aureus, то это повышало риск инфекции в ходе двухэтапного лечения [13].
Широко используются преформированные, функционально артикулирующие и блоковидные спейсе-ры [23, 24]. Результаты многочисленных публикаций свидетельствуют о большей удовлетворенности пациентов и снижении числа осложнений при использовании артикулирующих спейсеров [3, 7, 8, 24, 25]. По результатам системного обзора 25 статей было выявлено, что при использовании преформированных, функционально артикулирующих и индивидуально изготовленных (блоковидных) спейсеров контроль инфекции был сопоставим и распределялся в пределах 93–96 % [24]. Однако результаты собственной работы, проведенной этими авторами, показали значимую разницу в полученном функциональном результате и эрадикации инфекции у пациентов с артикулирующими и преформированными спейсерами: 93 % против 78 % [9]. В нашем исследовании, если пациенты имели хорошую функцию перед вы- полнением второго этапа, то итоговая функциональная оценка после ревизионного эндопротезирования также была выше. Поэтому пациенты с ранее установленными артикулирующими спейсерами имели более высокую функцию на итоговом осмотре.
Авторы ряда публикаций пришли к выводу, что выживаемость бесцементных ножек при двухэтапных ревизиях выше, чем цементных [26–29]. В данном аспекте интересными представляются исследования, сообщающие о высокой частоте механических неудач (расшатываний) цементных ножек, имплантируемых в ходе ревизионного эндопротезирования после удаления спейсера [11, 29]. Основной причиной принято считать истончение и склероз на границе кости и цементного спейсера, что, в свою очередь, препятствует проникновению цемента в поврежденную во время ревизий губчатую кость компонента и ухудшает фиксацию бедренного компонента на втором этапе [28, 29]. Мы опирались на вышеприведенные аргументы, отдавая предпочтение бесцементным имплантам в своей работе.
В таблице 5 представлен обзор публикаций с результатами лечения перипротезной инфекции методом двухэтапного эндопротезирования. В приведенных статьях доля сохраненных имплантов после выполнения второго этапа была в пределах 70,8–100 %, что сопоставимо с нашими результатами.
Основным ограничением данной работы является ее ретроспективный дизайн и малое количество наблюдений, что могло повлиять на результаты. Выбор имплантов осуществлялся исходя из предпочтений хирурга и наличия эндопротезов на складе.
Таблица 5
Результаты двухэтапного эндопротезирования у пациентов с перипротезной инфекцией тазобедренного сустава (по данным литературы)
|
Автор |
Срок наблюдения после операции (лет) |
Количество оперированных суставов |
Интервал между первым и вторым этапами |
Доля сохраненных эндопротезов (с учетом асептического расшатывания), % |
Контроль инфекции, % |
|
Biring G.S., 2010 [7] |
12 |
48 |
5 месяцев |
80 |
89 |
|
F. Leung, 2011 [4] |
4,8 |
38 |
6 месяцев |
нет данных |
79 |
|
B. Shen, 2014 [11] |
6 |
33 |
20 недель |
100 |
100 |
|
J. D. Tsung, 2014 [30] |
6,7 |
42 |
20 недель |
70,8 |
84 |
|
D. Marczak, 2017 [3] |
2 |
45 |
5,5 месяцев |
нет данных |
91 |
|
J Včelák, 2018 [25] |
2 |
57 |
нет данных |
89,5 |
|
|
B.P. Chalmers, 2018 [8] |
5 |
131 |
нет данных |
77 |
88 |
|
C.W. Jones, 2019 [12] |
6,5 |
155 |
нет данных |
нет данных |
87 |
ЗАКЛЮЧЕНИЕ
Выполнение второго этапа ревизионного эндопротезирования у пациентов, которым ранее был установлен спейсер для лечения перипротезной инфекции, обусловило значимое улучшение функционального состояния (p = 0,000052; Z – 4,04). Выживаемость имплантов по Kaplan-Meier составила 77,5 %. Сравнение итоговых функциональных результатов показало, что использование артикулирующих спейсеров на первом этапе улучшает показатели функциональной оценки как в период ожидания ревизионного эндопротезирования, так и в отдаленном послеоперационном периоде.


