Результаты хирургического лечения больных с ишемической болезнью сердца и фибрилляцией предсердий
Автор: Богданов Юрий Игоревич, Попов Сергей Валентинович, Вечерский Юрий Юрьевич, Баталов Роман Ефимович, Затолокин Василий Викторович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.31, 2016 года.
Бесплатный доступ
Статья освещает проблему лечения фибрилляции предсердий (ФП) у больных ишемической болезнью сердца (ИБС), требующей прямой реваскуляризации миокарда. Несмотря на рост количества хирургических вмешательств по коррекции ФП во время операции прямой реваскуляризации, до сих пор две трети пациентов остаются без лечения. Приведены результаты одноцентрового, проспективного исследования по сравнению стандартной методики с этапным комбинированным подходом в лечении данной группы пациентов. Установлено, что у пациентов с ФП и ИБС, требующей коронарного шунтирования (КШ), добавление процедуры радиочастотной аблации (РЧА) повышает эффективность, а также не увеличивает периоперационную летальность.
Фибрилляция предсердий, ишемическая болезнь сердца, прямая реваскуляризация миокарда, эпикардиальная аблация, электрофизиологическое исследование
Короткий адрес: https://sciup.org/14920116
IDR: 14920116 | УДК: 616.12-089
Текст научной статьи Результаты хирургического лечения больных с ишемической болезнью сердца и фибрилляцией предсердий
ФП ассоциируется с повышенным риском инсульта и встречается у 6,1% пациентов, направленных на операцию КШ. Развитие хирургических методов лечения ФП привело к их широкому применению во время вмешательств на клапанах и коронарных артериях. Процедура Cox-maze III является сложной операцией по восстановлению синусового ритма. Разработанная в 1992 г., операция включает создание линейных разрезов как в левом, так и в правом предсердии для прерывания кругов макро ре-энтри, которые, как известно, ответственны за распространение ФП. Новые представления о патофизиологических механизмах ФП и развитие новых технологий аблации (РЧА и крио) способствовали тиражированию аблации при кардиохирургических операциях. На сегодняшний день изоляция легочных вен входит во все схемы лечения ФП [1].
Появление ФП в послеоперационном периоде является частым нарушением ритма сердца после операции прямой реваскуляризации миокарда. Так, по данным метаанализа, проведенного за период с 2003 по 2007 гг., 5098 пациентам без анамнеза ФП выполнялась изолированная прямая реваскуляризация миокарда. Дебют ФП после операции был зарегистрирован у 1122 пациентов (22%). Смертность в первые 30 дней была выше у пациентов с документированной ФП в послеоперационном периоде (3,1%) по сравнению с теми, у кого сохранялся синусо- вый ритм (1,6%). Таким образом, ФП в послеоперационном периоде является независимым предиктором общей и поздней смертности после изолированной операции КШ [2]. Патогенез ФП после операции прямой реваскуляризации миокарда остается неясным и предположительно разнообразным по своей природе. Преходящий характер ФП после КШ, по всей вероятности, указывает на аномальный автоматизм и замедленное проведение по предсердиям как возможный электрофизиологический механизм.
В среднем аблация ФП во время операции аортокоронарного шунтирования выполняется лишь у 27,5% пациентов от общего числа нуждающихся. Известно, что сама по себе успешная реваскуляризация миокарда не устраняет ФП [3].
Материал и методы
Данное клиническое исследование является проспективным, одноцентровым, контролируемым исследованием. В НИИ кардиологии (Томск) за период с 2012 по 2015 гг. выполнено 43 операции по коррекции ФП у пациентов с прямой реваскуляризацией миокарда. В исследование включены больные с верифицированной ИБС, показаниями к прямой реваскуляризации миокарда и документированной ФП. В исследование вошло 28 пациентов (в том числе 24 мужчины) в возрасте от 44 до 76 лет (средний возраст – 64,1±7,8) с ИБС, требующей прямой реваскуляризации, в сочетании с персистирующей и длительно персистирующей формами ФП, согласно рекомендациям по нарушениям ритма сердца 2012 г. [4].
При поступлении в стационар большинство пациентов предъявляли жалобы на перебои в работе сердца
Таблица 1
Клиническая характеристика пациентов
|
Показатели |
Первая группа (n=18) |
Вторая группа (n=10) |
|
Возраст, лет |
64,2±4 |
63,1±3,3 |
|
Длительно персистирующая ФП, n |
11 |
6 |
|
Персистирующая ФП, n |
7 |
4 |
|
ФВ,% |
65,3±2 |
62,5±3 |
|
Средние размеры ЛП, мм |
58,6±1,6 |
53,1±4,4 |
|
Аритмический анамнез, лет NYHA: |
3,2±0,7 |
3,3±1,3 |
|
I, % |
29,7 |
32,3 |
|
II, % |
70,3 |
67,7 |
|
Инфаркт в анамнезе, % |
28,8 |
33,2 |
|
Объем поражения коронарного русла Syntax (балл) |
24,5 |
25,3 |
|
Таблица 2 Частота рецидива ФП |
||
|
Показатели |
Первая группа (n=18) |
Вторая группа (n=10) |
|
Рецидив ФП (в ранний п/о период) |
5,6% |
30% |
|
Синусовый ритм (к 30-му дню после |
94,4% |
70% |
|
прямой реваскуляризации) |
(p<0,05) |
(p<0,05) |
(95%), учащенное сердцебиение, давящие боли за грудиной и одышку (91%). Все пациенты получали антиарит-мическую терапию на догоспитальном этапе. Однако у 95% пациентов она была неэффективна. На госпитальном этапе проводилось общеклиническое обследование: ЭКГ в 12 отведениях, клинический и биохимический анализ крови, трансторакальная эхокардиография, чреспищеводная эхокардиография для исключения тромбов в ушке левого предсердия, коронарография. Клиническая характеристика пациентов представлена в таблице 1.
В зависимости от использованной оперативной методики пациенты были распределены на 2 группы. Первой группе пациентов (n=18) выполнялась прямая реваскуляризация миокарда и эпикардиальная биполярная РЧА легочных вен и крыши левого предсердия с использованием биполярных электродов Atricure и резекцией ушка левого предсердия, а также электрофизиологическое исследование через 16±7 дней после операции и катетерная эндокардиальная антральная изоляция легочных вен при обнаружении восстановления проведения в них (n=13). Второй группе пациентов выполнялась прямая реваскуляризация миокарда и биполярная эпикардиальная аблация по вышеописанной схеме (n=10). Пациентам обеих групп выполнена перевязка ушка левого предсердия для предотвращения образования тромбов. Результаты оценивались по количеству рецидивов ФП, в том числе и суточному мониторированию ЭКГ. Холтеровское мониторирование (ХМ) ЭКГ проводилось на 7-е сутки (ранний послеоперационный период) и 30-е сутки после прямой реваскуляризации миокарда.
Результаты и обсуждение
По клинической характеристике пациентов достоверных различий между группами не выявлено, группы оказались сопоставимы. В первой группе в послеоперационном периоде синусовый ритм сохранялся у всех пациентов (100%), рецидив ФП к 30-м суткам после операции прямой реваскуляризации зарегистрирован у одного пациента (5,6%). Во второй группе 9 пациентов (90%) были свободны от ФП в ранний послеоперационный период, у 3 пациентов (30%) зарегистрированы рецидивы ФП к 30-м суткам после операции (табл. 2). По данным ЭФИ, электрическая изоляция всех легочных вен после биполярной эпикардиальной аблации была достигнута у 5 пациентов (27,7%). У остальных больных было выявлено восстановление проведения в легочные вены (72,3%). Во всех случаях восстановления проведения выполнена антральная изоляция легочных вен, достигнуты электрофизиологические критерии их изоляции. По результатам наблюдения, к 30-му дню после прямой реваскуляризации синусовый ритм сохранялся у 17 из 18 пациентов первой группы (94,4%), результаты представлены на рисунке 1 (p<0,05). Осложнение в виде кровотечения зарегистрировано у одного пациента первой группы (5,5%), что потребовало ревизии послеоперационной раны в первые сутки после операции и переливания свежезамороженной плазмы. Источником кровотечения являлась коллатераль левой внутренней грудной артерии. Летальных исходов в обеих группах не зарегистрировано. Согласно последним данным, восстановление проведения
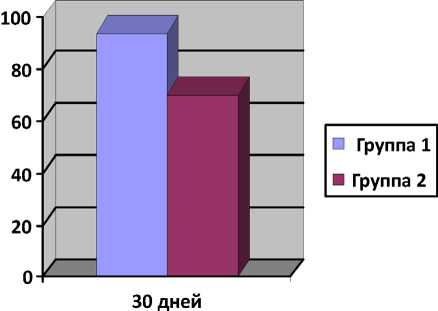
Рис. 1. Эффективность процедуры к 30-м суткам в легочных венах очень часто наблюдается среди пациентов, свободных от ФП, это же было продемонстрировано в проведенном исследовании. Полученные результаты подтверждают необходимость дальнейшего изучения роли восстановления проведения в легочных венах в развитии рецидивов после процедуры аблации. Высокий показатель восстановления проведения в легочных венах указывает на важность верификации электрофизиологических изменений после эпикардиальной аблации. Подобный подход позволяет улучшить результаты путем достижения большей трансмуральности, устранения прорывов аблационных линий и нанесения дополнительных воздействий на этапе электрофизиологического исследования и катетерной аблации.
Заключение
По данным проведенного исследования, применение электрофизиологического контроля изоляции легочных вен с возможностью нанесения катетерного радиочастотного воздействия после выполнения стандартной хирургической методики коррекции ФП у пациентов с прямой реваскуляризацией миокарда повышает эффективность процедуры. В исследовании отмечено, что частота рецидивов значительно ниже в группе применения комбинированного этапного подхода по сравнению со стандартной методикой и составляет 5,6 и 30% соответственно. Восстановление проведения в легочные вены зарегистрировано у 72,3% пациентов. У одного пациента первой группы (5,5%) развилось осложнение в виде кровотечения из коллатерали левой внутренней грудной артерии, что не повлияло на исход лечения. Для верификации полученных результатов требуются дальнейшие исследования на большем количестве пациентов с оценкой отдаленной эффективности.
Список литературы Результаты хирургического лечения больных с ишемической болезнью сердца и фибрилляцией предсердий
- Gillinov A.M., Gelijns A.C., Parides M.K. et al. Surgical ablation of atrial fibrillation during mitral-valve surgery//N. Engl. J. Medicine. -2015. -Vol. 372(15). -P. 1399-1409.
- La Meir M., Gelsomino S., Nonneman B. The problem with concomitant atrial fibrillation in non-mitral valve surgery//Ann. Cardiothorac. Surg. -2014. -Vol. 3(1). -P. 124-129.
- Bramer S.L., Van Straten A.H., Soliman Hamad M.A. et al. The impact of new-onset postoperative atrial fibrillation on mortality after coronary artery bypass grafting//Ann. Thorac. Surg. -2010, Aug. -Vol. 90(2). -P. 443-449.
- Calkins H., Kuck K.H., Cappato R. et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design//Europace. -2012. -Vol. 14. -P. 528-606.


