Результаты хирургической аллопластики дефектов костной ткани различной локализации при переломах дистального отдела плечевой кости
Автор: Давыдов А.П., Чибриков А.Г., Ульянов В.Ю., Норкин И.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.31, 2025 года.
Бесплатный доступ
Введение. В настоящее время после хирургического лечения до 30 % пациентов с переломами дистального отдела плечевой кости получают стойкую утрату трудоспособности. Актуальным является совершенствование оперативных методик, обеспечивающих восстановление анатомической целостности данного сегмента. Цель работы — выполнить сравнительный анализ результатов хирургической пластики костных дефектов с применением донорского блочного и кубического кадаверного аллотрансплантатов на основании оценки жесткости костной ткани и васкуляризации зоны трансплантации при переломах дистального отдела плечевой кости с дефектами различной локализации. Материалы и методы. Объектом исследования стали 56 пациентов с переломами дистального отдела плечевой кости, которые разделены на три группы в зависимости от локализации дефекта и две подгруппы в зависимости от способа хирургической пластики. Сравнительный анализ исходов лечения проведен на основании значений показателей индекса васкуляризации зоны замещения дефекта, полученных при ультразвуковом исследовании, а также значений индекса Хаунсфилда, полученных при компьютерной томографии поврежденного сегмента. Оценке подвергали участок аллотрансплантации, разделенный на три зоны интереса, — центральную, краевую и нативную костные структуры. Результаты. Применение блочного аллотрансплантата способствует увеличению значений индекса Хаунсфилда через 3 мес. после операции в центральной трансплантатной зоне при дефекте медиальной колонны до значения 190 HU (p = 0,01), при латеральном дефекте — до 185 HU (p = 0,01), при центральном дефекте — до 170 HU (p = 0,03). В краевой зоне трансплантата значение индекса Хаунсфилда через 3 мес. после операции повышается при медиальном дефекте до 210 HU (p = 0,01), латеральном дефекте — до 200 HU (p = 0,01), центральном дефекте — до 185 HU (p = 0,02). Использование данной технологии способствует повышению значений индекса васкуляризации зоны замещения при дефекте медиальной колонны в 1,2 раза (p = 0,01), латеральной колонны — в 1,15 (p = 0,01), центральной зоны — в 1,18 (p = 0,02). Обсуждение. Применение блочного аллотрансплантата способствует увеличению жесткости костной ткани в краевой и центральной зонах замещения дефекта через 3 мес. после операции, особенно при его локализации в области медиальной и латеральной колонн, способствует усилению интенсивности кровотока в зоне замещения дефекта через 2 мес. после операции. Заключение. Сравнение результатов пластики посттравматических костных дефектов при оскольчатых переломах дистального отдела плечевой кости показало преимущество использования нативного блочного аллотрансплантата при дефектах латеральной и медиальной колонн ввиду оптимизации остеоинтеграционных процессов в зоне замещения в среднесрочном послеоперационном периоде.
Плечевая кость, оскольчатый перелом, хирургическое лечение, аллотрансплантат, жесткость костной ткани, васкуляризация
Короткий адрес: https://sciup.org/142245417
IDR: 142245417 | УДК: 616.717.46-001.514-06:616.71-004.8-089.843-089.168 | DOI: 10.18019/1028-4427-2025-31-4-415-423
Текст научной статьи Результаты хирургической аллопластики дефектов костной ткани различной локализации при переломах дистального отдела плечевой кости
Оскольчатые переломы дистального отдела плечевой кости (ДОПК) являются тяжелой травматической патологией и встречаются в популяции с частотой 5,7 случаев на 100 тыс. взрослого населения, составляя до 15 % от всех травм плечевой кости [1]. В молодом трудоспособном возрасте подобные повреждения являются следствием высокоэнергетического механизма получения травмы, у пострадавших старшей возрастной группы — низкоэнергетического механизма в результате падений с высоты собственного роста на локтевой сустав. Учитывая бимодальность популяционного распределения данного вида повреждений, актуальность данной проблемы не вызывает сомнений в связи с увеличением продолжительности жизни, а также ростом абсолютного количества пользователей средств индивидуальной мобильности, таких как электросамокаты, моноколеса и т.д.
Оскольчатые переломы у пациентов старше 65 лет с сопутствующей остеопенией, а также мелкофрагментарные переломы у пациентов молодой возрастной группы сопровождаются посттравматическим дефектом костной ткани. В данном случае одним из видов лечения является тотальное эндопротезирование локтевого сустава. Но ввиду высокого риска послеоперационных осложнений и значительной доли (70 %) неудовлетворительных исходов лечения данный вариант оперативного лечения показан возрастным пациентам со сниженным индексом активности [2]. Открытая репозиция с внутренней фиксацией пластинами без восстановления дефектной зоны может привести к невозможности прочной интраоперационной фиксации фрагментов или сокращению площади контакта отломков в зоне перелома, вынуждая хирурга прибегать к дополнительной внешней иммобилизации в послеоперационном периоде, что способствует появлению контрактур локтевого сустава [3].
В настоящее время в качестве дефект замещающего материала возможно применение не только аутогенного, но и аллогенного трансплантата, существующего в виде различных форм [4]. Несмотря на высокие остеоиндуктивные свойства аутогенный трансплантат имеет недостатки в виде расширения операционного поля, повышения вероятности послеоперационных инфекционных осложнений и увеличения времени оперативного вмешательства [5]. Отсутствие данных недостатков у аллотрансплантата, высокие кондуктивные свойства, вариабельность применяемых форм трансплантата и неограниченность материала позволяют восполнять дефекты различных геометрических пропорций [6]. Но если при заполнении дефектной полости ввиду наличия кортикальных стенок ограничений к форме используемого трансплантата и способу его удержания в дефектном материнском ложе нет, то при наличии дефекта осевых кортикальных структур данная проблема все еще имеет место, особенно в случае, когда продленная внешняя иммобилизация нежелательна [7]. Поэтому в настоящее время актуальна разработка методов хирургического лечения и пластики дефектной зоны, направленных на реконструкцию ДОПК, которые могут обеспечить надежную фиксацию и улучшить результаты оперативного лечения [8].
Цель работы — выполнить сравнительный анализ результатов хирургической пластики костных дефектов с применением донорского блочного и кубического кадаверного аллотрансплантатов на основании оценки жесткости костной ткани и васкуляризации зоны трансплантации при переломах дистального отдела плечевой кости с дефектами различной локализации.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования стали 56 пациентов с диагностированным закрытым оскольчатым переломом ДОПК типа 13C2 и 13C3 по классификации AO с первичным дефектом костной ткани, возникшим вследствие травматического воздействия. Пострадавшие сопоставимы по возрасту и времени, прошедшему с момента получения травмы. Показания к операции определяли согласно клиническим рекомендациям по лечению пациентов с переломами дистального отдела плечевой кости (Клинические рекомендации «Переломы дистального отдела плечевой кости», 2024, одобрены НПС МЗ РФ).
В зависимости от локализации посттравматического дефекта, установленного по данным рентгенографии в двух стандартных проекциях и компьютерной томографии локтевого сустава, пациенты разделены на три группы (табл. 1, рис. 1–3):
-
— группа 1 — пациенты с сопутствующим посттравматическим дефектом в области медиальной колонны;
-
— группа 2 — пациенты с посттравматическим костным дефектом в зоне латеральной колонны;
-
— группа 3 — пациенты с локализацией посттравматического метафизарного дефекта в области центральной зоны.
В зависимости от размера дефекта каждая группа была разделена на две подгруппы:
-
— тип А — размер дефекта до 1,5 см2;
-
— тип Б — размер дефекта 1,5–3 см2.
Исходя из размера костного дефекта и технической возможности его фиксации, пациентам проводили два вида хирургической реконструкции зоны дефекта.
Пациентам с размером дефекта до 1,5 см3 выполняли пластику лиофилизированным, обработанным ультразвуком аллогенным трансплантатом кадаверного происхождения в виде кубиков путем импак-ции в костное ложе.
Пациентам с дефектом костной ткани от 1,5 до 3 см3 осуществляли пластику костного дефекта способом (рис. 4) [9], включающим:
-
— формирование в области материнского ложа шиповидного паза, а на поверхности трансплантата — шиповидного выступа;
-
— формирование костных каналов, связывающих блок аллотрансплантата с костномозговой полостью;
-
— проведение блокирующих винтов через накостную пластину и костный блок аллогенного трансплантата во взаимопересекающихся плоскостях.
Таблица 1
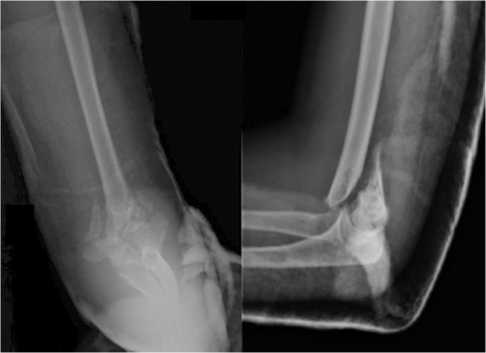
Рис. 1. Рентгенограмма пациента 43 лет, перелом дистального отдела плечевой кости с костным дефектом латеральной колонны (прямая и боковая проекции)
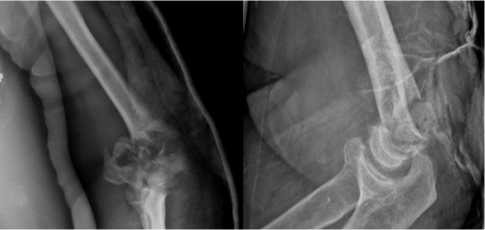
Рис. 2. Рентгенограмма пациента 49 лет, перелом дистального отдела плечевой кости с костным дефектом центральной метафизарной зоны (прямая и боковая проекции)
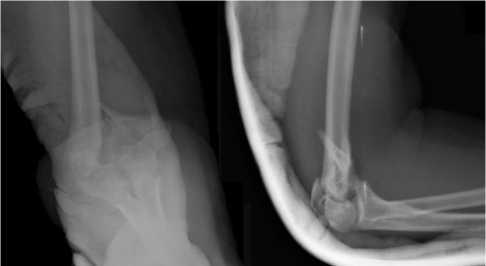
Рис. 3. Рентгенограмма пациентки 38 лет, перелом дистального отдела плечевой кости с костным дефектом медиальной колонны (прямая и боковая проекции)
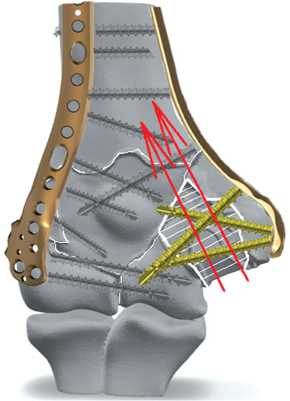
Рис. 4. Схема аллопластики блочным аллотрансплантатом посттравматического костного дефекта при оскольчатых переломах дистального отдела плечевой кости
Распределение больных в зависимости от локализации и размера костного дефекта
|
Показатели |
Группа 1 ( n = 19) |
Группа 2 ( n = 19) |
Группа 3 ( n = 18) |
||||
|
1А |
1Б |
2А |
2Б |
3А |
3Б |
||
|
Количество больных |
10 |
9 |
9 |
10 |
9 |
9 |
|
|
Пол женский |
абс. |
6 |
6 |
5 |
6 |
5 |
6 |
|
% |
60 |
66 |
55 |
60 |
55 |
66 |
|
|
Возраст, годы |
42 (21–60) |
37 (25–59) |
39 (19–58) |
46 (22–57) |
44 (28–55) |
39 (25–56) |
|
|
Тип перелома по АО |
13С3 |
13С2 |
13С2 |
13С3 |
13С2 |
13С3 |
|
|
ИМТ, кг/м2 |
28 (24–32) |
30 (26–34) |
34 (30–39) |
30 (25–32) |
31 (26–35) |
35 (28–38) |
|
|
Время, прошедшее с травмы, дни |
4 |
2 |
3 |
5 |
3 |
4 |
|
В качестве контроля процессов консолидации проводили рентгенологическое исследование с использованием универсального комплекса OPERA SWING производства Дженерал Медикал Мерате С.п.А. (Италия). Пациентам выполняли рентгенографию ДОПК в прямой и боковой проекциях. Для объективизации процессов минерализации костной ткани и количественной оценки жесткости костных структур выполняли мультиспиральную компьютерную томографию (МСКТ) на аппарате Phillips c подсчетом индекса Хаунсфилда (шкала денситометрических показателей, HU). Проводили оценку ослабления рентгеновского излучения, проходящего через исследуемую костную ткань, по отношению к дистиллированной воде. В случае замещения костного дефекта и применения аллогенного трансплантата изменение данного показателя во времени при динамическом наблюдении свидетельствует об активности процессов репарации и минерализации костного трансплантата. В качестве оценочной шкалы применяли классификацию Misch, согласно которой можно проводить сравнение абсолютных показателей в единицах HU.
Для проведения исследования МСКТ ДОПК определены три зоны интереса, соответствующие участку аллопластического материала и смежной кости пациента:
-
— зона R1 размером 0,5–1 см2 соответствовала краевому участку трансплантата, граничащему с костью реципиента;
-
— зона R2 размером 0,5–1 см2 соответствовала центральному участку аллотрансплантата;
-
— зона R3 размером 0,5–1 см2 являлась участком метафизарной кости пациента, граничащей с трансплантатом.
Подсчет индекса Хаунсфилда проводили с учетом размера использованного аллопластического материала [10–14].
Для установления активности протекания обменных процессов в зоне формирования костной мозоли у пациентов разных групп использовали метод ультразвуковой (УЗ) допплерографии с подсчетом индекса васкуляризации (ИВ), при котором происходит подсчет вновь образованных сосудов в зоне перелома. Их появление происходит на 7–10 день после травмы. Количество сосудов увеличивается пропорционально росту мягкой костной мозоли, к моменту формирования зрелой мозоли активность данного процесса сокращается. Вычисление интенсивности обменных процессов проводили путем подсчета площади визуализированных сосудов в зоне костной мозоли. Участок исследования составлял 2 × 2 см с захватом периостальной и интермедиарной зон проксимальнее и дистальнее линии перелома (рис. 5). Подсчет проводили по формуле: ИВ = S сосудов / S костной мозоли [15–18].
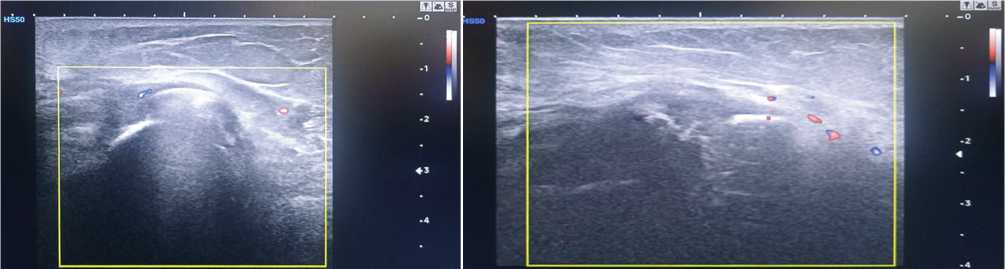
Рис. 5. Ультразвуковая допплерография зоны перелома ДОПК пациента 42 лет: через 14 дней и через 2 мес. после оперативного лечения
Период наблюдения пациентов исследуемых групп составил 6 мес. Рентгенологическое исследование выполняли через 1,5 мес. после операции с динамическим контролем через 3–3,5 мес. после операции для визуализации процесса образования костной мозоли, финальная рентгенография — через 6 мес. после операции для фиксации окончательных признаков консолидации перелома или осложнений, в случае их наличия. Компьютерную томографию выполняли через 1,5, 3,5 и 6 мес. для подсчета индекса Хаунсфил-да, что позволило провести объективное сравнение жесткости костной ткани и трансплантата, проходящего через 6 мес. после операции стадии интеграции, остеокластической и начальной стадии остеобластической регенерации. УЗ допплерографию с подсчетом ИВ выполняли через 14 дн., 1,5 и 3,5 мес. после операции. Сроки обусловлены стадийностью процесса формирования сосудов в костной мозоли, которые начинают образовываться в зоне перелома через 7–10 дн. после травмы, достигают наибольшей плотности на единицу костной ткани к 1,5–2 мес. после травмы и уменьшаются до начального значения через 3,5 мес.
Статистическую обработку полученных данных осуществляли при помощи пакета программ IBMSPSS 20 Statistics. Ввиду несоответствия большинства полученных данных закону нормального распределения, для сравнения значений использовали непараметрический U–критерий Манна – Уитни, критерий Вилкоксона и показатель достоверности ( р ).
Проведение данного исследования одобрено этическим комитетом Саратовского ГМУ им В.И. Разумовского и выполнено в соответствии с Хельсинкской декларацией. Все пациенты заранее проинформированы об условиях исследования и дали письменное согласие на участие.
РЕЗУЛЬТАТЫ
Оценивая динамические изменения показателей ИВ в зоне замещения дефекта, во всех подгруппах выявили увеличение значений через 2 мес. после операции. Более выраженно значение увеличилось в подгруппах 1Б, 2Б, 3Б, – в (7,9 ± 1,27) раз ( p = 0,01), в подгруппах 1А, 2А, 3А оно увеличилось в (6,9 ± 1,13) раз ( p = 0,02). Через 3,5 мес. после операции отмечали уменьшение показателей ИВ по сравнению с данными, полученными через 14 дней после операции. При этом средние значения ИВ в подгруппах 1А, 2А, 3А были ниже в (1,65 ± 1,13) раз ( p = 0,001), а в подгруппах 1Б, 2Б, 3Б — в 1,03 раза ( p = 0,002) (табл. 2).
Таблица 2
Динамика изменений значения ИВ
|
Группы |
Средние значения ИВ после операции, % |
|||||
|
14 дней |
2 месяца |
p |
4 месяца |
р 1 |
р 2 |
|
|
1А |
3,46 ± 0,14 |
24,02 ± 0,55 |
0,001 |
3,60 ± 0,09 |
0,017 |
> 0,05 |
|
2А |
3,32 ± 0,10 |
25,80 ± 0,68 |
0,001 |
3,61 ± 0,12 |
0,003 |
0,047 |
|
3А |
3,65 ± 0,15 |
23,17 ± 0,83 |
0,002 |
3,80 ± 0,10 |
0,002 |
0,048 |
|
1Б |
3,57 ± 0,25 |
28,44 ± 0,46 |
0,012 |
5,42 ± 0,18 |
0,003 |
0,040 |
|
2Б |
3,48 ± 0,18 |
29,51 ± 0,29 |
0,019 |
6,18 ± 0,25 |
0,005 |
0,045 |
|
3Б |
3,54 ± 0,12 |
27,12 ± 0,72 |
0,022 |
5,90 ± 0,16 |
0,007 |
0,039 |
Примечание : p — показатель достоверности по сравнению с данными через 2 нед.; р 1 — показатель достоверности по сравнению с данными через 2 мес.; р 2 — показатель достоверности по сравнению с данными через 2 нед.
При сравнении показателей отмечали, что способ пластики костного дефекта блочным аллотрансплантатом оказывал положительное влияние на значение жесткости костной ткани в приграничной краевой зоне R1 и центральной зоне R2 через 3 мес. после операции при всех локализациях дефекта ( p < 0,05).
При динамическом анализе показателей центральной зоны замещенного дефекта отмечали, что значения, полученные через 3 мес. после операции, ниже, чем значения через 1,5 мес. при всех локализациях дефекта ( p < 0,05).
При сравнении жесткости трансплантата в центральной зоне отмечали, что при оскольчатых переломах с дефектом центральной метафизарной зоны значения (170 HU, p = 0,032) были ниже в 1,12 раза, чем при медиальных дефектах (190 HU, p = 0,001), и в 1,1 раза, чем при латеральных (185 HU, p = 0,002) (табл. 3).
Таблица 3
Значение индекса Хаунсфилда по данным КТ при динамическом контроле
|
Значение индекса Хаунсфилда, HU |
||||||||||||||||||
|
1А |
2А |
3А |
1Б |
2Б |
3Б |
|||||||||||||
|
1,5 мес. |
3 мес. |
6 мес. |
1,5 мес. |
3 мес. |
6 мес. |
1,5 мес. |
3 мес. |
6 мес. |
170 |
210 |
250 |
170 |
200 |
260 |
160 |
185 |
270 |
|
|
R1 |
100 |
130 |
200 |
105 |
140 |
205 |
110 |
140 |
200 |
0,031 |
0,003 |
0,046 |
0,03 |
0,009 |
0,02 |
0,001 |
0,026 |
> 0,05 |
|
p 1 |
0,027 |
0,005 |
0,039 |
0,031 |
0,012 |
0,008 |
0,033 |
0,04 |
0,037 |
> 0,05 |
0,015 |
> 0,05 |
> 0,05 |
0,006 |
> 0,05 |
> 0,05 |
0,002 |
> 0,05 |
|
p 3 |
0,009 |
0,01 |
0,011 |
0,012 |
0,013 |
0,015 |
||||||||||||
|
p 4 |
0,02 |
0,001 |
0,021 |
0,03 |
0,02 |
0,01 |
||||||||||||
|
R2 |
140 |
120 |
190 |
130 |
120 |
200 |
130 |
110 |
190 |
210 |
190 |
250 |
205 |
185 |
240 |
190 |
170 |
250 |
|
p 2 |
0,011 |
0,01 |
0,029 |
0,025 |
0,002 |
0,031 |
0,026 |
0,001 |
0,031 |
0,025 |
0,001 |
0,04 |
0,008 |
0,007 |
0,003 |
0,03 |
0,032 |
> 0,05 |
|
p 3 |
0,038 |
0,012 |
0,003 |
0,021 |
0,003 |
0,026 |
0,023 |
0,009 |
0,025 |
0,02 |
0,01 |
0,028 |
||||||
|
p 4 |
0,021 |
0,001 |
0,001 |
0,014 |
0,015 |
0,012 |
||||||||||||
|
R3 |
220 |
280 |
330 |
210 |
270 |
310 |
230 |
260 |
300 |
0,041 |
0,01 |
0,022 |
||||||
|
p 3 |
0,015 |
0,012 |
0,019 |
240 |
280 |
320 |
240 |
285 |
305 |
220 |
255 |
300 |
||||||
|
p 4 |
0,01 |
0,002 |
0,021 |
> 0,05 |
0,05 |
> 0,05 |
> 0,05 |
> 0,05 |
> 0,05 |
> 0,05 |
0,033 |
> 0,05 |
||||||
Примечание : p — показатель достоверности при межгрупповом сравнении показателей; p 1 — показатель достоверности значения R1 относительно R3; p 2 — показатель достоверности значения R2 относительно R3; p 3 — значение коэффициента корреляции внутри группы при сравнении показателей через 3 мес. и через 1,5 мес.; p 4 — значение вероятности внутри группы при сравнении показателей через 6 мес. и через 1,5 мес.
В ходе наблюдений отмечали 14 случаев развития осложнений лечения (25 %), большинство из которых (шесть случаев, 9 %) встречались среди пациентов с дефектом центральной метафизарной зоны (табл. 4).
Таблица 4
Осложнения хирургической реконструкции при переломах ДОПК
|
Вид осложнения |
Количество осложнений |
||||||
|
1А |
2А |
3А |
1Б |
2Б |
3Б |
||
|
Остеорезорбция |
абс. |
0 |
1 |
1 |
0 |
1 |
0 |
|
% |
1,8 |
1,8 |
1,8 |
||||
|
р |
0,002 |
0,002 |
0,002 |
||||
|
Замедленная консолидация |
абс. |
2 |
2 |
3 |
1 |
1 |
2 |
|
% |
3,6 |
3,6 |
5,3 |
1,8 |
1,8 |
3,6 |
|
|
р |
0,02 |
0,007 |
0,01 |
0,02 |
0,03 |
0,07 |
|
ОБСУЖДЕНИЕ
Аллогенный трансплантат для замещения посттравматических дефектов костной ткани ДОПК используют для анатомической реконструкции сегмента, что создает возможность возвращения физиологической биомеханики движений локтевого сустава, для которого ранняя разработка движений имеет критическое значение. При этом недостаточная фиксация трансплантата в зоне дефекта или компрометированная стабильность костных отломков в зоне перелома вынуждает хирурга прибегать к продлению иммобилизации. В свою очередь жесткая фиксация отломков и трансплантата благодаря снижению микроподвижности последних способствует консолидации перелома и активным репаративным процессам, происходящим на границе «собственная кость – трансплантат» [2, 3, 19–21]. При этом анализ активности данных процессов почти невыполним в материале in vitro ввиду невозможности воссоздать множество клеток, с которыми трансплантат взаимодействует в процессе остеорепарации. При этом на активность самих последовательно сменяющих друг друга клеточных реакций влияют не только остеоиндуктивные, но и остеокондуктивные свойства трансплантата, такие как архитектура и размер пор. Поэтому нативная структура играет важную роль в процессе адаптации костного трансплантата в костном ложе [22, 23]. Имея в арсенале рентгенологический метод, а именно возможность выполнять МСКТ поврежденного сегмента, исследованию поддается непосредственно зона замещаемого дефекта. При использовании данного метода появляется возможность количественной оценки. Так как интеграция костного трансплантата происходит через стадию лизиса и дальнейшего неоостеогенеза в периферийной зоне последнего в направлении от периферии к центру, зона замещенного трансплантата разделена на три области одинакового радиуса, — R1, R2, R3 [13, 24, 25]. Согласно данным, полученным при выполнении КТ, в зонах исследуемого трансплантата можно установить несколько закономерностей. При исследовании зоны R1 во всех группах отмечено постепенное увеличение абсолютных значений HU, что свидетельствует об увеличении жесткости аллотрансплантата. Данный феномен может быть объяснен процессом минерализации костного трансплантата, начинающимся через 1–1,5 мес. после оперативного замещения дефекта. При этом отложение минеральных солей в субстрате костного вещества сопутствует процессу неоангиогенеза в сегменте костной ткани, уже прошедшей стадию лизиса. Внутри одной зоны замещенного сегмента разнонаправленные процесса лизиса и минерализации вновь образованной костной ткани могут происходить параллельно. Этим феноменом одновременной неоднородности трансплантата можно объяснить разброс количественных значений индекса Хаунсфилда [13, 19, 22]. При этом значение показателей приграничной зоны трансплантата R1 являлось, по нашему мнению, наиболее важным ввиду количественной характеристики прочности контакта между трансплантатом и костным ложем. Пограничная зона контакта по типу фиброзно-костного блока, соответствующая 201–300 HU у пациентов подгрупп 1А, 2А, 3А, была достигнута через 6 мес. после имплантации, в то время как у пациентов подгрупп 1Б, 2Б, 3Б — уже через 3 мес. после хирургического вмешательства (табл. 3). При этом значения 300 HU, соответствующее костному блоку, ни в одной подгруппе достигнуто не было [26–28].
У пациентов подгрупп 1А, 2А, 3А, которым в качестве дефект замещающего материала применен аллотрансплантат кадаверной природы в виде кубиков, во всех зонах исследования R1–R3 отмечены более низкие исходные значения HU в пограничной зоне, что сходно с данными жесткости костной ткани без замещения зоны дефекта [22, 30]. Учитывая вид и форму используемого материала, перед хирургом возникала необходимость в дополнительной фиксации замещаемого трансплантата посредством его прессования в дефектном ложе с помощью надставки. При этом происходило разрушение трабекулярной архитектуры аллотрансплантата на границе слоя «материнская кость — костный блок», что проявлялось уменьшением количественных показателей жесткости костной ткани и изменяло свойства и характеристики применяемого материала. С одной стороны, дополнительное прессование замещаемого материала способствует его механическому уплотнению в материнском ложе, в то же время вследствие данной манипуляции качество ткани применяемого трансплантата снижалось ввиду микроповреждений и нарушения костной архитектуры и геометрии, что находит отражение в недостаточно прочной фиксации материала [28–30].
Уменьшение показателя индекса Хаунсфилда в зоне R2 через 3 мес. после проведенного оперативного вмешательства по сравнению со значениями, полученными через 1,5 мес., можно объяснить физиологическим разрежением костного вещества. В процессе остеорепарации формирование вновь образованной костной ткани происходит через стадию лизиса, в результате чего жесткость ткани, выраженная в HU, уменьшилась. Увеличение данного показателя к 6 мес. после операции свидетельствует о преобладании процессов аккумулирования минерального субстрата в замещенной костной ткани над процессами ее распада, что выражается в увеличении жесткости костного трансплантата. При сравнении показателей через 6 мес. после операции можно увидеть различия при межгрупповых сравнениях соответствующих зон исследования, при этом не происходит достижения показателей «здоровой» мета-физарной костной ткани без остеопении [23, 25, 29, 31, 32].
При изучении результатов допплерографии зоны перелома отмечено, что у всех пациентов имелась общая тенденция к сравнительно низким показателям индекса васкуляризации в период репарации и начала формирования первичный костной мозоли через 2 нед., а также к моменту окончания репаративной фазы остеозамещения через 4 мес. после травмы. При этом через 2 мес. после операции в период высокой активности фазы формирования вторичной костной мозоли отмечен рост данного показателя. Учитывая, что активное кровоснабжение зоны перелома, а именно наружной части костной мозоли, способствует дифференцировке остеогенных клеток в остеобласты, можно предположить, что наличие остеопластического материала не изменяет общего направления остеорепаративных процессов [15, 17, 18].
Отмеченный через 2 мес. после операции рост площади мелких вновь образованных сосудов в зоне формирования костной мозоли у пациентов подгрупп 1Б, 2Б, 3Б можно объяснить как более высокими остеоинтегративными свойствами используемого материала, так и дополнительными интраоперационными мероприятиями, способствующими увеличению биоактивных веществ в зоне перелома [9]. Уменьшение площади образованных сосудов в зоне костной мозоли через 4 мес. после хирургического вмешательства более выражено у пациентов подгрупп 1А, 2А, 3А и свидетельствует о снижении активности кровоснабжения и обменных процессов в зоне формирования костной мозоли [16, 17]. В случае с положительной рентгенологической картиной и наличием признаков консолидации перелома можно предположить благоприятное течение и пролонгированный характер остеорепаративных процессов при использовании аллогенного блочного трансплантата.
ЗАКЛЮЧЕНИЕ
При сравнении результатов использования аллогенного трансплантата разной природы при оскольчатых переломах ДОПК типа 13C2 и 13C3, сопровождавшихся посттравматическими дефектами костной ткани, установлено, что показатели среднесрочной остеоинтеграции более выражены при применении нативного аллогенного материала блочного типа при локализации дефекта в области медиальной и латеральной колонн. Однако наличие осложнений и неудовлетворительных исходов лечения определяет необходимость дальнейшего изучения применения данных материалов и методик пластики костных дефектов.


