Результаты I фазы клинических испытаний таблетированной формы антиаритмического препарата III класса
Автор: Юричева Ю. А., Дзаурова Х. М., Беляева М. М., Миронов Н. Ю., Соколов С. Ф., Шерина Т. А., Голицын С. П.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Цель: изучение безопасности и переносимости таблетированной формы препарата Рефралон (кавутилид) при его однократном и многократном приеме здоровыми добровольцами, исследование его фармакокинетических (ФК) параметров и абсолютной биодоступности.Материал и методы. Здоровые добровольцы мужского пола в возрасте 18-45 лет включались в 1 из 7 когорт: 1, 2, 4 и 6 мг однократного перорального приема препарата, 1 мг в/в введения (эти когорты состояли из 6 человек каждая), 1 когорту из 12 добровольцев, принимавших 2 мг препарата ежедневно в течение 5 дней, и 1 когорту из 6 человек, получавших 2 мг Рефралона ежедневно в течение 10 дней. В условиях стационара проводились прием / введение препарата, контроль анализов крови и мочи, отбор проб крови для ФК анализа, оценка жизненно важных функций, регистрация электрокардиограммы (ЭКГ) в установленные точки, холтеровское мониторирование (ХМ) ЭКГ.Результаты. В исследование были включены 48 мужчин в возрасте 32 ± 7,2 года со средним весом 74,6 ± 4,7 кг. Не отмечалось значимого изменения жизненно важных показателей и анализов крови и мочи ни в одной из когорт. При однократном приеме исследуемого препарата стойкое статистически значимое увеличение продолжительности интервалов QT и QTc отмечается только при использовании максимальной дозы 6 мг. При многократном приеме препарата в дозе 2 мг отмечается достоверное увеличение продолжительности интервалов QT и QTc c максимальным приростом к 9-10-м сут наблюдения. К этому времени достигается стационарное состояние - равновесие между процессами всасывания и элиминации лекарственного препарата.Выводы. При пероральном однократном приеме всех исследуемых доз Рефралона и многократном его приеме в дозе 2 мг/сут величина интервалов QT/QTc остается в пределах референтных значений весь период наблюдения. Достоверное стойкое увеличение продолжительности интервалов QT/QTc отмечается только при приеме максимальной исследуемой дозы 6 мг однократно и при многократном дозировании 2 мг препарата. На 8-10-е сут приема 2 мг Рефралона достигается стационарное состояние.
Антиаритмический препарат iii класса, рефралон, кавутилид, i фаза клинических испытаний, интервал qt
Короткий адрес: https://sciup.org/149144101
IDR: 149144101 | УДК: 615.222:615.453.6]-03 | DOI: 10.29001/2073-8552-2023-38-4-141-150
Текст научной статьи Результаты I фазы клинических испытаний таблетированной формы антиаритмического препарата III класса
Рефралон (кавутилид) – российский антиаритмиче-ский препарат (ААП) III класса для внутривенного введения с целью купирования фибрилляции / трепетания предсердий (ФП / ТП). Препарат при в/в введении в дозах от 5–10- до 30 мкг/кг демонстрирует беспрецедентно высокую антиаритмическую активность (более 90%) в восстановлении синусового ритма у больных с персистирующей формой ФП / ТП, сопоставимую с электроимпульсной терапией (ЭИТ), при умеренном риске аритмогенного действия (1,5–1,7%) [1, 2]. Разработана таблетированная лекарственная форма Рефралона. В ходе ее доклинических испытаний были получены данные, позволившие запланировать исследование препарата на здоровых добровольцах.
Цель исследования: изучение безопасности и переносимости таблетированной формы препарата Рефралон при его однократном и многократном приеме внутрь здоровыми добровольцами, а также исследование фармакокинетических (ФК) параметров и абсолютной биодоступности препарата.
Материал и методы
В исследование включали здоровых мужчин в возрасте 18–45 лет с индексом массы тела (ИМТ) 18,5–30 кг/м², весом 60–80 кг, подписавших информированное согласие.
Исследование I фазы состояло из двух этапов (рис. 1). Длительность периода скрининга составляла до 14 сут. По результатам скрининга производился последовательный набор семи групп добровольцев с различными дозами приема препарата, общей численностью 48 человек. На 1-м этапе добровольцы из когорт А, В1, С и D принимали препарат однократно перорально натощак в дозе 1, 2, 4 и 6 мг соответственно. Добровольцам из когорты B2 Реф-ралон однократно вводился в/в в дозе 1 мг, что было необходимо для определения абсолютной биодоступности препарата. Согласно первоначальному протоколу исследования, 2-й этап должен был быть представлен когортой Е, включавшей в себя 12 добровольцев, принимавших препарат в дозе 2 мг однократно ежедневно в течение 5 дней. Однако описанные ниже результаты ФК исследования определили необходимость дополнительного формирования когорты F, включавшей 6 добровольцев, принимавших 2 мг Рефралона ежедневно течение 10 дней.
После проведения скрининга выполнялась клиническая фаза. При скрининге проводились серологическое исследование крови на ВИЧ, сифилис, вирусные гепатиты В и С; при скрининге и госпитализации тест на наличие паров алкоголя в выдыхаемом воздухе, исследование мочи на запрещенные препараты (кокаин, опиаты, марихуана, барбитураты, амфетамины), анализ мочи на котинин, тест на коронавирус SARS-CoV-2 методом ПЦР.
Для 1-го этапа клиническая фаза состояла из периода стационарного наблюдения до 2 дней, включающего в себя прием / введение препарата, отбор проб крови для ФК, анализ и мониторинг нежелательных явлений (НЯ) в условиях стационара (палаты интенсивной терапии) в течение 24 ч и периода последующего наблюдения с визитом через 7 сут. В каждую когорту включались 6 добровольцев для перорального приема препарата, в когорту В – еще 6 человек для в/в введения.
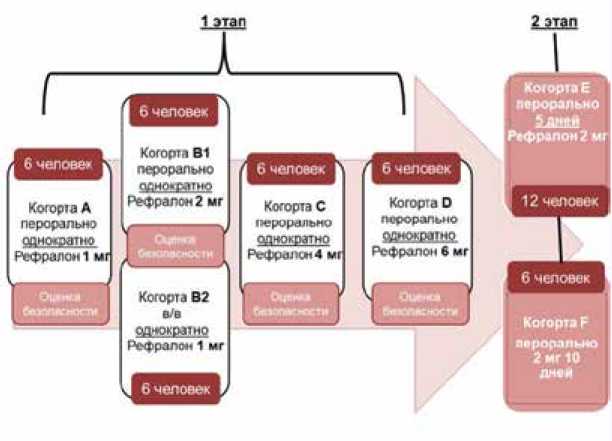
Рис. 1. Дизайн исследования
Cohort В1
Rcfralon 1 mg
Refralon 4 mg
6 patients
Cohort B2
Re fra Ion 1 mg
mg
12 patients
Refralon 6 mg

Cohort F
Re fra I on 2
Fig. 1. Study design
Клиническая фаза 2-го этапа состояла из периода стационарного наблюдения (до 6 дней для когорты E и до 11 дней для когорты F), включающего в себя прием препарата и мониторинг НЯ в условиях стационара, забор образцов крови, визит для последующего наблюдения через 7 сут.
В стационаре добровольцам под непрерывным мониторированием электрокардиограммы (ЭКГ) проводились прием / введение препарата, общеклинический и биохимический анализ крови, общий анализ мочи, отбор проб крови для ФК анализа, оценка жизненно важных функций, регистрация ЭКГ в 12 отведениях в установленные точки в течение 24 ч для когорт однократного приема и в течение 5–10 сут – для когорт многократного приема. Проводилось суточное мониторирование ЭКГ по Холтеру (ХМ ЭКГ), все сутки наблюдения для когорт A–D, на 5-е сут – для когорты Е, на 7-е и 10-е сут – для когорты F. Через 7 сут после выписки из стационара был выполнен контрольный визит, в рамках которого проводились ЭКГ исследования в 12 стандартных отведениях, клиническая оценка состояния здоровья, общеклинический и биохимический анализы крови, общий анализ мочи.
В когорте F на 12-й и 13-й день, по окончании приема препарата, проводились амбулаторные визиты, в ходе которых также выполнялась регистрация ЭКГ, оценка физикальных данных и забор крови для оценки ФК параметров.
ЭКГ в 12 отведениях и измерение показателей жизненно важных функций на 1-м этапе (когорты A-D) проводилось в день дозирования перед установкой катетера до приема препарата и через 10 мин, 30 мин, 1 ч, 2 ч, 3 ч, 4 ч, 8 ч, 12 ч, 16 и 24 ч после дозирования.
На 2-м этапе (когорта Е) аналогичные процедуры выполнялись через 10 мин, 30 мин, 1 ч, 2 ч, 3 ч, 4 ч, 8 ч, 12 ч, 16 ч после каждого применения препарата, а также на 6-й день. ЭКГ регистрировали в 12 стандартных отведениях при скорости движения бумаги 25 мм/с. По данным ЭКГ оценивались продолжительность интервалов PQ, QRS, QT, QTc, частота сердечных сокращений (ЧСС), а также преходящих потенциально возможных отклонений: атриовентрикулярной (АВ) блокады II–III cтепени, прироста длительности комплексов QRS на 25%, увеличения длительности интервала QTc до 500 мс и более, снижения ЧСС ниже 50 уд/мин, развития желудочковой тахикардии типа Torsade de pointes. Оценка длительности интервала QT проводилась по методу Lepeshkin и Surawics [3] в отведении, где данный интервал имел максимальное значение. Корригированный интервал QT (QTc) рассчитывался по формуле Bazett при ЧСС от 60 до 100 уд/мин [4], если ЧСС была ниже 60 или выше 100 уд/мин, расчет QTc производился по формуле Framingham.
Образцы крови были собраны в стерильные, герметично закрывающиеся одноразовые полипропиленовые пробирки с антикоагулянтом К2ЭДТА. Для определения концентрации Рефралона в плазме крови использовался предварительно валидированный аналитический метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. В исследовании определялись концентрации активного вещества Рефралона в плазме крови добровольцев в дискретные интервалы времени для построения ФК кривых «концентрация время» для исследуемого препарата.
Статистический анализ полученных данных проводился с использованием программ StatTech 2.8.8 (ООО
«Статтех», Россия), Jamovi 2.2, СТАТИСТИКА 12. Количественные показатели оценивались на соответствие нормальному распределению с помощью критерия Шапиро – Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних значений ( M ) и стандартных отклонений ( SD ), М ± SD. Для сравнения трех и более связанных выборок нормально распределенных количественных признаков использовался однофакторный дисперсионный анализ повторных измерений, в случае отсутствия нормального распределения показателя – критерий Фридмана.
Для оценки ФК данных применялось программное обеспечение Phoenix WinNonLin 8.3 (Certara, USA). Для выявления статистически значимых парных различий средней концентрации (Сavg) и площади под ФК кривой «концентрация время» в течение очередного интервала дозирования (AUCτ) Рефралона в первый и десятый день, при многократном приеме 2 мг препарата Рефра-лон использовался критерий Вилкоксона.
Результаты
В исследование были рандомизированы 48 добровольцев-мужчин: 30 человек в когорты A–D однократного приема Рефралона в дозах 1–6 мг, 12 человек в когорту Е многократного приема Рефралона в дозе 2 мг в течение 5 дней, 6 человек в когорту F многократного приема Реф-ралона в дозе 2 мг в течение 10 дней. Один доброволец из когорты Е завершил исследование преждевременно в связи с семейными обстоятельствами. Средний возраст добровольцев составил 32 ± 7,2 года, средний вес 74,6 ± 4,7 кг, ИМТ 23,6 ± 0,95 кг/м².
Не отмечалось статистически значимого изменения жизненно важных показателей и анализов крови и мочи после однократного приема препарата внутрь в дозах 1–6 мг, после в/в введения 1 мг Рефралона, как и после многократного его приема внутрь в дозе 2 мг в течение 5 и 10 дней, а также на визите амбулаторного наблюдения.
Основным показателем, характеризующим безопасность приема ААП III класса, является величина интервалов QT/QTc, отражающая продолжительность периода реполяризации миокарда желудочков.
Значение QT на ЭКГ превысило потенциально опасную величину 500 мс у 2 человек когорты В2 через 10 мин после в/в введения Рефралона, составив 512 и 528 мс. Величина QTс превысила 500 мс у 3 добровольцев когорты В2, составив 501, 517 и 539 мс. К первому часу наблюдения значения QT и QTc у всех 6 добровольцев когорты B2 составляли менее 480 мс, регистрировалось их дальнейшее снижение до конца наблюдения.
При однократном приеме исследуемого препарата в дозах 1, 2 и 4 мг не отмечалось стойкого значимого увеличения продолжительности интервалов QT и QTc на протяжении 24 ч наблюдения. При однократном приеме Рефралона 6 мг стойкое статистически значимое увеличение продолжительности интервалов QT и QTc установлено, начиная с 1 и 3 ч исследования соответственно, и оно сохранялось до конца 24 ч наблюдения.
При приеме препарата в дозе 2 мг в течение 5 дней отмечалось достоверное увеличение продолжительности интервалов QT и QTc, начиная с 1–3 ч после приема. Максимальный прирост регистрировался к 4–5-м сут наблюдения, составив 40 мс на 4-е сут для интервала QT и 35 мс на 5-е сут наблюдения для интервала QTc. При пе- роральном приеме Рефралона 1, 2, 4 и 6 мг однократно и 2 мг/сут в течение 5 дней продолжительность интервалов QT/QTc оставалась в пределах референтных значений весь период наблюдения.
Значения ЧСС во всех точках наблюдения в когортах А–Е значимо не отличались от исходных. Эти данные были нами подробно описаны ранее [5].
Анализ динамики интервала QT в когорте F продемонстрировал достоверный прирост его продолжительности на 30 мс по сравнению с исходным значением (387 ± 21 мс), начиная с 4-х сут приема ( р = 0,042), далее большую часть времени различия оставались достоверными с максимальным приростом на 9–10-е сут (35 и 43 мс, значения QT при этом составили 422 ± 24 мс и 430 ± 27 мс соответственно). На 5-е и 9-е сут прирост продолжительности QT не достигал критериев достоверности, что, вероятно, связано с меньшим числом включенных добровольцев по сравнению с когортой E (6 против 12). Разница в длительности QT в первые 3 дня после отмены препарата (407 ± 35, 407 ± 40 и 394 ± 32 мс) и на 10-е сут после прекращения его приема (383 ± 22 мс) с исходным показателем не была достоверной.
В отношении динамики интервала QTc достоверный стойкий прирост его величины по отношению с исходной (400 ± 20 мс) отмечается, начиная с 5-х сут приема препарата, составляя 39 мс ( р = 0,025). Максимальный прирост QTc регистрируется на 9–10-е сут после начала терапии и первые сутки его отмены, составляя 43, 44 и 47 мс соответственно. Достоверных различий между продолжительностью QTc в эти дни не зарегистрировано. Длительность QTс достоверно превышала исходный показатель даже на 3-и сут после прекращения приема Рефралона (436 ± 23 мс, р = 0,022). Только на контрольном визите через неделю после выписки величина QTс значимо снижалась по сравнению с 3-м днем отмены препарата, составляя 416 ± 18 мс ( р = 0,005) и не имела достоверных различий с исходным значением (рис. 2).
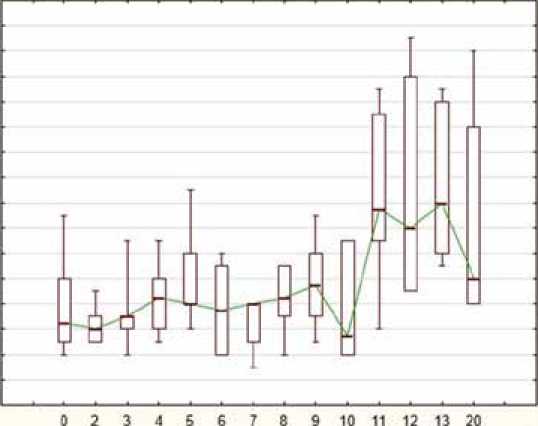
Достоверной динамики в ЧСС на протяжении 10 дней приема 2 мг Рефралона не выявлено. Статистически значимые различия ЧСС были зарегистрированы только между 10-м днем приема Рефралон в дозе 2 мг и первыми 2 днями его отмены (72 ± 7; 73 ± 9 и 73 ± 6 уд/мин, p = 0,005; 0,001 и 0,017 для 1, 2 и 3-го дня отмены соответственно) (рис. 3).
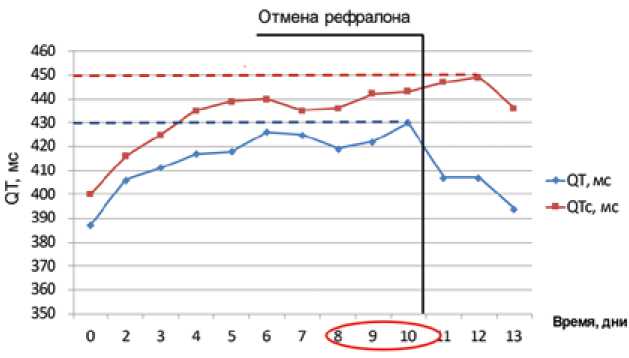
Рис. 2. Динамика средних значений интервалов QT и QTc в когорте F. Горизонтальными пунктирными линиями обозначены максимальные зарегистрированные показатели продолжительности QT и QTс за весь период наблюдения
Fig. 2. Dynamics of mean QT and QTc duration in cohort F. Horizontal dotted lines indicate the maximum duration of QT and QTc during the follow up period.
j 5
т 6 ,6 74
$1 72
8* 70
x 68
Показатели ЧСС на фойе 10 дневного приема и последующей отмены кавутмлида Heart rale during 10 days of taking and subsequent withdrawal of cavutilide
— Median Время день □ 254-75%
Рис. 3. Динамика частоты сердечных сокращений в когорте F, уд/мин Fig. 3. Dynamics of mean heart rate in cohort F, beats per minute
Анализ длительности интервала PQ, а также продолжительности комплекса QRS не продемонстрировал значимых изменений за весь период наблюдения.
При анализе ХМ ЭКГ у 4 пациентов зарегистрированы эпизоды синоатриальной (СА) блокады 2-й и 3-й ст. Всего зарегистрировано 14 пауз, в том числе 2 паузы выявлены у добровольца когорты А, 2 паузы у добровольца когорты В1, 9 пауз у 1 добровольца когорты D, 1 пауза у добровольца когорты F. Продолжительность лишь 3 пауз превысила 3 с. Величина максимальной зарегистрированной паузы у добровольца когорты D составила 5,156 с.
Брадикардия с ЧСС менее 50 уд/мин в дневное время на протяжении 3 сердечных циклов зарегистрирована у 3 добровольцев когорты А, 2 добровольцев когорты D, 1 добровольца когорты E, 1 добровольца когорты F. Минимальная ЧСС в дневное время 42 уд/мин зарегистрирована у добровольца когорты D. Устойчивых и симптомных эпизодов брадикардии не установлено.
Удлинение интервала QT более 500 мс по данным ХМ ЭКГ зафиксировано у 3 добровольцев когорты B2 (в/в введение препарата), максимально до 560 мс с последующей быстрой нормализацией показателя.
У 1 добровольца когорты А зарегистрирована частая предсердная экстрасистолия – 5 308 за сут. У другого добровольца когорты А отмечалась частая желудочковая экстрасистолия (360 в час).
Ни у одного из добровольцев всех 7 когорт, не было зарегистрировано эпизодов развития АВ- блокады II–III степени, расширения комплексов QRS на 25% и более, стойкой патологической синусовой брадикардии, желудочковой тахикардии типа Torsade de pointes.
При непрерывном мониторировании ЭКГ при помощи кардиомонитора не было установлено ни одного неотложного аритмического события.
Исследование фармакокинетических параметров
После в/в введения 1 мг препарата Рефралон максимальная концентрация в плазме крови (Сmax) составила 11 978,3 ± 1 551,2 пг/мл и достигалась в первые 5 мин после его введения, еще через 5 мин она снижалась в 4 раза до 3 088,2 ± 616,6 пг/мл, а через час – в 10 раз, до 1 093,4 ± 422,9 пг/мл.
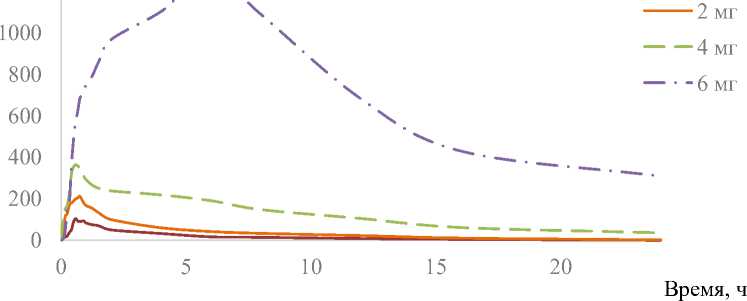
Показано, что при последовательном увеличении принимаемой однократно перорально дозы препарата Рефралон с 1 до 6 мг происходит увеличение дозозависимых ФК параметров. Сmax возрастала с 119,1 ± 15,8 пг/мл для дозы 1 мг до 1 326,4 ± 136,6 пг/мл для дозы 6 мг. При этом при использовании различных доз увеличение Сmax и AUCτ происходит непропорционально. Так, если при двукратном увеличении дозировки с 1 до 2 мг и от 2 до 4 мг Сmax возрастает в 1,8 раза, то при полуторакратном увеличении дозировки с 4 до 6 мг Сmax растет в 3,5 раза. Для AUCτ при увеличении дозы с 1 до 2 мг и с 2 до 4 мг AUCτ растет в 2,3 и 3,5 раза соответственно, а при увеличении с 4 до 6 мг AUCτ увеличивается в 5,7 раза (рис. 4).
И
к к а мг
н я о
Рис. 4. График усредненных фармакокинетических профилей (в линейных координатах) после однократного перорального приема препарата Реф-ралон, таблетки, 1, 2, 4 и 6 мг
Fig. 2. Graph of mean pharmacokinetic profiles after 1, 2, 4 и 6 mg of single dose oral administration of Refralon, tabs (in linear coordinates)
Для препарата Рефралон, таблетки, в дозировке 1 мг относительная биодоступность составляет 8,1%.
А когорте Е показатели Cmax и AUCτ в 4-й день статистически значимо увеличиваются по сравнению с первым приемом, что говорит о накоплении вещества в организме.
Для оценки накопления препарата с целью расчета его поддерживаемой терапевтической концентрации рассчитывается усредненная для данного интервала дозирования концентрация препарата (Cavg). При достижении стабильной концентрации вещества в организме кривая зависимости Cavg от дня исследования приобретает вид плеча параболы или выходит на плато. Как наличие четко прослеживаемой линейной зависимости Cavg от дня исследования, так и отсутствие выхода Cavg на плато в когорте Е указывает на то, что при продолжительности приема 2 мг Рефралона в течение 5 дней стационарное состояние не было достигнуто.
Для расчета станционарных параметров было необходимо увеличение времени исследования, что пре- допределило набор дополнительной когорты F более длительного приема Рефралона в той же дозе 2 мг/сут. Как уже было описано выше, в эту когорту вошли 6 человек, принимавших 2 мг Рефралона ежедневно однократно в течение 10 дней. При приеме препарата в течение 10 дней происходит увеличение Cmax и AUCτ, что говорит о накоплении вещества в организме.
Со 2-го по 7-й день исследования в когорте F наблюдался рост таких ФК параметров, как Cmax и AUCτ, минимальная концентрация, Cavg. Cmax Рефралона в плазме крови в 3-й день исследования составила 874 ± 263 пг/мл, в 4-й день 1 208 ± 371 пг/мл, в 5-й день исследования увеличилась до 1 565 ± 778 пг/мл, в 6-й и 7-й день достигла значений 2 176 ± 1 015 и 1 902 ± 801 пг/мл соответственно. AUCτ составила на 3-й день исследования
15 418 ± 3 909 пг/мл × ч, в 4-й день исследования увеличилась до 21 974 ± 4 267 пг/мл × ч, на 5-й, 6-й и 7-й день исследования AUCτ составляла 29 964 ± 14 940; 38 244 ± 17 705 и 40 884 ± 16 273 пг/мл × ч соответственно.
Средние концентрации рассчитывались как AUCτ/24 ч и также возрастали в промежутке от 3-го до 7-го дня исследования. На 3-й день исследования Cavg составляла 642 ± 46 пг/мл, на 4-й день исследования 916 ± 78 пг/мл, на 5-й день достигла 1 249 ± 622 пг/мл, на 6-й и 7-й день исследования 1 594 ± 738 и 1703 ± 678 пг/мл соответственно. На 10-й день исследования Cavg составила 1 941 ± 886 пг/мл, что сопоставимо со средними концентрациями, достигнутыми на 9-й и 8-й день исследования: 1 939 ± 1 068 и 1895 ± 895 пг/мл соответственно (рис. 5, 6).
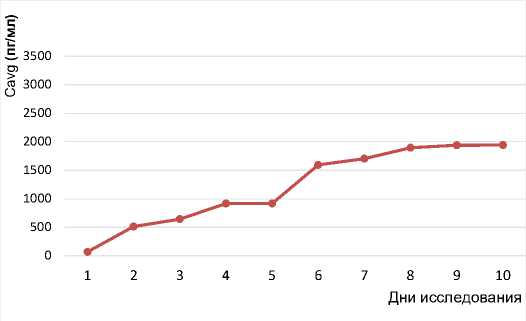
Рис. 5. Динамика значений средней для данного интервала дозирования концентрации препарата (Cavg) в течение 10 дней исследования в когорте F Fig. 5. Dynamics of the average drug concentration for a given dosing interval (Cavg) during 10 days of the study in cohort F
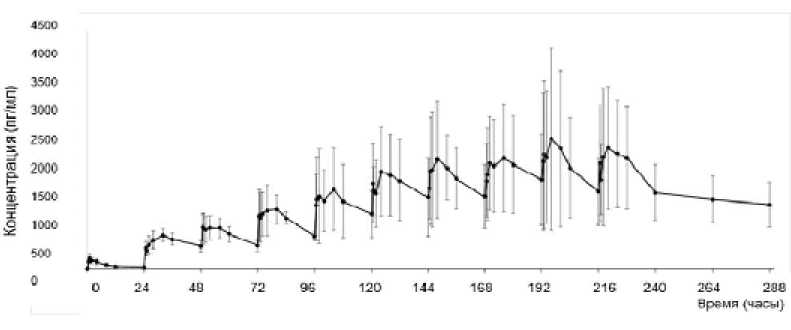
Рис. 6. График усредненного фармакокинетического профиля (в линейных координатах) приема препарата Рефралон, 2 мг, в течение 10 дней (240 ч) и 2 (48 ч) дней после отмены препарата
Fig. 6. Graph of the average pharmacokinetic profile of multiple oral intake of Refralon, 2 mg, during 10 days (240 h) and 2 days (48h) after the end of admission (in linear coordinates)
Таким образом, отсутствуют статистически значимые отличия между средними концентрациями Рефралона в плазме крови в 8–10-й день исследования, что указывает на то, что кривая зависимости Cavg от дня исследования к 9–10-му дню выходит на плато (см. рис. 5). Это позволяет сделать вывод о достижении стационарного состояния – равновесия между процессами всасывания и элиминации лекарственного препарата. Для AUCτ также не выявлено статистически значимых отличий между показателями, достигнутыми в 8–9-й, а также 9–10-й дни исследования, что говорит о достижении стационарного состояния.
Сmax для когорты F на 9-й день составила 2 499 ± 1 698 пг/мл, что в 5 раз меньше соответствующей величины, достигнутой при в/в введении.
Обсуждение
Ввиду высокой распространенности ФП / ТП по всему миру и малоудовлетворительной эффективности доступных в настоящее время ААП в ее предотвращении, разработка новых эффективных и безопасных средств профилактики ФП / ТП представляется крайне актуальной задачей.
Убедительно показано, что Рефралон (кавутилид) при в/в введении демонстрирует свое значительное превосходство над таким эталогичным ААП, как амиодарон и в эффективности купирования пароксизмальной и персистирующей форм ФП / ТП, и в скорости достижения анти-аритмического эффекта [6]. Доказано также, что медикаментозная кардиоверсия с применением Рефралона не уступает по эффективности ЭИТ у пациентов с персистирующим течением ФП / ТП [7].
Высокая эффективность Рефралона в купировании эпизодов ФП / ТП порождает обоснованную надежду на возможность не менее эффективного использования таблетированной формы этого препарата с целью профилактики ФП / ТП.
В экспериментах на животных установлено, что при внутрижелудочном применении Рефралон обладает достаточно высокой биодоступностью, демонстрируя при этом фармакодинамические эффекты, характерные для ААП III класса. Это проявляется дозозависимым увеличением длительности интервала QTc, увеличением продолжительности трансмембранного потенциала действия миокарда предсердий и его функционального рефрактерного периода (ФРП), с максимальным приростом этого показателя в области устьев легочных вен, биоэлектрическая активность которых является ключевым триггером развития ФП. Последнее имеет крайне важное значение для достижения антиаритмического эффекта при ФП. В рамках доклинических исследований были проведены расчеты предположительной дозы Рефралона для применения внутрь у человека [ОТЧЕТ о результатах доклинического исследования, 2011]. Все это явилось основанием для проведения I фазы клинических испытаний.
Прежде всего следует отметить, что в рамках настоящего исследования были обнаружены существенные фармакодинамические и ФК различия при применении Рефралона в/в и внутрь. При в/в введении препарата отмечалось быстрое увеличение его концентрации в крови с последующим 4-кратным его снижением в течение 5 мин и 10-кратным снижением в течение получаса. И только в этой группе добровольцев отмечался быстрый и значительный прирост продолжительности интервалов QT/QTc с максимальными значениями среди всех включенных мужчин. В части случаев были превышены референтные границы этих показателей с последующим быстрым уменьшением их длительности в первые 10–30 мин после введения.
Влияние Рефралона в таблетированной форме на величину интервалов QT/QTc было дозозависимым. В когортах однократного приема стойкое статистически значимое увеличение продолжительности интервалов QT и QTc отмечалось только при использовании максимальной дозы 6 мг с 3-го ч приема, при этом их величина оставалась в рамках допустимых границ.
При однократном приеме Рефралона в дозе 1–6 мг изменение ФК параметров происходит непропорционально, являясь максимальным при увеличении дозы с 4 до 6 мг. Время достижения Сmax, как и продолжительность влияния Рефралона на ФРП в доклинических исследованиях, зависела от дозы: при однократном приеме 1–4 мг Смах достигалась в течение 40 мин – 1 ч 15 мин, а при использовании 6 мг – через 6 ч после приема.
Максимальный прирост величины QT и QTc отмечен к 4–5-м сут наблюдения для когорты E и к 9–10-м сут приема и в первые сутки отмены Рефралона (только QTc) для когорты F, составив соответственно 40–43 мс для QT и 35–47 мс для QTc. Эти изменения, составляющие 10– 12% от исходных значений и соответствующие результатам доклинических испытаний, можно расценивать как клинически значимые и допустимые.
В когортах многократного приема препарата происходил постепенный прирост ФК параметров. При этом в когорте F на 8–10-й день отмечено достижение стационарного состояния (равновесия между процессами всасывания и элиминации лекарственного препарата), что соответствует динамике интервалов QT/QTc на ЭКГ , постепенному и контролируемому их удлинению до значений, стабильно находящихся в пределах референтных границ при многократном приеме препарата в дозе 2 мг.
В когортах A–E не установлено изменения ЧСС на фоне приема Рефралона. Только в когорте F различия в ЧСС в последний день приема Рефралона и в первые 2 дня его отмены были достоверны. Максимальное число нарушений СА-проводимости отмечалось в когорте D однократного приема 6 мг Рефралона. В когортах E и F длительного приема отмечено по 1 случаю снижения ЧСС менее 50 уд/мин в дневное время. Важно отметить, что это была не стойкая брадикардия, а последовательность из 3 сердечных циклов, образующих ЧСС в соответствии с критериями ХМ ЭКГ. Только у 1 пациента когорты F выявлена 1 пауза за счет СА-блокады 2-й ст. Все установленные нарушения проводимости были кратковременными и бессимптомными. Выявленные нарушения ритма и проводимости не были дозозависимыми. Ввиду отсутствия данных ХМ ЭКГ «на чистом фоне», т. е. до или по окончании приема Рефралона, достоверно определить взаимосвязь зарегистрированных нарушений ритма и проводимости сердца с приемом препарата не представляется возможным.
Не обнаружено признаков влияния Рефралона на АВи внутрижелудочковое проведение, проявлений желудочкового аритмогенного действия.
Сmax после перорального приема даже максимальной дозы 6 мг была в 9 раз ниже, а при многократном приеме дозы 2 мг на 9–10-й день в 5 раз меньше таковой при в/в введении. Относительная биодоступность для препарата Рефралон в таблетированной форме в дозе 1 мг составляет 8,1%.
Ни в одной из когорт не отмечалось значимого изменения жизненно важных показателей и анализов крови и мочи как во время, так и после окончания приема препарата.
На основании полученных данных сделано заключение о хорошей переносимости и приемлемом профиле безопасности лекарственного препарата Рефралон, таблетки, в исследованных дозировках при его однократном и многократном приеме здоровыми добровольцами натощак. Это открывает путь для дальнейшего исследования его безопасности, а также эффективности в предотвращении приступов ФП / ТП в рамках II фазы клинических испытаний на пациентах.
Список литературы Результаты I фазы клинических испытаний таблетированной формы антиаритмического препарата III класса
- Миронов Н.Ю., Юричева Ю.А., Влодзяновский В.В., Соколов С.Ф., Дзаурова Х.М., Голицын С.П. и др. Опыт клинического применения отечественного антиаритмического препарата III класса для медикаментозной кардиоверсии фибрилляции и трепетания предсердий: результаты многоцентрового исследования. Часть 1: методология исследования и оценка эффективности. Рациональная фармакотерапия в кардиологии. 2021;17(2):193-199.. DOI: 10.20996/1819-6446-2021-03-05.
- Миронов Н.Ю., Юричева Ю.А., Влодзяновский В.В., Соколов С.Ф., Дзаурова Х.М., Голицын С.П. и др. Опыт клинического применения отечественного антиаритмического препарата III класса для медикаментозной кардиоверсии фибрилляции и трепетания предсердий: результаты многоцентрового исследования. Часть 2: оценка безопасности лечения. Рациональная Фармакотерапия в Кардиологии. 2021;17(5):668-673.. DOI: 10.20996/1819-6446-2021-10-06.
- Lepeschkin E., Surawicz B. The measurement of the QT interval of the electrocardiogram. Circulation. 1952;6(3):378-388. DOI: 10.1161/01.cir.6.3.378.
- Funck-Brentano C., Jaillon P. Rate-corrected QT interval: techniques and limitations. Am. J. Cardiol. 1993;72(6):17B-22B. DOI: 10.1016/00029149(93)90035-b.
- Юричева Ю.А., Миронов Н.Ю., Дзаурова Х.М., Соколов С.Ф., Ахметов И.Р., Субочев А.Г. и др. Первые результаты клинического исследования таблетированной формы отечественного антиаритмического препарата III класса на здоровых добровольцах. Кардиологический вестник. 2022;17(4):55-62.. DOI: 10.17116/Cardiobulletin20221704155.
- Гаглоева Д.А., Дзаурова Х.М., Зельберг М.А., Миронов Н.Ю., Юричева Ю.А., Соколов С.Ф. и др. Предварительные результаты проспективного рандомизированного исследования по сравнению эффективности и безопасности рефралона и амиодарона при кардиоверсии у больных пароксизмальной формой фибрилляции и трепетания предсердий. Кардиоваскулярная терапия и профилактика. 2023;22(4):3527.. DOI: 10.15829/1728-8800-2023-3527.
- Миронов Н.Ю., Влодзяновский В.В., Юричева Ю.А., Соколов С.Ф., Голицын С.П., Розенштраух Л.В. и др. Проспективное рандомизированное исследование эффективности и безопасности электрической и медикаментозной кардиоверсии при персистирующей фибрилляции предсердий. Часть 1: методология исследования и оценка эффективности. Рациональная Фармакотерапия в Кардиологии. 2018;14(5):664-669. DOI: 10.20996/1819-6446-2018-14-5-664669.DOI: 10.20996/1819-6446-2018-14-5-664-669.


