Результаты интраоперационного применения альфа-дефензин экспресс-теста при выполнении второго этапа РЭТС
Автор: Мурылев В.Ю., Парвизи Д., Руднев А.И., Куковенко Г.А., Елизаров П.М., Музыченков А.В., Алексеев С.С., Голубкин Д.О., Яковлев К.Г., Угольникова А.О.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.30, 2024 года.
Бесплатный доступ
Введение. Верификация реинфекции у пациентов с установленным спейсером тазобедренного сустава остается нерешенной проблемой. Существующие методы диагностики обладают различными диагностическими показателями. Альфа-дефензин экспресс-тест (АДЭТ) является современным и точным инструментом, позволяющим выявлять/исключать перипротезную инфекцию (ППИ), однако его применение у пациентов с установленным спейсером тазобедренного сустава еще до конца не изучено.Цель работы - определить диагностические показатели (точность, специфичность, чувствительность, AUC) альфа-дефензин экспресс-теста в рамках верификации реинфекции у пациентов с установленным спейсером тазобедренного сустава при выполнении второго этапа РЭТС.Материалы и методы. В проспективном исследовании, проводившемся в период 2019-2024 гг., осуществлена оценка эффективности интраоперационного применения альфа-дефензин экспресс-теста у 105 пациентов с установленным спейсером тазобедренного сустава при выполнении второго этапа РЭТС. «Золотым стандартом» диагностики реинфекции принято микробиологическое исследование интраоперационных образцов периимплантных тканей и синовиальной жидкости.Результаты. Рост микрофлоры по результатам интраоперационного микробиологического исследования выявлен в 24 (23 %) случаях. Расхождение в результатах интраоперационного микробиологического исследования и результатов альфа-дефензин экспресс-теста обнаружено в 10 (11 %) случаях. Были также выявлены ложноположительные и ложноотрицательные случаи. Альфа-дефензин экспресс-тест продемонстрировал 96,39 % специфичности, 89,52 % точности и 63,64 % чувствительности метода. Показатель AUC составил 0,8.Обсуждение. АДЭТ обладает хорошими диагностическими показателями при верификации ППИ у пациентов после эндопротезирования тазобедренного сустава. Применение АДЭТ у пациентов, с установленным спейсером тазобедренного сустава, продолжающих прием антибактериальной терапии, дает возможность использования теста при выполнении 2 этапа РЭТС. Однако результаты применения АДЭТ у пациентов при выполнении второго этапа РЭТС нуждаются в дополнительных исследованиях.Заключение. Альфа-дефензин экспресс-тест, несмотря на неоднозначные данные научных публикаций, обладает высокими диагностическими показателями в рамках интраоперационной верификации реинфекции у пациентов с установленным спейсером тазобедренного сустава, позволяя своевременно скорректировать тактику лечения. Случаи «сухого сустава», использование синовиальной жидкости, не соответствующей требованиям выполнения теста, а также слабовирулентная коагулазонегативная микрофлора, в том числе в составе микробных ассоциаций, являются ограничениями применения альфа-дефензин экспресс-теста.
Перипротезная инфекция (ппи), диагностика реинфекции тазобедренного сустава, интраоперационная аспирация синовиальной жидкости тазобедренного сустава, спейсер тазобедренного сустава, ревизионное эндопротезирование тазобедренного сустава, альфа-дефензин экспресс-тест
Короткий адрес: https://sciup.org/142243864
IDR: 142243864 | УДК: 616.728.2-089.227.843-77-089.168.1-002:615.33 | DOI: 10.18019/1028-4427-2024-30-6-811-821
Текст научной статьи Результаты интраоперационного применения альфа-дефензин экспресс-теста при выполнении второго этапа РЭТС
Тотальное эндопротезирование тазобедренного сустава, являясь «операцией XXI века» [1], позволяет значительно улучшить качество жизни пациентов, страдающих поздними стадиями остеоартроза [2]. Растущий уровень ожирения, увеличение продолжительности жизни населения способствуют росту случаев заболеваний опорно-двигательного аппарата [3, 4]. Как следствие, растет число операций первичного эндопротезирования крупных суставов и связанное с этим число потенциальных осложнений [5]. Перипротезнаяинфекция (ППИ) являетсяоднимизлидирующих по частотевстречаемости,деструктивности и стоимости лечения осложнением после операций по эндопротезированию суставов [6, 7]. Своевременная и точная диагностика перипротезной инфекции тазобедренного сустава позволяет наиболее рационально выбрать тактику лечения и снизить риск потенциально неблагоприятных последствий [8].
«Золотым стандартом» лечения пациентов с хронической формой перипротезной инфекции является двухэтапное ревизионное эндопротезирование тазобедренного сустава (РЭТС), в рамках которого на первом этапе проводят удаление компонентов эндопротеза, санацию, установку спейсера, импрегнирован-ного антибактериальными препаратами. После купирования инфекционного процесса, заживления раны и нормализации лабораторных показателей проводят второй этап РЭТС, в рамках которого выполняют удаление спейсера, санацию, установку ревизионных компонентов эндопротеза [9]. Так или иначе, авторы говорят о высоких показателях реинфекции после выполнения второго этапа РЭТС [10, 11]. В связи с этим периоперационная диагностика с целью исключения реинфекции при выполнении второго этапа РЭТС является крайне важной задачей. Существуют различные алгоритмы по диагностике ППИ, такие как ICM, WAIOT, EBJIS, каждый из которых обладает хорошими диагностическими показателями [12]. Однако использование данных алгоритмов для принятия решения о выполнении второго этапа на данный момент имеет ограниченную значимость [13]. В условиях отсутствия общепринятого предоперационного диагностического алгоритма перед выполнением второго этапа РЭТС актуальным становится применение различных синовиальных интраоперационных экспресс-тестов, позволяющих исключить/выявить реинфекцию и в случае необходимости изменить тактику лечения.
Альфа-дефензин экспресс-тecт (АДЭТ) является одним из наиболее современных, быстрых, чувствительных и специфичных тестов, позволяющих эффективно верифицировать ППИ, даже в условиях продолжающейся антибактериальной терапии [14, 15, 16]. Более того, в обновленный алгоритм ICM 2018 добавлено определение альфа-дефензиновых белков в синовиальной жидкости как «малый критерий» диагностики ППИ [17]. Однако в настоящее время недостаточно данных о том, насколько АДЭТ эффективен для выявления реинфекции после установки спейсера [18]. Существует мнение, согласно которому особенности местного иммунитета после операций первого этапа РЭТС, а также само по себе наличие установленного спейсера, импрегнированного антибактериальными препаратами, способствуют снижению прогностической значимости использования различных сывороточных и, тем более, синовиальных биомаркеров с целью исключения реинфекции [19]. Доступные сведения об оценке диагностических показателей АДЭТ в рамках периоперационной диагностики реинфекции при выполнении второго этапа ревизионного эндопротезирования у пациентов с установленным спейсером тазобедренного сустава в значительной степени различаются [20, 21, 22, 23].
Цель работы — определить диагностические показатели (точность, специфичность, чувствительность, AUC) альфа-дефензин экспресс-тecта в рамках верификации реинфекции у пациентов с установленным спейсером тазобедренного сустава при выполнении второго этапа РЭТС.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективном исследовании, проведенном в 2019–2024 гг. на базе ортопедического отделения ГКБ им. С.П. Боткина, приняло участие 135 пациентов.
Критерии включения:
-
— впервые установленный спейсер тазобедренного сустава по поводу перипротезной инфекции;
-
— отсутствие клинических признаков инфекционного процесса в области планируемой операции (отсутствие свища, локальной гиперемии, гипертермии);
-
— согласие на выполнение второго этапа ревизионного эндопротезирования;
-
— письменное информированное согласие на участие в исследовании.
Критерии невключения в исследование:
-
— активный инфекционный процесс с наличием свищевого хода в области тазобедренного сустава, локальной гиперемией, гипертермией;
-
— ранее выполненная операция по Гирдлестоуну («висячее бедро») по поводу перипротезной инфекции;
-
— объективные противопоказания в силу соматического или психического статуса к ревизионной операции;
-
— наличие ВИЧ-инфекции;
-
— повторно выполненная имплантация спейсера.
Критерии исключения:
-
— появление у пациента свищевого хода в области исследуемого тазобедренного сустава;
-
— отказ пациента от оперативного вмешательства и дальнейшее нежелание участвовать в исследовании;
-
— выявление реинфекции при проведении предоперационной диагностики;
-
— смерть пациента до выполнения второго этапа РЭТС.
В исследовании проводили оценку диагностических показателей интраоперационного применения альфа-дефензин экспресс-тecта у пациентов с установленным спейсером тазобедренного сустава при проведении второго этапа РЭТС.
Средний возраст пациентов составил 64 года (42–78 лет). Большинство пациентов, включенных в исследование, — женщины ( n = 67; 63 %), мужчин было 38 человек (37 %). Среднее время до выполнения второго этапа РЭТС составило 45 (19–69) недель.
Все 135 (100 %) пациентов, которые поступали для выполнения второго этапа РЭТС, предварительно обследованы с целью исключения реинфекции в области тазобедренного сустава. В рамках предоперационного исключения реинфекции у пациентов анализировали сывороточные биомаркеры (СОЭ, СРБ, число лейкоцитов в общем анализе крови, интерлейкин-6) и выполняли предоперационную аспирацию синовиальной жидкости исследуемого тазобедренного сустава с последующим микробиологическим анализом аспирата.
При проведении предоперационной диагностики выявлено 26 (19 %) случаев роста микрофлоры (по результатам предоперационного микробиологического исследования при выполнении предоперационной аспирации синовиальной жидкости). Ситуацию трактовали как реинфекцию. Эти пациенты исключены из исследования и направлены на повторную санацию и замену спейсера тазобедренного сустава.
Было также выявлено 4 (3 %) случая появления свища в области интересующего тазобедренного сустава до выполнения второго этапа РЭТС. Ситуацию трактовали как выявление свищевой формы реинфекции. Эти пациенты также исключены из исследования и направлены на выполнение санации, повторной установки спейсера тазобедренного сустава (рис. 1).
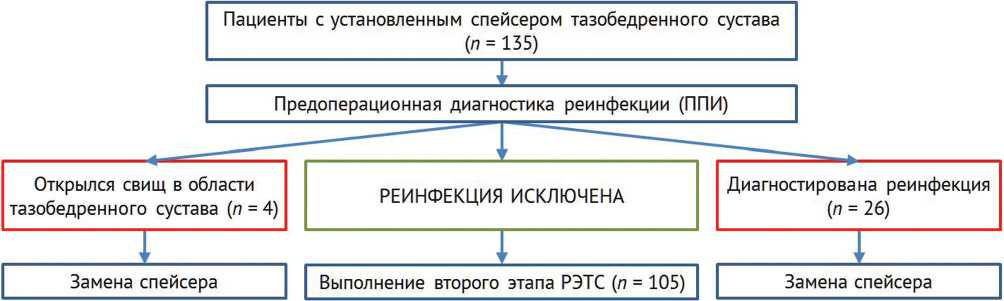
Рис. 1. Блок-схема дизайна исследования
По данным предоперационной диагностики, реинфекция у 105 (78 %) пациентов была исключена. Все 105 пациентов, поступавших для выполнения второго этапа ревизионного эндопротезирования, в обязательном порядке должны были закончить прием антибактериальных препаратов не менее чем за 14 дней до даты планируемой операции (так называемые «антибактериальные каникулы»).
В рамках второго этапа ревизионного эндопротезирования проводили удаление спейсера, санацию и установку ревизионных компонентов эндопротеза. У всех пациентов при доступе и после эксплантации спейсера взяты образцы периимплантных тканей из полости сустава и из-под удаленных компонентов спейсера (от 3 до 6 образцов), которые затем подвергали микробиологическому анализу с продолжительностью культивирования 14 дней и обязательным определением чувствительности к антибактериальным препаратам в случае выявления роста микроорганизмов.
На этапе доступа к спейсеру до вскрытия фасции у всех пациентов проводили аспирацию синовиальной жидкости с целью дальнейшего микробиологического исследования. Культивирование осуществляли на питательной среде PEDS PLUS с продолжительностью культивирования 14 дней. При наличии достаточного объема синовиальной жидкости (не менее 5 мл) без видимых следов попутной крови и/или других примесей с целью интраоперационной верификации реинфекции выполняли экспресс-тecт на альфа-дефензин.
Интраоперационное введение антибактериальных препаратов производили только после забора образцов периимплантных тканей и синовиальной жидкости. При продолжительности операции в течение 2–4 часов и более (в зависимости от вводимого препарата) выполняли введение дополнительной дозы антибактериальных препаратов в соответствии с клиническими рекомендациями [24].
При отсутствии синовиальной жидкости во время интраоперационной аспирации («сухой сустав») пациенту назначали курс двухкомпонентной эмпирической антибактериальной терапии до получения результатов интраоперационного микробиологического исследования образцов периимплантных тканей. В случае отсутствия роста микрофлоры по результатам интраоперационного микробиологического исследования при выполнении второго этапа ревизионного эндопротезирования курс антибактериальной терапии отменяли.
Результаты интраоперационного микробиологического анализа образцов периимплантных тканей и синовиальной жидкости во время выполнения второго этапа РЭТС были использованы в качестве эталонных, на основе которых оценивали и анализировали результаты интраоперационной верификации реинфекции с использованием альфа-дефензин экспресс-тecта.
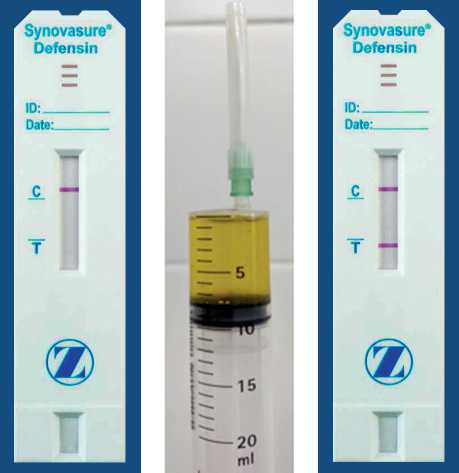
Выполнение альфа-дефензин экспресс-тecта и интерпретация полученных результатов соответствовали инструкции производителя (рис. 2).
Интенсивность контрольной полоски и результат тест-полоски на устройстве могут варьировать. Любая сплошная красновато-розовая полоса считается полоской, независимо от интенсивности или размера. Результаты анализа не следует интерпретировать по истечении 20 минут.
Отрицательный результат для альфа-дефензина означает только наличие красновато-розовой контрольной полосы (C) на устройстве без появления результата на тест-полоске (T) после 10 мин. Наличие контрольной полосы свидетельствует о правильности проведения теста.
Положительный (неотрицательный) результат для альфа-дефензина — это появление красновато-розовой контрольной полосы (C) на устройстве и красновато-розовой полосы на тест-полоске (T). Наличие контрольной полосы свидетельствует о правильности проведения теста.
Недействительный тест : перед интерпретацией результатов проверяется, появилась ли на устрой-
альфа-дефензин
Рис. 2. Иллюстрация результатов экспресс-тecта: слева — отрицательный результат, в центре — образец используемой синовиальной жидкости, справа — положительный результат 1
стве контрольная полоска с маркировкой «C». Если контрольная полоска не появилась, тест-полоска не проявилась полностью или фон не стал прозрачным, анализ считается недействительным и его результаты не могут быть использованы. Тест следует повторить с новым устройством. Для повторного тестирования используют предварительно приготовленный флакон для разведения. Повторный анализ должен быть проведен в течение 4 часов.
В случае выявления положительного результата пациенту назначали курс двухкомпонентной эмпирической антибактериальной терапии до получения результатов интраоперационного микробиологического исследования. При получении роста микрофлоры пациента переводили на антибактериальные препараты с учетом данных чувствительности выявленного микроорганизма.
Исследование проведено в соответствии с «Правилами клинической практики в Российской Федерации» (Приказ Минздрава РФ от 19.06.2003 г. No 266), этическими принципами Хельсинкской деклара-
1 ции (World Medical Association Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects, 2013) и одобрено локальным этическим комитетом при Первом МГМУ им. И.М. Сеченова (протокол от 20.01.2022 No 01-22).
Для сбора, обработки и систематизации информации использовали программу Microsoft Office Excel. Для определения статистической значимости данных применяли t-критерий Стьюдента. Статистически значимыми считали различия на уровне значимости p < 0,05. Данные также проанализированы с помощью программы MedCalc 13.2.2 (MedCalc Software bv, Ostend, Belgium) с целью проведения ROC-анализа и определения чувствительности, AUC, специфичности и точности альфа-дефензин экспресс-тecта в рамках интраоперационной верификации реинфекции у пациентов с установленным спейсе-ром тазобедренного сустава.
РЕЗУЛЬТАТЫ
Согласно результатам интраоперационного микробиологического исследования образцов периим-плантных тканей и синовиальной жидкости при выполнении второго этапа ревизионного эндопротезирования тазобедренного сустава было выявлено 24 случая (23 %) роста микрофлоры (рис. 3).
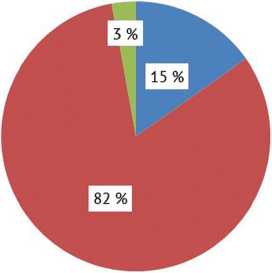
Получены следующие данные относительно результатов интраоперационной верификации реинфекции при использовании альфа-дефензин экспресс-теста: из 105 пациентов, которым выполняли ревизионное вмешательство, оценить эффективность данного теста удалось в 86 (82 %) случаях (рис. 4).
У 3 (3 %) пациентов при интраоперационной аспирации получена синовиальная жидкость с большим содержанием попутной крови. У остальных 16 (15 %) пациентов при выполнении интраоперационной аспирации синовиальной жидкости последнюю получить не удалось («сухой сустав»). Этот факт говорит о том, что в 18 % случаев оценить эффективность любых синовиальных биомаркеров невозможно (рис. 4).
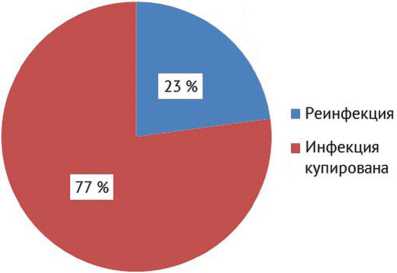
Рис. 3. Результаты интраоперационного микробиологического исследования образцов пери-имплантных тканей и синовиальной жидкости
■ 'Сухой сустав"
■ Синовиальная жидкость, соответствующая выполнению теста
■ Синовиальная жидкость, не соответствующая выполнению теста
Рис. 4. Распределение пациентов в соответствии с интраоперационно полученным аспиратом
Диагностические показатели альфа-дефензин экспресс-теста при получении достаточного количества синовиальной жидкости без посторонних примесей представлены на диаграмме (рис. 5).
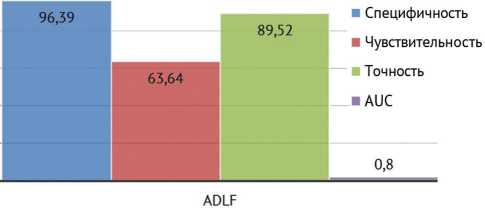
Рис. 5. Диагностические показатели интраоперационного применения альфа-дефензин экспресс-тecта у пациентов с установленным спейсером тазобедренного сустава
В соответствии с результатами интраоперационного микробиологического исследования образцов периимплантных тканей и синовиальной жидкости получено 65 (76 %) истинно отрицательных и 11 (13 %) истинно положительных результатов альфа-дефензин экспресс-тecта.
Также зарегистрированы 10 (11 %) случаев, при которых наблюдали расхождение результатов интраоперационного альфа-дефензин экспресс-теста и интраоперационного микробиологического исследования образцов периимплантных тканей и синовиальной жидкости: ложноотрицательный результат — 7 случаев (7 %), ложноположительный результат — 3 (4 %) случая.
Статистически значимых различий при анализе полученных результатов интраоперационного микробиологического исследования образцов периимплантных тканей и синовиальной жидкости при сравнении с результатами интраоперационного выполненного альфа-дефензин экспресс-тecта не выявлено ( p ≥ 0,05).
ОБСУЖДЕНИЕ
В исследовании, посвященном особенностям воздействия артикулирующих спейсеров на периим-плантные ткани, выявлено, что спейсеры, изготовленные из ПММА, способствуют иммуномодулирующему воздействию на синовиальную оболочку и окружающие имплант ткани. Образующаяся на месте контакта спейсер–кость мембрана индуцирована различными иммунными клетками (за счет истирания цемента, образования цементного дебриса и миграции компонентов клеточного иммунитета) [29]. Важно понимать, что антибактериальные препараты, входящие в состав спейсера, высвобождаясь в синовиальную жидкость, способствуют получению ложноотрицательных результатов микробиологического исследования [30].
Вопрос продолжительности выделения антибактериальных препаратов из спейсера вполне дискута-бельный. В связи с чем точность синовиальных биомаркеров при аспирации синовиальной жидкости у пациентов с установленным спейсером в разные сроки может отличаться. Так, S.P. Boelch с соавт. продемонстрировали, что локальная концентрация антибактериальных препаратов может сохраняться повышенной более 6 недель с момента операции. Авторы отмечают, что указанные данные получены в эксперименте in vitro , и что в ситуациях in vivo продолжительность выделения антибиотика может отличаться [31]. Исходя из вышеизложенного, наличие в полости сустава повышенной концентрации иммунных клеток и антибактериальных препаратов может способствовать ложным результатам диагностики реинфекции при выполнении исследований синовиальной жидкости.
Несмотря на обилие различных сывороточных и синовиальных маркеров перипротезной инфекции, показатели диагностической точности синовиальных тестов превосходят сывороточные биомаркеры [25]. Однако синовиальную жидкость удается получить далеко не во всех случаях при проведении пред/интраоперационной аспирации. В связи с чем, оценить эффективность любых синовиальных биомаркеров с целью верификации ППИ/реинфекции невозможно примерно в трети случаев [26, 27]. В нашем исследовании количество случаев, при которых выполнить АДЭТ в связи с отсутствием / крайне скудным количеством или не соответствующей критериям выполнения АДЭТ синовиальной жидкости при интраоперационной аспирации, составило 18 %.
Доказана высокая эффективность альфа-дефензин теста для верификации перипротезной инфекции в крупных суставах [28, 29, 30, 31, 32]. В свою очередь, публикаций, в которых оценивался диагностический потенциал альфа-дефензин экспресс-тecта в рамках исключения/подтверждения реинфекции у пациентов с установленным спейсером тазобедренного сустава, немного.
C.N. Carender et al. проводили оценку диагностических показателей предоперационного применения альфа-дефензин экспресс-тecта у пациентов с установленным спейсером коленного и тазобедренного суставов перед выполнением второго этапа ревизионного эндопротезирования [22]. Авторы продемонстрировали данные о высоких показателях специфичности (96 %) при 0 % показателе чувствительности метода, говоря о том, что проведение альфа-дефензин теста не повышало эффективности предоперационного исключения реинфекции при его добавлении к общепринятым синовиальным и серологическим маркерам инфекции [22].
В других исследованиях авторы выявили высокие диагностические показатели применения альфа-дефензин экспресс-тecта перед выполнением ревизионного эндопротезирования [21, 33]. В исследовании S. Frangiamore et al. показатели специфичности и чувствительности метода составили 97 % и 67 % соответственно [33]. W. Stone et al. также говорят о высоких значениях специфичности (92 %) при не столь значительных показателях чувствительности (50 %) при использовании альфа-дефензин экспресс-тecта у пациентов с установленным спейсером перед выполнением второго этапа ревизионного эндопротезирования [21].
Авторы обращают внимание на два ложноотрицательных результата альфа-дефензин экспресс-тecта, отмечая рост Cutibacterium acnes в одном случае и выявление роста двух различных коагулазонегативных стафилококков (микробная ассоциация) во втором случае [21].
Справедливости ради, стоит подчеркнуть, что ни W.Z. Stone, ни S.J. Frangiamore в своих работах не указывали количество «сухих суставов», в связи с чем истинные показатели эффективности альфа-дефензин теста у пациентов с установленным спейсером в данных публикациях остаются до конца не ясными [21, 33].
В нашем исследовании также выявлено семь случаев ложноотрицательных результатов альфа-дефензин экспресс-тecта, связанных в 5 (71 %) случаях с ростом различных слабовирулентных коагулазонегативных микроорганизмов и в 2 (29 %) случаях с выявлением различных микробных ассоциаций.
Полученные нами ложноотрицательные результаты АДЭТ согласуются с причинами ложноотрицательных результатов в других исследованиях [21, 34, 35].
Ложноположительные результаты альфа-дефензин теста (3 случая, 4 %), полученные в нашем исследовании, по всей видимости, связаны с использованием жидкости, не полностью соответствующей критериям выполнения теста: полученная при интраоперацонной аспирации синовиальная жидкость имела в своем составе геморрагический компонент (рис. 6).
В некоторых публикациях говорится об успешном применении АДЭТ при получении СЖ, содержащей примесь крови, в отличие от использования тест-полосок для определения лейкоцитарной эстеразы [36, 37]. Однако авторы не уточняли объем разбавления/примесей крови при использовании данных тестов.
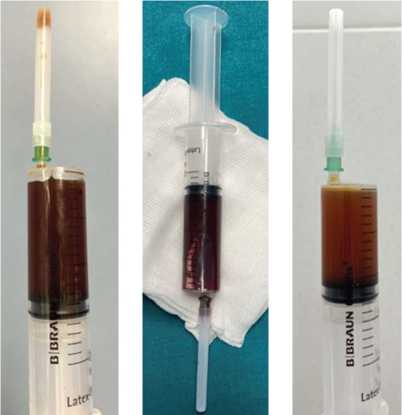
Рис. 6. Интраоперационно полученные образцы синовиальной жидкости с геморрагическим компонентом
В инструкции использования дается заключение о высоких диагностических показателях АДЭТ, однако есть примечание, что данные показатели актуальны при использовании образцов синовиальной жидкости, исклю- чая образцы с разведением крови > 20 % 2. В связи с чем, вероятность получения ложноположительных результатов АДЭТ при использовании синовиальной жидкости с более чем 20 % разведением крови не исключена.
Согласно результатам проведенного нами исследования, показатели диагностической точности интраоперационного использования АДЭТ в рамках верификации реинфекции у пациентов с установленным спейсером тазобедренного сустава составили 96,39 % для специфичности, 63,64 % для чувствительности метода, что находит отражение в результатах аналогичных исследований [21, 33].
A. Shahi et al. утверждают, что такой инструмент диагностики перипротезной инфекции как альфа-дефензин обладал более высокой специфичностью и обеспечивал лучший скрининг ППИ у пациентов, продолжающих прием антибактериальных препаратов, чем сывороточные СОЭ, СРБ, определение в синовиальной жидкости ПЯН и даже микробиологическое исследование [16]. Однако исследование проводили до выполнения ревизионного вмешательства, и оценить эффективность данного инструмента у пациентов с установленным спейсером не представляется возможным. В свою очередь, J.M. Owens et al. отмечали, что рутинное использование такого синовиального биомаркера как альфа-дефензин перед выполнением второго этапа РЭТС может быть неоправданно [38].
Лечение ППИ является сложной задачей, решать которую необходимо с использованием мультидисципли-нарного подхода и опытной команды специалистов, включающих, в том числе, клинического фармаколога [39]. Несмотря на то, что к настоящему времени нет единого протокола назначения антибактериальной терапии, при выполнении второго этапа ревизионного эндопротезирования важно понимать, что антибиотики должны быть подобраны, исходя из соматического состояния пациента (функции почек, печени, сердечнососудистой системы), с учетом возможных аллергических реакций на тот или иной антибактериальный препарат, а также результатов чувствительности микроорганизмов по данным микробиологического исследования, проведенного при выполнении первого этапа РЭТС. Пациенты, поступающие для выполнения второго этапа РЭТС, предварительно обследованы, реинфекция/рецидив ППИ исключены. Такие пациенты признаются «реконвалесцентами» по ППИ. Следовательно, актуально применение именно профилактических, а не лечебных схем и дозировок при назначении антибактериальных препаратов.
В различных медицинских центрах используют различные эмпирические схемы, учитывающие особенности видового спектра возбудителей ППИ и локальные протоколы лечения [40]. Наиболее часто применяют различные комбинации или монотерапию антибактериальными препаратами таких групп как цефалоспорины III поколения, гликопептиды, линкозамиды, фторхинолоны [41], а также бета-лак-тамов широкого спектра действия [42].
При интраоперационной верификации реинфекции/рецидива ППИ после взятия образцов периим-плантных тканей из полости сустава и из-под удаленных компонентов спейсера, а также образца синовиальной жидкости с последующим проведением АДЭТ (при получении СЖ, соответствующей критериям выполнения теста), в случае отрицательного результата АДЭТ выполняли введение про- филактической дозировки одного из антибактериальных препаратов продолжительностью двое суток. При получении положительного результата АДЭТ интраоперационно выполняли введение двух антибактериальных препаратов (в рамках стартовой эмпирической терапии) до получения результатов интраоперационного микробиологического исследования с последующим переходом на таргетную пролонгированную антибактериальную терапию с учетом данных чувствительности.
ЗАКЛЮЧЕНИЕ
Как и все синовиальные биомаркеры, АДЭТ неэффективен при выявлении «сухих суставов». Тест также демонстрирует ограниченные результаты при использовании синовиальной жидкости с выраженным геморрагическим компонентом и при наличии слабовирулентной коагулазонегативной микрофлоры и/или микробных ассоциаций.
Альфа-дефензин экспресс-тecт продемонстрировал высокие показатели диагностической точности, специфичности и AUC у пациентов с установленным спейсером тазобедренного сустава при выполнении второго этапа РЭТС. АДЭТ является хорошим дополнительным интраоперационным экспресс-тестом, позволяющим, в случае необходимости, изменить тактику лечения. Несмотря на противоречивые данные научных публикаций, применение АДЭТ позволяет эффективно верифицировать реинфекцию и является хорошим инструментом подтверждения успешной эрадикации инфекции области тазобедренного сустава.
Список литературы Результаты интраоперационного применения альфа-дефензин экспресс-теста при выполнении второго этапа РЭТС
- Пронских А.А., Романова С.В., Лукинов В.Л. и др. Эндопротезирование тазобедренного сустава у пациентов с посттравматическими дефектами и деформациями вертлужной впадины. Травматология и ортопедия России. 2022;28(4):66-78. doi: 10.17816/2311-2905-2001
- Гольник В.Н., Пелеганчук В.А., Джухаев Д.А. и др. Импакционная костная пластика как метод выбора в замещении дефектов вертлужной впадины при ревизионном эндопротезировании тазобедренного сустава: серия клинических случаев. Гений ортопедии. 2024;30(2):245-254. doi: 10.18019/1028-4427- 2024-30-2-245-254. EDN: LCXHIZ.
- Назаров В.А., Закревский К.В., Согомонян Л.В. Комбинация известных способов костной аутопластики при эндопротезировании диспластического тазобедренного сустава II степени по Hartofilakidis у пациента с тяжелой сопутствующей патологией. Уральский медицинский журнал. 2023;22(4):85-91. doi: 10.52420/2071-5943-2023-22-4-85-91
- Clement ND, van der Linden M, Keating JF. Higher rate of complications with uncemented compared to cemented total hip arthroplasty for displaced intracapsular hip fractures: A randomised controlled trial of 50 patients. Eur J Orthop SurgTraumatol. 2021;31(3):587-594. doi: 10.1007/s00590-020-02808-x
- Коваленко А.Н., Тихилов Р.М., Шубняков И.И. и др. Дизайн индивидуальных вертлужных компонентов: влияние типа дефекта на вид конструкции. Российский журнал биомеханики. 2021;25(2):159-172. doi: 10.15593/ RZhBiomeh/2021.2.04
- Ковалдов К.А., Морозова Е.А., Герасимов Е.А. и др. Результаты лечения пациентов с массивными костными дефектами вертлужной впадины. Политравма. 2024;(1):27-35. doi: 10.24412/1819-1495-2024-1-27-35
- Schatzker J, Glynn MK, Ritter D. A preliminary review of the Müller acetabular and Burch-Schneider antiprotrusio support rings. Arch Orthop Trauma Surg(1978). 1984;103(1):5-12. doi: 10.1007/BF00451312
- Загородний Н.В., Алексанян О.А., Чрягян Г.А. и др. Реконструкция вертлужной впадины с использованием компонентов из трабекулярного металла. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2019;(1):5-10. doi: 10.17116/vto20190115
- Коваленко А.Н., Тихилов Р.М., Шубняков И.И. и др. Ревизии вертлужных компонентов индивидуальными конструкциями с минимальным сроком наблюдения 12 месяцев: функциональные результаты, качество жизни и удовлетворенность пациентов. Травматология и ортопедия России. 2019;25(1):21-31. doi: 10.21823/2311-29052019-25-1-21-31
- D'Antonio JA, Capello WN, Borden LS, et al. Classification and management of acetabular abnormalities in total hip arthroplasty. Clin OrthopRelatRes. 1989;(243):126-137.
- Crowe JF, Mani VJ, Ranawat CS. Total hip replacement in congenital dislocation and dysplasia of the hip. J Bone Joint Surg Am. 1979;61(1):15-23.
- Волокитина Е.А., Колотыгин Д.А. Особенности первичной и ревизионной имплантации бесцементного тазового компонента при диспластическом коксартрозе. Травматология и ортопедия России. 2009;(3):119-121. doi: 10.17816/2311-2905-1913
- Волокитина Е.А., Колотыгин Д.А. Эндопротезирование тазобедренного сустава при деформациях тазовой кости: особенности предоперационного проектирования и хирургической техники. Вестник травматологии и ортопедии Урала. 2013;1(2):42-48.
- Ершов А.С., Волокитина Е.А. Эндопротезирование тазобедренного сустава у больных ревматоидным артритом. Уральский медицинский журнал. 2022;21(2):26-37. doi: 10.52420/2071-5943-2022-21-2-26-37
- Удинцева М.Ю., Кутепов С.М. Причины ревизий эндопротезов тазобедренного сустава у больных ревматоидным артритом. Уральский медицинский журнал. 2022;21(2):63-66. doi: 10.52420/2071-5943- 2022-21-2-63-66
- Тихилов Р.М., Шубняков И.И., Чиладзе И.Т. и др. Тотальное эндопротезирование тазобедренного сустава с использованием аугментов из трабекулярного металла при последствиях переломов вертлужной впадины. Травматология и ортопедия России. 2011;17(1):76-81. doi: 10.21823/2311-2905-2011-0-1-76-81
- Paprosky WG, Perona PG, Lawrence JM. Acetabular defect classification and surgical reconstruction in revision arthroplasty. A 6-year follow-up evaluation. J Arthroplasty. 1994;9(1):33-44. doi: 10.1016/0883-5403(94)90135-x
- Волокитина Е.А., Удинцева М.Ю., Ершов А. С., Кутепов С.М. Восполнение дефектов вертлужной впадины при первичном и ревизионном эндопротезировании. Учебное пособие. Екатеринбург: «ИИЦ «Знак качества»; 2022:32. Доступно по: https://usma.ru/wp-content/uploads/2024/09/Дефекты_верл_впад.pdf. Ссылка активна на 04.10.2024.
- Бабушкин В.Н. Билатеральное эндопротезирование в лечении дегенеративно-дистрофических заболеваний тазобедренных суставов: автореф. дис.... канд. мед. наук. Курган; 2007:25. Доступно по: https://medical-diss.com/ docreader/240392/a#?page=1. Ссылка активна на 04.10.2024.
- Волокитина Е.А., Колотыгин Д.А. Особенности первичной и ревизионной имплантации бесцементного тазового компонента при диспластическом коксартрозе. Травматология и ортопедия России. 2009;(3):119-121. doi: 10.17816/2311-2905-1913
- Malahias MA, Mancino F, Gu A, et al. Acetabular impaction grafting with mesh for acetabular bone defects: a systematic review. Hip Int. 2022;32(2):185-196. doi: 10.1177/1120700020971851
- Dawson J, Fitzpatrick R, Carr A, Murray D. Questionnaire on the perceptions of patients about total hip replacement. J Bone Joint Surg Br. 1996;78-B(2):185-190. doi:10.1302/0301-620X.78B2.0780185
- Morlock MM, Hube R, Wassilew G, et al. Taper corrosion: a complication of total hip arthroplasty. EFORT Open Rev. 2020;5(11):776-784. doi: 10.1302/2058-5241.5.200013
- Петров А.Б., Рузанов В.И., Машуков Т.С. Отдаленные результаты хирургического лечения пациентов с переломами вертлужной впадины. Гений ортопедии. 2020;26(3): 300-305. doi: 10.18019/1028-4427-2020-26-3-300-305
- Hao Y, Luo D, Wu J, et al. A novel revision system for complex pelvic defects utilizing 3D-printed custom prosthesis. J Orthop Translat. 2021;31:102-109. doi: 10.1016/j.jot.2021.09.006
- Цыбин А.В., Любчак В.В., Фалькович А.С. и дп. Определение конгруэнтности стандартного полусферического вертлужного компонента и посттравматически деформированной вертлужной впадины при первичном эндопротезировании тазобедренного сустава. Экспериментальное исследование. Гений ортопедии. 2022;28(5):698-703. doi: 10.18019/1028-4427-2022-28-5-698-703
- Ершов А. С., Волокитина Е. А., Меньшикова И. А., Удинцева М. Ю. Особенности морфологии вертлужной впадины, определяющие технологию имплантации тазового компонента протеза. Уральский медицинский журнал. 2022;21(2):6-12. doi: 10.52420/2071-5943-2022-21-2-6-12
- Тихилов Р.М., Джавадов А.А., Денисов А.О. и др. Анализ экономической эффективности использования индивидуальных и серийных вертлужных конструкций при ревизионном эндопротезировании тазобедренного сустава. Гений ортопедии. 2022;28(2):234-240. doi: 10.18019/1028-4427-2022-28-2-234-240
- Рукин Я.А., Лычагин А.В., Мурылев В.Ю. и др. Ранние результаты эндопротезирования тазобедренного сустава с применением индивидуальных аугментов при диспластическом коксартрозе. Травматология и ортопедия России. 2020;26(2):50-59. doi: 10.21823/2311-2905-2020-26-2-50-59
- Николаев Н.С., Малюченко Л.И., Преображенская Е.В. и др. Применение индивидуальных вертлужных компонентов в эндопротезировании тазобедренного сустава при посттравматическом коксартрозе. Гений ортопедии. 2019;25(2):207-213. doi: 10.18019/1028-4427-2019-25-2-207-213
- Алексанян О.А., Чрагян Г.А., Каграманов С.В., Загородний Н.В. Лечение обширного дефекта вертлужной впадины у пациентки с асептической нестабильностью тотального эндопротеза тазобедренного сустава. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2020;27(3):60-66. doi: 10.17816/vto202027360-66
- Lychagin AV, Rosenberg N, Gritsyuk AA. Evaluation of the potential complications of surgical wound drainage in primary total hip arthroplasty: a prospective controlled double-blind study. Hip Int. 2021;31(5):589-592. doi: 10.1177/1120700020941749


