Результаты лечения пациентов с синдромом компрессии чревного ствола
Автор: Васильченко М.И., Ерин С.А., Хусаинов И.Р., Овчинникова У.Р., Гололобов Г.Ю., Гадлевский Г.С.
Журнал: Хирургическая практика @spractice
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.9, 2024 года.
Бесплатный доступ
Цель. Демонстрация авторского опыта применения метода лапароскопической декомпрессии чревного ствола у пациентов с верифицированным синдромом компрессии чревногоствола (СКЧС, синдром Данбара).Методы. Представлен ретроспективный анализ результатов лечения 8 пациентов, которые были прооперированы по поводу СКЧС в период с января 2020 г. по декабрь 2023 г. Диагноз во всех случаях был установлен на основе жалоб, КТ-ангиографии, УЗДГ. У всех пациентов этапы оперативного вмешательства включали осуществление доступа в брюшную полость, обзорную лапароскопию, расстановку троакаров. После этого проводилось вскрытие малого сальника для создания доступа к основанию ножек пищеводного отверстия диафрагмы. Далее выделяли дугообразную связку с последующим пересечением, в результате чего определяли контурирование чревного ствола.Результат. Средняя продолжительность операции составила 93,72 мин (60 - 180), средняя кровопотеря - 36,25 мл. Среднее время пребывания в стационаре - 3,25 суток. При оценке отдаленных результатов у 5 пациентов наступило полное выздоровление, 3 пациента отметили уменьшение интенсивности и частоты болей. После операции всем пациентам было проведено УЗДГ чревного ствола. Показатели скорости кровотока на выдохе и PSV в ЧС/PSV были в пределах референтных значений.Заключение. По данным исследования, в клинической картине у большинства пациентов с данным заболеванием доминируют жалобы на тошноту, рвоту, потерю веса и болевой синдром после приема пищи или физической нагрузки, что совпадает с данными мировой литературы. В диагностике заболевания наибольшую клиническую значимость имеют методы компьютерной ангиографии и УЗДГ чревного ствола. Показанием к оперативному лечению СКЧС является наличие стеноза чревного ствола и симптоматики хронической абдоминальной ишемии. По результатам исследования, безопасный и эффективный способ лечения - лапароскопическая декомпрессия чревного ствола с диссекцией чревного сплетения.
Синдром компрессии чревного ствола, синдром данбара, синдром срединной дугообразной связки, лапароскопическая декомпрессия чревного ствола
Короткий адрес: https://sciup.org/142243836
IDR: 142243836 | УДК: 616.33-089 | DOI: 10.5922/2223-2427-2024-9-4-7
Текст научной статьи Результаты лечения пациентов с синдромом компрессии чревного ствола
Синдром компрессии чревного ствола (СКЧС, синдром срединной дугообразной связки, синдром Данбара; англ. median arcuate ligament syndrome, MALS) — редкое заболевание, обусловленное экстравазальным сдавлением чревного ствола срединной дугообразной связкой диафрагмы. Такое заболевание является одной из причин хронической абдоминальной ишемии [1].
Впервые данная патология была описана в 1917 г. В. Lipshutz, который выполнил вскрытие трупа и продемонстрировал пережатие чревного ствола срединной дугообразной связкой диафрагмы, приводящее к компрессии [2]. В 1963 г. T. Harjola и соавт. сообщили о симптоматическом облегчении постпрандиальной боли в эпигастральной области у 57-летнего мужчины после хирургической декомпрессии чревной артерии, которая возникла из-за фиброза данной области [3]. В 1965 г. J. Dunbar впервые описал этот синдром, который в последующем стал называться его именем [4].
Срединная дугообразная связка (СДС) представляет собой плотную фиброзную дугу, соединяющую правую и левую ножки диафрагмы на уровне аортального отверстия (T/LJ. Она 叩 оходит спереди от аорты и 面 ычно краниально от чревной артерии. Краниальное отхождение чревной артерии или каудальное отхождение СДС могут привести к внешнему сдавлению проксимальной части чревного ствола. В норме чревный ствол отходит от аорты ниже поясничной части диафрагмы, что исключает его компрессию. В случае высокого отхождения этого сосуда от брюшной аорты или низкого расположения поясничной части диафрагмы или сочетания этих анатомических отклонений в процессе онтогенеза развивается компрессия чревного ствола [1].
Близость чревного узла к сдавленной чревной артерии и доказательства положительного эффекта после оперативных вмешательств, направленных на диссекцию в области чревного ганглия, привели к предположению о том, что невропатическая боль является фактором, способствующим развитию СКЧС. Считается, что механизмом этого выступает сдавливание чревного ганглия СДС и последующая чрезмерная стимуляция болевых волокон симпатической нервной системы.
Истинная распространенность СКЧС неясна, что отчасти связано с различными клиническими проявлениями. Существует тенденция к женскому фенотипу (4 : 1), а средний возраст обычно составляет от 30 до 50 лет [5]. Сдавление чревного ствола срединной дуго 面 разной связкой 叩 исутствует у 3,4—7,3 % бессимптомных пациентов, которым визуализация проводится по другим показаниям [6].
Цель исследования — демонстрация авторского опыта применения метода лапароскопической декомпрессии чревного ствола с диссекцией чревного сплетения у пациентов с верифицированным синдромом Данбара.
Материалы и методы
Проведен ретроспективный анализ данных 8 пациентов, которые были прооперированы по поводу синдрома Данбара на базах клинического исследования в период с января 2020 г. по декабрь 2023 г. Диагноз был установлен на основе жалоб, КТ-ангиографии, в ходе которой выявлялся стеноз чревного ствола, и дуплексного ультразвукового исследования чревного ствола. Все пациенты ранее наблюдались у гастроэнтерологов, неврологов. Консервативная терапия оказалась неэффективной.
Критерии оценки
Оценивались анкетные данные пациентов (пол, возраст, рост, вес, ИМТ, анестезиологические риски по классификации Американского общества анестезиологов (ASA, 2014), сопутствующие заболевания). Всем пациентам была выполнена лапароскопическая декомпрессия чревного ствола и одной пациентке — симультанная фундопликация по поводу грыжи пищеводного отверстия диафрагмы (ГПОД).
Регистрировали и в последующем анализировали следующие интраоперационные параметры: 叩 одолжительность операции, объем кровопотери, интраоперационные осложнения. В послеоперационном периоде проведена оценка результатов: структура послеоперационных осложнений (согласно унифицированной шкале Clavien — Dindo) и их коррекция, общее время пребывания в стационаре.
Статистический анализ
Количественные переменные представлены в виде средних величин с расчетом стандартных отклонений или минимумов и максимумов; для качественных переменных указывали абсолютные и относительные (в %) частоты. Статистическая обработка данных проведена с использованием программы Microsoft Excel 2019 («Microsoft corporation», США).
Характеристика исследуемых пациентов
В исследование включены 8 пациентов, которым была выполнена лапароскопическая декомпрессия чревного ствола. Средний возраст составил 36,4 года (22—62), самая частая жалоба — на боль в животе после приема пищи и при физических нагрузках (у 6 из 8 пациентов), у 2 пациентов боли носили постоянный характер, 2 пациента предъявляли жалобы на констипацию. Средний индекс массы тела (ИМТ) составил 22,3 кг/м2. Индекс ASA у всех пациентов не превышал 2.
Диагноз был установлен на основе данных КТ органов брюшной полости. У 100 % пациентов наблюдался стеноз устья чревного ствола более 50 % (рис. 1).
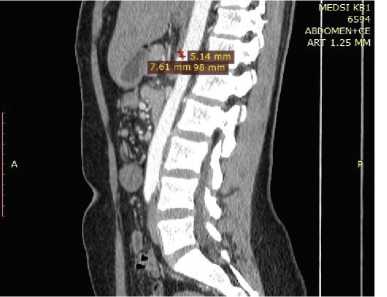
Рис. 1. Данные компьютерной томографии (КТ) органов брюшной полости до операции
Fig. 1. CT scan of the abdomen before surgery
Также в ходе предоперационного обследования было проведено УЗДГ с целью определения гемодинамической значимости стеноза (табл. 1).
Таблица 1. Характеристика исследуемых пациентов *
Table 1. Characteristics of patients
|
Пол |
Возраст, лет (36,375) |
Симптомы |
ИМТ (22,30875) |
ASA |
Степень стеноза по КТ, % (69,375) |
Результаты УЗДГ |
|
Ж |
34 |
Постоянные боли в животе, диарея |
24,63 |
1 |
75 |
СКВ = 130 см/с; PSV в ЧС/PSV = 4,6 |
|
Ж |
42 |
Боль после приема пищи |
24,42 |
1 |
80 |
СКВ = 125 см/с; PSV в ЧС/PSV = 4,0 |
|
Ж |
36 |
Боль после приема пищи |
20,36 |
1 |
70 |
СКВ = 120 см/с; PSV в ЧС/PSV = 4,5 |
|
М |
29 |
Хронические боли в животе, запоры, потеря аппетита |
22,65 |
1 |
70 |
СКВ = 100 см/с; PSV в ЧС/PSV = 4,3 |
|
М |
62 |
Боль после приема пищи, потеря веса, боли в спине |
21,63 |
1 |
80 |
СКВ = 120 см/с; PSV в ЧС/PSV = 4,5 |
|
М |
22 |
Боль после приема пищи |
19,2 |
1 |
70 |
СКВ = 154 см/с; PSV в ЧС/PSV = 4,6 |
|
Ж |
42 |
Боль после приема пищи |
24,6 |
2 |
50 |
СКВ = 112 см/с; PSV в ЧС/PSV = 3,4 |
|
Ж |
24 |
Боль после приема пищи |
20,98 |
1 |
60 |
СКВ = 115 см/с; PSV в ЧС/PSV = 3,6 |
* В скобках указано среднее значение показателя.
Техника оперативного вмешательства
В параумбиликальной области произведен разрез 10 мм, через который установлен 10-мм троакар, наложен карбоксиперитонеум, после чего установлены два 5-мм троакара в правой и левой боковых областях. После расстановки троакаров произведено вскрытие малого сальника для осуществления доступа к основанию ножек пищеводного отверстия диафрагмы (ПОД).
Далее выделена дугообразная связка (рис. 2) с последующим пересечением ультразвуковым диссектором (рис. 3), в результате чего определялось контурирование чревного ствола (рис. 4). После выполнения описанных этапов произведены гемостаз зоны оперативного интереса, послойное ушивание ран.
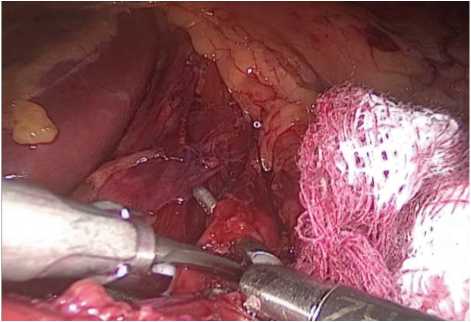
Рис 2. Выделение срединной дугообразной связки
Fig. 2. Isolation of the median arcuate ligament
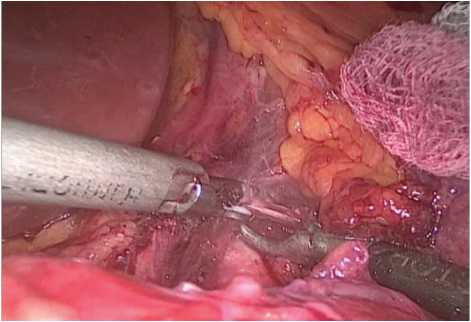
Рис. 3. Пересечение срединной дугообразной связки
Fig. 3. The intersection of the median arcuate ligament
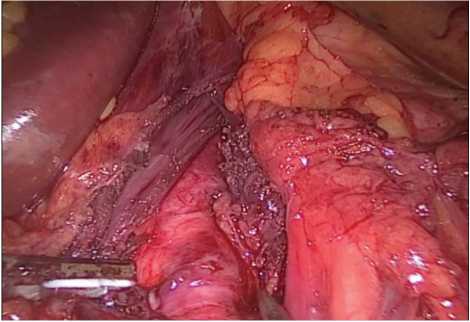
Рис. 4. Интраоперационная картина после рассечения срединной дугообразной связки
Fig. 4. Intraoperative picture after dissection of the median arcuate ligament
Результаты
Всем пациентам была проведена лапароскопическая декомпрессия чревного ствола. Одной пациентке также была выполнена симультанная фундопликация по поводу грыжи пищеводного отверстия диафрагмы. Средняя продолжительность операции составила 93,72 мин (60—180), средняя кровопотеря — 36,25 мл. Среднее время пребывания в стационаре — 3,25 суток.
У одной пациентки в раннем послеоперационном периоде был выявлен абсцесс левого поддиафрагмального пространства, который потребовал проведения ревизионного вмешательства и санации брюшной полости (осложнение по Clavien — Dindo = 3). Других осложнений выявлено не было.
При оценке отдаленных результатов у 5 пациентов наступило полное выздоровление (исчезновение всех симптомов и жалоб), 3 пациента отметили уменьшение частоты и интенсивности болевого синдрома. Стоит отметить, что 2 из этих пациентов были крайне эмоционально лабильны (по оценке состояния психического здоровья по Mental Health Quality of Life questionnaire (MHQoL-7D) — 10 и 12 (по шкале от 0 до 21), в связи с чем отсутствие полного выздоровления у данных пациентов может быть объяснено их психоэмоциональным статусом).
После операции всем пациентам было проведено обследование в следующем объеме: КТ органов брюшной полости (рис. 5), ультразвуковое дуплексное сканирование чревного ствола.
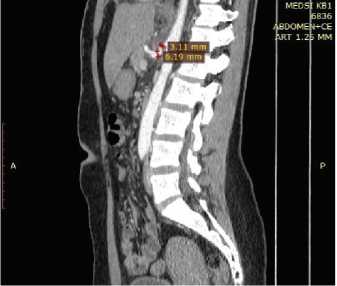
Рис. 5. Данные КТ органов брюшной полости после операции
Fig. 5. CT scan of the abdomen after surgery
У 100 % пациентов показатели скорости кровотока на выдохе и PSV в ЧС/PSV были в пределах референтных значений (СКВ менее 72 и PSV в ЧС/PSV менее 3,0).
Более подробно результаты представлены в таблице 2.
Таблица 2. Результаты лечения синдрома компрессии чревного ствола
Table 2. The results of the treatment
|
Продолжительность операции, мин |
Кровопотеря, мл |
Осложнения |
Результаты |
Длительность госпитализации, суток |
|
160 |
60 |
Полное излечивание |
3 |
|
|
140 |
40 |
Полное излечивание |
4 |
Окончание табл. 2
|
Продолжительность операции, мин |
Кровопотеря, мл |
Осложнения |
Результаты |
Длительность госпитализации, суток |
|
180 |
40 |
Уменьшение боли |
4 |
|
|
90 |
20 |
Полное излечивание |
3 |
|
|
60 |
20 |
Уменьшение боли |
2 |
|
|
60 |
20 |
Полное излечивание |
2 |
|
|
90 (+фундопликация) |
70 |
Поддиафрагмальный абсцесс |
Уменьшение боли |
5 |
|
60 |
20 |
Полное излечивание |
3 |
Обсуждение
Группа авторов отметила основную клиническую картину у данной группы пациентов: наиболее частые симптомы включают боль в эпигастральной области, тошноту, рвоту, потерю веса и боль в животе после приема пищи или при физической нагрузке. Клинические признаки могут включать боли в животе (усиливающиеся при выдохе), болезненность в эпигастральной области и выраженную потерю массы тела. Для сравнения: в исследовании Р. Walker и соавт., включающем 43 участника, оперированных по поводу СКЧС, клинические признаки до лечения включали болевой синдром у 91 % пациентов (боль после приема пищи у 62 %, после физической нагрузки у 32 % и неспровоцированная у 33 %). Кроме того, у 40 % пациентов наблюдалась потеря веса, у 30 % — тошнота [7].
Новой темой для обсуждения в литературе является наличие сопутствующих психиатрических заболеваний у части пациентов с СКЧС. В проспективном исследовании С. Skelly и соавт. у 16 из 51 пациента, перенесшего хирургическое вмешательство по поводу СКЧС, у 28 % пациентов до операции наблюдались симптомы, соответствующие психическому расстройству в соответствии с критериями Диагностического и статистического руководства по психическим расстройствам (Diagnostic and Statistical Manual of Mental Disorders, 4-ое издание) [8]. Пациенты с сопутствующим психиатрическим диагнозом имели значительно более низкий показатель качества жизни до операции по сравнению с пациентами с неотягощенным психическим статусом. Общая разница в показателях качества жизни была снижена после операции с 12,9 (Р = 0,007) до 11,3 балла (Р = 0,01), что свидетельствует об улучшении общего качества жизни у пациентов с ранее существовавшим психическим расстройством.
Согласно данным Европейского общества сосудистых хирургов (European Society of Vascular Surgery, ESVS), в качестве основных методов диагностики хронической мезентериальной ишемии рекомендуется ультразвуковая допплерография (УЗДГ) [9]. Метод УЗДГ выгоден в качестве первичного исследования, поскольку он дешев и неинвазивен. В ретроспективном когортном исследовании Gruber и соавт., включающем 364 пациента, перенесших УЗДГ чревного ствола, из 6 пациентов с диагнозом СКЧС (основанным на хронических абдоминальных симптомах и ангиографических признаках стеноза чревной артерии с внешней компрессией) у 100 % углы отклонения чревного ствола составляли > 50° по сравнению с 40 % в бессимптомной контрольной группе (8/20 пациентов). Анализ продемонстрировал значительные различия в пиковых систолических скоростях во время выдоха (peak systolic flow velocities, PSV) у пациентов с СКЧС (среднее значение PSV = 425 ± 130,1 см/с) и у бессимптомной контрольной группы (среднее значение PSV = 209,9 ± 80,1 см/с; р = 0,001). Авторы пришли к выводу, что сочетание угла откло- нения > 50° и скорости выдоха > 350 см/с обеспечивает 83 %-ную чувствительность, 100 %-ную специфичность и 100 %-ную положительную прогностическую ценность для постановки диагноза СКЧС.
КТ-ангиография (КТ-АГ) — это дополнительный инструмент визуализации для диагностики артериальной окклюзии, позволяющий быстро получить трехмерные изображения брыжеечных артерий, оценить положение СДС, провести дифференциальный диагноз. В руководстве ESVS указано, что пациентам с подозрением на хроническую брыжеечную ишемию рекомендуется выполнение КТ-АГ для визуализации окклюзионного поражения и исключения других заболеваний [9]. КТ-признаки при СКЧС включают очаговое сужение проксимальной чревной артерии с характерным крючковатым видом [10; 11]. Это «зацепление» помогает отличить стеноз СКЧС от атеросклеротического сужения. КТ-АГ имеет преимущество по сравнению с ультразвуковыми методами при оценке постстенотической дилатации и наличия аневризм висцеральных артерий. Напротив, изменения калибра сосуда и скорости кровотока при дыхании легче оценить при УЗДГ. Магнитно-резонансная ангиография и цифровая субтракционная ангиография обеспечивают оптимальную оценку стеноза, сопоставимую с данными КТ-АГ.
Европейские гайдлайны по хронической мезентериальной ишемии предусматривают возможность хирургической декомпрессии чревного ствола при СКЧС, однако консенсус относительно тактики лечения не достигнут, в связи с чем отсутствуют четкие рекомендации [6]. В ряде публикаций сообщается, что блокада целиакического сплетения может быть альтернативным методом лечения СКЧС, однако данный метод не описан как вариант лечения ни в одном из крупных европейских руководств [6; 9].
Сравнение эндоваскулярного и лапароскопического (декомпрессия и симпатэктомия) методов демонстрирует преимущество последнего в связи с меньшим числом рецидивов и лучшими долгосрочными результатами [12]. В систематическом обзоре Е. San и соавт., посвященном лапароскопическому подходу к лечению пациентов с синдромом Данбара, на основании анализа 504 случаев были описаны преимущества такого подхода, в частности уменьшение длительности операции (136,0 мин, диапазон — 70—242), уменьшение послеоперационного койко-дня (3,8 дня, диапазон 0,5—7) и низкий процент конверсии в открытый доступ (4,2 %) [13]. C. DeCarlo и соавт. в мультицентровом когортном исследовании продемонстрировали значимость предоперационной блокады чревного ствола и описали преимущества лапароскопического подхода [14]. По результатам исследования, включающего 516 участников, открытая, лапароскопическая и робот-ассистированная декомпрессия СКЧС были выполнены у 227 (44,0 %), 235 (45,5 %), и 54 (10,5 %) пациентов соответственно. Периоперационные осложнения по Clavien — Dindo ≥ 3 имели место после открытого (30,0 %), лапароскопического (8,9 %) и роботизированного (18,5 %) вмешательств. Медиана наблюдения составила 1,59 года. Из 488 пациентов 287 (58,8 %) демонстрировали полное выздоровление, 119 (24,4 %) — частичное, у 82 (16,8 %) эффекта не было. В сравнительном обзоре J. Jiminez и соавт. сообщается о результатах хирургических вмешательств при СКЧС [15]. Включены 20 исследований, в которых были представлены данные о лечении 400 пациентов, перенесших хирургическое вмешательство по поводу СКЧС; у 279 была открытая декомпрессия ЧС, у 121 — лапароскопическая. В результате большинство пациентов сообщили о полном купировании симптомов (открытая группа — 78 %; лапароскопическая группа — 96 %). Частота поздних рецидивов составила 6,8 % у пациентов после открытого вмешательства и 5,7 % у пациентов после лапароскопического лечения; частота конверсии доступа — 9,1 % (по причине кровотечения).
Результаты исследования A. Chen и соавт. не демонстрировали существенных различий между лапароскопическим, робот-ассистированным и открытым доступами [16].
Авторы пришли к выводу, что ключевым критерием успеха лечения является возраст пациента. В серии наблюдений из 46 пациентов с диагнозом СКЧС 89 % предъявляли полное купирование симптомов либо значительное улучшение в сроки до 20 месяцев [17].
Робот-ассистированная декомпрессия чревного ствола и целиакическая ганглионэкто-мия представляют собой новое направление в лечении пациентов с СКЧС. М. Do и соавт. отмечали, что лапароскопическая декомпрессия значительно сокращает длительность операции, однако пришли к выводу, что оба варианта вмешательства являются безопасными и эффективными на основании исследования с выборкой из 16 пациентов [18]. Сравнение робот-ассистированного (RMARL) и лапароскопического (LMARL) подходов в исследовании Т. Shin и соавт. продемонстрировало преимущества первого в связи с уменьшением частоты рецидивов, однако отмечались недостатки в виде более длительной продолжительности вмешательства. Среднее время операции при LMALR и RMALR составило 86 и 134 мин соответственно (р < 0,0001). По параметру купирования послеоперационных симптомов между группами не было статистически значимой разницы, однако пациенты после RMALR со 面 щали о значительном 面 легчении пост 叩 андиальной боли в животе (р < 0,0001) и хронической тошноты (р = 0,0002) [19].
Заключение
Синдром Данбара является редким заболеванием, 面 условленным компрессией чревного ствола срединной дугообразной связкой диафрагмы, что в ряде случаев является 叩 ичиной развития хронической абдоминальной ишемии. По данным авторов, в клинической картине у большинства пациентов доминируют жалобы на тошноту, рвоту, потерю веса и болевой синдром после приема пищи или физической нагрузки, что совпадает с данными мировой и отечественной литературы.
В диагностике заболевания наибольшую клиническую значимость имеют методы рентгенологической визуализации, в частности компьютерная ангиография, позволяющая оценить характер окклюзионного поражения и исключить другие заболевания данной области, а также метод УЗДГ чревного ствола, дающий возможность определить угол отклонения чревного ствола и пиковые систолические скорости во время выдоха (PSV).
Показанием к оперативному лечению СКЧС является наличие верифицированного стеноза чревного ствола и наличие симптоматики хронической абдоминальной ишемии. По результатам исследования можно сделать вывод, что безопасным и эффективным способом лечения является лапароскопическая декомпрессия чревного ствола с диссекцией чревного сплетения.
Список литературы Результаты лечения пациентов с синдромом компрессии чревного ствола
- Иванов Ю. В., Чупин А. В., Орехов П. Ю., Терехин А. А., Шабловский О. Р. Современные подходы к хирургическому лечению экстравазальной компрессии чревного ствола (синдром Данбара). Клиническая и экспериментальная хирургия. 2017;4(18):18—29. [Ivanov YuV, Chupin AV, Orekhov PYu, Terekhin AA, Shablovskij OR. Sovremennye podhody k hirurgicheskomu lecheniyu ekstravazal’noj kompressii chrevnogo stvola (sindrom Danbara). Klinicheskaya i eksperimental’naya hirurgiya. 2017;4(18):18—29 (in Russ.). https://doi.org/10.24411/2308-1198-2017-00003]
- Lipshutz B. A composite study of the coeliac axis artery. Ann Surg. 1917 Feb;65(2):159—169. https://doi.org/10.1097/00000658-191702000-00006
- Harjola PT. A Rare obstruction of the coeliac artery. Report of a case. Ann Chir Gynaecol Fenn. 1963;52:547—550.
- Dunbar JD, Molnar W, Beman FF, Marable SA. Compression of the celiac trunk and abdominal angina. Am J Roentgenol Radium Ther Nucl Med. 1965 Nov;95(3):731—744. https://doi.org/10.2214/ajr.95.3.731
- Стяжкина С. Н., Антропова З. А., Шарафутдинов М. Р., Зайцев Д. В., Усачев А. В., Шистерова Е. В. Cиндром данбара. Таврический медико-биологический вестник. 2022;25(2):165—169. [Styazhkina SN, Antropova ZA, Sharafutdinov MR, Zajcev DV, Usachev AV, Shisterova EV. Cindrom danbara. Tavricheskij mediko-biologicheskij vestnik. 2022;25(2):165—169 (in Russ.).]
- Terlouw LG, Moelker A, Abrahamsen J, Acosta S, Bakker OJ, Baumgartner I, Boyer L, Corcos O, van Dijk LJ, Duran M, Geelkerken RH, Illuminati G, Jackson RW, Kärkkäinen JM, Kolkman JJ, Lönn L, Mazzei MA, Nuzzo A, Pecoraro F, Raupach J, Verhagen HJ, Zech CJ, van Noord D, Bruno MJ. European guidelines on chronic mesenteric ischaemia — joint United European Gastroenterology, European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Gastrointestinal and Abdominal Radiology, Netherlands Association of Hepatogastroenterologists, Hellenic Society of Gastroenterology, Cardiovascular and Interventional Radiological Society of Europe, and Dutch Mesenteric Ischemia Study group clinical guidelines on the diagnosis and treatment of patients with chronic mesenteric ischaemia. United European Gastroenterol J. 2020 May;8(4):371—395. https://doi.org/10.1177/2050640620916681
- Ho KKF, Walker P, Smithers BM, Foster W, Nathanson L, O’Rourke N, Shaw I, McGahan T. Outcome predictors in median arcuate ligament syndrome. J Vasc Surg. 2017 Jun;65(6):1745—1752. https://doi.org/10.1016/j.jvs.2016.11.040
- Skelly CL, Stiles-Shields C, Mak GZ, Speaker CR, Lorenz J, Anitescu M, Dickerson DM, Boyd H, O’Brien S, Drossos T. The impact of psychiatric comorbidities on patient-reported surgical outcomes in adults treated for the median arcuate ligament syndrome. J Vasc Surg. 2018 Nov;68(5):1414—1421. https://doi.org/10.1016/j.jvs.2017.12.078
- Björck M, Koelemay M, Acosta S, Bastos Goncalves F, Kölbel T, Kolkman JJ, Lees T, Lefevre JH, Menyhei G, Oderich G, Esvs Guidelines Committee, Kolh P, de Borst GJ, Chakfe N, Debus S, Hinchliffe R, Kakkos S, Koncar I, Sanddal Lindholt J, Vega de Ceniga M, Vermassen F, Verzini F, Document Reviewers, Geelkerken B, Gloviczki P, Huber T, Naylor R. Editor’s Choice — Management of the Diseases of Mesenteric Arteries and Veins: Clinical Practice Guidelines of the European Society of Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg. 2017 Apr;53(4):460—510. https://doi.org/10.1016/j.ejvs.2017.01.010
- Horton KM, Talamini MA, Fishman EK. Median arcuate ligament syndrome: Evaluation with CT angiography. Radiographics. 2005 Sep;25(5):1177—1182. https://doi.org/10.1148/rg.255055001
- Животова Е. Ю., Косенко П. М., Гунбина А. В., Горобец К. А. Cиндром данбара: вариантная анатомия чревного ствола и клинический случай. Актуальные вопросы современной медицины. 2022;63—65. [Zhivotova EYu, Kosenko PM, Gunbina AV, Gorobec KA. Cindrom danbara: variantnaya anatomiya chrevnogo stvola i klinicheskij sluchaj. Aktual’nye voprosy sovremennoj mediciny. 2022;63—65 (in Russ.).]
- Sultan SA, Acharya Y, Mustafa M, Hynes N. Two Decades of Experience With Chronic Mesenteric Ischaemia and Median Arcuate Ligament Syndrome in a Tertiary Referral Centre: A Parallel Longitudinal Comparative Study. Cureus. 2021 Dec 27;13(12):e20726. https://doi.org/10.7759/cureus.20726
- San Norberto EM, Romero A, Fidalgo-Domingos LA, García-Saiz I, Taylor J, Vaquero C. Laparoscopic treatment of median arcuate ligament syndrome: a systematic review. Int Angiol. 2019 Dec;38(6):474—483. https://doi.org/10.23736/s0392-9590.19.04161-0
- 1DeCarlo C, Woo K, van Petersen AS, Geelkerken RH, Chen AJ, Yeh SL, Kim GY, Henke PK, Tracci MC, Schneck MB, Grotemeyer D, Meyer B, DeMartino RR, Wilkins PB, Iranmanesh S, Rastogi V, Aulivola B, Korepta LM, Shutze WP, Jett KG, Sorber R, Abularrage CJ, Long GW, Bove PG, Davies MG, Miserlis D, Shih M, Yi J, Gupta R, Loa J, Robinson DA, Gombert A, Doukas P, de Caridi G, Benedetto F, Wittgen CM, Smeds MR, Sumpio BE, Harris S, Szeberin Z, Pomozi E, Stilo F, Montelione N, Mouawad NJ, Lawrence P, Dua A. Factors associated with successful median arcuate ligament release in an international, multi-institutional cohort. J Vasc Surg. 2023 Feb;77(2):567—577.e2. https://doi.org/10.1016/j.jvs.2022.10.022
- Jimenez JC, Harlander-Locke M, Dutson EP. Open and laparoscopic treatment of median arcuate ligament syndrome. J Vasc Surg. 2012;56(3):869—873. https://doi.org/10.1016/j.jvs.2012.04.057
- Chen AJ, Yeh S, Dhindsa Y, Lawrence PF, Woo K. Outcomes of Median Arcuate Ligament Release: A Single Institution Retrospective Review. Ann Vasc Surg. 2023;94:296—300. https://doi.org/10.1016/j.avsg.2023.02.030
- van Petersen AS, Vriens BH, Huisman AB, Kolkman JJ, Geelkerken RH. Retroperitoneal endoscopic release in the management of celiac artery compression syndrome. J Vasc Surg. 2009 Jul;50(1):140—147. https://doi.org/10.1016/j.jvs.2008.12.077
- Do MV, Smith TA, Bazan HA, Sternbergh WC 3rd, Abbas AE, Richardson WS. Laparoscopic versus robot-assisted surgery for median arcuate ligament syndrome. Surg Endosc. 2013 Nov;27(11):4060—4066. https://doi.org/10.1007/s00464-013-3061-x
- Shin TH, Rosinski B, Strong A, Fayazzadeh H, Fathalizadeh A, Rodriguez J, El-Hayek K. Robotic versus laparoscopic median arcuate ligament (MAL) release: a retrospective comparative study. Surg Endosc. 2022 Jul;36(7):5416—5423. https://doi.org/10.1007/s00464-021-08877-1


