Результаты оценки устойчивости к антракнозу сортов земляники садовой на основе фенотипирования и ДНК-анализа
Автор: Камедько Т.Н., Пугачёв Р.М., Скорина В.В.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 6 (86), 2025 года.
Бесплатный доступ
Актуальность. Антракноз является вредоносным грибным заболеванием земляники садовой. Во многих странах этот возбудитель включен в список карантинных объектов. Для создания новых устойчивых к антракнозу сортов необходимо вместе с традиционными методами оценки и отбора устойчивых форм на инфекционном фоне, использовать и маркер-ассоциированную селекцию. Материал и методика. Объект исследований – 197 сортов земляники садовой различного происхождения. Предмет исследований – устойчивость сортов к антракнозу. Оценку проводили в полевых условиях на естественном инфекционном фоне. В работе использовались молекулярно-генетические методы выделения ДНК, ПЦР-анализ, оценка продуктов амплификации в агарозном геле. Экспериментальные данные обрабатывали методом кластерного анализа. Результаты. При оценке на естественном инфекционном фоне все сорта были разделены на 5 кластеров. Из них второй кластер с баллом поражения меньше 1 объединил в себя 82 относительно устойчивых сортов, которые можно рекомендовать в качестве источников ценных признаков в селекции на устойчивость к антракнозу. Первый и пятый кластер объединили в себя неустойчивые сорта с баллом поражения 3 и выше, куда вошло 20 и 21 сорт соответственно. Третий и четвертый кластеры объединили в себя среднеустойчивые сорта с баллом поражения выше 1 и меньше 3, куда вошло 43 и 31 сорта соответственно. На основе генетического анализа ПЦР-продукты обоих маркеров (STS Rca2_240 и STS-Rca2_417) были идентифицированы у 15,2 % изученных сортов земляники садовой, среди них сорта Татиус и Тарро, созданные в УО БГСХА на кафедре плодоовощеводства. 11,7 % сортов имели маркер STS Rca2_240. Наибольшее количество сортов (53,8 %) характеризовались наличием маркера STS-Rca2_417. У остальных сортов данные маркеры не выявлены. Учитывая полученные результаты, нельзя утверждать, что наличие в геноме образца земляники обоих изученных маркеров обеспечивает устойчивость к антракнозу.
Fragaria × ananássa, Colletotrichum acutatum, ДНК-маркеры, устойчивость к болезням, гены, сорт, кластерный анализ
Короткий адрес: https://sciup.org/140313414
IDR: 140313414 | УДК: 634.75:631.524.86:001.8 | DOI: 10.18619/2072-9146-2025-6-154-158
Текст научной статьи Результаты оценки устойчивости к антракнозу сортов земляники садовой на основе фенотипирования и ДНК-анализа
Оригинальная статья / Original article
В о многих странах Европы, Азии, Африки, Америки антракноз является широко распространенным грибным заболеванием земляники садовой. В странах Европейского союза, в Израиле и Чили этот возбудитель включен в карантинный список, также Colletotrichum acutatum J.H. Simmonds – карантинный организм, ограниченно распространенный на территории Евразийского экономического союза [1].
Грибной патоген C. acutatum обладает высокой вредоносностью. Антракнозом поражаются все органы растений земляники. Гифы гриба распространяются внутриклеточно, уничтожая при этом клетки или участки тканей растений. При сильном поражении листья некротизируются и опадают, на черешках и побегах отмечается формирование мелких, глубоких язвочек, которые при слиянии формируют вмятины, плоды покрываются пятнами и мумифицируются. Также болезнь опасна тем, что после проникновения в растение патоген может прекратить свое развитие до определенного периода и симптомы заражения могут не проявляться в течение нескольких лет [2].
Экономические потери урожая земляники садовой от антракноза могут составлять от 30 до 80%, а выпады растений в маточных насаждениях – более 33% [2, 3].
О развитии антракноза на землянике садовой в научных работах белорусских исследователей ранее не упоминалось. Однако в ходе научно-исследовательских работ по темам «Видоспецифический состав и патогенность эпифитотийно опасных возбудителей болезней земляники садовой ( Fragaria × ananassa Duch.) на территории Беларуси» (проект БРФФИ № Б14-120) и «Разработать эффективный метод отбора устойчивых к болезням генотипов земляники садовой на ранних этапах развития растений» (проект БРФФИ № Б16М-124) из пораженных органов земляники (листья, ягоды) был выделен и введен в культуру гриб Colletotrichum acutatum J.H. Simmonds, вызывающий антракноз [4, 5]. Также О.В. Скрипка, заведующий лабораторией микологии ФГБУ «ВНИИКР» утверждает, что из Беларуси в Воронежскую область РФ с посадочным материалом был завезен патоген, вызывающий антракноз земляники садовой [3].
Для успешного решения селекционных задач путем создания новых устойчивых к антракнозу сортов и гибридов, особое значение приобретает не только использование традиционных методов оценки и отбора на естественном инфекционном фоне, но и современные, пока мало применяемые на ягодных культурах в Республике Беларусь, селекционные методы, такие как МАС (маркер-ассоциированная селекция). Использование диагностических ДНК-маркеров для выявления генотипов, несущих локусы, ассоциированные с устойчивостью земляники садовой к антракнозу, повысит надёжность идентификации и ускорит селекционный процесс.
Устойчивость к антракнозу у земляники контролируется доминантным геном Rca2. Методом сегрегационного bulk-анализа (BSA-Bulked segregant analysis) картировали ген Rca2 и идентифицировали сцепленные с ним AFLP-маркеры mf1, mf2, mf3 и mf4. Два из них были конвертированы в ПЦР-маркеры STS-Rca2_240 и STS-Rca2_417. Ген Rca2 был картирован на расстоянии 2,8 cM от маркера STS-Rca2_240 и 0,6 сМ от маркера STS-Rca2_417 [6].
В связи с этим целью наших исследований являлась оценка устойчивых к антракнозу сортов земляники садовой на основе гено- и фенотипирования, сопоставление результатов и на их основе выделить источники устойчивости к антракнозу для дальнейшей селекции.
Задачи исследований:
-
– оценить коллекцию сортов земляники садовой различного происхождения по устойчивости к антракнозу на инфекционном фоне;
-
– на основе ДНК-анализа выявить генотипы несущие локусы ДНК, ассоциированные с устойчивостью к антракнозу;
-
– сопоставить результаты гено- и фенотипирования и рекомендовать устойчивые генотипы в качестве источников ценных признаков в селекции.
Материал и методика проведения исследований
Полевые опыты проводили в учебно-опытном саду кафедры плодоовощеводства учреждение образования «Белорусская государственная орденов Октябрьской Революции и Трудового Красного Знамени сельскохозяйственная академия» (Белорусская государственная сельскохозяйственная академия). Коллекционные насаждения земляники садовой включают более 200 сортов различного происхождения. Растения выращивали на гребнях, мульчированных черной плёнкой, с расположением растений двумя строчками 30×30 см и междурядьем 1,4 м.
Во время проведения исследований (2024 год) погодные условия были близкими к оптимальным для развития антракноза [7], что позволило объективно оценить устойчивость сортов.
Среднемесячные температуры вегетационного периода 2024 года значительно отличались от средних многолетних. В целом отмечены превышения среднемесячных температур от 2,6–3,0 ° в июне, августе, июле и апреле, до 6,2, 6,3 и 6,8°С в марте, сентябре и феврале. Колебания температур по декадам характеризовались той же тенденцией.
Для режима осадков вегетационного периода 2024 года были характерны существенные колебания по сравнению со средней многолетней. В целом, относительный дефицит влаги ощущался в августе, что повлияло на спад в развитии болезни, и значительный в сентябре (осадков выпало только 10% от среднего многолетнего значения), а также во второй половине апреля.
В июне, во время максимального развития антракноза на землянике, среднесуточная температура воздуха составила 20 °С, а максимальная температура была на уровне 31,8°C. Относительная влажность воздуха была на уровне 70–80%.
Опытный участок представлен дерново-подзолистой суглинистой почвой. Содержание фосфора (Р2О5) и калия (К2О) в почве составляло – 316,95 мг/кг и 184,15 мг/кг соответственно, содержание гумуса 2,5%, рНKCl – 6,1.
Уход за опытными насаждениями осуществляется по общепринятой агротехнике без применения средств защиты от болезней [8].
Сведения о динамике развития антракноза на землянике в Республике Беларусь отсутствуют. Поэтому был проведён ряд учетов, чтобы выявить время начала проявления болезни и время максимального развития антракноза земляники садовой за вегетационный период. Учеты проводили в период с мая по сентябрь 2024 года.
Оценку сортов на устойчивость к антракнозу проводили визуально по всей опытной делянке, опираясь на бальную шкалу для грибных болезней, вызывающих увядание растений [9]: 0 – признаки болезни отсутствуют, растения развиваются нормально;
-
1 – очень слабое поражение: в росте отдельных растений наблюдается отставание или легкое подвядание;
-
2 – слабое поражение: поражено слабо до 10 % растений. В росте заболевших растений заметно отставание или подвяда-ние;
-
3 – среднее поражение: поражено в значительной степени до 25 % растений; отмечается явное отставание в росте и подсыхание листьев на периферии кустов или явное увядание с резкой потерей тургора без отставания в росте;
-
4 – сильное поражение: поражено в сильной степени до 50 % растений; растения с сильным поражением на грани отмирания, побурели, в центре кустов в области сердечка сохранились молодые листочки; остальные растения ослаблены в росте или имеют подвядание;
-
5 – очень сильное поражение: поражено в сильной степени свыше 50 % растений; растения на грани гибели.
Устойчивыми считались растения без признаков болезни (0 баллов), относительно устойчивыми (до 1 балла) – с признаками болезни, но энергично растущие, среднеустойчивыми (1–3 балла) – растения с явным отставанием в росте и неустойчивыми (более 3 баллов) – растения, рост которых сильно подавлен.
Молекулярно-генетический анализ проводили в научноисследовательской генетической лаборатории УО БГСХА.
Выделение ДНК из растений осуществляли с использованием набора компании Thermo Scientific (Genomic DNA Purification Kit #K0512) с модификациями протокола, рекомендованного производителем. Для получения препаратов ДНК использовали 100–200 мг растительной ткани (молодые листья), гомогенизировали их в микропробирках (тип Эппендорф) на лабораторном гомогенизаторе MILLMIX 20. Концентрацию и чистоту выделенной ДНК проверяли на спектрофотометре DeNovix DS-11 FX.
Использованные для анализа праймеры были синтезированы ОДО «Праймтех» (Беларусь) (табл.1) .
Таблица 1. Праймеры и их нуклеотидные последовательности [6]
Table 1. Names, sequences and the sizes of DNA fragments for used primers [6]
|
Праймер |
Нуклеотидная последовательность |
Размер ампликонов, п.н. |
|
STS-Rca2_240 EMFv020 (контроль) |
F 5′GCC ACG TCA CTA GTC AAA TTC AA3′, R 5′TCA TGG ACA GTG GTC TCA GC3′; F 5′ CAG GCG CCA ACG GCG TGC TCT TGT3′ R 5′CAG CGC CGC CAG CTC ATC CCT AGG3′ |
240 154 |
|
STS-Rca2_417 |
F 5′ACC ATG CAG AAC GTT CAG ATA T3′, R 5′TCC CAG CTG AAG ATC AAT GTA GT3′ |
417 |
Реакционная смесь для ПЦР объемом 20 мкл содержала: 3 мкл ДНК (20 нг/мкл), 0,2 мМ dNTPs, 0,2 мМ каждого праймера, 0,8 U Taq-полимеразы и 1 мМ Taq-буфера (+(NH 4 ) 2 SO 4 , KCl+MgCl 2 ,).
Амплификацию проводили в термоциклере C1000 производства фирмы Touch по следующим программам: маркер STS-Rca2_240: денатурация: 95°С – 3 мин, 35 циклов: 95°С – 50 с 64°С – 50 с; 72°С – 1 мин; 1 цикл – 72°С – 5 мин; маркер STS-Rca2_417: денатурация: 95°С – 3 мин, 35 циклов: 95°С – 50 с 62°С – 50 с; 72°С – 1 мин; 1 цикл – 72°С – 5 мин. Разделение ампликонов осуществляли методом электрофореза в 1,5% агарозном геле. Для определения длины амплифицированных фрагментов использовали ДНК маркер молекулярного веса, m100bp (Евроген). Гели документировали с помощью фотографирования после окрашивания этидиум бромидом.
В результате амплификации у образцов выявляли фрагменты длиной 154 (контроль ПЦР) и 240 п.н. Сцепленный с геном Rca2 фрагмент имеет длину 240 п.н. Также фрагменты длиной от 417 до 421 п.н. и дополнительно фрагмент 397 п.н. Сцепленный с геном Rca2 фрагмент имеет длину 417 п.н.
Кластерный анализ по степени поражения растений земляники антракнозом (в баллах) проводился в программе STATISTICA 12. В качестве правила объединения был выбран метод полной связи, который определяет расстояние между кластерами как наибольшее расстояние между любыми двумя объектами в различных кластерах. В качестве меры близости – Евклидово расстояние, геометрическое расстояние в n-мерном пространстве. На основе полученных данных выделили 5 кластеров. Далее проводилась кластеризация методом k-средних.
Результаты исследований и их обсуждение
Первые признаки развития антракноза начали появляться в конце мая на черешках в виде мелких глубоких язвочек темного цвета и крупных пятен с хорошо заметным красно-фиолетовым оттенком на листьях. Максимальное развитие антракноза было отмечено в конце июня в середине плодоношения, когда на многих сортах уже начали появляться усы. Характерные сухие вдавленные пятна были на всех частях растения (черешки, цветоносы, листья, усы, плоды). В этот промежуток времени имели место близкие к оптимальным условия для жизнедеятельности гриба: среднесуточная температура 20°С и относительная влажность воздуха 70%. Снижение степени развития болезни у 53 сортов наблюдался в августе, что объясняется высокой температурой воздуха в этот период и ограниченным количеством осадков, это обуславливало слабое заражение отрастающих листьев. У 62 сортов земляники садовой степень поражения растений значительно возросла, что вероятнее всего связано с морфологическими и генетическими особенностями сорта (габитус растения, слабая опушённость черешков и листьев, низкая плотность ягод и др.).
Кластеризация методом k-средних позволила установить сорта со сходными особенностями в отношении поражения антракнозом (рисунок).
Во второй кластер относительно устойчивых сортов, с баллом поражения меньше 1 вошло 82 сорта: Сюзи, Ремонтантная розовая, Талия, Олимпия, Готика, Гигантелла Максима, Троицкая, Богота, Элькат, Онега, Найдена добрая, Кармен, Натали, Дивная, Ударница, Холидей, Викода, Сенди, Купчиха улучшенная, Садовый рубин, Фронтерас, Торпеда, Рания, Камароза, Дестини, Бьянка Фрагола №5, Барокко, Вента, Лия, Текла, Кори, Лималексия, Кимберли, Татиус, Веснянка, Тарро, Соловушка, Фламинго, Фестивальная ромашка, Любава, Мишутка, Красный берег, Кама, Загадка, Сириус, Полли, Челси, Фраголория, Набила, Джоли, Марисоль, Пальмерита, Сударушка, Априка, Вима Тарда, Фенелла, Осирис, Кент, Лаура, Магнус, Мальвина, Витязь, Вима Занта, Эльсанта, Талка, Польвина, Аргентера, Флавия, Венди, Петалума, Элиани, Элли, Примелла, Фламиния, Сирия, Фейерверк, Гармония, Пегасус, Флоранс, Мадлен, Царскосельская, Моллинг столетие.
Первый и пятый кластер объединили в себя неустойчивые сорта с баллом поражения 3 и более, куда вошло 20 и 21 сорт соответственно:
-
– кластер 1: Дали, Хадемар, Брилла, Мурано, Румба, Эми, Славутич, ВР4, Хансалола, Вирена, Полка, Викториана, Ренессанс, Гора Эверест, Синсерли, Эви 2, Анаис, Фернандо, Осенняя радость;
-
– кластер 5: Вима Ксима, Красавица, Сапоро, Шарлотта, Фестивальная, Лакомка, Дели, Багряная, Корона, Сладкая Анна, Лорд, Росинка, Ирма, Сюрприз Олимпиаде, Зенга Зенгана, Флорида Фестиваль, Мармолада, Эльвира, Тея, Рубиновый кулон, Дачница.
Третий и четвертый кластеры включали среднеустойчивые сорта с баллом поражения более 1, но меньше 3, куда вошло 43 и 31 сорта:
-
– кластер 3: Наяд, Ева, Чендлер, Вега, Моллинг Аллюр, Онда, Слоненок, Тетис, Маригет, Жемчужница, Джоника, Королева Элиза, Аллегро, Студенческая, Купчиха, Сандра, Вырицкая, Кандис, Кокинская ранняя, Гаригуетта новая, Роксана, Сизоже, Принцесса Диана, Хику, Кембридж, Спасская, Московский деликатес, Сенсация, Кристина, Антеа, Хоней, Эверли, Маришка, Маэстро, Верити, Елизавета, Остара, Вивара, Клери, Соната, Женева, Тельма, Альба;
-
– кластер 4: Арабелла, Царица, Азия, Крапо 10, Скала, Сибилла, Эвита, Елизавета II, Гренада, Кокинская заря, Дукат, Классика, Боровицкая, Орли, Люция, Флорида, Гелеос, Фаворит, Юния Смайдс, Присвята, Тенира, Торос, Прими, Гаригуетта, Заря, Квики, Нанди, Фейт, Вима Рина, Красная Капелька, Джемил.
В ходе проведения ДНК-анализа с использованием генетических маркеров для идентификации устойчивости земляники садовой к C. acutatum , нами были использованы ПЦР-маркеры STS-Rca2_240 и STS-Rca2_417. На основе их наличия изучаемые сорта были разделены на четыре группы: имеющие оба маркера, имеющие только один из маркеров и не имеющие их (табл. 2).
ПЦР-продукты маркеров STSRca2_240 и STS-Rca2_417 с размером 240 п.н. и 417 п.н. были идентифицированы у 15,2
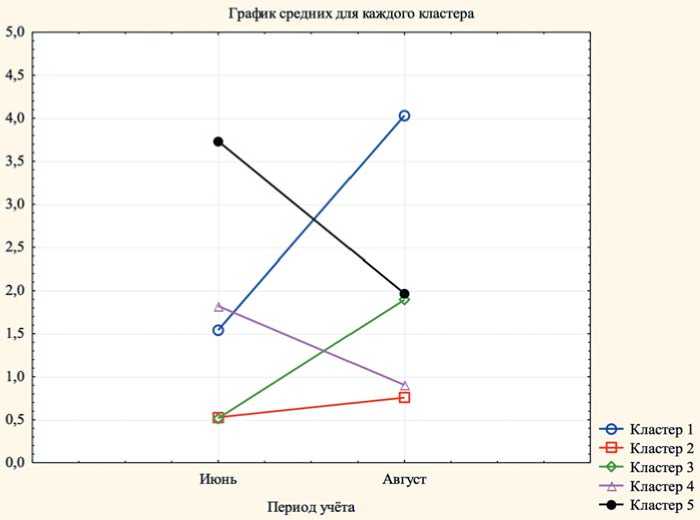
Рис. Результаты кластерного анализа устойчивости к антракнозу сортов земляники садовой на основе метода k-средних, 2024 г Fig. Results of cluster analysis of strawberry anthracnose resistance based on the k-means method, 2024
% сортов земляники садовой, среди них сорта Татиус и Тарро, созданные в УО БГСХА на кафедре плодоовощевод-ства. Маркер STSRca2_240 без маркера STSRca2_417 был отмечен у 11,7% сортов. Наибольшее количество сортов – 53,8%, характеризовались отсутствием в генотипах маркера STSRca2_240 и проявлением маркера STSRca2_417. Отсутствие обоих маркеров было отмечено у 19,3% сортов.
Использовали два способа оценки сортов земляники садовой на устойчивость к антракнозу: на естественном инфекционном фоне и с помощью ДНК-анализа. На основе сравнительного анализа полученных результатов были выделены две группы сортов – относительно устойчивые и восприимчивые (табл. 3). К относительно устойчивым сортам отнесли те, которые в полевых условиях имели поражение антракнозом не выше 1 балла и характеризовались наличием одного или обоих маркеров устойчивости к антракнозу. В эту группу вошли следующие 64 сорта: Сюзи –/+, Ремонтантная розовая +/+, Талия –/+, Олимпия –/+, Готика –/+, Гигантелла Максима –/+, Онега –/+, Найдена добрая +/–, Кармен –/+, Дивная +/–, Холидей +/+, Викода –/+, Купчиха улучшенная +/+, Садовый рубин +/+, Фронтерас –/+, Торпеда –/+, Рания +/+, Камароза +/–, Дестини –/+, Вента –/+, Лия –/+, Текла –/+, Кори –/+, Кимберли–/+, Татиус+/+, Веснянка+/–, Тарро +/+, Фестивальная ромашка –/+, Мишутка +/–, Красный берег +/–, Кама +/–, Загадка –/+, Сириус –/+, Набила +/+, Джоли –/+, Марисоль +/–, Сударушка +/–, Априка +/–, Вима Тарда –/+, Осирис –/+, Кент –/+, Лаура +/+, Магнус –/+, Мальвина +/+, Витязь –/+, Вима Занта –/+, Талка +/–, Польвина –/+, Аргентера –/+, Петалума +/+, Элиани +/–, Элли +/–, Фламиния +/–, Сирия +/+, Фейерверк –/+, Гармония –/+,
Таблица 2. Структура коллекции земляники садовой по наличию маркеров устойчивости к антракнозу Table 2. Structure of the strawberries collection by the presence of anthracnose resistance markers
|
Наличие (+), отсутствие (–) маркера |
Удельный вес, % |
Распределение сортов по кластерам |
|
Rca2_240+ Rca2_417+ |
15,2 |
|
|
Rca2_240+ Rca2_417– |
11,7 |
|
|
Rca2_240– Rca2_417+ |
53,8 |
|
|
Rca2_240– Rca2_417– |
19,3 |
|
Флоранс –/+, Мадлен –/+, Царскосельская +/+, Моллинг столетие –/+, Бьянка Фрагола №5 –/+, Фраголория –/+, Примела –/+. Среди них можно отметить сорта, имеющие в своем геноме оба маркера (STSRca2_240 и STS-Rca2_417): Ремонтантная розовая, Холидей, Купчиха улучшенная, Садовый рубин, Рания, Татиус, Тарро, Набила, Лаура, Мальвина, Петалума, Сирия, Царскосельская.
Восприимчивые – сорта, поражавшиеся патогеном более, чем на 1 балл и не имеющие в своем геноме маркеров STS-Rca2_240 и STS-Rca2_417: Вима Ксима –/–, Дачница –/–, Корона –/–, Румба –/–, Хадемар –/–, Хансалола –/–.
Заключение
В селекции на устойчивость к антракнозу земляники садовой, вызываемому патогенным грибом Colletotrichum acutatum J.H. Simmonds, целесообразно использовать сорта, которые на естественном инфекционном фоне имели балл поражения до 1 и имеющие в своем геноме маркеры, ассоциированные с геном устойчивости к антракнозу STS-Rca2_240 и STS-Rca2_417: Ремонтантная розовая, Холидей, Купчиха улучшенная, Садовый рубин, Рания, Татиус, Тарро, Набила, Лаура, Мальвина, Петалума, Сирия, Царскосельская.
Однако, учитывая результаты проведенных исследований, нельзя достоверно сделать заключение, что наличие в геноме образца земляники обоих изученных маркеров обеспечивает устойчивость к антракнозу.
В связи с этим, необходимо продолжать изучать особенности генетического контроля устойчивости земляники садовой к антракнозу и разрабатывать на этой основе новые генетические маркеры для использования в МАС. Важным также является совершенствование методов оценки устойчивости к антракнозу на ранних этапах развития гибридных сеянцев на инфекционных фонах.
-
• Литература
-
1. Baroncelli R., Talhinhas P., Pensec F., Sukno S.A., Gaetan le F., Thon M.R. The Colletotrichum acutatum species complex as a model system to study evolution and host specialization in plant pathogens. Frontiers in Microbiology. 2017;(8):2001.
-
-
2. Forcelini B. B., Gonçalves F. P., Peres N. A. Effect of inoculum concentration and interrupted wetness duration on the development of anthracnose fruit rot of strawberry. Plant disease. 2017;2(101):372–377.
-
3. Скрипка О.В., Дудченко И.П., Никифоров С.В., Копина М.Б. Антракноз Colletotrichum acutatum Simmonds – опасное заболевание земляники. Карантин растений. Наука и практика. 2014;4(10):24–35. https://elibrary.ru/vkbszj
-
4. Пугачёв Р.М., Пугачева И.Г. Купцов В.Н., Камедько Т.Н. Морфологические особенности фитопатогенных грибов земляники садовой на различных питательных средах. Земледелие и защита растений. 2015;6(103):30–33.
-
5. Камедько Т.Н. Результаты оценки различных методов искусственного заражения семян земляники садовой антракнозом ( Colletotrichum acutatum J.H. Simmonds). Вестник Бел. гос. с.-х. акад. 2017;(3):81–84. https://elibrary.ru/zmmfeb
-
6. Lerceteau-Köhler E., Guerin G., D enoyes-Rothan B. Identification of SCAR markers linked to Rca2 anthracnose resistance gene and their assessment in strawberry germplasm. Theoretical and applied genetics. 2005;5(111);862–870.
-
7. Staňková B., Víchová J., Pokorný R. Virulence of Colletotrichum acutatum isolates to several host plants. Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis. 2011;3(20)161–169.
-
8. Организационно-технологические нормативы возделывания овощных, плодовых, ягодных культур и выращивания посадочного материала :сб.отраслевых регламентов /Нац. акад. наук Беларуси, Ин-т систем исслед. в АПК НАН Беларуси; рук. разраб.: В. Г. Гусаков [и др.). - Минск : Беларус. навука, 2010. 520 с.
-
9. Пугачёв Р.М., Пугачева И.Г. Камедько Т.Н., Купцов В.Н., Сандалова М.В. Методические рекомендации по проведению экспедиционного обследования насаждений земляники садовой. Горки: БГСХА; 2017.
Об авторах:
Татьяна Николаевна Камедько – кандидат с.-х. наук, доцент кафедры плодоовощеводства Белорусской государственной сельскохозяйственной академии, SPIN-код: 5009-8054, автор для переписки, Роман Михайлович Пугачёв – кандидат с.-х. наук, доцент кафедры плодоовощеводства Белорусской государственной сельскохозяйственной академии, SPIN-код: 8980-9461, , Владимир Владимирович Скорина – доктор с.-х. наук, профессор кафедры плодоовощеводства
Tatsiana N. Kamedzko – Cand. Sci. (Agriculturе),
Associate Professor, Belarusian State Agricultural Academy, SPIN-code: 5009-8054,
Correspondence Author, Roman M. Puhachov – Cand. Sci. (Agriculturе), Associate Professor of the Department of Horticulture, Belarusian State Agricultural Academy, SPIN- code: 8980-9461, ,
Vladimir V. Skorina – Dr. Sci. (Agriculture),
Professor of the Department of Horticulture, Belarusian State Agricultural Academy,
ISSN 2618-7132 (Online) Овощи России №6 2025
[ 158
Vegetable crops of Russia №6 2025 ISSN 2072-9146 (Print)


