Результаты пилотного исследования микропотенциалов сердца у больных инфарктом миокарда с развитием кардиогенного шока
Автор: Максимов И.В., Авдеева Д.К., Иванов М.Л., Зимин И.А., Южаков М.М., Турушев И.В., Кодермятов Р.Э., Балахонова М.В., Цой Е.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.33, 2018 года.
Бесплатный доступ
Цель: исследование микропотенциалов сердца, зарегистрированных аппаратно-программным комплексом на наносенсорах у больных инфарктом миокарда, для раннего выявления жизнеугрожающих состояний.Материал и методы. В пилотное исследование вошли 29 больных острым инфарктом миокарда, имевших осложнения, угрожающие жизни, в виде нарушения сердечного ритма, развития острой левожелудочковой недостаточности или наступления клинической смерти на догоспитальном этапе или при поступлении в палату интенсивной терапии. Диагноз инфаркта миокарда был установлен, лечение проводилось согласно принятым национальным рекомендациям ведения больных, включая выполнение методов реваскуляризации миокарда.Результаты. У 8 больных за период госпитализации развились кардиогенный шок и летальный исход. Выжил 21 больной, они составили группу сравнения. Всем больным при поступлении регистрировали электрокардиограмму (ЭКГ) высокого разрешения с использованием оригинальных аппаратно-программных комплексов (АПК) и наносенсоров. В режиме online в течение 30 с в трех отведениях регистрировали микропотенциалы на сегменте ST ЭКГ. Анализировали количество микропотенциалов (МП) в исследуемых группах. Анализ количества МП определенного диапазона амплитуды и длительности, зарегистрированных на высокоточных (ВТ) ЭКГ в исследованных группах, выявил снижение количества МП в группе больных, погибших от кардиогенного шока, в сравнении с группой выживших больных.Выводы. Результаты проведенного пилотного исследования микропотенциалов сердца являются предварительными и требуют дальнейшего накопления материала, а также поиска новых критериев диагностики, прогноза и оценки эффективности проводимого лечения больных инфарктом миокарда.
Инфаркт миокарда, кардиогенный шок, микропотенциалы сердца, высокоточная электрокардиография
Короткий адрес: https://sciup.org/149125243
IDR: 149125243 | DOI: 10.29001/2073-8552-2018-33-4-103-110
Текст научной статьи Результаты пилотного исследования микропотенциалов сердца у больных инфарктом миокарда с развитием кардиогенного шока
По оценкам Всемирной организации здравоохранения, заболевания сердца и сосудов являются основной причиной смерти в развитых странах. По имеющейся статистике, за 2015 г. в мире умерло 17 866 560 человек от заболеваний сердечно-сосудистой системы, из них смертность от ишемической болезни сердца (ИБС) составляет до 80% всех случаев смерти от сердечно-сосудистой патологии. Сердечно-сосудистые заболевания широко распространены среди всех возрастных групп взрослого населения с наибольшей частотой летальных исходов в старшей возрастной группе (старше 70 лет). У этих пациентов наибольший риск развития внезапной сердечной смерти (ВСС), развития инфаркта миокарда (ИМ), осложненного острой сердечной недостаточностью, с развитием кардиогенного шока вследствие развития тяжелого нарушения коронарного кровообращения, приводящего к жизнеугрожающим сердечным аритмиям и нарушению насосной функции сердца [1–3]. Существенную роль в предупреждении неблагоприятного развития течения заболевания в случае выживания до прибытия медицинской помощи играет временной фактор начала лечения и его эффективность, а также своевременная диагностика неблагоприятных событий, угрожающих жизни больного. Формирование неблагоприятного исхода может происходить как в результате острого осложнения ИМ, приводящего к остановке кровообращения, так и замедленного прогрессирования сердечной недостаточности с нарушением коронарного кровотока, функции почек и головного мозга. В клинической практике мониторирование параметров работы этих систем жизнеобеспечения, в первую очередь сердца, имеет большое значение для осуществления интенсивной терапии [3, 4]. Одним из наиболее перспективных методов выявления высокого риска остановки кровообращения оста- ется ЭКГ метод для оценки нарушений электрофизиологических параметров работы сердца. В настоящее время мониторирование ЭКГ в реальном масштабе времени позволяет выявить появление сердечной аритмии, эпизоды появления ишемии миокарда в бассейне пораженной коронарной артерии. Тем не менее выявление мелких очагов ишемии с нарушением электрофизиологических параметров возбуждения и проведение электрического импульса при регистрации стандартной ЭКГ остаются недоступны из-за низкой чувствительности регистрирующей аппаратуры [4, 5]. Совершенствование технологии регистрации и точности измерения электрической активности сердца при различной сердечно-сосудистой патологии является перспективным направлением развития ЭКГ технологии [6–8]. В клинической практике необходим инструмент для выявления патологических очагов электрической нестабильности не только по факту выявления эпизодов аритмии сердца, но и по выявлению прямых признаков такой нестабильности на уровне отдельных очагов миокардиального повреждения [9–11] в виде микропотенциалов (МП), определения их количества, частотного спектра, амплитуды и длительности, зарегистрированных в реальном масштабе времени [4, 7, 8, 12].
Разработка медицинской технологии раннего выявления очагов миокарда, генерирующих МП, и определение их диагностической ценности в качестве маркера жизнеугрожающих состояний сердца человека может иметь клиническое значение [11, 14–16]. Для решения этой задачи необходимо иметь возможность регистрации высокоточной (ВТ) ЭКГ в режиме online без фильтрации первичного сигнала. В лаборатории «Медицинская инженерия» Инженерной школы неразрушающего контроля и безопасности Томского политехнического университета профессором ТПУ Д. К. Авдеевой и сотрудниками был разработан аппаратно-программный комплекс на наносенсорах высокого разрешения, реализующий метод регистрации МП сердца в реальном времени без фильтрации и усреднения ЭКГ сигнала [6]. Наносенсоры оригинальной разработки обладают помехозащищенностью и высокой чувствительностью. Трехканальный аппаратно-программный комплекс (АПК) для регистрации МП сердца был успешно апробирован в отделении неотложной кардиологии НИИ кардиологии Томского НИМЦ (руководитель — д.м.н. В. В. Рябов) [6, 17]. Наличие высокочувствительного инструмента для регистрации низковольтных потенциалов сердца в реальном масштабе времени позволило приступить к разработке новой актуальной медицинской технологии определения состояния электрической активности миокарда при наиболее тяжелых заболеваниях, в частности, при остром ИМ.
Материал и методы
Дизайн исследования предполагал современную объективизацию факторов риска развития у больных острым ИМ жизнеугрожающих нарушений сердечного ритма, которые могут явиться непосредственной причиной развития ВСС.
Критерии включения:
-
1. Мужчины и женщины в возрасте 40 лет и старше, которым был поставлен диагноз острого ИМ.
-
2. Принадлежность к группе высокого риска развития ВСС; пациенты, у которых задокументировано нарушение сердечного ритма, угрожающее жизни (пароксизм желудочковой тахикардии, фибрилляция желудочков сердца, желудочковые аритмии) при поступлении в палату интенсивной терапии или на догоспитальном этапе.
-
3. Письменное согласие пациента на регистрацию ВТ ЭКГ, наблюдение в динамике с повторной регистрацией ЭКГ и определение жизненного статуса пациента.
Диагноз ИМ подтверждался согласно принятым критериям национальных рекомендаций. Все больные после установления диагноза получили рекомендованную терапию, включая методы чрескожной коронарной ангиопластики и стентирования стенозов артерий [1, 3].
Критерии исключения: невозможность наблюдения пациента в динамике с повторной регистрацией ЭКГ и определения жизненного статуса пациента.
Регистрировали и анализировали статус пациента по первичной конечной точке: смерть пациента вследствие сердечно-сосудистого неблагоприятного события.
Дополнительные сердечно-сосудистые конечные точки:
-
1. Зарегистрированные эпизоды нарушения сердечного ритма, угрожающие жизни больного.
-
2. Эпизоды потери сознания (синкопальные состояния).
В пилотное клиническое исследование вошли 29 пациентов с острым инфарктом миокарда.
Каждый доброволец (пациент) подписывал информированное согласие на проведение исследования (проведение клинического исследования было одобрено локальным этическим комитетом по биомедицинской этике при НИИ кардиологии, протокол № 147 от 28.06.2016). У всех пациентов течение ИМ было осложнено нарушением сердечного ритма, развитием острой сердечной недостаточности (2–4-го класса по классификации Killip), у 10 больных при поступлении проводилась успешная сердечно-легочная реанимация. В последующий период лечения пациенты были распределены в группы в соответствии с клиническим исходом ИМ: выжившие пациенты ( n =21) и пациенты (n =8), погибшие по причине развития истинного кардиогенного шока (табл. 1).
В клинике пациентам проводили необходимые для верификации диагноза ИМ и его осложнений методы исследования и лечение согласно Национальным рекомендациям экспертов по лечению острого коронарного синдрома и ИМ [1, 3]. Клиническая характеристика больных представлена в таблице 2.
Для выявления новых ранних ЭКГ признаков развития жизнеугрожающих состояний сердца человека регистрировали ЭКГ высокого разрешения электрокардиографическим АПК с использованием высокочувствительных наносенсоров. ВТ ЭКГ регистрировали в день поступления, на 2–3 сутки и на 10–12-й день от начала ИМ (перед выпиской из стационара).
Для регистрации МП сердца использовали оригинальный трехканальный электрокардиограф, представляющий АПК для регистрации ВТ ЭКГ. В устройстве применялись оригинальные наносенсоры, обладающие высокими метрологическими характеристиками, позволяющими создавать измерительные устройства, регистрирующие биоэлектрические сигналы на уровне 300 нВ и выше в полосе частот от 0 до 10 000 Гц. Разработанные оригинальные наносенсоры практически не поляризовались при токах, не превышающих 100 нА. Разработанный электрокардиограф способен регистрировать ЭКГ сигналы от ±0,3 мкВ до ±10 мВ в диапазоне частот от 0 до 10 000 Гц. Устройство снабжено комплексом
Таблица 1
Распределение пациентов по группам исследования
|
Группы пациентов |
Диагноз и клиническая характеристика пациентов |
Количество пациентов |
|
Группа 1 |
Острый ИМ с подъемом сегмента ST и нарушением сердечного ритма, угрожающим жизни больного или наступлением клинической смерти, зарегистрированными на догоспитальном этапе или при поступлении в палату интенсивной терапии и наблюдения. Пациенты умерли от кардиогенного шока |
8 |
|
Группа 2 |
Острый ИМ с подъемом сегмента ST и нарушением сердечного ритма, угрожающим жизни больного или наступлением клинической смерти, зарегистрированными на догоспитальном этапе или при поступлении в палату интенсивной терапии и наблюдения. Пациенты выжили и были выписаны из стационара |
21 |
Таблица 2
Клиническая характеристика пациентов
|
Показатели |
Группа 1 ( n =8) |
Группа 2 ( n =21) |
p< |
|
Возраст, годы (М± δ ) |
66,6±12,8 |
61,8±7,2 |
Незначимо |
|
Мужской пол (%) |
37,5 |
66,7 |
0,001 |
|
ИМ в анамнезе (%) |
42,8 |
38,9 |
Незначимо |
|
Сахарный диабет 2-го типа (%) |
42,8 |
22,2 |
0,02 |
|
Артериальная гипертония (%) |
100 |
94,4 |
Незначимо |
|
Хроническая болезнь почек (%) |
0 |
5,5 |
Незначимо |
|
Тромболизис на догоспитальном этапе (%) |
14,3 |
38,9 |
0,001 |
|
ЧКВ в анамнезе (%) |
57,1 |
66,7 |
0,001 |
|
Острая сердечная недостаточность (2–3-го класса по Killip), % |
100 |
16,7 |
0,001 |
Примечание: данные представлены в виде частоты признака (%), (М± δ ) средней величины «М» и ее стандартного отклонения ± δ ; n — количество единиц; ИБС — ишемическая болезнь сердца; ЧКВ — чрескожное коронарное вмешательство; ИМ — инфаркт миокарда.
программ, которые позволяют эффективно устранять сосредоточенные помехи и шум измерительного канала без искажения спектра полезного сигнала. Значение шума измерительного канала при регистрации ЭКГ было равно шуму измерительного канала при коротком замыкании, что позволило его устранить при регистрации ЭКГ. АПК успешно прошел технические испытания и предварительные медицинские испытания на добровольцах.
ЭКГ для регистрации МП снимали в покое в трех отведениях с грудной клетки по системе Холтера. Запись сигнала ЭКГ высокого разрешения производили на протяжении 30 с, результат суммировали. С помощью специальной программы из зарегистрированной ЭКГ удаляли сосредоточенные помехи при их наличии и собственный шум измерительного канала АПК. Электрокардиограф создавался в рамках проекта ФЦП «Разработка экспериментального образца аппаратно-программного комплекса для неинвазивной регистрации микропотенциалов сердца в широкой полосе частот без фильтрации и усреднения в реальном времени с целью раннего выявления признаков внезапной сердечной смерти» (Соглашение № 14.578.21.0032 от 05.06.2014, 2014–2016 гг.).
Для оценки параметров МП в пилотном исследовании были выбраны показатели, оценивающие суммарное количество МП на сегменте ST в диапазоне заданных амплитуд МП в мкВ (0,75–8,0 мкВ) за период времени в 30 с; суммарное количество МП в диапазоне заданной длительности МП в мс (0,3–3,0 мс) за период времени в 30 с. Также рассчитывали суммарный индекс мощности МП в виде произведения суммарных амплитуды и длительности МП (мкВ·мс). Указанные показатели МП сердца определяли и сравнивали в группах выживших больных и больных, погибших в результате развития истинного кардиогенного шока (рис. 1).
Статистическую обработку полученных данных проводили с использованием пакета статистических прикладных программ (SPSS Inc., версия 23.0). Результаты анализа по исследуемым группам представлены в виде среднего значения (М±SD) и медианой (Ме) с интер- квартильным размахом в виде 25 и 75-го процентилей. Предварительный анализ нормальности распределения количественных переменных определяли с помощью критерия Колмогорова — Смирнова. По результатам анализа распределение в группах не соответствовало нормальному, поэтому при сопоставлении количественных переменных несвязанных асимметричных выборок использовали ранговый критерий U (Манна — Уитни). При анализе частот наличия признаков в группах применялся непараметрический критерий χ2 с применением поправки Йейтса. Различия между группами считали статистически значимыми при р<0,05.
Результаты
Пациенты в группах различались по частоте развития острой сердечной недостаточности с формированием кардиогенного шока (табл. 2). Все пациенты группы 1 погибли от истинного кардиогенного шока за период госпитализации. Больные группы 2 имели положительную динамику клинического статуса и были выписаны на амбулаторное лечение. Сравнительный анализ групп 1 и 2 не выявил различий по возрастному составу: Ме 68,0 (64,0; 75,5) и 64,0 (56,0; 67,0) соответственно. Различий по частоте наличия гипертонической болезни, хронической болезни почек, перенесенного ИМ в анамнезе не было. В группе 1 чаще встречались пациенты женского пола — 62,5 против 33,3% в группе 2. В группе неблагоприятного исхода ИМ чаще были представлены больные сахарным диабетом 2-го типа (42,8 против 22,2%, р =0,02). Высокой была частота выполнения попыток реваскуляризации миокарда: выполнение системного тромболизиса на догоспитальном этапе в группе выживших составило 38,9%, ЧКВ — 66,7% против 14,3% и 57,1% в группе неблагоприятного исхода соответственно.
Анализ групп сравнения на нормальность распределения указал на несоответствие выборки нормальному распределению, поэтому для сравнения групп применяли непараметрический ранговый критерий Манна —
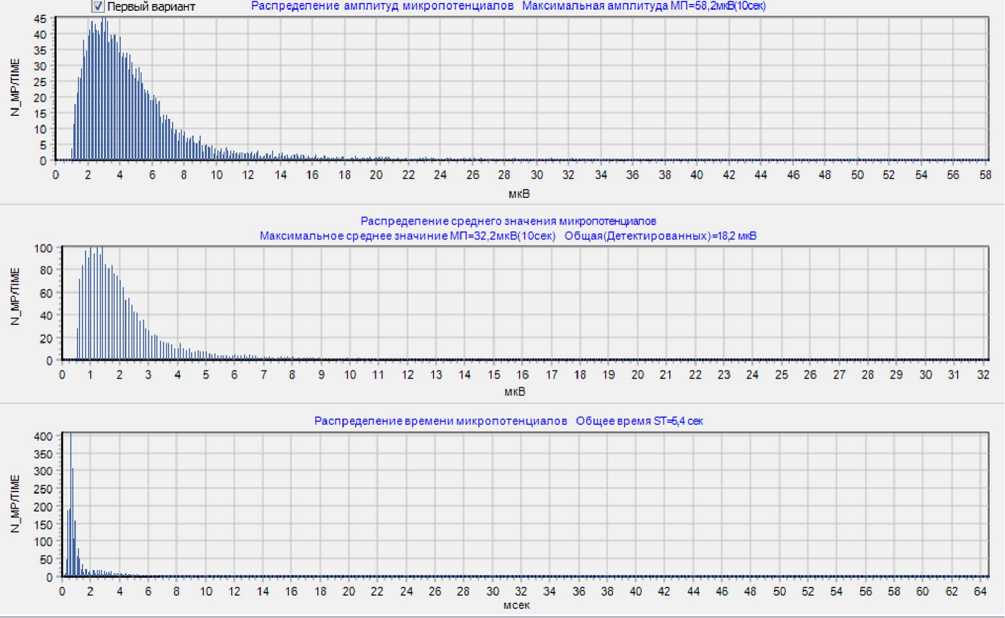
Рис. 1. Гистограмма распределения количества МП в зависимости от их амплитуды (мкВ) и длительности (мc) за временной интервал в 30 с
Таблица 3
Показатели микропотенциалов у выживших (группа 2) и погибших от кардиогенного шока (группа 1) больных ИМ
|
Показатели |
Группа 1 ( n =8) |
Группа 2 ( n =21) |
Вероятность p |
|
Суммарное количество МП в диапазоне выбранных амплитуд МП (n) |
60,5 (31,8; 78,5) |
73,0 (64,0; 110,0) |
<0,01 |
|
Суммарное количество МП в диапазоне выбранной длительности МП (n) |
87,0 (64,5; 127,0) |
132,5 (87,0; 162,8) |
<0,05 |
|
Индекс суммарной мощности МП (мкВ•мс) |
6076,0 (3581,0; 8170,5) |
10 074,0 (5924,0; 15 120,0) |
<0,05 |
|
Динамика МП (Me; Q1; Q3) |
|||
|
Динамика количества МП по амплитуде (%) |
-54,5 (-73,0; -37,0) |
-5,0 (-23,5; -37,0) |
Незначимо |
|
Динамика количества МП по длительности (%) |
-28,5 (-80,0; 26,8) |
-16 (-55,0; 15,5) |
Незначимо |
Примечание. МП — микропотенциалы сердца; (М± δ ) — средняя величина М и δ — ее стандартное отклонение; Me; Q1; Q3 — медиана выборки и ее 1-й (25%) и 3-й (75%) квартили; n — количество единиц.
Уитни. Результаты сравнения групп 1 и 2 представлены в таблице 3.
В динамике в группе умерших было выявлено снижение показателей количества МП сердца определенного диапазона амплитуд и продолжительности, тогда как в группе выживших пациентов с ИМ отчетливой динамики количества МП не было отмечено. Ввиду малого объема выборки больных группы 1 ( n =4) с повторной регистрацией ВТ ЭКГ статистический анализ сравнения динамики показателей МП был бы неинформативен. Анализ количества МП определенного диапазона амплитуды и длительности, зарегистрированных на ВТ ЭКГ в исследованных группах, выявил снижение количества МП в группе больных, погибших от кардиогенного шока.
Обсуждение
В начале XX столетия Виллем Эйнтховен зарегистрировал первую ЭКГ, и с тех пор этот метод регистрации электрической активности сердца развивается в направлении увеличения количества каналов регистрации ЭКГ сигнала и построения изопотенциальных или изохронных карт для решения «обратной задачи электрокардиографии» [2, 7–9, 13]. Перспективным признается направление технического развития регистраторов и сенсоров систем мониторирования жизненно важных функций организма, оперативной передачи полученной информации для анализа и принятия своевременного решения [2, 9, 13]. Перспективным направлением развития метода ЭКГ диагностики является поиск новых признаков, угрожающих развитием ВСС или неблагоприятным течением сердечной патологии [5, 18]. Разработка инструментальных средств измерения низкоамплитудных составляющих электрокардиосигнала, так называемых МП сердца, является перспективным направлением в поиске таких признаков [5, 12, 17]. Накопление клинического материала с использованием новой медицинской технологии регистрации МП у больных ИМ в режиме реального времени позволит определить новые критерии неблагоприятного развития заболевания и своевременно оптимизировать проводимое лечение у конкретного больного. Проведенный анализ у больных, различных по тяжести ИМ и его исхода, выявил снижение количества МП в группе неблагоприятного исхода, что подтверждает угнетение биоэлектрической спонтанной активности миокарда в отличие от группы выживших больных.
Полученные результаты проведенного пилотного исследования МП сердца являются предварительными и требуют дальнейшего накопления материала для разработки новых критериев диагностики, прогноза и оценки эффективности проводимого лечения больных ИМ.
Список литературы Результаты пилотного исследования микропотенциалов сердца у больных инфарктом миокарда с развитием кардиогенного шока
- Ibanez B., James S., Agewall S., Antunes M. J., Bucciarelli-Ducci C., Bueno H., Hindricks G. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2017; 39(2): 119-177. DOI: 10.1093/eurheartj/ehx393
- Внезапная сердечная смерть. Под ред. Е. В. Шляхто, Г. П. Арутюнова, Ю. Н. Беленкова, А. В. Ардашева. М.: Медпрактика-М, 2015.
- Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Под ред. комитета экспертов ВНОК по разработке рекомендаций: М. Я. Руда, С. П. Голицына, Н. А. Грацианского, А. Л. Комарова, Е. П. Панченко, И. И. Староверова, С. Н. Терещенко, И. С. Явелова. Кардиоваскулярная терапия и профилактика. 2007; 6(8); Приложение 1.
- Exner D. V., Kavanagh K. M., Slawnych M. P., Mitchell L. B., Ramadan D., Aggarwal S. G., Noullett C., VanSchaik A., Mitchell R. T., Shibata M. A., Gulamhussein S., McMeekin J., Tymchak W., Schnell G., Gillis A. M., Sheldon R. S., Fick G. H., Duff H. J. REFINE investigators. Noninvasive risk assessment early after a myocardial infarction: the REFINE study. J. Am. Coll. Cardiol. 2007; 50: 2275-2284. org/. DOI: 10.15420/ecr.2008.4.1.21
- Никифоров В. С., Метсо К. В. Электрокардиографические предикторы внезапной сердечной смерти. Consilium Medicum. 2018; 20(5): 29-33. 10 26442/2075.1753_2018 5 29 33. DOI: 10.26442/2075.1753_2018
- Avdeeva D. K., Ivanov M. L., Rybalka S. A., Maksimov I. V., Balahonova M. V. Investigation of the possibility to detect ventricular late potentials by a high-resolution electrocardiographic hardware-software complex based on nanosensors using Simson's method. Biology and Medicine. 2015; 7(4): BM-129-15. DOI:
- org/.
- DOI: 10.1051/matecconf/201815501008
- Kazakov V. Y., Avdeeva D. K., Grigoriev M. G., Natalinova N. M., Maksimov I. V., Balahonova M. V. Electrodynamic model of the heart to detect necrotic areas in a human heart. Biology and Medicine.2015; 7(5): 1-8. org/20167901005.
- DOI: 10.1051/matecconf/
- Baranov V. A., Avdeeva D. K., Ewert U., Yuzhakov M. M., Turushev N. V., Kodermyatov R. E., Maximov I. V., Balakhonova M. V. Structural Resonance Methods for Image Processing and Pattern Recognition. International Journal of Applied Engineering Research. 2017; 12(19): 9087-9098. org/.
- DOI: 10.21090/ijaerd.47751
- Хлынин М. С., Попов С. В., Криволапов С. Н., Баталов Р. Е. Неинвазивная топическая диагностика нарушений ритма сердца. Патология кровообращения и кардиохирургия. 2014; 4: 96-103.
- DOI: 10.21688/1681-3472-2014-4-96-103
- Shipulin V., Babokin V., Andreev S., Usov V., Aimanov R., Bogunetsky A., Batalov R., Popov S. Diagnostics and Surgical Treatment of Left Ventricular Aneurysm with Ventricular Tachycardia. Eur. J. Heart Fail. 2014; 16: 89. org/.
- DOI: 10.5772/54126
- Afanasiev S. A., Garganeeva A. A., Kuzheleva E. A., Andriyanova A. V., Kondratieva D. S., Popov S. V. The Impact of Type 2 Diabetes Mellitus on Long-Term Prognosis in Patients of Different Ages with Myocardial Infarction. J. Diabetes Res. 2018: 1780683.
- DOI: 10.1155/2018/1780683
- Mishchenko K. V., Avdeeva D. K., Yukhin Y. M., Titkov A. I., Logutenko O. A. Preparation of electroconductive aluminum-silicon oxide ceramic sensors modified with silver and bismuth nanoparticles. Eur. J. Nanomedicine. 2016; 8(4): 195-202.
- DOI: 10.1515/ejnm-2016-0019
- Bokeria L. A., Revishvili A. Sh., Kalinin V. V., Lyajina O. S., Fetisova E. A., Simonyan G. Yu. Non-invasive endocardial mapping of the ventricles of the heart on the basis of solving the inverse problem of electrocardiography. Herald of arrhythmology. 2009; 57: 24-28.
- DOI: 10.1007/s10527-009-9065-0
- Голухова Е. З., Громова О. И., Булаева Н. И., Бокерия Л. А. Внезапная сердечная смерть у больных ишемической болезнью сердца: от механизмов к клинической практике. Кардиология. 2017; 57(12): 73-81.
- DOI: 10.18087/cardio.2017.12.10069
- Zavadovsky K. V., Saushkin V. V., Khlynin M. S., Popov S. V., Lishmanov Yu. B. Cardiac sympathetic activity and ventricular dyssynchrony in patients with heart failure referred for cardiac resynchronization therapy. Eur. J. Heart Fail. 2017; 19: 584.
- DOI: 10.1111/pace.12948
- Идрисов М. З., Попов С. В., Баталов Р. Е., Борисова Е. В., Максимов И. В. Современный взгляд на прогностическую значимость и лечение желудочковых нарушений ритма сердца, возникших в ранние сроки острого инфаркта миокарда. Сибирский медицинский журнал. 2015; 30(1): 123-128.
- Pietrasik G., Zareba W. QRS fragmentation: diagnostic and prognostic significance. Cardiol. J. 2012; 19(2): 114-121.
- DOI: 10.5603/cj.2012.0022
- Bauer A., Guzik P., Barthel P., Ulm K., Watanabe M. A., Schmidt G. Reduced prognostic power of ventricular late potentials in postinfarction patients of the reperfusion era. Eur. Heart J. 2005; 26(8): 755-761.
- DOI: 10.1016/j.accreview.2005.08.074


