Результаты планирования пластики постинфарктных аневризм левого желудочка на основе магнитнорезонансной томографии и трехмерного моделирования
Автор: Кушнарев С.В., Железняк И.С., Кравчук В.Н., Рудь С.Д., Ширшин А.В., Меньков И.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Цель: оценить результаты планирования оперативных вмешательств с использованием трехмерных моделей, изготовленных на основе магнитно-резонансной томографии (МРТ), у пациентов с постинфарктными аневризмами левого желудочка (ПАЛЖ).Материал и методы. В исследовании участвовали две группы пациентов с ПАЛЖ общей численностью 41 человек. В 1-ю (экспериментальную) группу были включены 17 пациентов, у которых ПАЛЖ была диагностирована по результатам МРТ, планирование оперативного вмешательства выполнялось по изготовленной 3D-модели сердца. Вторая (контрольная) группа была представлена 24 пациентами, у которых ПАЛЖ были диагностированы по данным эхокардиографии (ЭхоКГ) или вентрикулографии, а планирование оперативного вмешательства выполнялось по традиционным двухмерным срезам на экране монитора.Результаты. Сравнение времени полного искусственного кровообращения (ИК) между группами показало наличие статистически значимых различий: в 1-й группе этот параметр составил 60 [56; 68] мин, в то время как во 2-й группе - 71 [61; 84] мин (р = 0,043). При сравнении времени общей продолжительности операции (1-я группа - 280 [265; 320], 2-я группа - 263 [248; 283], р = 0,055), общего времени ИК (1-я группа - 93 [86; 109], 2-я группа - 104 [83; 109], p = 0,653) и времени параллельного ИК (1-я группа - 31 [26; 39], 2-я группа - 27 [21; 32], p = 0,127) статистически значимые различия отсутствовали.Заключение. Применение 3D-моделей для подготовки хирургов к пластике ПАЛЖ позволяет определить тип реконструктивной операции, отработать основные этапы предстоящего вмешательства, а также уменьшить время полного ИК при его проведении.
Магнитно-резонансная томография, 3d-печать, 3d-модель сердца, предоперационное планирование, постинфарктная аневризма левого желудочка
Короткий адрес: https://sciup.org/149140021
IDR: 149140021 | УДК: 616.124.2-005.8-06-007.64-089.844-035-073.86
Текст научной статьи Результаты планирования пластики постинфарктных аневризм левого желудочка на основе магнитнорезонансной томографии и трехмерного моделирования
По данным Всемирной организации здравоохранения, в 2019 г. 16% всех летальных исходов в мире пришлось на ишемическую болезнь сердца (ИБС) [1]. Ростовой тренд сердечно-сосудистых заболеваний сохраняется с начала 2000 г., и прогноз неутешительный – к 2030 г. смертность возрастет на 50% [2].
С внедрением эндоваскулярных методов лечения, а также благодаря своевременному применению тромболитических препаратов снизилось количество леталь- ных исходов среди пациентов, перенесших обширный трасмуральный инфаркт миокарда (ИМ) [3]. В среднем у 20% таких пациентов возникает такое осложнение, как постинфарктная аневризма левого желудочка (ПАЛЖ) [4]. Количество пациентов с терминальной стадией хронической сердечной недостаточности (ХСН) вследствие ИБС ежегодно увеличивается.
Хирургический метод лечения пациентов с терминальной стадией ХСН остается одним из эффективных [5]. Оперативное лечение таких пациентов имеет высокий риск развития осложнений [6]. Существуют различные виды реконструктивных операций на левом желудочке (ЛЖ), однако окончательное решение хирурга зависит от множества факторов и принимается непосредственно во время операции. Вид и объем пластики определяются индивидуально для каждого конкретного случая и зависят от общего состояния пациента, формы и размера полости ЛЖ, локализации и глубины фиброзных изменений [7].
В качестве основного метода диагностики ПАЛЖ в настоящее время применяют трансторакальную эхокардиографию (ЭхоКГ). Несмотря на это, визуализация сердечных структур и фиброзных изменений миокарда при ЭхоКГ ограничена [8]. Магнитно-резонансная томография (МРТ) с контрастным усилением позволяет проводить оценку структурных и функциональных изменений миокарда, а также выступает в качестве референсного метода для расчета количественных показателей сердца [9]. Несмотря на высокую тканевую контрастность изображений, получаемых при МРТ, они представляют плоскостную картину, при этом размеры могут быть пропорционально искажены, что может повлечь расхождение в интерпретации одного и того же клинического случая различными специалистами. В результате возможности планирования предстоящего оперативного вмешатель- ства ограничены [10]. Аддитивные технологии, а именно трехмерная печать (3D-печать), могут решить проблему наглядной демонстрации патологических изменений [11].
Цель исследования: оценка результатов планирования оперативных вмешательств с использованием трехмерных моделей, изготовленных на основе МРТ, у пациентов с ПАЛЖ.
Материал и методы
В период с 2015 по 2020 гг. были обследованы и прооперированы 41 пациент с ПАЛЖ, которых разделили на две группы; 1-я группа была сформирована проспективно, 2-я группа – ретроспективно. В 1-ю (экспериментальную) группу были включены 17 пациентов с ПАЛЖ, диагностированной по данным МРТ, планирование операции которым осуществлялось с использованием 3D-модели. Вторая (контрольная) группа состояла из 24 пациентов, у которых ПАЛЖ была диагностирована на основе вентрикулографии и результатов ЭхоКГ, а планирование реконструктивной операции основывалось на анализе двумерных срезов, отображаемых на мониторе. В таблице 1 представлены основные клинические параметры для каждой из групп пациентов.
Таблица 1. Общая клиническая характеристика пациентов по группам Table 1. General clinical characteristics of patient groups
|
Параметры Characteristics |
1-я группа (оперированные с использованием 3D-модели) Group 1 (with 3D model) |
2-я группа (оперированные без использования 3D-модели) Group 2 (without 3D model) |
|
Количество обследуемых, n Number of people examined, n |
17 |
24 |
|
Возраст, лет Age, years |
62 [57; 66] |
59 [55; 66] |
|
Мужчины, n (%) Male, n (%) |
16 (94,1) |
22 (91,6) |
|
Женщины, n (%) Female, n (%) |
1 (5,9) |
2 (8,4) |
|
Длительность анамнеза ИБС, лет History of coronary artery disease, years |
8 [3; 10] |
6 [2,5; 9] |
|
Количество инфарктов в анамнезе, n Number of heart attacks in history, n |
1 [1; 2] |
1 [1; 2] |
|
Функциональный класс стенокардии напряжения ( n, %) : Functional class of angina pectoris ( n, %) : I |
||
|
II |
– |
5 (20,8) |
|
III |
16 (94,1) |
19 (79,2) |
|
IV |
1 (5,9) |
– |
|
Хроническая сердечная недостаточность ( n, %) : Chronic heart failure ( n, %) : I |
||
|
IIA |
5 (29,4) |
17 (70,8) |
|
IIB |
10 (58,8) |
6 (25,0) |
|
III |
2 (11,8) |
1 (4,2) |
|
Функциональный класс сердечной недостаточности ( n, %) : Functional class of heart failure (NYHA) ( n, %) : I |
||
|
II |
2 (11,8) |
12 (50,0) |
|
III |
14 (82,4) |
11 (45,8) |
|
IV |
1 (5,9) |
1 (4,2) |
ЭхоКГ выполняли по стандартной методике на аппарате экспертного класса. Сканирование производили из парастернального и апикального доступов для визуализации сердечных структур по длинным и коротким осям. МРТ сердца выполняли на компьютерном томогра- фе с индукцией магнитного поля 1,5 Тесла, с получением МР-изображений в стандартных плоскостях ска-нирова-ния. Для визуализации фиброзных изменений внутривенно вводили парамагнитный контрастный препарат в дозировке 0,15 ммоль/кг, через 10 мин выполняли скани- рование. МР-изображения получали с помощью двух типов импульсных последовательностей (ИП). Первый тип – стандартная двухмерная ИП «инверсия-восстановление» на основе сверхбыстрого градиентного эха (2D_IR_TFE), второй тип – усовершенствованная трехмерная ИП «инверсия-восстановление» на основе сверхбыстрого градиентного эха (3D_PSIR_TFE). МР-критерии диагностики ПАЛЖ представлены на рисунке 1.
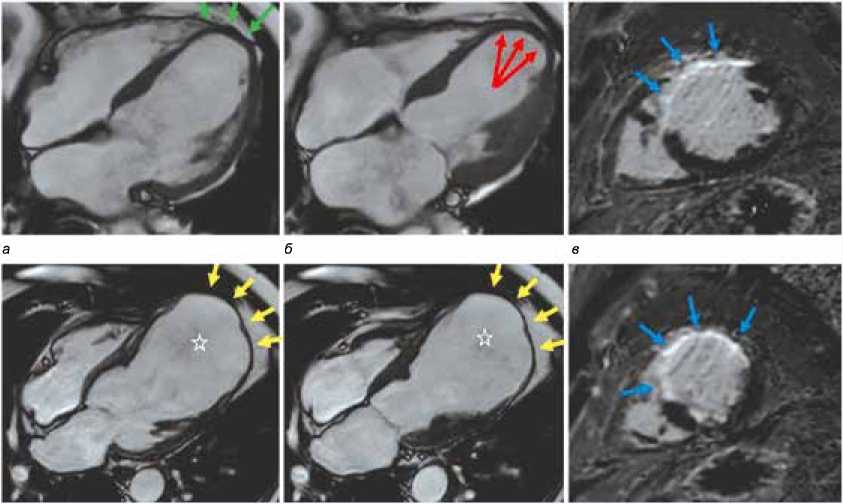
г д е
Рис. 1. Критерии постинфарктной аневризмы левого желудочка на МР-изображениях: а, б – киноизображения, 4-камерная ось, парадоксальный ход стенки (дискинезия) во время диастолы ( а ) и систолы ( б ). Зелеными стрелками обозначена зона западения стенки, красными – зона выбухания в области верхушки левого желудочка. г, д – киноизображения, 4-камерная ось, акинезия стенки во время диастолы ( г) и систолы ( д ). Желтыми стрелками обозначена зона акинезии в области верхушки левого желудочка с истончением стенки до 3 мм и шарообразной деформацией его полости (звездочка). в, е – постконтрастные МР-изображения, короткая ось, срединные (в) и апикальные (е) сегменты. Синими стрелками обозначено трансмуральное накопление контрастного вещества стенками левого желудочка
Fig. 1. Criteria of postinfa rction left ventricular (LV) aneurysm on MR images: a, b – cine images, 4-chamber axis, paradoxical wall motion (dyskinesia) during diastole (a) and systole (b ). Green arrows indicate the zone of wall recession and red arrows indicate the bulging zone in the LV apex. d, e – cine images, 4-chamber axis, wall akinesia during diastole ( d ) and systole ( e ). Yellow arrows indicate an area of akinesia in the LV apex with wall thinning up to 3 mm and spherical deformation of its cavity (asterisk). c, f – post-contrast MR images, short axis, medial ( c ) and apical ( f ) segments. Blue arrows indicate transmural accumulation of contrast agent by LV walls.
Цифровую 3D-модель сердца создавали на основе МР-изображений, полученных с помощью ИП 3D_ PSIR_TFE. На каждом срезе осуществляли выделение (сегментирование) интактного миокарда и фиброзных изменений. Далее сегментированные зоны интереса суммировались между собой и сохранялись в цифровую 3D-модель, которую изготавливали на 3D-принтере. На финальном этапе напечатанную 3D-модель обрабатывали механическим и термическим способами. Особенностью получаемых 3D-моделей была эластичность и двухцветность. Красным материалом обозначался интактный миокард, белым – фиброзные изменения. При наличии тромба в полости ЛЖ он изготавливался отдельно синим и фиксировался в полости ЛЖ двухцветной модели. Основные этапы изготовления представлены на рисунке 2.
Хирурги использовали изготовленные прототипы для планирования и отработки основных этапов предстоящей операции. На 3D-модели оценивали форму и размеры ЛЖ, общий вид фиброзных изменений. Далее выполняли подробный визуальный анализ фиброзных изменений – определяли точную локализацию, их глубину и распространение на межжелудочковую перегородку (МЖП).
Полученные данные использовали для выбора оптимального типа реконструктивной операции. Также на 3D-модели проектировали линии нанесения разрезов, вероятные объемы иссекаемых тканей, место вшивания дакроновой заплаты и моделировали остаточную полость ЛЖ.
В экспериментальной группе на предоперационном этапе оперативное вмешательство планировалось с использованием плоскостных изображений ЭхоКГ и изготовленной 3D-модели. Окончательное решение о типе пластики ЛЖ принималось во время операции. В зависимости от соответствия результатов планирования различными методами была рассчитана их диагностическая точность.
В качестве критериев эффективности выполненных оперативных вмешательств для обеих групп выступали время операции и время ИК (полное, параллельное и общее).
Для создания базы пациентов и хранения исходных данных использовали редактор «MS Excel 2019» (Microsoft, США). В качестве инструментов статистической обработки применяли программные пакеты «Jamovi 1.2» ( и «PSPP» (.
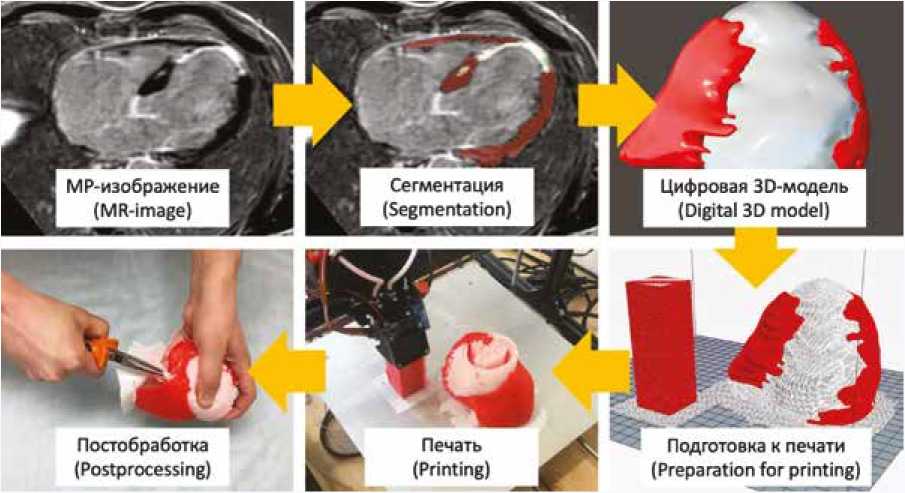
Рис. 2. Алгоритм изготовления 3D-моделей. Последовательность этапов обозначена желтыми стрелками
Fig. 2. Algorithm of 3D models making. The order of steps is indicated by yellow arrows
Распределение значений исследуемых параметров в результате проверки с использованием критерия Шапиро – Уилка отличалось от нормального. Учитывая малый объем выборок, оценку различий между ними проводили с использованием критерия Уилкоксона – Манна – Уитни, а различия между ранговыми и номинальными переменными оценивали на основе точного теста Фишера. Критерием статистической значимости различий считали значение p , не превышающее 0,05.
Результаты
В 1-й группе на первом этапе предоперационное планирование хирургом осуществлялось по изображениям на экране монитора, полученным при выполнении плановой ЭхоКГ. Далее вторым этапом пациенту выполнялась
МРТ сердца, по изображениям которой изготавливалась 3D-модель, после анализа которой хирург принимал окончательное решение о виде предстоящей пластики ЛЖ. Итоги принятых решений по выполнению оперативных вмешательств в предоперационном периоде в зависимости от метода визуализации и их сравнение с интраоперационным результатом представлены в таблице 2.
По результатам, приведенным в таблице 2, видно, что при планировании оперативных вмешательств с использованием 3D-модели только у одного пациента (5,8% случаев) решение не совпало с интраоперационным, в то время как при планировании оперативных вмешательств с использованием ЭхоКГ у трех пациентов (17,6%) было принято решение, отличающееся от интраоперационного.
Таблица 2. Сравнение результатов количества запланированных и выполненных реконструктивных операций по видам пластики в 1-й группе пациентов
Table 2. Comparison of the results in regard to the number of planned and performed reconstructive surgeries by plastic surgery type in group 1
|
Вид пластики Type of plastic surgery |
Запланированное количество операций Scheduled number of operations |
Выполнено Performed surgeries |
|
|
2D-изображения ЭхоКГ 2D TTE images |
3D-модель на основе МРТ MRI-based 3D model |
||
|
Линейная Linear repair |
14 |
10 |
11 |
|
Чувствительность, % Sensitivity, % |
100 [71,5; 100] |
90,9 [58,7; 99,8] |
– |
|
Специфичность, % Specificity, % |
50 [11,8; 88,2] |
100 [54,1; 100] |
– |
|
Расширенная Extended |
3 |
7 |
6 |
|
Чувствительность, % Sensitivity, % |
50 [11,8; 88,2] |
100 [54,1; 100] |
– |
|
Специфичность, % Specificity, % |
100 [71,5; 100] |
90,9 [58,7; 99,8] |
– |
Таким образом, точность планирования с использованием плоскостных изображений ЭхоКГ составила 82,4 против 94,1% при использовании 3D-модели.
Пример отработки основных этапов выполнения внутрижелудочковой пластики и соответствующие им интраоперационные фотографии представлены на рисунках 3–4.
Во 2-й группе 17 пациентам (70,8%) была выполнена линейная пластика, 7 – расширенная (29,2%). Решение о необходимости выполнения реконструктивной операции ЛЖ принималось только с учетом данных ЭхоКГ, однако они не позволяли однозначно осуществить выбор пластики, окончательное решение принималось интраоперационно.
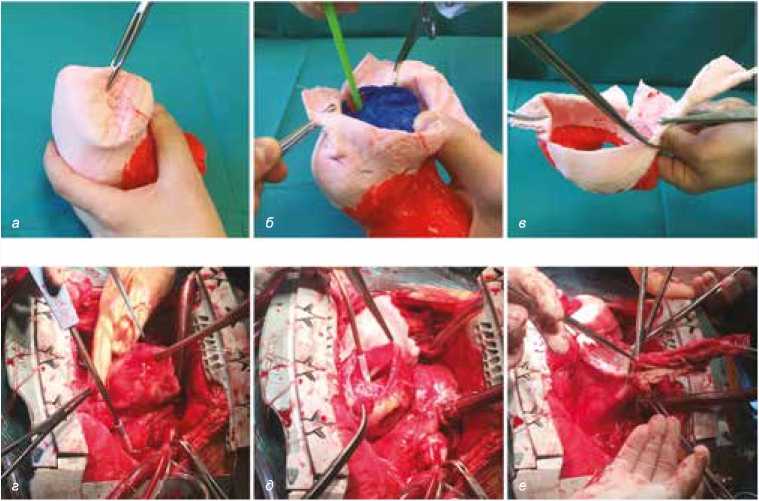
б
в
г
а
Рис. 3. а, б, в – фотографии планирования оперативного вмешательства на 3D-модели, г, д, е – интраоперационные фотографии, соответствующие этапам планирования. Выделение купола аневризмы ( а , г ), аневризмотомия и экспирация крови из полости ЛЖ ( б , д ), иссечение фиброзных тканей ( в , е )
Fig. 3. а, б, в – photographs at different stages of surgical planning using 3D model, г, д, е – corresponding intraoperative photographs. Extraction of aneurysm dome ( а, г ), aneurysmotomy and blood expiration from LV cavity ( б , д ), and excision of fibrous tissues ( в, е )
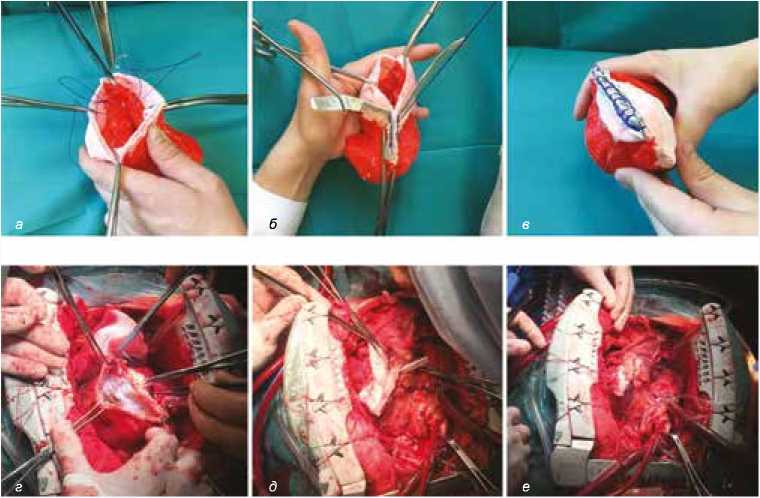
Рис. 4. а, б, в – фотографии планирования оперативного вмешательства на 3D-модели, г, д, е – интраоперационные фотографии, соответствующие этапам планирования. Наложение эндовентрикулярного кисетного шва ( а, г ), ушивание полости ЛЖ ( б, д ), наложение циркулярных швов на завершающем этапе ( в, е )
Fig. 4. а, б, в – photographs at different stages of surgical planning using 3D model, г, д, е – corresponding intraoperative photos. Endoventricular suturing ( а, г ), suturing of LV cavity ( б, д ), and circular suturing at the final stage ( в, е )
Показатели сравнения времени, затраченного на всю операции, и времени ИК (общего, параллельного и полного) представлены в таблице 3.
Таблица 3. Сравнение временных показателей выполненных операций
Table 3. Comparison of surgery time parameters
|
Показатели Parameters |
1-я группа Group 1 |
2-я группа Group 2 |
р |
|
Общее время операции, мин Total time of operation, min |
280 [265; 320] |
263 [248; 283] |
0,055 |
|
Общее время ИК, мин Total artificial circulation time, min |
93 [86; 109] |
104 [83; 109] |
0,653 |
|
Время параллельного ИК, мин Parallel artificial circulation time, min |
31 [26; 39] |
27 [21; 32] |
0,127 |
|
Время полного ИК, мин Full artificial circulation time, min |
60 [56; 68] |
71 [61; 84] |
0,043 |
В 1-й (экспериментальной) группе время полного ИК составило 60 [56; 68] мин, в то время как во 2-й (контрольной) группе этот показатель был выше и составил 71 [61; 84] мин ( р = 0,043).
Обсуждение
Одним из фундаментальных преимуществ МРТ перед ЭхоКГ является возможность прямой визуализации фиброзных изменений (рис. 5), что было одним из ключевых параметром в изготовлении 3D-моделей.
Двухмерная ИП «инверсия-восстановление» на основе сверхбыстрого градиентного эха (2D_IR_TFE) используется для получения МР-изображений фиброзных изменений миокарда при выполнении стандартного исследования сердца. Она позволяет получить отдельные срезы, чаще всего 3–5, толщиной 8 мм, что достаточно только для посегментной оценки распространения фиброзных изменений. На основе таких изображений невозможно создать качественную 3D-модель, так как для приемлемой детализации структур толщина срезов не должна превышать 2 мм. Также важно, чтобы серия МР-изображений покрывала весь объем сердца без промежутков.
Для решения этих проблем мы использовали трехмерную ИП «инверсия-восстановление» на основе сверхбыстрого градиентного эха (3D_PSIR_TFE).
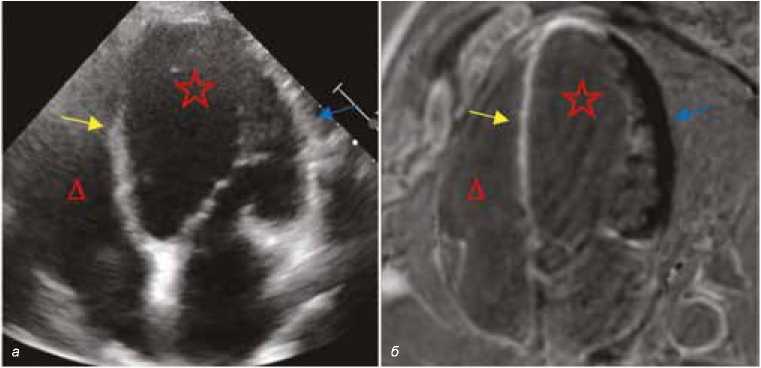
Рис. 5. Постинфарктные аневризмы левого желудочка, переднеперегородочно-верхушечная локализации: а – сонограмма (ЭхоКГ), б – мульти-планарная реконструкция постконтрастной серии МР-изображений, 4-камерные плоскости. Звездочка – полость левого желудочка. Треугольник – полость правого желудочка. Желтая стрелка – трансмуральные фиброзные изменения. Синяя стрелка – интактный миокард (синяя стрелка) Fig. 5. Postinfarction left ventricular aneurysms, anteroparietal-apical localization: а – sonogram (TTE), б – multiplanar reconstruction of the post-contrast series of MR images, 4-chamber planes. The asterisk is the left ventricular cavity. Triangle – right ventricular cavity. Yellow arrow – transmural fibrous changes. Blue arrow – intact myocardium
Трехмерный тип ИП последовательностей позволяет выполнить сбор данных со всей области сканирования (без промежутков между ними) с различной толщиной среза. При подборе минимальной толщины среза эмпирическим путем, при условии сохранения высокого соотношения «сигнал – шум», таковой являлась толщина среза 3 мм в получаемой серии МР-изображений. Дальнейшее снижение толщины среза достигалось за счет использования 50% интерполяции между срезами, что позволило снизить толщину среза до 1,5 мм с сохранением соотношения «сигнал – шум». Снижение времени сканирования достигалось изменением направления сбора данных с короткой оси сердца на длинную. Проблема поддержания тканевой контрастности получаемых МР-изображений, возникающая при постоянном сдвиге «времени инверсии», была решена применением ИП «инверсия-восста- новление» с фазовой чувствительностью. В результате технических решений, с помощью усовершенствованной трехмерной ИП «инверсия-восстановление» на основе сверхбыстрого градиентного эха (3D_PSIR_TFE), стало возможным получение качественной высокоинформативной серии МР-изображений, на основе которых возможно создание 3D-модели у пациентов с ПАЛЖ.
Одним из важных условий при выборе типа пластики ЛЖ являются предоперационная оценка состояния миокарда левого желудочка [12] и точное определение границы между миокардом и фиброзными изменениями [13], что не всегда возможно [7]. Проблема выбора типа пластики при ПАЛЖ ставит перед специалистами задачу поиска новых способов лечения и усовершенствования уже имеющихся.
Результатом внедрения 3D-технологий стала возможность комплексной визуализации патологических изме- нений, планирования и отработки этапов операции. На сегодняшний день речь идет о передаче реальных пространственных соотношений между нормальными анатомическими структурами и детальной демонстрации распространенности патологических изменений. Создание 3D-модели на этапе планирования операции позволит расширить ограничения метода ЭхоКГ, используемого в настоящее время для этих целей.
Несмотря на многочисленные обзоры литературы о применении 3D-моделей в кардиохирургии, роль их остается неопределенной. Большинство работ посвящено отдельным клиническим случаям. Положительная тенденция сохраняется только в направлении врожденных пороков сердца и подборе окклюдеров ушка левого предсердия. Как следствие, кардиохирургия нуждается в «больших исследованиях» касательно применения 3D-моделей. На современном этапе происходит определение именно целесообразности применения 3D-печати при определенной патологии, что может быть доказано или опровергнуто мультицентровыми исследованиями.
Единственная публикация, посвященная применению 3D-модели у пациентов с ПАЛЖ, была опубликована S. Jacobs и соавт. в 2008 г. [14]. В статье описывается два клинических случая. По итогам работы авторы резюмируют, что применение 3D-моделей на подготовительном этапе может улучшить результаты предстоящей операции. Подробный процесс создания 3D-модели не описан, однако авторы упоминают, что для ее создания использовали изображения компьютерной томографии. МРТ пациентам также выполнялась, но только для определения участков дис- и акинезии ЛЖ. Стоит отметить, что модели, представленные на рисунках, были двухцветными, однако по какому принципу сегментировались фиброзные изменения и здоровый миокарда, а также определялась граница между ними, в работе не описывается.
Результаты нашего исследования показывают, что использование 3D-моделей в клинической практике позволяет повысить точность выбора типа реконструкции и отработать ее основные этапы на индивидуализированном макете, отражающем анатомические соотношения и распространенность патологических изменений.
Преимущества 3D-моделей в качестве инструмента планирования оперативного вмешательства заключаются в наглядном отображении границ интактных и патологически измененных участков миокарда, в том числе глубины распространения фиброза. Помимо этого, возможна визуализация внутренних структур сердца (рас- пространение фиброза на папиллярные мышцы и МЖП, наличие тромботических масс в полостях), оценка которых возможна только после вскрытия полости ЛЖ.
В нашем исследовании было выявлено статистически значимое снижение времени полного ИК в 1-й (экспериментальной) группе. Несмотря на постоянное усовершенствование аппаратов для проведения ИК, многие параметры этой процедуры все равно достаточно сильно отличаются от физиологических, что приводит к нарушениям гомеостаза [15]. Осложнения, возникшие после выполнения процедуры ИК, могут свести к минимуму все результаты, достигнутые во время сложных оперативных вмешательств [16]. Возникающая при ИК ишемия оказывает нефротоксическое действие отдельными лекарственными препаратами и компонентами переливаемой крови, что может привести к повреждению почечного эпителия и развитию острой почечной недостаточности [17]. Использование ИК часто вызывает неврологические осложнения [18], 3–6% которых приводят к возникновению очаговой неврологической симптоматики в виде транзиторной ишемической атаки, инсульта или комы [19, 20].
Справедливо отметить, что ограничением выполненной нами работы является небольшой объем выборки пациентов в 1-й (экспериментальной) группе, поэтому выполнение исследования с большим объемом выборки пациентов ( n > 35) будет являться направлением развития в долгосрочной перспективе.
Выводы
МРТ является высокоинформативным методом в визуализации фиброзных изменений миокарда. Данных о распространенности патологических изменений миокарда, получаемых по усовершенствованной методике МР-сканирования, достаточно для создания двухцветных эластичных 3D-моделей сердца.
Использование 3D-моделей для планирования реконструктивных операций у пациентов с ПАЛЖ позволяет спланировать и отработать основные этапы предстоящей операции. Точность выбора способа пластики с применением 3D-модели выше, чем при традиционном планировании, которое планируется на плоскостных изображениях ЭхоКГ, отображаемых на мониторе.
Предоперационное планирование этапов реконструктивной операции на ЛЖ с использованием 3D-модели ведет к снижению времени полного ИК, что, в свою очередь, способно положительно сказаться на эффективности оперативного вмешательства.
Список литературы Результаты планирования пластики постинфарктных аневризм левого желудочка на основе магнитнорезонансной томографии и трехмерного моделирования
- Всемирная организация здравоохранения. 10 ведущих причин смерти в мире. URL: https://www.who.int/ru/news-room/fact-sheets/ detail/the-top-10-causes-of-death
- Starodubov V.I., Marczak L.B., Varavikova E., Bikbov B., Ermakov S.P., Gall J. et al. The burden of disease in Russia from 1980 to 2016: А systematic analysis for the Global Burden of Pisease Study 2016. Lancet. 2018;392(10153):1138-1146. 00I: 10.1016/S0140-6736(18)31485-5.
- Коков А.Н., Масенко В.Л., Семенов С.Е., Барбараш О.Л. МРТ сердца в оценке постинфарктных изменений и ее роль в определении тактики реваскуляризации миокарда. Комплексные проблемы сердечно-сосудистых заболеваний. 2014;(3):97-102. 00I: 10.17802/23061278-2014-3-97-102.
- Сигаев И.Ю., Алшибая М.М., Бокерия О.Л., Бузиашвили Ю.И., Голу-хова Е.З., Мерзляков В.Ю. и др. Современные тенденции развития коронарной хирургии в НЦССХ им. А.Н. Бакулева. Бюллетень НЦС-СХ им А.Н. Бакулева РАМН. 2016;17(3):66-76.
- Contreras C.A.M., Orellana P.X., de Almeida A.F.S., Finger M.A., Rossi Neto J.M., Chaccur P. Left ventricular reconstruction surgery in candidates for heart transplantation. Braz. J. Cardiovasc. Surg. 2019;34(3):265-270. 00I: 10.21470/1678-9741-2018-0087.
- Hartyanszky I., Toth A., Berta B., Polos M., Veres G., Merkely B. et al. Personalized surgical repair of left ventricular aneurysm with computer-assisted ventricular engineering. Interact. Сardiovasc. Thorac. Surg. 2014;19(5):801-806. 00I: 10.1093/icvts/ivu219.
- Yan J., Jiang S.-L. Impact of surgical ventricular restoration on early and long-term outcomes of patients with left ventricular aneu-rysm. Medicine (Baltimore). 2020;97(41):e12773. 00I: 10.1097/ M0.0000000000012773.
- Siddiqui I., Nguyen T., Movahed A., Kabirdas 0. Elusive left ventricular thrombus: 0iagnostic role of cardiac magnetic resonance imag-ing-A case report and review of the literature. World J. Clin. Cases. 2018;6(6):127-131. 00I: 10.12998/wjcc.v6.i6.127.
- Paul M., Schäfers M., Grude M., Reinke F., Juergens K.U., Fischbach R. et al. Idiopathic left ventricular aneurysm and sudden cardiac death in young adults. Europace. 2006;8(8):607-612. DOI: 10.1093/europace/ eul074.
- Levin D., Mackensen G.B., Reisman M., McCabe J.M., Dvir D., Ripley B. 3D printing applications for transcatheter aortic valve replacement. Curr. Card. Rep. 2020;22(4):23. DOI: 10.1007/s11886-020-1276-8.
- Vukicevic M., Puperi D.S., Jane Grande-Allen K., Little S.H. 3D printed modeling of the mitral valve for catheter-based structural interventions. Ann. Biomed. Eng. 2017;45(2):508-519. DOI: 10.1007/s10439-016-1676-5.
- Чернявский А.М., Карева Ю.Е., Денисова М.А., Эфендиев В.У. Проблема предоперационного моделирования левого желудочка. Кардиология и сердечно-сосудистая хирургия. 2015;8(2):4-7. DOI: 10.17116/kardio2015824-7.
- Cox J.L. Surgical management of left ventricular aneurysms: a clarification of the similarities and differences between the Jatene and Dor techniques. Semin. Thorac. Cardiovasc. Surg. 1997;9(2):131-138.
- Jacobs S., Grunert R., Mohr F.W., Falk V. 3D-Imaging of cardiac structures using 3D heart models for planning in heart surgery: a preliminary study. Interact. Cardiovasc. Thorac. Surg. 2008;7(1):6-9. DOI: 10.1510/ icvts.2007.156588.
- Радивилко А.С. Профилактика осложнений после операций с искусственным кровообращением (дайджест публикаций). Комплексные проблемы сердечно-сосудистых заболеваний. 2016;(3):117—123. 00I: 10.17802/2306-1278-2016-3-117-123.
- Чегрина Л.В., Рыбка М.М. Взаимосвязь повышения послеоперационного уровня тропонина Т и лактата с развитием осложнений у больных, оперированных с применением искусственного кровообращения. Клиническая физиология кровообращения. 2015;(1):42—48.
- Белов Ю.В., Литвицкий П.Ф., Винокуров И.А. Острая почечная недостаточность в кардиохирургической практике: предикторы, механизмы развития и критерии диагноза. Сеченовский вестник. 2015;22(4):4-11.
- Farhoudi M., Mehrvar K., Afrasiabi A., Parvizi R., Khalili A.A., Nasiri B. et al. Neurocognitive impairment after off-pump and on-pump coronary artery bypass graft surgery - an Iranian experience. Neuropsychiatr. Dis. Treat. 2010;6:775-778. 00I: 10.2147/N0T.S14348.
- Motallebzadeh R., Bland J.M., Markus H.S., Kaski J.C., Jahangiri M. Neurocognitive function and cerebral emboli: randomized study of on-pump versus off-pump coronary artery bypass surgery. Ann. Thorac. Surg. 2007;83(2):475-482. 00I: 10.1016/j.athoracsur.2006.09.024.
- Lombard F.W., Mathew J.P. Neurocognitive dysfunction following cardiac surgery. Semin. Cardiothorac. Vasc. Anesth. 2010;14(2):102-110. 00I: 10.1177/1089253210371519.


