Результаты применения модифицированного "закрытого" метода реимплантации коронарных артерий при артериальном переключении
Автор: Ефимочкин Г.А., Борисков М.В., Барбухатти К.О., Кандинский М.Л., Порханов В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.32, 2017 года.
Бесплатный доступ
Введение. В настоящее время стандартом оперативного лечения больных с транспозицией магистральных артерий (ТМА) является операция артериального переключения в периоде новорожденности. Реимплантация коронарной артерией (КА) при этой операции - ключ к успеху, поэтому постоянно ведется поиск новых и модификация уже известных методик. Цель нашей работы: представить результаты операции артериального переключения с использованием «модифицированной» закрытой методики реимплантации КА. Материал и методы. За период с 2011 г. по декабрь 2016 г. в НИИ ККБ № 1 им. С.В. Очаповского выполнено 63 операции артериального переключения с использованием модифицированной закрытой методики реимплантации КА. Средний возраст на момент операции составил 4,77+2,54 дня, средний вес 3,33+0,35 кг. В среднем операции выполнялись на 5-е сутки после рождения. Диагнозы: больные с простой ТМА (n=49), больные с ТМА и дефектом межжелудочковой перегородки (ДМЖП), n=11; у 3 больных с ТМА и ДМЖП (1 больной с множественным дефектом) имела место обструкция дуги аорты. В процессе исследования выявлено, что единственным ограничением применения модифицированного «закрытого» метода реимплантации КА является интрамуральный ход КА. Инфу- зию альпростана/вазопростана получали 58 больных (92% пациентов), баллонная атриосептостомия (процедура Рашкинда) потребовалась 22 больным (34,9%). Результаты. Госпитальная летальность составила 7,93% (5 больных). Среди пациентов с простой ТМС летальность составила 6,1% (3 больных на 49 операций), у больных с ДМЖП - 18,1% (2/11 пациентов). Среди пациентов с аномалией дуги аорты летальных исходов не было. Причинами летальности послужили полиорганная недостаточность (2 больных) и сепсис на фоне некротического энтероколита (НЭК), 3 пациента. Обсуждение. Операция артериального переключения на современном этапе развития детской кардиохирургии - метод выбора для пациентов с транспозицией магистральных сосудов при возможности 2-желудочковой коррекции. Летальность обусловлена в первую очередь исходной тяжестью пациентов и сопутствующей инфекционной патологией. «Закрытая» методика реимплантации позволяет улучшить контроль кровотечения за счет уменьшения количества «слабых» мест аортального анастомоза («слабыми» местами при U-образном либо «trap door» анастомозах являются места завязывания нитей при создании корня неоаорты) и сформировать синотубулярный переход неоаорты, что уменьшает риск развития аортальной недостаточности. Анализируя данные литературы и собственные наблюдения, можно предположить, что закрытая методика и ее модификации уменьшают вероятность коронарной ишемии. Также реимплантация КА по закрытой методике возможна при любой коронарной анатомии, кроме интрамуральной КА. Более того, наша модификация позволяет уменьшить время ишемии миокарда (нет этапа снятия зажима с аорты для наполнения неоаорты кровью) и, соответственно, уменьшить время искусственного кровообращения и всего вмешательства в целом.
Транспозиция магистральных артерий, коронарные артерии, модифицированная закрытая методика, реимплантация коронарных артерий
Короткий адрес: https://sciup.org/149125171
IDR: 149125171 | DOI: 10.29001/2073-8552-2017-32-3-60-66
Текст научной статьи Результаты применения модифицированного "закрытого" метода реимплантации коронарных артерий при артериальном переключении
ТМА — сложный «синий» врожденный порок сердца (ВПС), который без хирургического лечения является фатальным. Жизнь больного зависит от функции фетальных коммуникаций (артериальный проток и межпредсердное сообщение). Вехи развития кардиохирургии неразрывно связаны с лечением ТМА: от паллиативных вмешательств к радикальной коррекции. В настоящее время радикальная коррекция ТМА — операция артериального переключения у новорожденных — является «золотым» стандартом лечения таких пациентов [1, 2]. Операция предполагает создание неоаорты и не-олегочной артерии с реимплантацией КА. Тщательная и прецизионная реимплантация КА является ключевым фактором успеха оперативного вмешательства. Оригинальная операция артериального переключения была предложена хирургом Жатене из Сан-Пауло (Бразилия) в 1976 г. [3], применялся U-образный «на кнопках» метод реимплантации КА. Первая операция артериального переключения у новорожденных была выполнена Норвудом и Кастанедой в Детской больнице Бостона, она была крайне важна и показала, что радикальная хирургическая коррекция у новорожденных может быть проведена с замечательно низкой летальностью [4]. Однако хирургам пришлось столкнуться с изменением динамической анатомии корня аорты и легочной артерии после операции и, как следствие, коронарной недостаточностью, которая возникала в 5–7% случаев непосредственно, и в отдаленном периоде после операции [5–9]. Коронарная недостаточность у новорожденных приводила либо к летальному исходу, либо, в лучшем случае, к попыткам повторной реимплантации. Это заставило искать новые способы реимплантации, к которым относятся техника «люка» («trap door») [26] и «закрытая» методики [10]. Принципиальным отличием методов является этап коронарных анастомозов: при «открытых» методах (U-образный или «trap door») первым этапом формируются анастомозы КА с последующим формированием неоаорты. Суть «закрытого» метода — формирование первым этапом неоаорты с последующей реимплантацией КА.
Цель работы: представить результаты операции артериального переключения с использованием «модифицированной» закрытой методики реимплантации КА.
Материал и методы
За период с 2011 г. по декабрь 2016 г. нами выполнено 63 операции артериального переключения с использованием модифицированной закрытой методики реимплантации КА. Средний возраст на момент поступления составил 4,77+2,54 дня (1–20 суток). Средний к/день в специализированной кардиореанимации до операции составил 2,6+1,3 дня (от 1 до 14 суток), средний вес — 3,33+0,35 кг (от 2,3 до 4,1 кг). Всех пациентов мы разделили на 3 группы: 1-я группа — больные с простой ТМА
(n=49), 2-я группа — больные с ТМА и ДМЖП (n=11); у 3 больных с ТМА и ДМЖП (1 больной с множественным дефектом) имела место коарктация аорты с гипоплазией дуги (3-я группа). Изначально мы пользовались Лейденской классификацией анатомии КА [11], однако в процессе исследования была обнаружена закономерность, что единственным ограничением применения модифицированного «закрытого» метода реимплантации КА является интрамуральный ход КА, при котором требуются совершенно иные различные методики, описанные многими авторами (Планше, Якуб–Ридли–Смит и др.) [12–15].
Инфузию альпростана/вазопростана получали 58 больных (92% пациентов), баллонная атриосептосто-мия (процедура Рашкинда) [16] потребовалась 22 больным (34,9%), причиной проведения данной процедуры служила выраженная гипоксия/гипоксемия без эффективного управления с помощью искусственной вентиляции легких (ИВЛ) и инотропной поддержки. Двум больным в связи с развитием до операции НЭК 2-й степени оперативное вмешательство было отложено на срок 7 и 12 суток (до купирования явлений энтероколита), таблица 1.
Таблица 1
Характеристика пациентов
|
Показатели |
ТМА (n=49) |
ТМА+ДМЖП (n=11) |
ТМА+ДМЖП+обструкция дуги аорты (n=3) |
Всего (n=63) |
|
Возраст, поступление, сутки |
2,45+4,76 (1–20) |
14+15,16 (1–60) |
2,27+1,35 (1–5) |
4,77+5,36 |
|
К/день до операции, сутки |
2,67+1,47 (1–14) |
2,41+0,88 (1–7) |
1,35+0,82 (1–2) |
2,6+1,3 |
|
Средний вес, кг |
3,32+0,38 (2,3–4,1) |
3,38+0,25 (2,8–3,75) |
3,23+0,37 (3,048–3,38) |
3,33+0,35 |
|
Вазапростан, % |
97 |
63 |
100 |
92 |
|
Процедура Рашкинда, % |
38,77 |
27,2 |
0 |
34,9 |
|
Анатомия КА |
||||
|
– обычная, % |
– 100 |
– 100 |
– 100 |
– 100 |
|
– интрамуральный ход*, % |
– 0 |
– 0 |
– 0 |
– 0 |
|
НЭК, число случаев, (%) |
1 (2,04%) |
2 (18,18%) |
0 |
3 (4,76) |
Примечание: КА — коронарные артерии (обычная анатомия — любая анатомия кроме интрамурального хода), * — в нашем последовательном ряду пациентов интрамуральный ход КА не встречался.
Хирургическая техника. Доступ — стандартная срединная стернотомия. После вскрытия перикарда визуально оценивается анатомия аорты, легочной артерии, КА. После выделения артериального протока высоко, у места отхождения брахиоцефального ствола, канюлируется восходящая аорта артериальной канюлей размером 8–10 Fr. Раздельно канюлируются полые вены (канюлями 12 и 14 Fr), с началом искусственного кровообращения перевязывается и пересекается артериальный проток. Стандартно дренируется левый желудочек (ЛЖ) через правую верхнюю легочную вену. В настоящее время мы применяем нормотермию либо спонтанное охлаждение
(32–34 °С). После выделения легочной артерии пережимается аорта. В корень аорты вводится холодовая кровяная кардиоплегия по del Nido (повтор каждые 20 мин). Оценивается коронарная анатомия (обычная либо интрамуральный ход), при обычной коронарной анатомии мобилизуются устья КА на «кнопках» и сами КА на 5–7 мм. Длина мобилизованной артерии должна быть достаточной для реимплантации без натяжения, но не избыточной, чтобы не допустить перегибов КА. После пересечения легочной артерии и маневра Лекомпта в синусах легочной артерии (будущей неоаорты) выполняются разрезы острым скальпелем (рис. 1).
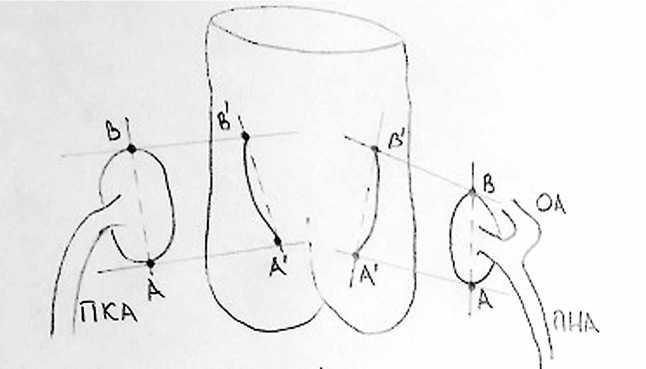
Рис. 1а

Рис. 1б
Рис. 1. Линии разрезов в синусах легочной артерии (а). При различных вариантах анатомии КА возможно иссечение участков соответствующих синусов неоаорты (б)
Классическая методика Бови предполагает выполнение косых разрезов примерно на 60° к линии фиброзного кольца. По нашему методу разрезы выполняются без строгого соответствия 60°, главное — примерить КА при отведенной дорсально неоаорте (ее новое анатомическое положение) и четко придерживаться единой осевой линии между линией разреза синуса неоаорты и оси КА (рис. 2).
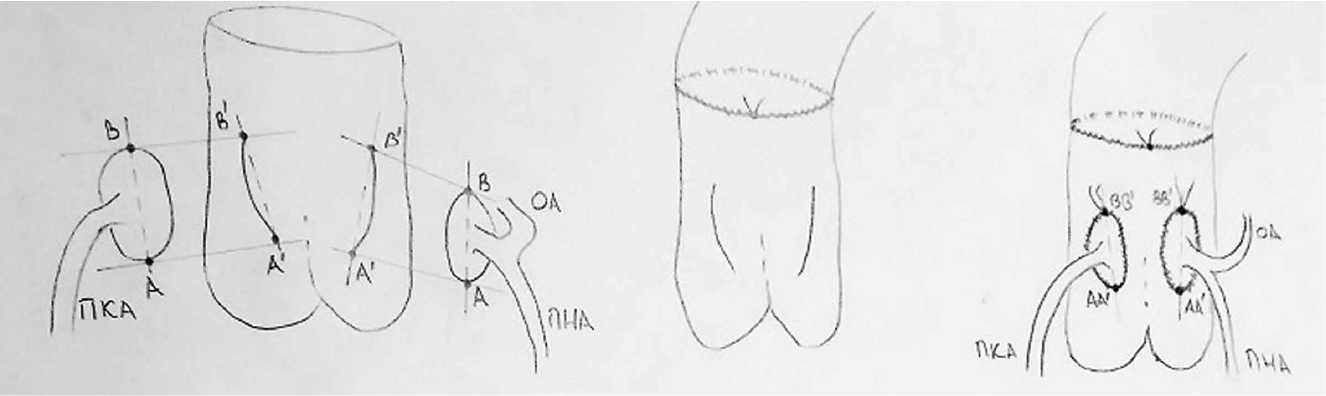
Рис. 2б
Рис. 2а
Рис. 2в
Рис. 2. Модифицированная закрытая методика реимплантации КА. Можно частично иссечь ткани синусов неоаорты. Главной задачей является сопоставление точек А — А ' и В — В ' и сопоставление осевых линий АВ — А ' В ' . При подобном четком сопоставлении вероятность перегиба артерии низка
Затем формируется неоаорта путем создания анастомоза между восходящей аортой и легочной артерией (рис. 3).
Рис. 3. Формирование неоарты путем создания циркулярного анастомоза дистальной восходящей аорты с проксимальной легочной артерией (используется непрерывный обвивной шов нитью пролен 7/0 либо 6/0)
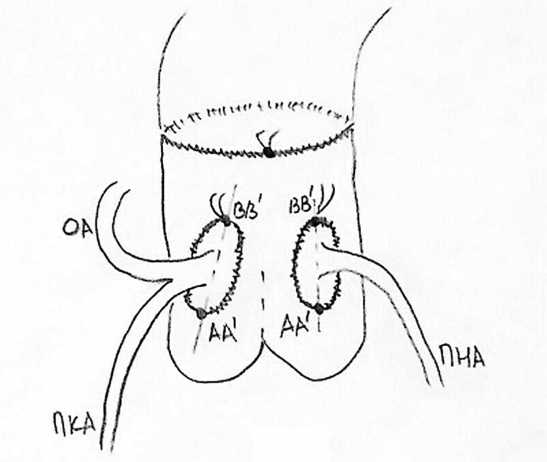
Рис. 4. Имплантация КА в синусы неоаорты (без снятия зажима с аорты) «на кнопках» (нитью пролен 7/0) по типу конец-в-бок. Как показано на рисунке, отсутствуют «слабые» места в циркулярном анастомозе, что характерно для «открытой» методики
Без снятия зажима с аорты КА «на кнопках» имплантируются в синусы неоаорты (нитью пролен 7/0) по типу конец-в-бок (рис. 4).
Дальнейшие этапы стандартны (из нативного аутоперикардиального лоскута формируется трапециевидная заплата, при помощи которой восполняется дефицит стенки неолегочной артерии в зоне иссеченных синусов, снимается зажим с аорты и формируется анастомоз легочного ствола с неолегочной артерией). Обязательно подшиваются 4 эпикардиальных электрода и устанавливается линия мониторинга давления в левом предсердии. Всем больным выполняется модифицированная ультрафильтрация (МУФ).
Сопутствующие ВПС (ДМЖП, аномалии дуги аорты) корригируются во всех случаях. Патология дуги аорты корригируется первым этапом, артериальная канюляция проводится через протез ПТФЕ 4 мм, который анастомозируется с брахиоцефальным стволом, используется умеренная (32–34 °С) гипотермия. Пластика ДМЖП выполняется после артериального переключения.
Результаты
В проспективное когортное исследование типа «слу-чай-контроль» вошли 63 последовательных пациента с транспозицией магистральных сосудов, которым выполнялась двухжелудочковая коррекция (артериальное переключение) с коррекцией всех сопутствующих внутрисердечных аномалий.
Статистическая обработка выполнялась с помощью программы SPSS 23.0 (StatSoft Inc.). Данные представлены в виде M±σ, где M — среднее значение, σ — стандартное отклонение. В скобках указаны минимальное и максимальное значения. Для описания интраоперационных количественных показателей, длительности ИВЛ и прерывания в кардиореанимации использовалась медиана и верхний и нижний квартили — Me (Q1; Q3).
Для оценки факторов, влияющих на летальность, использовалась множественная линейная регрессия. Для установления взаимосвязей между признаками использовался коэффициент корреляции Спирмена.
Медиана времени пережатия аорты (табл. 2) составила 50 мин (40; 71), медиана времени искусственного кровообращения составила 129 мин (117; 141). Синдром «тесного» средостения имел место у 26 больных (41,2%), что потребовало хирургического диастаза грудины и отсроченного сведения (в среднем, на 3-и сутки после операции, интервал 1–5 суток). Всем пациентам проводилась инотропная поддержка допмином, в среднем 208,512+117,74 ч (24–552 ч). 34 больным (56,9%) требовалась инотропная поддержка адреналином, длительность инфузии составила в среднем 189,84+89,76 ч (4–
408 ч). Медиана времени ИВЛ составила 6 суток (3; 13), медиана длительности пребывания в кардиореанимации составила 11 суток (7; 17). В 1-е сутки после операции у подавляющего большинства (95%) пациентов отмечалось снижение фракции выброса (ФВ) ЛЖ, в среднем ФВ составляла 48,27+5,32% (25–68%); на 5-е сутки ФВ восстанавливалась до нормальных значений у всех оставшихся в живых пациентов и составляла 63,84+3,7% (62–68%). У 6 больных (9,5%) был выявлен стеноз неолегочной артерии с пиковым градиентом 32–52 мм рт. ст.; в настоящее время все больные наблюдаются без признаков гипертрофии правого желудочка и необходимости повторного вмешательства. Следует отметить, что среди 24 последовательных пациентов за 2015–2016 гг. не было выявлено стеноза неолегочной артерии (у этих больных для трапециевидной заплаты применялся нативный аутоперикард; до 2015 г. применялся аутоперикард, обработанный глутаровым альдегидом). У 3 больных (4,9%) отмечались нарушения ритма (суправентрикулярная тахикардия), которые купировались консервативной терапией амиодароном.
Таблица 2
Результаты лечения пациентов
|
Показатели |
ТМС (n=49) |
ТМС+ДМЖП (n=11) |
ТМС+ДМЖП+обструкция дуги аорты (n=3) |
Всего (n=63) |
|
Среднее время пережатия аорты, мин |
51,67+14,43 (30–99) |
72,45+11,63 (48–90) |
84+18 (48–107) |
56,32+17,43 (32–107) |
|
Среднее время ИК, мин |
129,91+19,70 (73–385) |
142,45+13,95 (105–180) |
167+2,5 (162–171) |
132,85+20,40 (73–385) |
|
Допамин, часы |
208,08+120,48 (24–552) |
245,28+86,88 (96–504) |
207,84+31,92 (144–264) |
208,512+117,74 (24–552) |
|
Допамин + адреналин, число случаев, % |
24 (48,97) |
7 (63,63) |
3 (100) |
|
|
Отсроченное сведение, кол-во (%) |
21 (42,85) |
3 (27,27) |
2 (66,67) |
26 (41,2) |
|
ИВЛ, сутки |
8,32+6,04 (1–32) |
10,22+5,02 (2–23) |
7,66+1,66 (5–11) |
8,42+5,97 (1–26) |
|
Пребывание в АРО, сутки |
12,14+6,4 (1–36) |
16,33+4,86 (8–24) |
9,66+0,66 (9–11) |
14,04+8,71 (1–34) |
|
ФВ, % |
||||
|
– 1-е сутки, % |
– 48,67+5,40 |
– 47,66+2,53 |
– 48+5 (38–52) |
– 48,27+5,32 (25–68) |
|
– 5-е сутки, % |
– 63,68+3,89 |
– 65,22+1,26 |
– 65+5 (55–70) |
– 63,84+3,7 (62–68) |
|
Стеноз неолегочной артерии, кол-во (%) |
4 (8,1%) |
2 (18,18%) |
0 |
6 (9,5) |
|
Летальность, кол-во, % |
3 (6,1) |
2 (18,1) |
0 |
5 (7,93) |
Госпитальная летальность составила 7,9% (5 больных). В группе с простой ТМС летальность (табл. 5) составила 6,1% (3 больных на 49 операций), в группе больных с ДМЖП — 18,2% (2/11 пациентов). Среди больных с аномалией дуги аорты летальных исходов не было. Причинами летальности послужили полиорганная недостаточность на фоне дисфункции ЛЖ (2 больных) и сепсис на фоне НЭК (3 пациента).
Для оценки факторов, влияющих на летальность, использовалась модель множественной линейной регрессии. Множественная линейная регрессия показала прямую статистически значимую связь (F=15,6; р<0,0001) количества осложнений (и летального исхода) с временем ишемии и объемом кровопотери. Длительность ишемии миокарда (t=3,9; p<0,0001) оказывает более сильное влияние на количество послеоперационных осложнений, чем кровопотеря (t=2,6; p<0,05), таблица 3. Результаты регрессионного анализа можно дополнить расчетами корреляции Спирмена, представленными в таблице 4.
Таблица 3
Регрессионные коэффициенты
|
Нестандартизован-ные коэффициенты |
Стан- |
||
|
дартизо-ванные коэффи- |
Значи- |
||
|
Модель |
циенты |
t |
|
|
мость |
|||
Стан-
B дартная Бета ошибка
|
(Константа) |
–1,017 |
0,408 |
–2,492 |
0,015 |
|
|
Иш |
0,020 |
0,005 |
0,426 |
3,901 |
<0,0001 |
|
Кровопотеря, мл |
0,008 |
0,003 |
0,279 |
2,558 |
0,013 |
Таблица 4
Корреляционный анализ связи ишемии и кровопотери с количеством осложнений
|
Парные связи |
Коэффициент Спирмена |
р |
|
Ишемия vs кол-во осложнений |
0,525 |
<0,0001 |
|
Кровопотеря vs кол-во осложнений |
0,459 |
<0,0001 |
Сравнительная летальность при артериальном переключении различных мировых центров показывает достаточно высокий общий уровень выживаемости у этой сложной когорты пациентов (табл. 5).
Таблица 5
Летальность при простой ТМС различных мировых центров
|
Центр |
Годы наблюдения |
Количество больных, n |
Простая ТМС, % |
Летальность, % |
|
Sarris [17], 2006 |
1998–2000 |
613 |
70 |
3 |
|
Lalezari [18], 2011 |
1977–2007 |
332 |
60.8 |
11,4 |
|
Fricke [19], 2012 |
1983–2009 |
618 |
64 |
1,8 |
|
Khairy [20], 2013 |
1983–1999 |
400 |
59.5 |
6,5 |
|
Cain [21], 2014 |
2000–2011 |
70 |
100 |
1,4 |
|
Anderson [22], 2014 |
2003–2012 |
140 |
75 |
1,4 |
|
Ильин В.Н. [23], 2006 |
2000–2006 |
170 |
54,7 |
14 |
|
Краснодар, 2016 |
2011–2016 |
49 |
3 |
6,1 |
Обсуждение
Не подлежит сомнению, что операция артериального переключения на современном этапе развития детской кардиохирургии — операция выбора для пациентов с транспозицией магистральных сосудов при возможности 2-хжелудочковой коррекции. Летальность обусловлена в первую очередь исходной тяжестью пациентов и сопутствующей инфекционной патологией. В различных клиниках летальность составляет от 2% [19, 21, 22] до 6,4% [17, 20]. Правильная и прецизионная имплантация КА является основой успешного лечения этих сложных больных, поэтому поиск оптимального способа реимплантации продолжается хирургами многих клиник. Помимо коронарной ишемии, интраоперационная кровопотеря также является фактором риска летальности, осложненного течения послеоперационного периода (развития синдрома «капиллярной» протечки, полиор-ганной недостаточности, удлинения времени пребывания пациента в отделении реанимации). Предложенная E.L. Bove и соавт. [10] и модифицированная в нашей клинике «закрытая» методика реимплантации позволяет улучшить контроль кровотечения за счет уменьшения количества «слабых» мест аортального анастомоза. «Слабыми» местами при U-образном либо «trap door» анастомозах являются места завязывания нитей при создании корня неоаорты. Также формирование синотубулярного перехода неоаорты уменьшает риск развития аортальной недостаточности (W. Jhang) [24]. Анализируя данные литературы и собственные наблюдения, можно предположить, что закрытая методика и ее модификации уменьшают вероятность коронарной ишемии в послеоперационном периоде (ни одного случая на 63 больных). Реимплантация КА по закрытой методике возможна при любой коронарной анатомии, кроме интрамурального прохождения КА. Более того, наша модификация позволяет уменьшить время ишемии миокарда (нет этапа снятия зажима с аорты для наполнения неоаорты кровью) и, соответственно, уменьшить время искусственного кровообращения и всего вмешательства в целом.
T. Suzuki и соавт. [25] изменили стратегию реимплантации с открытой на закрытую, отметив при этом улучшение непосредственных результатов и уменьшение частоты возникновения осложнений со стороны КА.
Для дальнейшего улучшения результатов необходима более тщательная оценка состояния прочих систем и органов в дооперационном периоде, хотя в 2 случаях развитие НЭК у наших пациентов (послужившее причиной сепсиса и летального исхода) пришлось на терапевтическое окно (12–24 ч до операции).
Список литературы Результаты применения модифицированного "закрытого" метода реимплантации коронарных артерий при артериальном переключении
- Ричард А. Джонас. Хирургическое лечение врожденных пороков сердца, 1-е изд. -М.: ГЭОТАР. -2016.
- Mavroudis C. Pediatric Cardiac Surgery. -St. Louis: Mosby-Year Book, 2003. -227 p.
- Jatene A.D., Fontes V.F., Paulista P.P. et al. Anatomic correction of transposition of the great vessels//J. Thorac. Cardiovasc. Surg. -1976. -Vol. 72. -P. 364-370.
- Castaneda A.R., Norwood W.I., Jonas R.A. et al. Transposition of the great arteries and intact ventricular septum: anatomical repair in the neonate//Ann. Thorac. Surg. -1984. -Vol. 38. -P. 438-443.
- Raisky O., Bergoend E., Agnoletti G. et al. Late coronary artery lesions after neonatal arterial switch operation: results of surgical coronary revascularization//Eur. J. Cardiothorac. Surg. -2007. -Vol. 31. -P. 894-908.
- Legendre A., Losay J., Touchot-Kone A. et al. Coronary events after arterial switch operation for transposition of the great arteries//Circulation. -2003. -Vol. 108, Suppl. 1. -P. 1186-1190.
- Saini A.P., Wolfe L.T., Millington K.A. et al. Occult coronary ostial obstruction late after arterial switch operation//J. Card. Surg. -2013. -Vol. 28. -P. 308-311.
- Thrupp S.F., Gentles T.L., Kerr A.R., Finucane K. Arterial switch operation: early and late outcome for intramural coronary arteries//Ann. Thorac. Surg. -2012. -Vol. 94. -P. 2084-2090.
- Tweddell J.S., MD, Lantin-Hermoso M.R., MD, Wernovsky G., MD. D-Transposition of the Great Arteries the Current Era of the Arterial Switch Operation//JACC. -2014. -Vol. 64, No. 5. -P. 498-511.
- Bove E.L. Current technique of the arterial switch procedure for transposition of the great arteries//J. Card. Surg. -1989. -Vol. 4, No. 3. -P. 193-199.
- Gittenberger-deGroot A.C., Sauer U., Quaegebeur J. Aortic intramural coronary artery in three hearts with transposition of the great arteries//J. Thorac. Cardiovasc. Surg. -1986. -Vol. 9. -P. 566-571.
- Planche C., Bruniaux J., Lacour-Gayet F. et al. Switch operation for transposition of the great arteries in neonates. A study of 120 patients//Thorac. Cardiovasc. Surg. -1988. -Vol. 96. -P. 354-363.
- Yacoub M.H., Radley-Smith R. Anatomy of the coronary arteries in transposition of the great arteries and methods for their transfer in anatomical correction//Thorax. -1978. -Vol. 33. -P. 418-424.
- Li J., Tulloh R.M., Cook A. et al. Coronary arterial origins in transposition of the great arteries: factors that affect outcome. A morphological and clinical study//Heart. -2000. -Vol. 83. -P. 320-325.
- Asou T., Karl T.R., Pawade A. et al. Arterial switch: translocation of the intramural coronary artery//Ann. Thorac. Surg. -1994. -Vol. 57(2). -P. 461-465.


