Результаты применения PTFE-кондуитов в реконструкции магистральных вен брюшной полости при местнораспространенном раке поджелудочной железы
Автор: Восканян С.Э., Артемьев А.И., Найденов Е.В., Шабалин М.В., Забежинский Д.А., Колышев И.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Цель: изучение непосредственных и отдаленных результатов применения PTFE-кондуитов при реконструкции магистральных вен брюшной полости при радикальном хирургическом лечении местнораспространенного рака поджелудочной железы с их опухолевой инвазией. Материал и методы. 315 пациентам были выполнены панкреатодуоденальная резекция (ПДР) или панкреатодуоденэктомия с резекцией и пластикой магистральных вен брюшной полости. 143 пациентам выполняли протезирование магистральных вен при их реконструкции различными сосудистыми эксплантами. Пациенты были разделены на три группы. I (основная) включала 82 пациента, которым при реконструкции магистральных вен использовали PTFE-кондуиты. II группа состояла из 36 пациентов, которым при реконструкции магистральных вен использовали FLL-кондуиты. В III группу входили 25 пациентов, которым при реконструкции магистральных вен использовали аутовенозные кондуиты. В послеоперационном периоде проводили сравнение длительности операции и ее реконструктивного этапа, величины кровопотери, частоты тромбоза вен в ближайшем послеоперационном периоде и отдаленной проходимости реконструированных вен, прослеженной ультразвуковым методом в сроки 6 месяцев, 1, 2 и 3 года. Изучали общую частоту послеоперационных осложнений (ОЧО), частоту инфекционных осложнений, госпитальную летальность (ГЛ), средний послеоперационный койко-день(СПКД), а также медиану выживаемости. Результаты. Применение PTFE-кондуитов приводило к уменьшению длительности реконструктивного этапа операции, а также длительности операции и величины интраоперационной кровопотери. В I группе больных также отмечено уменьшение общей частоты послеоперационных осложнений, длительности послеоперационного койко-дня, госпитальной летальности по сравнению со II и III группами больных. Во II группе больных у 2 больных (5,5%) отмечены тромбозы сосудов после их реконструкции, которые привели к фатальному исходу. Отдаленная проходимость сосудистых PTFE-кондуитов и реконструированных вен в I группе составляла 100% во все исследованные сроки в послеоперационном периоде. Заключение. Применение PTFE-кондуитов при реконструкции магистральных вен брюшной полости позволяет снизить длительность как реконструктивного этапа, так и всей операции в целом. Применение PTFE-кондуитов способствует уменьшению частоты послеоперационных осложнений, частоты инфекционных осложнений, длительности послеоперационного койко-дня, госпитальной летальности, а также улучшению показателей проходимости реконструированных сосудов.
Fll-кондуиты, ptfe-кондуиты, аутовенозные протезы, опухолевая инвазия магистральных сосудов, рак поджелудочной железы
Короткий адрес: https://sciup.org/14918219
IDR: 14918219
Текст научной статьи Результаты применения PTFE-кондуитов в реконструкции магистральных вен брюшной полости при местнораспространенном раке поджелудочной железы
1 Введение. Одна из приоритетных задач здравоохранения — повышение эффективности хирургического лечения пациентов с онкологическими заболеваниями органов брюшной полости и малого таза.
Несмотря на совершенствование современных диагностических методов визуализации очаговых образований, иммунологического и генетического методов скрининга, частота местнораспространенного рака различной локализации у инкурабельных больных достигает 47,6% [1]. Заболеваемость местнораспространенными опухолями с инвазией магистральных сосудов брюшной полости не имеет тенденции к снижению, а результаты их лечения нельзя назвать в целом удовлетворительными [2, 3]. Необходимость обширной резекции магистральных сосудов практически всегда связана с их опухолевым поражением, однако в большинстве случаев высокая частота поражения магистральных сосудов в связи с местным распространением опухоли характеризуется весьма низкой резектабельностью [4, 5].
Данные обстоятельства в значительной мере обусловливают необходимость разработки хирургических подходов к оперативному лечению местнораспространенных опухолей брюшной полости и забрюшинного пространства с опухолевой инвазией магистральных сосудов, в то время как применение традиционных хирургических приемов при распространенных опухолях или невозможно, или не радикально, или является потенциально опасным в связи с высоким риском угрожающего жизни кровотечения [5–8].
Поражение магистральных сосудов брюшной полости при их опухолевой инвазии длительное время считалось противопоказанием к оперативному лечению, однако накопленный опыт и данные многочисленных исследований доказывают возможность и необходимость проведения комбинированных оперативных вмешательств с резекцией и одномоментной реконструкцией магистральных сосудов [9, 10], что ставит перед современной хирургией задачи поиска оптимального материала для реконструкции магистральных вен.
Цель: изучение непосредственных и отдаленных результатов применения PTFE-кондуитов при реконструкции магистральных вен брюшной полости при радикальном хирургическом лечении местнораспространенного рака поджелудочной железы с их опухолевой инвазией.
Материал и методы. В ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна ФМБА России были проопериро-
ваны 315 больных местнораспространенным раком поджелудочной железы с обширной опухолевой инвазией магистральных сосудов. Материал исследования составили 143 пациента, которым выполняли протезирование магистральных вен при их реконструкции различными сосудистыми эксплантами. Реконструкция магистральных сосудов выполнялась в случае образования неустранимого диастаза между дистальным и проксимальным концами сосуда после его резекции «en block» и, как следствие, невозможности выполнения концевой реконструкции сосуда.
Возраст пациентов варьировал от 30 до 73 лет.
Всем пациентам выполнены панкреатодуоденальная резекция (ПДР) или панкреатодуоденэкто-мия с резекцией и пластикой магистральных сосудов. Магистральными сосудами, пораженными опухолевым процессом и подвергнутыми резекции, являлись верхняя брыжеечная вена (ВБВ), воротная вена (ВВ), селезеночная вена (СВ), нижняя полая вена (НПВ), левая почечная вена (ЛПВ). 24 пациентам (25,2%) дополнительно выполнена свободная аутотрансплантация тонкой киши. 7 пациентам (7,4%) оперативное лечение дополнено аутотрансплантацией культи поджелудочной железы, 3 пациентам (3,2%) выполнена аутотрансплантация печени. При наличии нескольких основных стволов ВБВ выполнялась реконструкция всех стволов, а при необходимости резекции устья воротной вены или селезеночной вены производили восстановление кровотока по селезеночной вене (рис. 1).
В I группе (основной, 82 пациента) выполнялось прямое протезирование магистральных вен с использованием PTFE-кондуитов (политетрафторэтилен).
Во II группу вошли 36 пациентов, которым выполнялось протезирование магистральных вен с применением FLL-кондуитов (фторлонлавсан).
В III группу вошли 25 больных, которым в реконструкции магистральных сосудов использовали аутовенозное протезирование. Для аутовенозного протезирования применяли левую почечную вену, большую подкожную вену, нижнюю брыжеечную вену, селезеночную вену, яремную вену.
На рис. 1 представлен один из вариантов реконструкции магистральных вен мезентерико-порталь-ной системы.
Прогнозирование и профилактика развития острого послеоперационного панкреатита проводились по предложенным нами схемам [11, 12].
Во время оперативного вмешательства изучали сравнение длительности реконструктивного этапа и длительности операции, а также измеряли объем интраоперационной кровопотери.
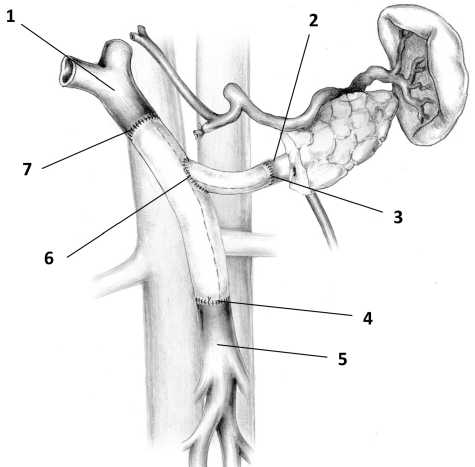
Рис. 1. Способ панкреатодуоденальной резекции при местнораспространенном раке периампулярной области с обширной опухолевой инвазией магистральных вен мезен-терико-портальной системы. 1 — воротная вена; 2 — селезеночная вена; 3 — анастомоз между селезеночной веной и синтетическим кондуитом; 4 — анастомоз между верхней брыжеечной веной и мезентерико-портальным протезом;
5 — верхняя брыжеечная вена; 6 — дистальный анастомоз между протезом селезеночной вены и мезентерико-пор-тальным протезом; 7 — анастомоз между воротной веной и мезентерико-портальным протезом
В послеоперационном периоде изучали общую частоту послеоперационных осложнений (ОЧО), частоту инфекционных осложнений, госпитальную летальность (ГЛ), средний послеоперационный койкодень (СПКД), медиану выживаемости.
Изучали частоту тромбоза вен в ближайшем послеоперационном периоде и отдаленную проходимость реконструированных вен, прослеженную ультразвуковым методом, в сроки 6 месяцев, 1, 2 и 3 года.
Для оценки статистически значимых различий между сравниваемыми группами использовали непараметрические критерии (U-критерий Манна — Уитни, критерий χ2), уровень статистической значимости принят как p<0,05 [13].
Результаты. Средняя длительность операции в I группе составила 280,4 (247,5–318,3) минуты, тогда как во II группе — 348,2 (332,4–424,8) минуты, а в III группе — 374,2 (357,3–437,8) минуты (таблица). Средняя длительность реконструктивного этапа в I группе составила 18,6 (15,2–22,4) минуты, во II группе — 18,2 (15,1–21,4) минуты, а в III группе — 36,7 (31,4–42,3) минуты (см. таблицу).
В III группе больных объем кровопотери во время операции составил 750 (670-840) мл, тогда как в I группе 550 (480-630) мл, а во II группе 580 (500-590) мл (см. таблицу).
Очо в I группе больных составила 18,3% и была статистически значимо ниже (p<0,05) по сравнению со II группой — 47,2% и III группой — 40,0% (см. таблицу).
В I и III группах пациентов не было выявлено инфекционных осложнений, связанных с инфицированием протеза, тогда как у 3 пациентов (8,3%) II группы развился сепсис, связанный с инфицированием FLL-кондуитов (p<0,05 по сравнению с I группой пациентов).
Послеоперационный койко-день в I группе составил 13,5 (11–18,5) койко-дня и был статистически значимо ниже (p<0,05) по сравнению со II группой больных — 20,0 (15,0–25,0) койко-дня и III группой больных — 18,0 (15,0–23,0) койко-дня.
Во II группе больных (реконструкция магистральных сосудов FLL-кондуитами) у 2 больных (5,5%) отмечены тромбозы сосудов после их реконструкции (см. таблицу), которые привели к фатальному исходу.
Госпитальная летальность в I группе пациентов составила 3,6%, что было статистически значимо (p<0,05) ниже по сравнению с II и III группами больных — 16,7 и 16,0% соответственно (см. таблицу).
Отдаленная проходимость сосудистых PTFE-кондуитов и реконструированных вен в I группе составляла 100% во все исследованные сроки в послеоперационном периоде. Во II группе больных отдаленная проходимость реконструированных вен составила в сроки 6 месяцев 88,9%, через 1 год 72,2%, через 2 года 69,4%, через 3 года 63,9% (p<0,05 по сравнению с I группой больных). В III группе пациентов отдаленная проходимость реконструированных вен аутовенозными протезами через 6 месяцев составила 100%, через 1 год 97,2% (у 1 больного выявлен тромбоз аутовенозного кондуита вследствие его сдавления извне локорегионарным рецидивом опухоли), через 2 года 84%, через 3 года 76% (p<0,05 по сравнению с I группой больных) (рис. 2).
Медиана выживаемости в I группе составила 13 месяцев, во II группе 11,5 месяца, в III группе 11 месяцев и была статистически значимо (p<0,05) выше, чем у больных местнораспространенным раком головки поджелудочной железы, которым радикальное хирургическое лечение не производилось (2 месяца).
Обсуждение. Рост числа местнораспространенных опухолей с инвазией в магистральные сосуды брюшной полости ставит перед современной хирургией задачи поиска оптимального материала для реконструкции магистральных вен [14]. В качестве пластического материала для реконструкции магистральных вен возможно использование различных сосудистых протезов, однако их использование огра-
Результаты применения различных сосудистых эксплантов в хирургии местнораспространенного рака органов брюшной полости и забрюшинного пространства
|
Группа пациентов |
Средняя длительность операции, мин |
Величина интраоперационной кровопотери, мл |
Тромбозы кондуитов и вен, % |
ОЧО, % |
ГЛ, % |
|
I |
280,4 (247,5–318,3) |
550 (480-630) |
0* |
18,3*^ |
3,6*^ |
|
II |
348,2 (332,4–424,8) |
580 (500-590) |
5,5 |
47,2 |
16,7 |
|
III |
374,2 (357,3–437,8) |
750 (670-840) |
0* |
40,0 |
16,0 |
П р и м еч а н и е : ОЧПО — общая частота осложнений; ГЛ — госпитальная летальность, * — различия статистически значимы (p<0,05) по сравнению со II группой больных (критерий χ2); ^ — различия статистически значимы (p<0,05) по сравнению с III группой больных (критерий χ2).
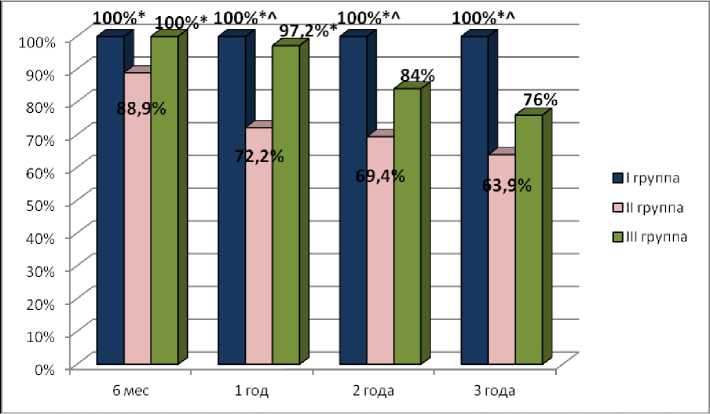
Рис. 2. Отдаленная проходимость сосудистых кондуитов и реконструированных вен: * — различия статистически значимы (p<0,05) по сравнению со II группой больных (критерий χ2); ^ — различия статистически значимы (p<0,05) по сравнению с III группой больных (критерий χ2)
ничено ввиду различных факторов и, особенно, повышенной склонности к тромбированию. Наиболее перспективным при реконструкции магистральных вен является применение протезов из политетрафторэтилена (PTFE) в связи с нулевой хирургической и высокой биологической порозностью, устойчивостью к инфицированию, тромборезистентностью, биологической инертностью [15, 16].
В нашем исследовании проведена оценка применения сосудистых кондуитов из политретрафторэти-лена (PTFE), фторлонлавсана (FLL), а также аутовенозных протезов в реконструкции сосудов после их резекции «en block» при радикальном хирургическом лечении местнораспространенного рака поджелудочной железы с опухолевой инвазией магистральных вен брюшной полости. Во всех случаях сосудистая реконструкция использована при невозможности выполнения концевой ангиопластики.
В результате исследования установлено, что применение PTFE-кондуитов в качестве пластического материала в реконструкции магистральных вен брюшной полости привело к уменьшению длительности как реконструктивного этапа, так и операции в целом, а также к уменьшению интраоперационной кровопотери. В группе больных, которым в реконструкции магистральных вен брюшной полости применяли PTFE-кондуиты, отмечено значительное уменьшение частоты послеоперационных осложнений и послеоперационной летальности.
Кроме того, при реконструкции магистральных вен брюшной полости PTFE-кондуитами ни в одном случае не наблюдалось инфицирования протезов, что подтверждало безопасность использования протезов из политетрафторэтилена при сосудистой реконструкции.
При изучении отдаленной проходимости сосудистых протезов выявлена удовлетворительная проходимость эксплантов из политетрафторэтилена во все сроки исследования.
Высокая степень тромбоза реконструированных вен, а также высокая частота послеоперационных осложнений и инфекционных осложнений (развитие сепсиса, связанного с инфицированием FLL-кондуита) привели нас к полному отказу от использования FLL-кондуитов при реконструкции и пластике магистральных вен брюшной полости после их резекции.
Результаты исследования позволяют рекомендовать использование PTFE-кондуитов при реконструкции магистральных сосудов брюшной полости при их опухолевой инвазии.
Заключение. PTFE-кондуиты являются универсальным пластическим материалом; применение их при реконструкции магистральных вен брюшной полости позволяет уменьшить длительность реконструктивного сосудистого этапа, а также всей операции в целом.
Использование PTFE-кондуитов дает возможность снизить частоту послеоперационных осложнений, частоту инфекционных осложнений, а также добиться положительных показателей ранней и отдаленной проходимости реконструированных вен в сравнении с FLL-кондуитами и при использовании аутовенозных кондуитов.
Список литературы Результаты применения PTFE-кондуитов в реконструкции магистральных вен брюшной полости при местнораспространенном раке поджелудочной железы
- Патютко Ю.И., Котельников А.Г. Рак поджелудочной железы: диагностика и хирургическое лечение на современном этапе. Анналы хирургической гепатологии 1998; 3: 96-111
- Martin RCG, Scoggins CR, Egnatashvili V, et al. Arterial and venous resection for pancreatic adenocarcinoma. Arch Surg 2009; 144(2): 154-157
- Sugiura Y, Horio T, Aiko S, et al. Pancreatectomy for pancreatic cancer with reference to combined resection of the vessels, twenty nine year experience by a single surgeon. Keio J Med2009;58: 103-109
- Henne-Bruns D, Vogel I. Does the extent of lymphadenectomy have impact on the prognosis of patients with pancreatic cancer? Onkologie 2008; 25 (1): 69-71
- Cohen L, Batavia IL, Hendrickson FR, et al. Treatment of pancreatic cancer with neutrons and chemotherapy. Radiology 1995; 197 (8): 263
- Heстеренко Ю.А., Приказчиков А.В. Современные тенденции хирургического лечения больных раком поджелудочной железы. Анналы хирургической гепатологии 1999; 4 (2): 13-22
- Bianco F, Sassaroli C, Delrio P, et al. Vascular resection in pancreaticoduodenectomy: is it worthwhile? Curr Drug Targets 2014; 6 (13): 772-80
- Schramm H, Theilig K, Schmidt S, Arnold F. Late results after operative treatment of biliopancreatic cancer. Zentralbl Chir 2003; 128 (5): 401-05
- Riediger H, Makowiec F, Fischer E, et al. Postoperative morbidity and long-term survival after pancreaticoduodenectomy with superior mesenterico-portal vein resection. J Gastrointest Surg2006; 10(8): 1106-15
- Sgroi MD, Narayan RR, Lane JS, et al. Vascular reconstruction plays an important role in the treatment of pancreatic adenocarcinoma. J Vase Surg 2015; 61 (2): 475-80
- Восканян С.Э., Корсаков И.Н., Найденов Е.В. Профилактика острого послеоперационного панкреатита в хирургии рака поджелудочной железы. Анналы хирургической гепатологии 2013; 18 (2): 95-102
- Восканян С.Э., Котенко К.В., Корсаков И.Н., Найденов Е.В. Прогнозирование развития острого панкреатита как осложнения после оперативных вмешательств на поджелудочной железе. Экспериментальная и клиническая гастроэнтерология 2014; 109 (9): 61-68
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера, 2002; 312 с.
- Кубышкин В.A., Вишневский В.А. Рак поджелудочной железы. М.: ИД Мед-практика, 2003; 386 с.
- Лебедев Л.В., Плоткин Л.Л., Смирнов А.Д. и др. Протезы кровеносных сосудов. СПб.: ИД «Адмиралтейство», 2001; 292 с.
- Dorrucci V, Grisseli F, Petralia G, etal. Heparin-bonded expanded polytetrafluoroethylene grafts for infragenicular bypass in patients with critical limb ischemia: 2-year results. J Cardiovasc Surg (Torino) 2008; 49 (2): 145-149.


