Результаты проспективного одноцентрового рандомизированого исследования роли неоадъювантной химиотерапии в комбинированном лечении больных III стадией рака ободочной кишки (Node-Rads 3–5 баллов)
Автор: Данилова М.А., Семёнов Н.Н., Данилов М.А., Леонтьев А.В., Саакян Г.Г., Алиев В.А., Феоктистова П.С., Цвиркун В.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования. Вопросы онкохирургии
Статья в выпуске: 3 т.15, 2025 года.
Бесплатный доступ
Цель исследования: Оценить влияние неоадьювантной химиотерапии (НеоАХТ) на результаты лечения III стадии рака ободочной кишки (Node-Rads 3–5). Материалы и методы: В проспективное одноцентровое рандомизированное исследование в МКНЦ им. А. С. Логинова ДЗМ включено 108 пациентов, разделенных на две группы: группа НеоАХТ (n = 54) и группа первичной хирургии (n = 54). В группе НеоАХТ проводили лечение по схемам CapOX (4 курса) или FOLFOX6 (6 курсов) с последующим оперативным вмешательством. Оценивались непосредственные результаты хирургического вмешательства (длительность операции, интраоперационная кровопотеря, частота конверсии, частота послеоперационных осложнений по Clavien-Dindo, количество койко-дней), результаты морфологического исследования, токсичность и завершенность проведенного химиотерапевтического этапа лечения. Результаты: НеоАХТ не оказала негативного влияния на хирургические исходы: медиана длительности операции составила 180 минут, медиана послеоперационного койко / дня — 8,7, интраоперационная кровопотеря — 50–100 мл в обеих группах. В группе НеоАХТ выявлено значимое увеличение частоты конверсии из лапароскопии в лапаротомию (p = 0,046). Частота послеоперационных осложнений 3a-b по Clavien-Dindo — 4,2 и 3,8 % соответственно (р = 1). При сравнении клинической и патоморфологической стадии опухоли после НеоАХТ отмечено значимое увеличение частоты выявления pN0 (p < 0,001), уменьшение частоты выявления лимфоваскулярной инвазии (p < 0,001), выраженное уменьшение частоты выявления pT4b (р = 0,053), pN2 (р = 0,06). Частота назначения адъювантной химиотерапии в группе НеоАХТ была значительно ниже: 44,7 % пациентов получали АХТ 6 месяца против 66,7 %, пациентов в группе первичной хирургии, p = 0,029). Заключение: НеоАХТ не увеличивает частоту хирургических осложнений, но способствует снижению стадии и, как следствие, сокращению объёма адъювантной химиотерапии. Включение в исследование пациентов 4–5 баллов по Node-RADS позволяет снизить риск завышения стадии при отборе на неоадъювантную терапию с 25–33 % до 8 %.
Рак ободочной кишки, III стадия, неоадъювантная химиотерапия, адъювантная химиотерапия, хирургическое лечение, Node-RADS
Короткий адрес: https://sciup.org/140312605
IDR: 140312605 | DOI: 10.18027/2224-5057-2025-049
Текст научной статьи Результаты проспективного одноцентрового рандомизированого исследования роли неоадъювантной химиотерапии в комбинированном лечении больных III стадией рака ободочной кишки (Node-Rads 3–5 баллов)
Золотым стандартом лечения больных раком ободочной кишки III стадии является хирургическое вмешательство с последующим проведением адъювантной химиотерапии (АХТ). Характер и длительность АХТ варьирует в зависимости от биологии опухоли, прогностически неблагоприятных факторов и стадии заболевания, продолжаясь от 3 до 6 месяцев [1]. Рандомизированные исследования, такие как FOxTROT, OPTICAL и др., посвященные неоадъювантной химиотерапии (НеоАХТ) рака ободочной кишки II и III стадии доказали безопасность НеоАХТ, а также достоверное снижение стадии первичной опухоли [2–5]. В мета-анализе, посвященном НеоАХТ локализованного рака ободочной кишки, Davey M. G. и соавт. (2023 г.) отметили улучшение показателей безрецидивной и общей выживаемости [6]. Однако во всех приведенных исследованиях указывают на невысокую диагностическую точность компьютерной томографии (КТ) в предоперационном стадировании, что может приводить к значимому проценту перелечивания пациентов при назначении Нео-АХТ. В исследовании PRODIGE 22 в контрольной группе выявлено завышение стадии в 33 % случаев, FOxTROT — 25 % [7, 2]. При изучении специфичности КТ в определении N-статуса опухоли последняя достигала лишь 53 –62 % [8,9]. Ранее применение системы Node-RADS для оценки лимфатических узлов показало повышение специфичности КТ при раке мочевого пузыря, легких, предстательной железы [10–13]. При колоректальном раке нами проведено исследование у 75 пациентов с диагнозом рак ободочной кишки, которое продемонстрировало повышение достоверности диагностики N-статуса до 90 %, что позволяет с большей точностью отбирать пациентов для НеоАХТ [14].
Цель исследования: оценить влияние неоАХТ на результаты хирургического лечения больных III стадией рака ободочной кишки (Node- Rads 3 –5).
МАТЕРИАЛЫ И МЕТОДЫ
Проведенное проспективное одноцентровое рандомизированное исследование одобрено локальным этическим комитетом Московского Клинического Научнопрактического Центра им. А.С. Логинова Департамента Здравоохранения Москвы от 10.10.2022 г., протокол №11, согласно которому пациенты подписывали информированное согласие перед включением в исследование.
Критерии включения:
-
• возраст от 18 лет;
-
• морфологически верифицированная аденокарцинома ободочной кишки и ректосигмоидного отдела толстой кишки;
-
• отсутствие отдаленного метастазирования;
-
• оценка по шкале ECOG 0 –2;
-
• оценка по шкале Node- RADS 3 –5 баллов;
-
• нормальные показатели формулы крови (лейкоциты ≥ 4 × 10 9 /л, нейтрофилы ≥ 1,5 × 10 9 /л, тромбоциты ≥ 100 × 10 9 /л, гемоглобин ≥ 10 г/дл);
-
• нормальные биохимические показатели (общий билирубин < 21 мкмоль / л, АСТ < 40 Ед / л, АЛТ < 41 Ед/л, ЩФ < 150 Ед / л, клиренс креатинина > 60 мл / мин);
-
• согласие на адекватные меры контрацепции у женщин детородного возраста;
-
• отсутствие признаков беременности при тест-анализе мочи.
Критерии исключения:
-
• отдаленное метастазирование;
-
• наличие сопутствующих заболеваний, препятствующих проведению химиотерапии и выполнению операции
-
• отказ пациента от участия в исследовании.
Пациенты с признаками кишечной непроходимости допускались к участию в исследовании после формирования превентивной стомы или стентирования стенозированной опухолью кишки.
Всем пациентам выполняли КТ грудной клетки, брюшной полости и малого таза с внутривенным болюсным контрастированием, МРТ малого таза при локализации опухоли в области ректосигмоидного отдела толстой кишки для исключения распространения опухоли на прямую кишку, оценку соматического статуса пациента при помощи дополнительных инструментальных методов диагностики и оценку анестезиологического риска по шкале ASA. Определение молекулярных маркеров (MSI,
KRAS,NRAS,BRAF,HER2)не являлось обязательным для включения пациента в исследование.
ДИЗАЙН ИССЛЕДОВАНИЯ
Пациентов, соответствующих критериям включения, рандомизировали на две группы в соотношении 1:1 методом простой рандомизации: группа неоадъювантной химиотерапии и группа первичной хирургии (рис. 1).
В группе неоадъювантной химиотерапии проведено лечение по схеме CapOX 4 курса или FOLFOX6 –6 курсов. После проведения терапии выполняли КТ грудной клетки, брюшной полости и малого таза с контрастированием с последующим оперативным вмешательством при отсутствии признаков прогрессирования и отдаленного метастазирования. По результатам оперативного вмешательства определяли стадию заболевания в соответствии с результатами патоморфологического исследования, оценивали регресс опухоли по шкале Ryan. После оперативного вмешательства АХТ продолжали по прежней схеме на три месяца в случае выявления рN2 или pT4b.
В группе первичной хирургии первым этапом лечения выполнялось хирургическое вмешательство с последующим изучением операционного материала и определением дальнейшей тактики лечения. При II стадии и отсутствии признаков неблагоприятного прогноза пациенты направлялись на динамическое наблюдение. При II стадии высокого риска химиотерапия назначалась на 3 месяца в режиме
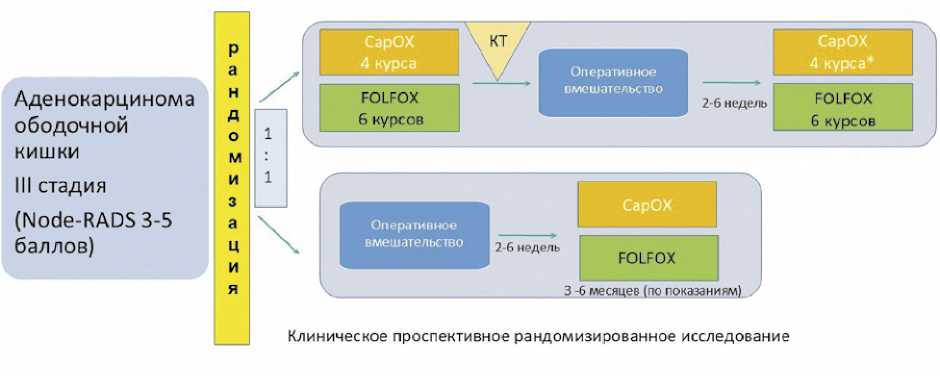
Рисунок 1. Дизайн исследования
Figure 1. Study design
-
1 CapOX (оксалиплатин 130 мг /м 2 , день 1, капецитабин 2000 мг /м 2 / день, внутрь, дни 1–14, начало очередного курса на
21-й день), 4 курса.
-
2 FOLFOX (оксалиплатин 85 мг /м 2 в виде 2-часовой инфузии в 1-й день, кальция фолинат 400 мг /м 2 , в течение 2 ч с последующим болюсным введением фторурацила, 400 мг /м 2 в / в, струйно, 46-часовая инфузия фторурацила 2400 мг /м 2 (по 1200 мг /м 2 в сутки.
Начало очередного курса на 15-й день), 6 курсов.
CapOX либо на 6 месяцев в режиме FOLFOX. При III стадии благоприятного прогноза (pN1) адъювантная химиотерапия назначалась по схеме CapOX в течение 3 месяцев или по схеме FOLFOX в течение 6 месяцев. При III стадии неблагоприятного прогноза химиотерапия назначалась на 6 месяцев по любой из схем.
В послеоперационном периоде оценивали интраоперационные показатели (длительность операции, объем кровопотери, необходимость выполнения комбинированной резекции, частота конверсии), а также показатели раннего послеоперационного периода: послеоперационные осложнения, длительность койко-дня.
/■
256 пациентов оценено на соответствие критериям

108 пациентов включены в исследование и рандомизированы 1:1
f
Первичная хирургия n = 54
J
Операция выполнена 54 пациентам (100%)
НеоАХТ n = 54
Операция выполнена 47 пациентам (87%)
Операция не выполнена 7 пациентам (13%)
J
|
Оценка |
Оценка |
|
|
хирурги- |
хирурги- |
|
|
ческих |
ческих |
|
|
исходов — |
исходов — |
|
|
PP 1 |
PP 1 |
|
-
• 2 (5 %) — прогрессирование;
-
• 2 (4 %) — токсичность (ECOG 3–4);
-
• 2 (4 %) — смерть до операции от других причин
\
J
\
Оценка побочных эффектов ХТ — ITT 2
Оценка побочных эффектов ХТ — ITT 2
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Мощность исследования была рассчитана на основании данных, полученных в предыдущем исследовании [14], в котором специфичность стандартной компьютерной томографии при стадировании рака ободочной кишки составила 48 % в МКНЦ им. А. С. Логинова. После внедрения системы Node-RADS (порог 3–5баллов)специфичность повысилась до 75%.Для выявления данной разницы при уровне значимости 0,05 и мощности 80 % в каждую из сравниваемых групп было включено не менее 50 пациентов.
Основной анализ хирургических и послеоперационных показателей проводился по принципу per-protocol (PP), включающему только прооперированных пациентов (n = 10 1). Оценка побочных эффектов и общих исходов проводилась по принципу intention-to-treat (ITT), включая всех рандомизированных пациентов (n = 108).
Статистический анализ проводили с использованием программы StatTech v. 4.7.2 (разработчик — ООО «Стат-тех», Россия). Сравнение двух групп по количественным показателям выполняли с помощью t-критерия Стьюдента и с помощью U-критерия Манна-Уитни.Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполняли с помощью критерия хи-квадрат Пирсона, точного критерия Фишера.В качестве количественной меры эффекта при сравнении относительных показателей рассчитывалось отношение шансов с 95 % доверительным интервалом (ОШ; 95 % ДИ). Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Набор пациентов осуществляли в период с ноября 2022 г. по май 2024 г. В исследование включено 108 пациентов. Диаграмма потока пациентов (flow-chart) в исследовании представлена на рисунке 2.
В таблице 1 представлена характеристика ряда параметров пациентов в исследуемых группах.
После проведения неоадъювантной химиотерапии 7 пациентов (13%) не были оперированы. У 3 отмечено прогрессирование заболевания, 2 умерли в связи с сопутствующими заболеваниями в процессе НеоАХТ, у 2 пациентов после проведенной НеоАХТ отмечены нежелательные явления 4 ст. (кардиотоксичность и нейротоксичность со снижением статуса до ECOG 4).
Хирургические результаты (группа per protocol)
Оперативное вмешательство выполнено 10 1 пациенту. Медиана длительности операции в каждой из групп составила 180 мин, интраоперационная кровопотеря составила от 50 до 100 мл, частота комбинированных резекций не отличалась в каждой из групп.Статистически значимые различия выявлены в частоте конверсии в группе НеоАХТ, p = 0,046 (табл. 2).
Таблица 1. Характеристика пациентов
Table 1. Characteristics ofpatients
|
Показатели |
Категории |
Первичная хирургия, n = 54, n ( ) |
НеоАХТ, n = 54, N ( ) |
|
Пол |
Женский |
24 (44) |
26 (48) |
|
Мужской |
30 (56) |
28 (52) |
|
|
ECOG |
0 |
22 (41) |
9 (17) |
|
1 |
28 (52) |
39 (72) |
|
|
2 |
4 (7) |
6 (11) |
|
|
Локализация |
Слепая |
7 (13) |
6 (11) |
|
Восходящая |
10 (19) |
8 (15) |
|
|
Правый изгиб |
4 (7) |
4 (7) |
|
|
Поперечная ободочная |
4 (7) |
5 (9) |
|
|
Левый изгиб |
4 (7) |
3 (6) |
|
|
Нисходящая |
3 (6) |
4 (7) |
|
|
Сигмовидная |
15 (28) |
17 (32) |
|
|
Ректосигмоидный отдел |
7 (13) |
7 (13) |
|
|
cT |
2 |
1 (2) |
5 (9) |
|
3 |
44 (81) |
32 (59) |
|
|
4a |
2 (4) |
8 (15) |
|
|
4b |
7 (13) |
9 (17) |
|
|
cN |
1 |
42 (78) |
36 (67) |
|
2 |
12 (22) |
18 (33) |
|
|
Node-Rads |
3 |
13 (24) |
13 (24) |
|
4 |
25 (46) |
31 (57) |
|
|
5 |
16 (30) |
10 (19) |
|
|
Непроходи- |
Нет |
40 (74) |
42 (78) |
|
мость |
Стома/стент |
14 (26) |
12 (22) |
Таблица 2. Интраоперационные показатели
Table 2. Intraoperative parameters
|
Показатели |
Первичная хирургия (n = 54) |
Неоадъювантная х/т (n = 47) |
р |
|
Длительность операции (мин), Me [IQR] |
180,0 [155,0; 215,0] |
180,0 [135,0; 233,0] |
0,500 |
|
Интраоперационная кровопотеря (мл), Me [IQR] |
100,0 [50,0; 100,0] |
50,0 [50,0; 100,0] |
0,562 |
|
Комбинированная резекция абс. (%) |
13 (24,1 %) |
9 (19,1 %) |
0,550 |
|
Конверсия, абс. (%) |
10 (18,5 %) |
17 (36,2%) |
0,046 |
Таблица 3. Причины конверсии хирургического доступа в группах
Table 3. Reasonsfor conversion of surgical access ingroups
|
Причина конверсии |
Первичная хирургия, n = 10 |
НеоАХТ, n = 17 |
|
Комбинированная резекция |
5 |
6 |
|
Фиброз, затрудняющий визуализацию |
1 |
8 |
|
Кровотечение |
1 |
1 |
|
Интраоперационные анестезиологические риски |
3 |
2 |
Таблица 4. Сравнительная характеристика показателей раннего послеоперационного периода
Table 4. Comparative characteristics of the early postoperative period indicators
|
Показатели |
Категории |
Первичная хирургия (n = 54), n ( ) |
НеоХТ (n = 47), n ( ) |
р |
|
Ранние после- |
Отсутствие |
48 (88,9) |
44 (93,6) |
0,498 |
|
операционные осложнения, абс. (%) |
Наличие |
6 (11,1) |
3 (6,4) |
|
|
Тип осложне- |
Гемотрансфузия |
1 (1,9) |
0 (0,0) |
0,253 |
|
ния, абс. (%) |
Инфицирование раны |
0 (0,0) |
1 (2,1) |
|
|
Кровотечение |
0 (0,0) |
2 (4,2) |
||
|
Непроходимость |
1 (1,9) |
0 (0,0) |
||
|
Несостоятельность анастомоза |
1 (1,9) |
0 (0,0) |
||
|
Несостоя тельность шва мочевого пузыря |
1 (1,9) |
0 (0,0) |
||
|
Панкреатит |
1 (1,9) |
0 (0,0) |
||
|
Клостридиальный колит |
1 (1,9) |
0 (0,0) |
||
|
Классификация |
3a |
1 (1,9) |
1 (2,1) |
1 |
|
Clavien-Dindo, абс. (%) |
3b |
1 (1,9) |
1 (2,1) |
|
|
Длительность госпитализации (койкодни), Me [IQR] |
8,00 [7,25; 10,00] |
8,00 [7,00; 9,50] |
0,330 |
Причины конверсии доступа представлены в таблице 3.
Обращает на себя внимание частота конверсии доступа в группе НеоАХТ из-за фиброза, возникшего, вероятнее всего, на фоне проводимой химиотерапии. У 7 из 8 пациен- тов данной группы при изучении операционного материала отмечен лечебный патоморфоз по Ryan TRG 2.
Показатели раннего послеоперационного периода не имели статистически значимых различий (табл. 4).
Результаты патоморфологического исследования
У 28 пациентов (60,9 %) после проведенной НеоАХТ отмечен лечебный патоморфоз по Ryan 2 степени. Проведен сравнительный анализ патоморфологической стадии T (pT), стадии N (pN), наличия лимфоваскулярной инвазии (LV), периневральной инвазии (Pn) в зависимости от проведения НеоАХТ (табл. 5).
Таблица 5. Анализ pT, pN, LV, Pn в зависимости от неоадъювантной химиотерапии
Table 5. Analysis ofpT, pN, LV, Pn depending on neoadjuvant chemotherapy
Таблица 6. Длительность химиотерапии в группах при различных стадиях
Table 6. Duration of chemotherapy ingroups at different stages
|
Пато-морфологи- |
Первичная хирургия, n = 54, n ( ) |
АХТ (0/3/6 мес.) |
Нео-АХТ, n = 47, n ( ) |
АХТ (0/3 мес.) |
|
|
ческая стадия |
Категория риска |
||||
|
I стадия |
0 |
0 |
6 |
6/0 |
|
|
II стадия |
Без факторов риска |
0 |
0 |
12 |
9/3 |
|
С факторами риска 1 |
8 |
0/4/4 |
9 |
4/5 |
|
|
III стадия |
Благоприятный прогноз 2 |
29 |
1/11/17 |
9 |
6/3 |
|
Неблагоприятный прогноз 3 |
17 |
1/1/15 |
11 |
1/10 |
|
1 pT4N0M0 /LV / Pn;
2 pT1–3N1M0;
3 T4N1M0 или pT1–4N2M0.
Таблица 7. Сравнение длительности химиотерапии между группами в режиме CapOX
Table 7. Comparison of chemotherapy duration between groups in the CapOX regimen
|
CapOX |
Первичная хирургия, n = 40 |
НеоАХТ, n = 39 |
р |
|
6 месяцев |
25 (62,5%) |
11 (28,2%) |
0,004 |
Значимые различия выявлены по частоте поражения регионарных лимфатических узлов: отсутствие метастазов в л/у (pN0) наблюдалось значительно чаще у пациентов после НеоАХТ (59,6 % против 14,8 %, p < 0,001), при снижении доли pN1 (25,5 % против 53,7 %, p = 0,004). Также отмечена выраженная тенденция к уменьшению частоты выявления pN2 (p = 0,06) и pT4b (р = 0,053), что позволяло избежать проведения адъювантной химиотерапии у пациентов, получивших НеоАХТ. У пациентов после НеоАХТ достоверно реже отмечалось выявление лимфоваскулярной инвазии (42,6 % против 87,0 %, p < 0,001).
В таблице 6 представлено распределение пациентов по патоморфологической стадии, категории прогностического риска, а также характеру и длительности проводимой адъювантной химиотерапии (АХТ) в группах первичной хирургии и НеоАХТ.
Таким образом, в группе первичной хирургии адъювантная химиотерапия в течение 6 месяцев проводилась 36 (66,7 %) пациентам, а в группе НеоАХТ — 21 (44,7 %), p = 0,029. С учетом того, что химиотерапия в режиме FOLFOX проводится 6 месяцев (12 курсов) независимо от стадии заболевания (II или III стадия), нами оценена отдельно группа пациентов, которым проводилась периоперационная химиотерапия в режиме CapOX (табл. 7).
Это подтверждает, что применение неоадъювантной химиотерапии позволило сократить общую длительность лечения при сохранении онкологической настороженности в отношении пациентов высокого риска.
Для оценки точности компьютерной томографии при отборе пациентов в исследование нами была проанализирована контрольная группа пациентов, которым первым этапом выполнялось оперативное вмешательство. Как представлено в таблице 8, наименьшая частота метастатического поражения лимфатических узлов (pN+) была зарегистрирована среди пациентов с баллом Node-RADS 3: у 9 из 13 пациентов (69,2 %) было подтверждено наличие метастазов, в то время как у 4 пациентов (30,8%) гистологически поражение не было выявлено.
Суммарно, среди всех включённых пациентов с баллами 3 –5, лимфоузлы не были поражены у 8 человек (14,8%). Это означает,что потенциальный риск избыточного назначения неоадъювантной химиотерапии имел место только
Таблица 8. Сравнение оценки лимфатических узлов по Node-RADS с данными патоморфологического исследования
Table 8. Comparison of lymph node assessment according to Node-RADS with pathological examination data
ТОКСИЧНОСТЬ ХИМИОТЕРАПИИ
При оценке токсичности химиотерапии использовался анализ с включением всех рандомизированных пациентов (n = 108). В таблице 9 представлены результаты проведенного анализа.
Проведенный анализ продемонстировал, что нео-/адъювантная химиотерапия не сопровождалась увеличением общей токсичности по сравнению с адъювантной схемой лечения. Частота развития гематологических, кожных, желудочно-кишечных осложнений, болевого синдрома и астенического состояния была сопоставима между группами (p > 0,05). Это свидетельствует о том, что проведение системного лечения на дооперационном этапе не ухудшает переносимость терапии.
В группе неоадъювантной химиотерапии редукция доз химиопрепаратов проводилась на 20 % реже, чем в группе первичной хирургии (9,3 % против 16,7 %) (табл. 10).
Необходимость повторной редукции в каждой группе отмечалось достаточно редко. Тем не менее, статистически значимой разницы между группами достигнуто не было. Это не позволяет однозначно утверждать, что переносимость химиотерапии в неоадъювантном режиме лучше. Однако, полученные данные могут отражать результат меньшей длительности проводимой периоперационной химиотерапии, что также положительно сказывается на токсичности проводимого лечения.
После проведенной неоадъювантной химиотерапии в двух случаях зарегистрирован летальный исход, наступивший по причине, не связанной с онкологическим заболеванием. У пациентов не было отмечено побочных явлений на фоне проводимой терапии. Еще двое пациентов из группы НеоАХТ не были прооперированы из-за развития нежелательных явлений III ст. Эти данные также
Таблица 9. Сравнительная характеристика профиля токсичности в различных режимах химиотерапии Table 9. Comparative characteristics of the toxicity profile in various chemotherapy regimens
|
Параметры |
Степень |
НеоАХТ, n = 54, n ( ) |
Первичная хирургия, n = 54, n ( ) |
р |
|
Анемия |
II–III ст. |
3 (5,6%) |
2 (3,7%) |
1 |
|
Нейтропения |
III–IV ст. |
4 (7,4 %) |
4 (7,4%) |
1 |
|
Тромбоцитопения |
II–III ст. |
2 (3,7 %) |
3 (5,6%) |
1 |
|
АЛТ/АСТ |
II–III ст. |
2 (3,7 %) |
3 (5,6%) |
1 |
|
Креатинин |
I–II ст. |
0 (0%) |
1 (1,9%) |
1 |
|
Ладонно-подошвенный синдром |
I–II ст. |
4 (7.4%) |
2 (3,7%) |
0,679 |
|
Диарея Тошнота/рвота |
II–III ст. |
4 (7,4) 4 (7,4) |
6 (11,1) 5 (9,2) |
0,614 |
|
Периферическая полинейропатия |
II–III ст. |
2 (3,7 %) |
10 (18,5%) |
0,029 |
|
Астения |
I–II ст |
7 (13,0) |
8 (14,8 %) |
1 |
Таблица 10. Редукция дозы химиопрепаратов
Table 10. Reduction of the dose of chemotherapy drugs
|
Степень редукции доз препаратов |
НеоАХТ, n = 54, n ( ) |
Первичная хирургия, n = 54, n ( ) |
p |
|
Редукция на 20 % |
5 (9,3%) |
9 (16,7%) |
0,389 |
|
Редукция на 50% |
1 (1,9 %) |
1 (1,9%) |
Таблица 11. Завершенность химиотерапевтического этапа лечения
Table 11. Completion of the chemotherapeutic stage of treatment
Полный курс терапии определялся как проведение 4 курсов терапии по схеме CapOX или 6 курсов по схеме FOLFOX в неоадъювантном режиме, а также, по показаниям, продолжение терапии в адъювантном режиме.
В группе неоадъювантной химиотерапии полный курс лечения удалось завершить у 77,8 % пациентов, тогда как в группе первичной хирургии — у 92,6 %. Несмотря на тенденцию к более высокой завершённости в группе первичной хирургии, различия между группами не достигли статистической значимости (p = 0,058). Данные различия также вызваны тем количеством пациентов, которые не были прооперированы по причине прогрессирования заболевания или токсичности. В нашем исследовании они составили 13 % (7 пациентов). Эти данные также необходимо учитывать при отборе пациентов на неоадъювантное лечение.
ОБСУЖДЕНИЕ
В нашем исследовании отмечено, что проведение НеоАХТ у пациентов с опухолью ободочной кишки III стадии не влияло на частоту послеоперационных осложнений хирургического вмешательства, однако следует учитывать тот факт, что у 13 % больных оперативное вмешательство выполнено не было — по причине прогрессирования (5 %), токсичности III ст. (4 %) и смерти от других причин (4 %).
Выводы об отсутствии хирургических осложнений между группами подтверждаются аналогичными данными других исследований — Lynch A. и соавт. (2023), FOxTROT [2,15]. Однако, в этих работах не отмечен факт увеличения частоты конверсии между группами, который был выявлен в нашем исследовании. По нашему мнению, частота конверсии повышалась из-за фиброза, возникшего на фоне проведения НеоАХТ, который видели врачи-патоморфологи и интерпретировали как лечебный патоморфоз. Однако следует также отметить и ограничение нашего исследования. Возможно, данная разница была достигнута небольшой выборкой пациентов, что могло быть нивелировано при большей когорте пациентов.
Nerad E. и соавт. (2016) объединили данные 20 исследований, в которых проводилась оценка достоверности КТ при раке ободочной кишки, в частности, была выполнена суммарная оценка чувствительности и специфичности в отношении поражения лимфатических узлов толстой кишки по данным КТ с внутривенным контрастированием. В зависимости от толщины среза (менее 5 мм или ≥ 5 мм) специфичность данного метода варьировала от 78 % до 62% соответственно [9]. Данное исследование указывает на низкую точность в обнаружении пораженных лимфоузлов по данным компьютерной томографии.
При использовании в клинической практике системы Node-RADS с оценкой лимфатических узлов от 1–5 баллов, повышается специфичность КТ от 84–100 %, на что указывают проведенные исследования [16,17]. Благодаря системе Node-RADS, использованной для оценки регионарных лимфоузлов брюшной полости, в нашу работу были включены пациенты с высокой достоверностью наличия N + .Данный факт был также ранее нами подтвержден анализом, проведенным в нашей клинике, где у пациентов с оценкой 1–2 балла лишь в 10 –20 % случаев выявлялось поражение лимфатических узлов [14]. Группа больных с оценкой 3 балла являлась пограничной, в ней лишь в 30% случаев выявлялись пораженные лимфоузлы. Однако при сочетании данной оценки с дополнительными факторами неблагоприятного прогноза, таких как признаки инвазии в смежные органы или низкая степень дифференцировки опухоли, нами было принято решение отнести данную группу к III стадии заболевания с возможным поражением лимфоузлов.
По данным рандомизированного исследования FOxTROT, частота завышения стадии заболевания в контрольной группе по данным КТ встречалась в 25% случаев [2]. В нашем же исследовании завышение стадии по данным КТ в контрольной группе встречалось в 15 % благодаря использованию системы Node-RADS от 3–5 баллов. При дополнительном анализе было отмечено, что при включении в исследование пациентов только с оценкой 4–5 баллов завышение стадии могло быть снижено до 8%. Данный факт стоит учитывать при планировании дальнейших исследований, посвященных неоадъювантной химиотерапии рака ободочной кишки.
При сравнении клинической и патоморфологической оценки стадии опухоли после НеоАХТ отмечено значимое увеличение частоты выявления pN0 (p < 0,001), снижение частоты выявления лимфоваскулярной инвазии (р < 0,001), выраженное уменьшение частоты выявления pT4b (р = 0,053), pN2 (р = 0,06), однако последние два показателя не достигли статистически значимой разницы. Как следствие, это привело к уменьшению частоты назначения АХТ в группе пациентов после НеоАХТ по сравнению с 6 месяцами лечения больных с первичным хирургическим лечением. Ограничением нашего исследования является небольшая выборка пациентов в каждой группе и отсутствие онкологических результатов, а именно оценка безре-цидивной и общей выживаемости на фоне проводимой НеоАХТ. Для получения таких данных целесообразно продолжать рандомизированные исследования.
Несмотря на двухкратное увеличение конверсии хирургического доступа из лапароскопии в лапаротомию на фоне фиброза, а также невыполнение хирургического этапа лечения у 13 % пациентов в связи с токсичностью и прогрессированием, отмечаются также и положительные аспекты данного метода лечения. В нашем исследовании отмечено снижение токсичности от оксалиплатина на фоне уменьшения длительности химиотерапевтического этапа лечения, а также возможность оценить регресс опухоли после проведенного лечения. В исследовании FOxTROT указывают на увеличение безрецидивной выживаемости именно у тех пациентов, у которых был зарегистрирован лечебный патоморфоз после НеоАХТ [2]. Также это позволяет в дальнейшем выбирать персонифицированный подход для пациентов, кому эта схема лечения не подошла.
К сожалению, большинство исследований, посвященных неоадъювантной химиотерапии, были негативными, во многих из них не было зарегистрировано увеличения безрецидивной и общей выживаемости. Также всегда стоит помнить о пациентах, которым оперативное вмешательство выполнено не будет по причине токсичности или прогрессирования на фоне лечения. Однако нельзя игнорировать тот факт, что при проведении систематического обзора, мета-анализа, объединяющих все проведенные исследования, подтверждается увеличение безрецидивной и общей выживаемости. Последнее исследование, опубликованное Richard Sassun и соавт. в 2025 г., объединившее только рандимизированные исследования, посвященные неоадъювантной химиотерапии рака ободочной кишки, указывают на увеличение безрецидивной виживаемости с 73,7 % до 79,2 %, p = 0,003, а также увеличение общей выживаемости с 77,8% до 81,4 % [18].
В настоящее время, ведущие мировые клинические рекомендации, такие как NCCN, ESMO, а также отечественные рекомендации 2021 года по лечению рака ободочной кишки, не рассматривают НеоАХТ как стандарт лечения для данной стадии заболевания [19–21]. Согласно этим рекомендациям, основным методом лечения остаётся хирургическое вмешательство с последующей адъювантной химиотерапией.
Тем не менее, растущий объём данных, включая результаты нашего исследования, свидетельствует о целесообразности дальнейшего изучения неоадъювантной химиотерапии и её возможной интеграции в клинические протоколы лечения больных III стадией рака ободочной кишки.
ВЫВОДЫ
Проведение неоадьювантной химиотерапии не увеличивало частоту осложнений хирургического лечения. Отмечено влияние неоадъювантной химиотерапии на снижение частоты pT4b, N2, уменьшение частоты выявления лимфоваскулярной инвазии, увеличение pN0. Это привело к уменьшению объема адьювантной химиотерапии у этой группы пациентов по сравнению с группой первичного хирургического лечения. При планировании исследований по применению неоадьювантной химиотерапии целесообразно включать в них пациентов с регионарными лимфоузлами 4–5баллов по Node-RADS.


