Результаты раннего и среднесрочного послеоперационных периодов после коррекции тотального аномального дренажа легочных вен
Автор: Плотников Михаил Валерьевич, Горбатых Ю.Н., Архипов А.Н., Галстян М.Г., Богачев-прокофьев А.В., Тарасов Д.Г., Сойнов И.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 4 т.25, 2021 года.
Бесплатный доступ
Цель. Провести сравнительную оценку результатов среднесрочного периода наблюдения при коррекции тотального аномального дренажа легочных вен с помощью бесшовной коррекции (процедура Sutureless) и конвенциональной биатриальной коррекции. Методы. В пилотном двухцентровом проспективном рандомизированном исследовании сравнили среднесрочные результаты хирургического лечения тотального аномального дренажа легочных вен у детей 1-го года жизни двумя методиками - с помощью бесшовной коррекции (n = 20) и конвенциональной биатриальной коррекции (n = 20). Общий размер выборки составил 40 пациентов. Оценили общую летальность и осложнения в среднесрочном периоде. Результаты. Средний срок наблюдения пациентов составил 15 (13; 16) мес. Летальность была только в группе конвенциональной биатриальной методики и составила 5 (25 %) пациентов, p = 0,018. Тяжелая обструкция на анастомозе была также только в группе конвенциональной биатриальной методики у 8 (40 %) пациентов, p = 0,0013. Инфекционный эндокардит был у 1 (6,6 %) пациента в группе конвенциональной биатриальной методики, p = 0,42. Нарушения ритма присутствовали у 4 (26,6 %) пациентов в группе конвенциональной биатриальной методики, p = 0,02. Выводы. Обструкция коллектора легочных вен, нарушения ритма сердца и летальные исходы зависят от варианта коррекции тотального аномального дренажа легочных вен. Бесшовная методика позволяет снизить встречаемость среднесрочных послеоперационных осложнений.
Нарушение ритма сердца, стеноз легочных вен, тотальный аномальный дренаж легочных вен
Короткий адрес: https://sciup.org/142230807
IDR: 142230807 | DOI: 10.21688/1681-3472-2021-4-41-52
Текст научной статьи Результаты раннего и среднесрочного послеоперационных периодов после коррекции тотального аномального дренажа легочных вен
Плотников М.В., Горбатых Ю.Н., Архипов А.Н., Галстян М.Г., Богачев-Прокофьев А.В., Тарасов Д.Г., Сойнов И.А. Результаты раннего и среднесрочного послеоперационных периодов после коррекции тотального аномального дренажа легочных вен. Патология кровообращения и кардиохирургия. 2021;25(4):41-52. http:// org/10.21688/1681-3472-2021-4-41-52
М.В. Плотников, Ю.Н. Горбатых, А.Н. Архипов, М.Г. Галстян, А.В. Богачев-Прокофьев,
Тотальный аномальный дренаж легочных вен (ТАДЛВ) — редкий врожденный порок сердца, характеризующийся отсутствием прямой связи легочных вен с левым предсердием [1]. Частота ТАДЛВ составляет 1,0–1,5 % врожденных пороков сердца [2; 3]. Естественное течение заболевания неблагоприятное, поэтому раннее оперативное лечение крайне необходимо [2; 3]. С 1960-х гг. для коррекции ТАДЛВ используется конвенциональная биатриальная методика H.B. Shumacker Jr. и H. King [4]. Несмотря на простоту и большую популярность метода, сохраняются высокая летальность (до 18 %) и частая обструкция коллектора легочных вен [5–8].
В 1996 г. F. Lacour-Gayet предложил выполнять у пациентов с обструкцией легочных вен бесшовную коррекцию (процедура Sutureless), при которой прямой анастомоз между левым предсердием и легочными венами отсутствует, а соединение левого предсердия с легочными венами осуществляется путем анастомозирования левого предсердия и заднего листка перикарда [9]. В последние годы бесшовную методику используют для первичной коррекции ТАДЛВ, особенно у больных с высоким риском послеоперационного стеноза [8; 10–12]. Несмотря на снижение летальности и частоты осложнений в раннем и позднем послеоперационных периодах, бесшовную коррекцию нельзя назвать процедурой выбора при лечении ТАДЛВ. Большинство работ в мировой литературе — это когортные исследования, описывающие отдельные техники лечения ТАДЛВ и опыт их применения, и лишь в нескольких публикациях сравнили два этих метода [8; 11].
Цель — сравнить результаты среднесрочного периода наблюдения при коррекции ТАДЛВ с использованием бесшовной и конвенциональной биатри-альной методик.
Методы
В исследование включили анализ пациентов, оперированных в кардиохирургическом отделении врожденных пороков сердца ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (г. Новосибирск) и отделении кардиохирургии № 4 ФГБУ «ФЦССХ» Минздрава России (г. Астрахань) по поводу ТАДЛВ (супра-, инфракардиальная и смешанная формы) с декабря 2017 г. по январь 2020 г. Двухцентровое пилотное проспективное рандомизированное исследование направлено на изучение двух методик коррекции ТАДЛВ — бесшовной и конвенциональной биатриальной. Общий размер выборки составил 40 пациентов (рис. 1). Выполнили оценку общей летальности и осложнений в среднесрочном периоде. Клиническое исследование одобрено локальным этическим комитетом ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (протокол № 37 от 26.12.2017 г.)
Критерии включения: изолированный ТАДЛВ, возраст до 1 года. Критерии невключения: сопутствующий порок сердца, возраст более 1 года, сепсис или пневмония, полиорганная недостаточность. Критерии исключения: отказ пациента от участия на любом этапе исследования.
Первичная конечная точка: тяжелая обструкция анастомоза коллектора. Вторичные конечные точки: летальность в раннем и среднесрочном послеоперационных периодах, давление в легочной артерии, нарушение ритма сердца.
Всем пациентам перед хирургической коррекцией ТАДЛВ проводили комплекс обследований, включающий осмотр детского кардиолога со сбором жалоб и анамнеза и стандартные физикальное и инструментальное обследования.
Компьютерную томографию выполняли на 320-срезовом томографе Aquilion One (Toshiba Medical Systems Corporation, Япония). По данным компьютерной томографии оценивали анатомию легочных вен (супра-, инфракардиальная или смешанная формы ТАДЛВ), а также возможную обструкцию на уровне кардиальной вены, устьев легочных вен или коллектора; измеряли левое предсердие.
Трансторакальную эхокардиографию выполняли всем пациентам по стандартной методике в положении на спине или левом боку. На ультразвуковых системах Vingmed Ultrasound (США), VIVID-7D (Хортен, Норвегия) секторными датчиками с диапазоном частот от 3,5 до 8,0 МГц, а также матричным датчиком 3V проводили исследование, включающее одно-, двух- и трехмерное сканирование с применением допплерографии в импульсном и постоянноволновом режимах, а также цветное допплеровское картирование кровотока. Систолическую функцию левого желудочка оценивали в М-режиме по методу Тейхольца путем вычисления фракций выброса и укорочения левого желудочка. Измеряли показатели: конечные диастолический и систолический размеры, конечный диастолический объем и его индекс. Систолическое давление в правом желудочке оценивали с помощью трикуспидальной регургитирующей струи, а давление в легочной артерии — ранней диастолической скорости легочной регургитирующей струи. Для обоих измерений использовали модифицированное уравнение Бернулли. Тяжесть обструкции для каждой вены оценивали на основании градиента давления по данным эхокардиографии с использованием классификации T.-J. Yun и соавт. [12]: 0 — отсутствие стеноза (средний градиент < 2 Torr); 1 — умеренный стеноз (средний градиент 2,0–6,9 Torr); 2 — тяжелый стеноз (средний градиент > 7 Torr); 3 — полная окклюзия. Сумму баллов отдельных легочных вен применяли как меру оценки легочных вен (англ. Pulmonary Vein Score) в диапазоне от 0 до теоретически максимальных 12 баллов. Индексированный объем левого предсердия рассчитывали по формуле [13]:
0,85 × площадь левого предсердия в 4-камерном режиме × площадь левого предсердия в двухкамерном режиме / длина левого предсердия / площадь поверхности тела.
При бесшовной методике соединение левого предсердия с легочными венами осуществляли путем анастомозирования левого предсердия с задним листком перикарда [9], при конвенциональной биатриальной методике — с коллектором легочных вен [5].
Статистический анализ
Анализ данных хирургического лечения проводили с помощью программы Stata 13 для Windows 10 и Stata 14 для Mac OS (StataCorp LP, Колледж-Стейшен, США). Проверку гипотезы о нормальности распределения признаков выполняли с использованием критерия Шапиро – Уилка. Условие равенства дисперсий распределений признаков проверяли с помощью расчета критерия Левена. Представили качественные переменные в виде чисел (%), количественные — в виде медианы (25-й; 75-й процентиль), если не указаны другие. Для определения достоверности различий межгрупповых (независимых) сравнений применяли в группах номинальных данных критерий χ2 Пирсона; в группах порядковых данных — непараметрический U-критерий Манна – Уитни. Сравнительный анализ кривых выживаемости, свободы от нарушения ритма, резидуальной обструкции легочных вен и летальных исходов проводили с помощью лог-ранк критерия, что графически выражалось по методу Каплана – Майера. Регрессию пропорциональных рисков Кокса использовали для оценки связи между одной и более непрерывными или категориальными переменными и временем до наступления неблагоприятного события. Уровень значимости для всех методов установили как p < 0,05.
Табл. 1. Базовые и демографические характеристики пациентов до операции
|
Показатель |
Бесшовная методика |
Конвенциональная биатриальная методика |
p |
|
|
Возраст, дней |
72 (31; 153) |
58,0 (14,5; 135,5) |
0,43 |
|
|
Рост, см |
55,2 (52,5; 62,2) |
52,5 (50,5; 56,0) |
0,22 |
|
|
Вес, кг |
4,4 (3,4; 5,2) |
3,4 (2,9; 3,9) |
0,16 |
|
|
Площадь поверхности тела, м2 |
0,25 (0,22; 0,30) |
0,22 (0,21; 0,25) |
0,19 |
|
|
Мужской пол, n (%) |
13 (65) |
10 (50) |
0,50 |
|
|
Гестационный возраст, нед. |
39 (38; 40) |
38,5 (38,0; 39,0) |
0,32 |
|
|
Недоношенные пациенты, n (%) |
2 (10) |
2 (10) |
> 0,99 |
|
|
Новорожденные пациенты, n (%) |
6 (30) |
6 (30) |
> 0,99 |
|
|
Маловесные пациенты (< 2,5 кг), n (%) |
3 (15) |
1 (5) |
0,60 |
|
|
Пренатальная диагностика, n (%) |
8 (40) |
4 (20) |
0,30 |
|
|
Обструктивная форма, n (%) |
4 (20) |
2 (10) |
0,66 |
|
|
Форма ТАДЛВ по R.C. Darling и соавт. [14], n (%) |
супракардиальная |
12 (60) |
12 (60) |
|
|
инфракардиальная |
4 (20) |
4 (20) |
> 0,99 |
|
|
смешанная |
4 (20) |
4 (20) |
||
|
Искусственная вентиляция легких до операции, n (%) |
5 (25) |
3 (15) |
0,69 |
|
|
Пневмония до операции, n (%) |
3 (15) |
0 (0) |
0,23 |
|
|
I |
0 (0) |
0 (0) |
> 0,99 |
|
|
Функциональный класс сердеч- |
II |
0 (0) |
0 (0) |
> 0,99 |
|
ной недостаточности [15], n (%) |
III |
14 (70) |
17 (85) |
0,45 |
|
IV |
6 (30) |
3 (15) |
0,45 |
|
|
Фракция выброса, % |
76,5 (69,0; 81,5) |
75 (71; 85) |
0,88 |
|
|
Индекс конечного диастолического объема, мл/м2 |
18,75 (14,50; 23,30) |
23 (17; 34) |
0,051 |
|
|
Индексированный объем левого предсердия |
4,80 (3,95; 5,70) |
5,35 (4,30; 6,20) |
0,36 |
|
|
0 |
0 (0) |
0 (0) |
> 0,99 |
|
|
Трикуспидальная |
I |
3 (15) |
7 (35) |
0,27 |
|
недостаточность, n (%) |
II |
11 (55) |
8 (40) |
0,52 |
|
III |
7 (35) |
5 (25) |
0,73 |
|
|
Qp : Qs |
2,7 (2,4; 3,0) |
2,6 (2,2; 2,9) |
0,25 |
|
|
Давление в легочной артерии, мм рт. ст. |
56 (50; 64) |
55,0 (51,5; 60,0) |
0,72 |
|
Примечание. ТАДЛВ — тотальный аномальный дренаж легочных вен; Qp : Qs — соотношение легочного и системного кровотоков. Данные представлены как медиана (25-й; 75-й процентиль) или n (%).
Результаты
Базовые и демографические характеристики пациентов представлены в табл. 1. Группы были сопоставимы по росту, полу, возрасту, весу и площади поверхности тела, гестационному возрасту, количеству новорожденных, недоношенных, маловесных пациентов, пренатальной диагностике, формам ТАДЛВ, искусственной вентиляции легких до операции, пневмонии до операции, сердечной недостаточности, фракции выброса, индексу конечного диастолического объема, индексированному объему левого предсердия, трикуспидальной недостаточности, соотношению легочного и системного кровотоков и давлению в легочной артерии.
Полнота клинического наблюдения из общей выборки 35 выписанных пациентов (4 случая госпитальной летальности и 1 случай отдаленной ле-
Табл. 2. Демографические характеристики пациентов через год после операции
Показатель Бесшовная методика Конвенциональная биатриальная методика p
Возраст, мес. 17 (14; 21) 16,5 (12,5; 19,5) 0,43
Рост, см 85,2 (82,0; 96,5) 82,5 (80,0; 96,0) 0,39
Вес, кг 11,20 (10,25; 12,00) 9,6 (7,7; 10,6) 0,0017
Площадь поверхности тела, м2 0,48 (0,45; 0,51) 0,44 (0,37; 0,46) 0,0018
Примечание. Данные представлены как медиана (25-й; 75-й процентиль) или n (%).
Табл. 3. Эхокардиографические параметры в раннем и среднесрочном послеоперационных периодах
|
Показатель |
Бесшовная методика |
Конвенциональная биатриальная методика |
p |
|
Ранний послеоперационный период |
|||
|
Фракция выброса, % |
77 (71; 80) |
75,5 (71,5; 78,0) |
0,51 |
|
Индекс конечного диастолического объема, мл/м2 |
38,0 (28,5; 45,0) |
37,10 (31,00; 47,75) |
0,48 |
|
Индексированный объем левого предсердия, мл/м2 |
15,00 (13,65; 17,25) |
12,85 (10,95; 15,15) |
0,057 |
|
Давление в легочной артерии, мм рт. ст. |
27 (25; 28) |
45,5 (31,5; 60,5) |
0,001 |
|
Шкала обструкции легочных вен |
0 (0,0; 0,5) |
1,0 (0,5; 4,0) |
0,0001 |
|
Градиент на анастомозе, мм рт. ст. |
0 (0,0; 1,5) |
3,65 (1,25; 7,75) |
0,0001 |
|
Тяжелая обструкция на анастомозе, n (%) |
0 (0) |
6 (30) |
0,02 |
|
Отдаленный послеоперационный период |
|||
|
Фракция выброса, % |
72,0 (69,0; 74,5) |
68 (62; 75) |
0,27 |
|
Индекс конечного диастолического объема, мл/м2 |
50 (43; 57) |
50,2 (28,8; 60,9) |
0,49 |
|
Индексированный объем левого предсердия, мл/м2 |
37,0 (34,5; 38,9) |
31,0 (23,6; 35,0) |
0,01 |
|
Давление в легочной артерии, мм рт. ст. |
26,0 (22,5; 29,0) |
37 (25; 48) |
0,0055 |
|
Шкала обструкции легочных вен |
0 (0,0; 0,5) |
1 (0; 3) |
0,0004 |
|
Градиент на анастомозе, мм рт. ст. |
0 (0,0; 2,5) |
3,6 (0,0; 8,0) |
0,0026 |
Примечание. Данные представлены как медиана (25-й; 75-й процентиль) или n (%).
Табл. 4. Одно- и многофакторный анализ Кокса для общей летальности
Однофакторный анализ Многофакторный анализ
Показатель Отношение рисков Отношение рисков
|
(95% доверительный интервал) |
p |
(95% доверительный интервал) |
p |
|
|
Индексированный объем левого предсердия |
0,50 (0,31; 0,85) |
0,009 |
0,15 (0,02; 0,68) |
0,045 |
|
Давление в легочной артерии |
1,07 (1,03; 1,12) |
0,001 |
1,50 (0,95; 2,40) |
0,076 |
|
Градиент на уровне анастомоза Тяжелая обструкция легочных вен тальности) составила 100 %. Отдаленные обследования проводили у 21 (60 %) пациента в ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (г. Новосибирск) и у 14 (40 %) пациентов в ФГБУ «ФЦССХ» |
1,5 (1,2; 2,0) 0,001 2,00 (0,98; 2,30) 0,076 2,0 (1,3; 3,0) 0,001 27,40 (0,36; 204,00) 0,132 Минздрава России (г. Астрахань). Средний срок наблюдения больных составил 15 (13; 16) мес. Демографические характеристики в отдаленном периоде представлены в табл. 2. |
Рис. 2. Отдаленная выживаемость пациентов

Бесшовная методика
I_____________________________________________________________________
Конвенциональная биатриальная методика
Лог-ранк тест, p = 0,018
Пациенты, n
Бесшовная методика 20
Конвенциональная 20 биатриальная методика
5 10 1520
Период наблюдения, мес.
20 20 120
16 16 100
Эхокардиографические параметры в двух группах в раннем и отдаленном периодах отражены в табл. 3.
Летальность
Летальность была только в группе конвенциональной биатриальной методики (4 случая госпитальной летальности и 1 случай отдаленной летальности), p = 0,047. При ITT-анализе (англ. Intention-To-Treat Analysis — анализ намерения лечения) отдаленной выживаемости выявили статистически достоверные различия: в группе конвенциональной биатриальной методики через 1 мес.
она составила 85 % (95% доверительный интервал (ДИ) 60,0–94,9 %), через 2 мес. — 80 % (95% ДИ 55– 92 %), а через 10 мес. — 70 % (95% ДИ 40–87 %), в группе бесшовной методики — 100 % на этапах отдаленного обследования (лог-ранк тест, p = 0,018) (рис. 2).
Факторы риска общей летальности представлены в табл. 4. Согласно многофакторному анализу Кокса, увеличение индексированного объема левого предсердия после операции снижало риск летального исхода на 85 %.
ROC-анализ после вмешательства показал, что индексированный объем левого предсердия сни-
Рис. 3. ROC-анализ влияния индексированного объема левого предсердия на летальность
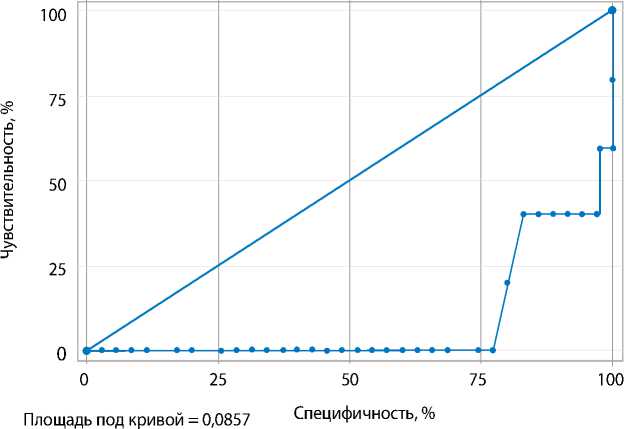
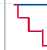
Рис. 4. Свобода от тяжелой обструкции коллектора легочных вен
Бесшовная методика

Конвенциональная биатриальная методика
Лог-ранк тест, p = 0,0013
Пациенты, n
Бесшовная методика
Конвенциональная биатриальная методика
5 10 1520
Период наблюдения, мес.
20 20 120
16 14 60
жал риск общей летальности в 9,7 раза с чувствительностью 69 % и специфичностью 63 %. Площадь под кривой 0,08 (95% ДИ 0,0001–0,1900), p = 0,015 (рис. 3).
Тяжелая обструкция коллекторалегочных вен
С тяжелой обструкцией коллектора легочных вен было 8 пациентов (4 пациента в раннем и 4 в отдаленном послеоперационных периодах), что составило 40 % группы конвенциональной биатриаль-ной методики, p = 0,003. При ITT-анализе свободы от тяжелой обструкции коллектора легочных вен выявили статистически достоверные различия: в группе конвенциональной биатриальной методики через 1 мес. она составила 89,7 % (95% ДИ 64,0–
97,3 %), через 2 мес. — 84,5 % (95% ДИ 59,0–94,7 %), через 9 мес. — 79,2 % (95% ДИ 53,5–91,5 %), через 10 мес. — 73,9 % (95% ДИ 48–88 %), через 11 мес. — 63,4 % (95% ДИ 38–80 %), через 13 мес. — 57,6 % (95% ДИ 32–76 %), в группе бесшовной методики — 100 % на этапах отдаленного обследования (лог-ранк тест, p = 0,0013) (рис. 4).
Факторы риска тяжелой обструкции коллектора легочных вен представлены в табл. 5. Согласно многофакторному анализу Кокса, на риск тяжелой обструкции влияли следующие факторы: повышенное давление в легочной артерии после операции увеличивало на 50 %, 1 мл/м2 индексированного объема левого предсердия сразу после операции снижал риск на 77 %, а через 1 год — на 52 %.
Табл. 5. Одно- и многофакторный анализ Кокса для тяжелой обструкции коллектора легочных вен
Однофакторный анализ Многофакторный анализ
Показатель Отношение рисков Отношение рисков
|
(95% доверительный интервал) |
p |
(95% доверительный интервал) |
p |
|
|
Индексированный объем левого предсердия |
0,51 (0,34; 0,75) |
0,001 |
0,23 (0,06; 0,56) |
0,039 |
|
Давление в легочной артерии |
1,10 (1,05; 1,15) |
0,0001 |
1,50 (1,12; 1,90) |
0,01 |
|
Маловесные пациенты (< 2,5 кг) |
1,11 (1,02; 1,78) |
0,02 |
1,28 (0,99; 3,70) |
0,07 |
|
Вес через 1 год |
0,15 (0,03; 0,67) |
0,013 |
0,02 (0,01; 1,12) |
0,35 |
|
Индексированный объем левого предсердия через 1 год |
0,78 (0,66; 0,93) |
0,007 |
0,48 (0,23; 0,76) |
0,02 |
|
Давление в легочной артерии через 1 год |
1,07 (1,03; 1,12) |
0,001 |
1,22 (0,92; 3,34) |
0,056 |
Табл. 6. Одно- и многофакторный анализ Кокса для нарушений ритма сердца
Однофакторный анализ Многофакторный анализ
|
Показатель |
Отношение рисков (95% доверительный интервал) |
p |
Отношение рисков (95% доверительный интервал) |
p |
|
Тяжелая обструкция легочных вен |
5,3 (1,4; 19,6) |
0,011 |
7,80 (0,62; 13,60) |
0,54 |
|
Давление в легочной артерии |
1,30 (1,02; 3,56) |
0,042 |
1,50 (0,32; 2,70) |
0,98 |
|
Индексированный объем левого предсердия через 1 год |
0,69 (0,52; 0,93) |
0,015 |
0,48 (0,12; 1,06) |
0,43 |
|
Градиент на анастомозе через 1 год |
3,20 (1,01; 10,20) |
0,047 |
4,70 (0,96; 10,50) |
0,87 |
Инфекционный эндокардит
Инфекционный эндокардит был у 1 (6,6 %) пациента в группе конвенциональной биатриальной методики, p = 0,42.
Нарушения ритма сердца
Обнаружили нарушения ритма сердца у 4 (26,6 %) пациентов в группе конвенциональной биатриаль-ной методики, p = 0,02. В 3 (20 %) случаях возникала слабость синусового узла, которая потребовала установки кардиостимулятора, и в 1 (6,6 %) случае — суправентрикулярная тахикардия, которая корригировалась медикаментозно. Факторы риска для нарушений ритма сердца представлены в табл. 6.
Согласно однофакторному анализу Кокса, на риск нарушений ритма сердца влияли следующие факторы: тяжелая обструкция легочных вен после операции увеличивала в 5,3 раза; 1 мм рт. ст. дав- ления в легочной артерии увеличивал на 30 %; градиент на анастомозе через 1 год после операции увеличивал в 3,2 раза; 1 мл/м2 индексированного объема левого предсердия через 1 год после операции снижал на 31 %.
При ITT-анализе свободы от нарушений ритма сердца выявили статистически достоверные различия: в группе конвенциональной биатриальной методики через 13 мес. она составила 92,8 % (95% ДИ 59–99 %), через 16 мес. — 81,25 % (95% ДИ 41–95 %), через 17 мес. — 66,5 % (95% ДИ 25,0–88,5 %), через 19 мес. — 40 % (95% ДИ 4–76 %), в группе бесшовной методики — 100 % на этапах отдаленного обследования (лог-ранк тест, p = 0,049) (рис. 5).
Обсуждение
До 1970 г. коррекция ТАДЛВ сопровождалась летальностью более 50 % [16]. С появлением новых
Рис. 5. Свобода от нарушений ритма сердца
>s
X ф Э а.
Конвенциональная биатриальная методика
Лог-ранк тест, p = 0,049
Бесшовная методика
Пациенты, n
Бесшовная методика 20
Конвенциональная 20 биатриальная методика
5 1015
Период наблюдения, мес.
20 2012
16 1610
хирургических и анестезиологических технологий с 1970 по 1980 г. смертность снизилась до 10–20 % [2]. В настоящее время она составляет 2–18 % и зависит от множества факторов [5–8]. Один из предикторов летального исхода — хирургическая техника [10]. O. Honjo и соавт. сообщили о летальности 0 % при бесшовной методике и 35,7 % — при конвенциональной биатриальной [17]. X.M. Gao и соавт. получили по этому критерию данные 4,9 и 19,4 % соответственно [18]. В нашем исследовании летальность была только в группе конвенциональной биатриальной методики и составила 20 % (n = 4). Причинами смерти были тяжелая сердечная недостаточность в 3 (15 %) случаях и полиорганная недостаточность в 1 (5 %) случае. В отдаленном периоде летальный исход был у 1 пациента из-за тяжелой полисегментарной пневмонии. Возможно, разрастание неоинтимы в области шва анастомоза привело к стенозу коллектора легочных вен, тяжелому венозному застою в легких и, как следствие, двусторонней полисегментарной пневмонии. Единственным фактором риска летальности являлся индексированный показатель объема левого предсердия — уменьшение в 9,7 раза. Недостаточный приток крови в левое предсердие из-за резидуального стеноза или пролиферации неоинтимы снижал рост левого предсердия, приводил к неполноценному наполнению левого желудочка и системной гипоперфузии, а также перегружал правый желудочек [8]. Эти условия привели к тяжелой сердечно-легочной недостаточности и смерти.
Одним из частых осложнений в отдаленном периоде являются различные аритмии. R.E. Tanel и со-авт. [19] проанализировали 29 детей через 11,2 ± 3,6 года после первоначального оперативного восстановления. Электрофизиологические исследования выявили признаки дисфункции синусового узла, включая синусовую брадикардию, синусовые паузы и хронотропное нарушение у большинства пациентов. У 29 % больных обнаружили хронотропные нарушения при физической нагрузке, у 2 — нарушения атриовентрикулярной проводимости. Наиболее частыми аритмиями были предсердные и желудочковые экстрасистолы, в то время как суправентрикулярная и желудочковая тахикардии наблюдались в 1 и 2 случаях соответственно. Похожие результаты описали и A. Bhan и соавт. [20], B. Korbmacher и соавт. [21]. Мы обнаружили аритмии у 26,6 % пациентов в группе конвенциональной биатриальной методики. У 20 % больных была дисфункция синусового узла, требующая импланта- ции кардиостимулятора, у 6,6 % — суправентрикулярная тахикардия, купируемая медикаментозными препаратами.
Ранее A. Bhan и соавт. и B. Korbmacher и соавт. также описывали факторы риска аритмий, такие как остаточный стеноз на коллекторе или легочных венах и легочная гипертензия, приводящие к увеличению правых отделов и перерастяжению стенок предсердия и желудочков, в которых могут возникать очаги аритмии [20; 21]. Двухпредсердный доступ при конвенциональной биатриальной методике мог негативно влиять на синусовый ритм [21].
Послеоперационные стенозы коллектора и легочных вен — частые отдаленные осложнения, которые приводят к вторичной легочной гипертензии, тяжелой сердечной недостаточности, являются основной причиной отдаленной летальности [8; 10; 17; 22]. Частота стеноза легочных вен — 10–15 % [1; 2]. Однако при разных хирургических техниках коррекции ТАДЛВ частота этого осложнения может различаться. Так, по данным O. Honjo и соавт., частота стенозов легочных вен при бесшовной методике составила 12,5 %, при конвенциональной биатри-альной методике — 42,8 % [17]. X.M. Gao и соавт. получили значения 2,5 и 14,3 % соответственно [18]. Постоперационный стеноз легочных вен, как правило, развивается в течение 6–12 мес. после коррекции ТАДЛВ и может быть вызван плохой техникой формирования анастомоза, пролиферацией интимы на линии шва и перекрутом легочных вен [1; 2]. Также к факторам риска послеоперационного стеноза легочных вен относят предоперационную обструкцию легочных вен, маленький коллектор легочных вен и гипоплазированные интрапаренхимальные легочные вены [6; 8; 10; 12; 17; 22]. В нашем анализе тяжелую обструкцию имели 26,6 % пациентов в группе конвенциональной биатриальной методики. B. Yanagawa и соавт. [8], Y. Wu и соавт. [10] полагают, что при этой методике линия шва находится непосредственно на легочной вене, что приводит к реактивной пролиферации интимы и, как следствие, тяжелому стенозу. У больных с инфракарди-альной формой ТАДЛВ или маловесных пациентов (с очень маленькими легочными венами и коллектором) коррекция без деформации и стеноза может быть затруднена [8; 10]. В послеоперационном периоде прямая линия шва может оставить незначительные градиенты на очень маленьких легочных венах или коллекторе, где впоследствии формируется неоинтима [8; 10]. Стратегиями для решения технических проблем послеоперационной легочной венозной обструкции маленьких легочных вен и коллектора были создание анастомоза большого размера между коллектором легочных вен и левым предсердием с использованием отдельных узловых или рассасывающихся швов, однако даже такая методика при прямом контакте с легочными венами приводила к стенозам [18; 23]. Даже небольшие градиенты на коллекторе легочных вен могут вызывать значительные сложности из-за вторичной легочной гипертензии [8].
В нашем анализе факторами риска отдаленных стенозов не были инфракардиальная форма ТАДЛВ и маловесные пациенты, однако являлась вторичная легочная гипертензия, как и в других исследованиях [8; 10; 18; 23].
В отдаленном периоде всем пациентам с тяжелой обструкцией выполнили повторную операцию с помощью бесшовной коррекции, после которой отметили снижение симптомов и улучшение состояния больных. По данным литературы, летальность может увеличиваться от 30 до 66 % при рецидивирующем стенозе легочной вены [9]. В нашем исследовании летальности не было.
Нет единого подхода в хирургическом лечении стеноза легочных вен и коллектора. В некоторых кардиохирургических центрах применяют бесшовную методику, в других — классическую конвенциональную методику или пластику с помощью заплат. Для решения этого вопроса необходимо выполнение большого проспективного исследования.
Ограничения
Работа направлена на оптимизацию отбора пациентов для определения хирургической тактики коррекции ТАДЛВ. В исследование избирательно включали больных ТАДЛВ без сопутствующих патологий, что может свидетельствовать об ограничении интерпретации результатов на основную группу пациентов. Полученные данные могут содержать субъективную оценку специалистов, проводящих анализ, что несомненно может влиять на полученные результаты. Малый размер выборки также является ограничением исследования.
Выводы
Резидуальная обструкция коллектора легочных вен зависит от варианта коррекции ТАДЛВ. Бесшовная методика позволяет снизить встречаемость резидуальной обструкции с 40 до 0 %.
Предикторами резидуальной обструкции коллектора легочных вен после коррекции ТАДЛВ являются давление в легочной артерии и индексированный объем левого предсердия в раннем послеоперационном периоде, индексированный объем левого предсердия в отдаленном послеоперационном периоде.
Бесшовная методика снижала частоту летальных исходов при коррекции ТАДЛВ с 25 до 0 %. Независимым предиктором являлся индексированный объем левого предсердия в раннем послеоперационном периоде.
Конвенциональная биатриальная методика увеличивала частоту нарушений ритма сердца с 0 до 26,6 %. Предикторами нарушения ритма являлись тяжелая обструкция легочных вен и давление в легочной артерии в раннем послеоперационном периоде, градиент на анастомозе и индексированный объем левого предсердия в отдаленном периоде.
Список литературы Результаты раннего и среднесрочного послеоперационных периодов после коррекции тотального аномального дренажа легочных вен
- Seale A.N., Uemura H., Webber S.A., Partridge J., Roughton M., Ho S.Y., McCarthy K.P., Jones S., Shaughnessy L., Sunnegardh J., Hanseus K., Berggren H., Johansson S., Rigby M.L., Keeton B.R., Daubeney P.E.; British Congenital Cardiac Association. Total anomalous pulmonary venous connection: outcome of postoperative pulmonary venous obstruction. J Thorac Cardiovasc Surg. 2013;145(5):1255-1262. PMID: 22892140. https://doi.org/10.1016Aitcvs.2012.06.031
- Shi G., Zhu Z., Chen J., Ou Y., Hong H., Nie Z., Zhang H., Liu X., Zheng J., Sun Q., Liu J., Chen H., Zhuang J. Total anomalous pulmonary venous connection: The current management strategies in a pediatric cohort of 768 patients. Circulation. 2017;135(1):48-58. PMID: 27881562. https://doi.org/10.1161/ CIRCULATI0NAHA.116.023889
- Lo Rito M., Gazzaz T., Wilder T., Saedi A., Chetan D., Van Arsdell G.S., Caldarone C.A., Yoo Sh.-J., Honio O. Repair type influences mode of pulmonary vein stenosis in total anomalous pulmonary venous drainage. Ann Thorac Surg. 2015;100(2):654-662. PMID: 26138763. https://doi. org/10.1016/i.athoracsur.2015.04.121
- Shumacker H.B. Jr., King H. A modified procedure for complete repair of total anomalous pulmonary venous drainage. Surg Gynecol Obstet. 1961;112:763-765.
- Kelle A.M., Backer C.L., Gossett J.G., Kaushal S., Mavroudis C. Total anomalous pulmonary venous connection: results of surgical repair of 100 patients at a single institution. J Thorac Cardiovasc Surg. 2010;139(6):1387-1394.e3. PMID: 20392458. https://doi.org/10.1016Aitcvs.2010.02.024
- Lacour-Gayet F. Surgery for pulmonary venous obstruction after repair of total anomalous pulmonary venous return. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2006;45-50. PMID: 16638547. https://doi.org/10.1053/i. pcsu.2006.02.010
- Matsuhisa H., Oshima Y., Maruo A., Hasegawa T., Tanaka A., Noda R. Primary sutureless repair and anterior translocation of the atrial septum for cardiac total anomalous pulmonary venous connection. Ann Thorac Surg. 2013;95(2):729-730. PMID: 23336897. https://doi.org/10.10167i.athoracsur.2012.09.080
- Yanagawa B., Alghamdi A.A., Dragulescu A.,Viola N., Al-Radi O.O., Mertens L.L., Coles J.G., Caldarone C.A., Van Arsdell G.S. Primary sutureless repair for "simple" total anomalous pulmonary venous connection: midterm results in a single institution. J Thorac Cardiovasc Surg. 2011;141(6):1346-1354. PMID: 21457999. https://doi.org/10.1016/jjtcvs.2010.10.056
- Lacour-Gayet F., Zoghbi J., Serraf A.E., Belli E., Piot D., Rey C., Marçon F., Bruniaux J., Planché C. Surgical management of progressive pulmonary venous obstruction after repair of total anomalous pulmonary venous connection. J Thorac Cardiovasc Surg. 1999;117(4):679-687. PMID: 10096962. https://doi.org/10.1016/S0022-5223(99)70287-4
- Wu Y., Wu Zh., Zheng J., Li Y., Zhou Y., Kuang H., Jin X., Wu Ch. Sutureless technique versus conventional surgery in the primary treatment of total anomalous pulmonary venous connection: a systematic review and meta-analysis. J Cardiothorac Surg. 2018;13(1):69. PMID: 29907127; PMCID: PMC6003069. https://doi.org/10.1186/s13019-018-0756-z
- Yoshimura N., Fukahara K., Yamashita A., Doi T., Takeuchi K., Yamashita Sh., Homma T., Yokoyama Sh., Aoki M., Ikeno Y. Surgery for total anomalous pulmonary venous connection: primary sutureless repair vs. conventional repair. Gen Thorac Cardiovasc Surg. 2017;65(5):245-251. PMID: 28332089. https:// doi.org/10.1007/s11748-017-0769-x
- Yun T.-J., Coles J.G., Konstantinov I.E., Al-Radi O.O., Wald R.M., Guerra V., de Oliveira N.C., Van Arsdell G.S., Williams W.G., Smallhorn J., Caldarone C.A. Conventional and sutureless techniques for management of the pulmonary veins: Evolution of indications from postrepair pulmonary vein stenosis to primary pulmonary vein anomalies. J Thorac Cardiovasc Surg. 2005;129(1 ):167-174. PMID: 15632839. https://doi.org/10.1016/Utcvs.2004.08.043
- Lang R.M., Bierig M., Devereux R.B., Flachskampf F.A., Foster E., Pellikka P.A., Picard M.H., Roman MJ., Seward J., Shanewise J.S., Solomon S.D., Spencer K.T., Sutton M.S., Stewart W.J.; Chamber Quantification Writing Group; American Society of Echocardiography's Guidelines and Standards Committee; European Association of Echocardiography. Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr. 2005;18(12):1440-1463. PMID: 16376782. https://doi.org/10.1016/ji.echo.2005.10.005
- Craig J.M., Darling R.C., Rothney W.B. Total pulmonary venous drainage into the right side of the heart; report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab Invest. 1957;6(1):44-64. PMID: 13386206.
- Ross R.D., Daniels S.R., Schwartz D.C., Hannon D.W., Shukla R., Kaplan S. Plasma norepinephrine levels in infants and children with congestive heart failure. Am J Cardiol. 1987;59(8):911-914. PMID: 3825955. https://doi. org/10.1016/0002-9149(87)91118-0
- Behrendt D.M., Aberdeen E., Waterson D.J., Bonham-Carter R.E. Total anomalous pulmonary venous drainage in infants. I. Clinical and hemodynamic findings, methods, and results of operation in 37 cases. Circulation. 1972;46(2):347-356. PMID: 5046028. https://doi.org/10.1161/01.cir.46.2.347
- Honjo O., Atlin C.R., Hamilton B.C.S., Al-Radi O., Viola N., Coles J.G., Van Arsdell G.S., Caldarone C.A. Primary sutureless repair for infants with mixed total anomalous pulmonary venous drainage. Ann Thorac Surg. 2010;90(3):862-868. PMID: 20732509. https://doi.org/10.1016/_i.athoracsur.2010.05.007
- Gao X.M., Nie Z.Q., Ou Y.Q., He B.C., Yuan H.Y., Qu Y.J. Comparison between two surgical techniques to repair total anomalous pulmonary venous connection using propensity score analysis. J Sun Yat-Sen Univ. 2017;38(1):143-150.
- Tanel R.E., Kirshbom P.M., Paridon S.M., Hartman D.M., Burnham N.B., McBride M.G., Ittenbach R.F., Spray T.L., Gaynor J.W. Long-term noninvasive arrhythmia assessment after total anomalous pulmonary venous connection repair. Am. Heart J. 2007;153(2):267-274. PMID: 17239688. https:// doi.org/10.1016/i.ahi.2006.11.003
- Bhan A., Umre M.A., Choudhary S.K., Saxena A., Sharma R., Airan B., Kothari S.S., Juneia R., Venugopal P. Cardiac arrhythmias in surgically repaired total anomalous pulmonary venous connection: a follow-up study. Indian Heart J. 2000;52(4):427-430. PMID: 11084784.
- Korbmacher B., Büttgen S., Schulte H.D., Hoffmann M., Krogmann O.N., Rammos S., Gams E. Long-term results after repair of total anomalous pulmonary venous connection. Thorac Cardiovasc Surg. 2001;49(2):101-106. PMID: 11339445. https://doi.org/10.1055/s-2001-11706
- Mueller C., Dave H., Prêtre R. Primary correction of total anomalous pulmonary venous return with a modified sutureless technique. Eur J Cardiothorac Surg. 2013;43(3):635-640. PMID: 22761490. https://doi.org/10.1093/eicts/ezs376
- Cui H., Chen X., Ma L., Xia Y., Yang Sh., Zou M., Chen W. Surgical treatment of total anomalous pulmonary venous connection under 6 months of age. Chin J Surg. 2016;54(4):276-280. PMID: 27029202. https://doi.org/10.3760/cma.Us sn.0529-5815.2016.04.007


