Результаты сочетанной лучевой терапии больных раком предстательной железы высокого риска
Автор: Потапова А. В., Гладилина И. А., Петровский А. В., Черняев В. А., Шолохов В. Н., Бухаркин Б. В., Нечушкин М. И., Валиев Р. К., Сергеев Ю. С., Ротобельская Л. Е., Назаренко А. В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.9, 2019 года.
Бесплатный доступ
Лучевая терапия является одним из основных радикальных методов лечения больных раком предстательной железы (РПЖ). Многие исследования по сочетанной лучевой терапии (СЛТ) больных РПЖ демонстрируют хорошие онкологические результаты, однако до сих пор остается открытым вопрос определения последовательности этапов СЛТ и оптимального временного интервала между ними. Недостаточно рандомизированных исследований, которые могли бы подтвердить преимущества проведения контактной лучевой терапии на первом или втором этапе, а также определить наиболее эффективный временной промежуток между контактной и дистанционной лучевой терапией, связи с чем исследование различных методик СЛТ является перспективным направлением. Цель исследования. Оценка результатов лечения больных РПЖ высокого риска в зависимости от последовательности этапов сочетанной лучевой терапии и временного интервала между ними. Материалы и методы. 53 больным РПЖ была выполнена сочетанная лучевая терапия на фоне длительной гормональной терапии (ГТ) с использованием на этапе брахитерапии радиоактивных источников 125I...
Рак предстательной железы, дистанционная конформная лучевая терапия, сочетанная лучевая терапия, брахитерапия
Короткий адрес: https://sciup.org/140249282
IDR: 140249282 | DOI: 10.18027/2224-5057-2019-9-4-32-40
Текст научной статьи Результаты сочетанной лучевой терапии больных раком предстательной железы высокого риска
В настоящее время лучевая терапия является одним из основных радикальных методов лечения больных РПЖ, особенно у пожилых пациентов с отягощенным соматическим статусом. Высокая доза лучевой терапии является одним из главных предикторов биохимического контроля над опухолью [2,3]. Однако применение высоких доз дистанционной лучевой терапии повышает частоту поздних лучевых повреждений здоровых органов (прямая кишка, мочевой пузырь), степень выраженности которых прямо пропорциональна величине суммарной поглощённой дозы, зависит от режима фракционирования и времени, прошедшего после лечения [4]. Даже при применении новых технологий дистанционной лучевой терапии не всегда возможно снизить частоту поздних лучевых повреждений.
Многие исследования по СЛТ больных РПЖ [7–12] демонстрируют хорошие онкологические результаты, однако до сих пор остается открытым вопрос определения последовательности этапов СЛТ и оптимального временного интервала между ними. Рандомизированных исследований, которые могли бы подтвердить преимущества проведения контактной лучевой терапии на первом или втором этапе, а также определить наиболее эффективный временной промежуток между контактной и дистанционной лучевой терапией, мало, в связи с чем исследование эффективности различных комбинаий СЛТ является перспективным направлением.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка результатов лечения больных РПЖ высокого риска в зависимости от последовательности этапов сочетанной лучевой терапии и временного интервала между ними.
МАТЕРИАЛЫ И МЕТОДЫ
С 2014–2017 гг. в отделении радиохирургии НМИЦ онкологии им. Н.Н. Блохина 53 больным РПЖ была проведена СЛТ на фоне длительной гормональной терапии (ГТ) (не менее 24 мес.). Медиана наблюдения составила 38 месяцев. Возраст больных варьировал от 54 лет до 81 года (68,11±4,7 лет). Анализ больных по возрастным группам показал, что большинство больных было старше 65 лет (71,6%).
В исследование были включены больные с гистологически верифицированным диагнозом РПЖ T1-3N0-1M0 стадии, индекс Глисона 6–10, уровень ПСА>10 нг/мл, высокий риск рецидивирования по шкале D’Amico, объем предстательной железы менее 60 см3.
Таблица 1. Характеристика больных в зависимости от последовательности проведения контактной и ДЛТ
|
Характеристика |
Все больные (n=53) |
БТ+ДЛТ (n=31) |
ДЛТ+БТ (n=22) |
|
Возраст |
|||
|
Средний возраст |
68,1 |
68,2 |
67,9 |
|
Клиническая стадия |
|||
|
T2N0M0 |
11 (20,8%) |
7 (13,2%) |
4 (7,55%) |
|
T3N0M0 |
42 (79,2%) |
24 (45,2%) |
18 (34%) |
|
Шкала Глисона |
|||
|
3+3=6 |
11 (20,7%) |
6 (11,3%) |
5 (9,4%) |
|
3+4=7 |
13 (24,5%) |
7 (13,2%) |
6 (11,3%) |
|
4+3=7 |
15 (28,3%) |
7 (13,2%) |
8 (15,1%) |
|
4+4=8 |
10 (18,9%) |
4 (7,6%) |
6 (11,3%) |
|
4+5=9 |
3 (5,7%) |
2 (3,8%) |
1 (1,9%) |
|
5+5=10 |
1 (1,9%) |
1 (1,9%) |
— |
|
Уровень ПСА до лечения |
|||
|
<10 нг/мл |
11 (20,8%) |
6 (11,3%) |
5 (9,5%) |
|
10–20 нг/мл |
14 (26,4%) |
8 (15,1%) |
6 (11,3%) |
|
>20 нг/мл |
28 (52,8%) |
17 (32%) |
11 (20,8%) |
|
Размер опухолевого узла |
|||
|
<1 см |
10 (18,8%) |
6 (11,3%) |
4 (7,5%) |
|
1–2см |
32 (60,4%) |
20 (37,8%) |
12 (22,6%) |
|
>2 см |
11 (20,8%) |
5 (9,5%) |
6 (11,3%) |
|
Объем железы до лечения |
|||
|
<30 см3 |
12 (22,7%) |
7 (13,2%) |
5 (9,5%) |
|
31–40см3 |
14 (26,4%) |
12 (22,7%) |
2 (3,7%) |
|
41–50см3 |
10 (18,8%) |
6 (11,3%) |
4 (7,5%) |
|
>50 см3 |
17 (32,1%) |
6 (11,3%) |
11 (20,8%) |
|
Урологические жалобы |
|||
|
Дизурия |
25 (47,2%) |
15 (28,4%) |
10 (18,8%) |
|
Никтурия |
11 (20,8%) |
5 (9,5%) |
6 (11,3%) |
|
Поллакиурия |
4 (7,5%) |
2 (3,77%) |
2 (3,77%) |
|
Вялая струя |
4 (7,5%) |
2 (3,77%) |
2 (3,77%) |
|
Не было жалоб |
9 (17%) |
7 (13,2%) |
2 (3,7%) |
|
Потенция до начала ГТ |
|||
|
Была |
25 (47,2%) |
15 (28,4%) |
10 (18,8%) |
|
Остаточная моча |
|||
|
Выявлена |
11 (20,7%) |
3 (5,7%) |
8 (15%) |
|
Среднее значение |
31,8 см3 |
36 см3 |
30,2 см3 |
|
Урофлоуметрия |
|||
|
Qmax < 10мл/сек |
7 (13,2%) |
3 (5,8%) |
4 (7,5%) |
|
Qmax 10–15 мл/сек |
17 (32%) |
9 (17%) |
8 (15%) |
|
Qmax > 15 мл/сек |
29 (54,8%) |
19 (35,8%) |
10 (19%) |
|
Интервал между этапами СЛТ |
|||
|
До 4 недель |
6 (11,3%) |
3 (5,66%) |
3 (5,66%) |
|
4–7 недель |
17 (32%) |
6 (11,3%) |
11 (20,8%) |
|
Более 8 недель |
30 (56,6%) |
22 (41,5%) |
8 (15,1%) |
БТ-ДЛТ — брахитерапия+дистанционная лучевая терапия; ДЛТ-БТ — дистанционная лучевая терапия+брахитерапия; ПСА — простат-специфический антиген; ГТ — гормональная терапия; СЛТ — сочетанная лучевая терапия; Qmax — максимальный поток мочи.
Таблица 2. Характеристика больных в зависимости от интервала между этапами СЛТ
|
Характеристика |
Все больные (n=53) |
Интервал между этапами СЛТ |
||
|
До 4 нед. (n=6) |
4–7 нед. (n=17) |
8 нед. (n=30) |
||
|
Возраст |
||||
|
Средний возраст |
68,1 |
63 |
69,1 |
68,5 |
|
Клиническая стадия |
||||
|
T2N0M0 |
11 (20,7%) |
2 (3,8%) |
4 (7,5%) |
5 (9,4%) |
|
T3N0M0 |
42 (79,2%) |
4 (7,5%) |
13 (24,5%) |
25 (47,2%) |
|
Шкала Глисона |
||||
|
3+3=6 |
11 (20,7%) |
2 (3,8%) |
4 (7,5%) |
5 (9,4%) |
|
3+4=7 |
13 (24,5%) |
- |
6 (11,3%) |
7 (13,2%) |
|
4+3=7 |
15 (28,3%) |
2 (3,8%) |
6 (11,3%) |
7 (13,2%) |
|
4+4=8 |
10 (18,9%) |
2 (3,8%) |
1 (1,9%) |
7 (13,2%) |
|
4+5=9 |
3 (5,7%) |
- |
- |
3 (5,7%) |
|
5+5=10 |
1 (1,9%) |
- |
- |
1 (1,9%) |
|
Уровень ПСА до лечения |
||||
|
<10 нг/мл |
11 (20,7%) |
2 (3,8%) |
4 (7,5%) |
5 (9,4%) |
|
10–20 нг/мл |
14 (26,4%) |
2 (3,8%) |
7 (13,2%) |
5 (9,4%) |
|
>20 нг/мл |
28 (52,8%) |
2 (3,8%) |
6 (11,3%) |
20 (37,7%) |
|
Объем железы до лечения |
||||
|
<30 см3 |
12 (22,7%) |
3 (5,8%) |
4 (7,5%) |
5 (9,4%) |
|
31–40см3 |
14 (26,4%) |
- |
5 (9,4%) |
9 (17%) |
|
41–50см3 |
10 (19%) |
- |
3 (5,8%) |
7 (13,2%) |
|
>50 см3 |
17 (32,1%) |
3 (5,8%) |
6 (11,3%) |
8 (15%) |
Критериями исключения пациентов из исследования было наличие отдаленных метастазов РПЖ, трансуретральная резекция предстательной железы в анамнезе, наличие противопоказаний к проведению спинального и общего обезболивания, отсутствие прямой кишки, ожидаемая продолжительность жизни менее 5 лет, ранее проведенная лучевая терапия на органы малого таза, ECOG>2.
Согласно классификации TNM, у большинства больных (42–79,2%) выявлена T3N0M0 стадия заболевания, T2N0M0 диагностирована у 11 пациентов (20,8%). В исследуемой группе пациентов уровень сывороточной концентрации ПСА варьировал от 5,5 нг/мл до 311 нг/мл (39,7±7,9 нг/мл). У большинства больных (52,8%) уровень ПСА был выше 20 нг/мл.
В зависимости от последовательности дистанционной и контактной лучевой терапии больные были распределены на 2 группы (табл. 1). В первую группу были включе-
ПСА — простат-специфический антиген; СЛТ — сочетанная лучевая терапия.
Таблица 3. Острые лучевые реакции в зависимости от групп
|
Группы больных |
Постлучевой цистит |
Постлучевой ректит |
|
1 группа n=31 (58,5%) |
14 (26,4%) |
3 (5,7%) |
|
2 группа n=22 (41,5%) |
12 (22,6%) |
4 (7,5%) |
|
Всего n=53 (100%) |
26 (49%) |
7 (13,2%) |
Таблица 4. Острые лучевые реакции в зависимости от интервала СЛТ
|
Интервал между этапами СЛТ |
Постлучевой цистит |
Постлучевой ректит |
|
до 4 нед. n=6 (11,3%) |
4 (66,7%) |
1 (16,6%) |
|
4–8 нед. n=17 (32,1%) |
10 (58,8%) |
2 (11,7%) |
|
более 8 нед. n=30 (56,6%) |
12 (40%) |
4 (13,3%) |
последовательность СЛТ
--БТ+ДЛТ
--ДЛТ+БТ
Рисунок 1. Безрецидивная выживаемость больных в зависимости от последовательности этапов СЛТ
Таблица 5. Анализ поздних лучевых повреждений по группам
ДЛТ выполнялась на линейном ускорителе электронов Clinac (Varian, USA) в режиме стандартного фракционирования 5 раз в неделю, до СД 46 Гр (23 фракции) с использованием технологии VMAT (лучевая терапия с объемной модулированной интенсивностью). В соответствии с рекомендациями ICRU, в клинический объем облучения были включены предстательная железа с па-рапростатической клетчаткой, семенные пузырьки, зоны регионарного метастазирования (общие, внутренние и наружные подвздошные, пресакральные и запирательные лимфатические узлы) [5]. Имплантация источников 125I
(Isocord, BEBIG, Россия) в предстательную железу проводилась под УЗ-контролем с использованием планирующей системы PSID 5.0 в режиме онлайн. Суммарная доза на предстательную железу была 110 Гр. Гормонотерапия аналогами лютеинизирующего гормона рилизинг гормона (гозерелин 3,6 мг 1 раз в 28 дней, подкожно) проводилась всем больным в неоадьювантном (2–4 мес.) и адьювантном режимах (не менее 24 мес.).
Для оценки эффективности проводимой терапии у больных применяли критерии RECIST 1.1. Продолжительность жизни оценивали с первого дня лечения больных до последнего дня наблюдения или смерти. Биохимическим рецидивом считали увеличение ПСА на 2 нг/мл по сравнению с минимальным достигнутым значением маркера (надир) [6]. Поскольку из 53 больных, включенных в исследование, умер всего 1 больной, было нецелесообразным проводить анализ общей и опухолево-специфичной выживаемости.
Для оценки отдаленных результатов использовался интервальный метод построения таблиц дожития «Life table», рекомендованный для применения Международным противораковым союзом (UICC). Выживаемость больных высчитывалась по состоянию на 01.05.2019 г. Для
£
60 -
20 -
10 -
о
Статус
интервал между этаимн
---др 4 недель
— 4-7 недель
— белее 3 недель
Time
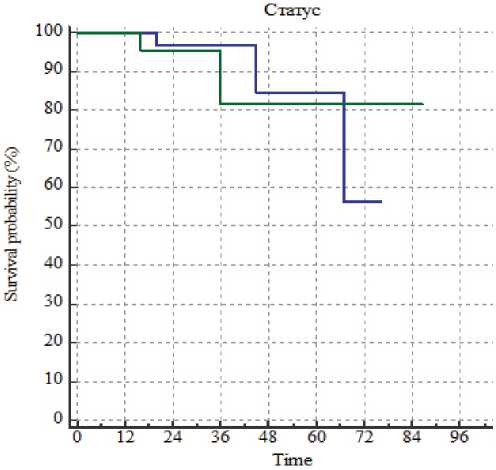
Рисунок 2. Безрецидивная выживаемость больных в зависимости от интервала между этапами СЛТ
сравнения таблиц выживаемости использовались тесты Wilcoxon (Breslow) и Mantel-Cox. Достоверность выявленных различий рассчитывалась по критерию Стьюдента. Достоверным считалось различие с вероятностью ошибки менее 5% (p <0,05).
РЕЗУЛЬТАТЫ
Курс СЛТ был реализован в полном объеме всем больным, включенным в исследование. Больные были прослежены от 24 до 86 мес. (42±2 мес.). Медиана наблюдения составила 38 мес. После неоадьювантной ГТ отмечено уменьшение объема предстательной железы на 33%, до 14–65 см3 (29,7±1,61 см3), снижение уровня сывороточного ПСА на 96%, до 1,6–9,04 нг/мл (1,61±0,32 нг/мл).
После завершения СЛТу всех больных отмечался полный клинический регресс первичной опухоли. Несмотря на это, у 5 (9,4%) пациентов наблюдалось прогрессирование заболевания через 20–67 мес. (37,9±7,4 мес) после завершения лучевой терапии. Медиана до прогрессирования заболевания составила 29,9 мес. У двух больных были диагностированы только биохимические рецидивы, а у трех больных были выявлены отдаленные метастазы. Отдаленные метастазы локализовались в парааорталь-ных лимфатических узлах, легких и костях. Один больной с биохимическим рецидивом умер от острого инфаркта миокарда (1,9%). Четверо больных с прогрессированием заболевания живы (7,5%), им назначена противоопухолевая терапия.
В первой группе, в которой брахитерапия проводилась на первом этапе, а ДЛТ на втором (БТ-ДЛТ), прогрессирование наблюдалось у 3 больных (5,7%); во второй группе, в которой ДЛТ была на первом этапе, а брахитерапия на втором, спрогрессировали 2 больных (3,8%). Не было выявлено достоверных различий в медиане пятилетней безрецидивной выживаемости больных в зависимости от последовательности этапов СЛТ, в первой группе она составила 84,5 ± 11,7%, а во второй 83,5 ± 9,1 (p=0,73, рис. 1).
У всех больных с прогрессированием интервал между этапами СЛТ был более 8 недель. Медиана пятилетней безрецидивной выживаемости больных с интервалом более 8 недель составила 58±2,4%. У больных с интервалом менее 4 недель и 4–7 недель не было ни одного случая прогрессирования заболевания (p=0,23, рис. 2).
Оценку острой токсичности и поздних лучевых повреждений после сочетанной лучевой терапии проводили по шкале RTOG (Radiation Therapy Oncology Group) и международной шкале токсичности NCI–CTC v. 4
ОСТРЫЕ ЛУЧЕВЫЕ ОСЛОЖНЕНИЯ
После проведения СЛТ больным РПЖ наблюдались лучевые реакции со стороны мочевыделительной системы (циститы) и со стороны нижних отделов желудочно-ки- шечного тракта (ректиты). Среди исследуемых больных не наблюдалось ни одного случая развития острых лучевых реакций IV степени.
Частота развития острых постлучевых циститов (ОПЦ) составила 49% (табл. 3): I степени у 23 больных (43,4%), II степени у 2 больных (3,8%), III степени у 1 больного (1,9%). Следует отметить, что у больного с ОПЦ III степени был короткий интервал между этапами СЛТ (менее 4 недель). В первой группе (n=31) ОПЦ I степени наблюдались у 14 больных (26,4%), а во второй группе (n=22) у 12 больных (22,6%). ОПЦ развивались гораздо чаще ОПР (49% и 13,2%). Частота острых постлучевых ректитов (ОПР) I степени составила 13,2%, а ОПР II–IV степени не наблюдались ни у одного больного. В первой группе ОПР наблюдались всего у 3 больных (5,7%), а во второй группе у 4 больных (7,5 %).
При анализе частоты острых лучевых реакций в зависимости от интервала между этапами СЛТ было отмечено, что у больных с интервалом до 4 недель (n=6) ОПЦ развивались чаще (66,7%), поэтому набор в данную группу был прекращен (табл. 4). Ау больных с интервалом 4–7 недель (n=17) частота ОПЦ составила 58,8%, с интервалом более 8 недель (n=12) 40%. Частота ОПР была на низком уровне и не зависела от интервала между этапами СЛТ: у больных с интервалом до 4 недель (n=6) ОПР наблюдались у 1 больного (16,6%), 4–7 недель (n=17) —у 2 больных (11,7%), более 8 недель — у 4 больных (13,3%, табл. 4).
ПОЗДНИЕ ЛУЧЕВЫЕ ОСЛОЖНЕНИЯ
Частота развития поздних лучевых осложнений (ПЛО) мочевого пузыря составила 9,5%: осложнения I степени наблюдались у 3 больных (5,7%), II степени у 2 больных (3,8%). Не было выявлено статистически достоверных различий в частоте ПЛО со стороны мочевого пузыря в первой и второй группах (табл. 5).
Частота развития ПЛО I степени со стороны прямой кишки была на низком уровне в обеих группах (5,7%): в первой группе — всего у одного больного (1,9%), а во второй у 2 больных (3,8%). ПЛО прямой кишки II–IV степени не отмечено ни у кого. Также не было выявлено достоверных отличий в частоте развития поздних повреждениях прямой кишки в зависимости от интервала СЛТ.
ОБСУЖДЕНИЕ
В настоящее время нет четких рекомендаций по поводу последовательности проведения этапов СЛТ и интервала между ними. Исторически сложилось так, что в разных учреждениях подходы в отношении последовательности и интервала СЛТ отличались. Sylvester et al. проводили имплантацию источников в предстательную железу после ДЛТ с интервалом 4 недели [7], в то время как Critz и Levinson имплантировали источники в предстательную железу до ДЛТ с интервалом 3 недели [8]. В обоих иссле- дованиях результаты лечения были обнадеживающими и существенно не различались: в исследовании Sylvester et al. 15-летняя выживаемость без биохимического рецидива у больных РПЖ высокого риска составила 68%, а в исследовании Critz и Levinson 10-летняя безрецидивная выживаемость больных РПЖ высокого риска была 61%.
В исследовании ASCENDE-RT имплантация источников в предстательную железу проводилась через 2–3 недели после ДЛТ; 5-, 7- и 9-летние результаты выживаемости без биохимического рецидива составили 89%, 86% и 83%, соответственно [9]. В исследовании фазы II RTOG 00–19 имплантацию источников в предстательную железу проводили через 3–6 недель после ДЛТ [10], в исследовании Spratt et al. — на первом этапе, с ДЛТ через 4–8 недель [11]. В некоторых исследованиях брахитерапия проводилась как до, так и после ДЛТ [12].
Несмотря на то, что во всех исследованиях были продемонстрированы хорошие результаты лечения больных РПЖ и результаты существенно не различались между собой, исследования были разнородными, не было акцента на последовательности проведения этапов СЛТ и временного фактора между ними. В настоящее время вопрос последовательности проведения этапов СЛТ и интервала между ними остается не до конца изученным, недостаточно крупных рандомизированных исследований, на основании которых можно было бы прийти к определенному консенсусу.
Наше исследование посвящено оценке результатов лечения больных РПЖ в зависимости от последовательности и интервала между этапами СЛТ. Последовательность проведения брахитерапии была определена наличием в нашем учреждении радиоактивных источников 125I. Таким образом, в первую группу был включен 31 больной, а во вторую 22 больных. Согласно общепринятым стандартам ДЛТ, на первом этапе всегда проводится облучение малого таза (регионарные лимфатические узлы, предстательная железа, парапростатическая клетчатка и семенные пузырьки), а затем проводится локальное облучение (буст) предстательной железы для достижения эскалации дозы. Аналогично данной последовательности, больным был подведен брахитерапевтический буст после ДЛТ на малый таз. В нашем исследовании мы ожидали увидеть преимущества данной последовательности, однако анализ результатов СЛТ показал отсутствие достоверных раз- личий 5-летней безрецидивной выживаемости и частоты токсичности между группами.
Согласно рекомендациям Американского общества брахитерапевтов, второй этап СЛТ (брахитерапия или ДЛТ) проводился после стихания острых лучевых реакций, так у нас сформировались 3 подгруппы с разным интервалом — до 4 недель, 4–7 недель, более 8 недель. В ходе нашего исследования было выявлено, что больные с интервалом до 4 недель между этапами СЛТ имели выраженные острые лучевые осложнения, в том числе III степени, в связи с чем набор в данную группу был прекращен. У всех больных с прогрессированием заболевания (9,4%) интервал между этапами СЛТ был более 8 недель. Следует отметить, что в этой группе зафиксировано больше всего неблагоприятных факторов риска рецидивирования. У большинства больных (37,7%) данной группы максимальный уровень ПСА до лечения был больше 20 нг/мл, индекс Глисона 8 у 13,2%, 9 у 5,7% и 10 у 1,9% больных, а стадия T3N0M0 была отмечена у 47,2% больных. Таким образом, в связи небольшой выборкой больных, а также наличием у больных с интервалом 8 недель больше факторов риска рециди-вирования, достоверность развития прогрессирования заболевания при увеличении интервала между этапами СЛТ не выявлена.
ВЫВОДЫ
СЛТ с использованием радиоактивных источников 125I на фоне длительной гормональной терапии является эффективным и безопасным методом лечения больных РПЖ высокого риска. При увеличении интервала между этапами СЛТ более 8 недель достоверность развития прогрессирования заболевания не выявлена. Риск развития прогрессирования заболевания у данной группы больных прежде всего связан со стадией заболевания, индексом Глисона и начальным уровнем ПСА более 20 нг/мл. Изменение последовательности этапов СЛТ не влияет на эффективность лечения и частоту лучевых осложнений. Определение последовательности проведения контактной и дистанционной лучевой терапии, а также оптимального интервала между ними является важным этапом для клинической практики. Однако преимущество определенной методики можно доказать только путем проведения рандомизированного исследования.
Список литературы Результаты сочетанной лучевой терапии больных раком предстательной железы высокого риска
- Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой Злокачественные новообразования в России в 2018 году (заболеваемость и смертность) М.: МНИОИ им. П. А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2019. илл. 250 с. ISBN: 978-5-85502-243-8
- Hanks GE, Martz KL, Diamond JJ. The effect of dose on local control of prostate cancer. // Int J Radiat Oncol Biol Phys. 1988 Dec; 15 (6):1299 - 305.
- Zelefsky MJ, Pei X, Chou JF, Schechter M, Kollmeier M, Cox B, Yamada Y, Fidaleo A, Sperling D, Happersett L, Zhang Z. Dose escalation for prostate cancer radiotherapy: predictors of long-term biochemical tumor control and distant metastases-free survival outcomes. Eur Urol. 2011 Dec;60 (6):1133 - 9. 10.1016 / j. eururo. 2011.08.029. Epub 2011 Aug 22. PMID: 21889832; PMCID: PMC4037155. DOI: 10.1016/j.eururo.2011.08.029
- Zelefsky MJ, Fuks Z, Wolfe T et al. Locally advanced prostatic cancer: long-term toxicity outcome after three-dimensional conformal radiation therapy: a dose-escalation study. // Radiology. 1998 Oct; 209 (1):169 - 74.
- International Commission on Radiation Units and Measurements. Prescribing, Recording, and Reporting Photon Beam Therapy (Supplement to ICRU Report 50). ICRU Report 62. Bethesda, MD: International Commission on Radiation Units and Measurements, 1999
- Roach, M., Hanks, G., Thames, H., Schellhammer, P., Shipley, W. U., Sokol, G. H., & Sandler, H. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: Recommendations of the RTOG-ASTRO Phoenix Consensus Conference. International Journal of Radiation Oncology Biol. Phys., 65 (4), 965 - 974. 10.1016 / j. ijrobp. 2006.04.029
- DOI: 10.1016/j.ijrobp.2006.04.029
- Sylvester JE, Grimm PD, Blasko JC, et al: 15-year biochemical relapse free survival in clinical stage T1-T3 prostate cancer following combined external beam radiotherapy and brachytherapy; Seattle experience. Int J Radiat Oncol Biol Phys 67:57 - 64, 2007
- Critz FA, Levinson K: 10-year disease-free survival rates after simultaneous irradiation for prostate cancer with a focus on calculation methodology. J Urol 172:2232 - 2238, 2004
- Morris WJ, Tyldesley S, Rodda S, Halperin R, Pai H, McKenzie M, Duncan G, Morton G, Hamm J, Murray N, *ASCENDE-RT: An Analysis of Survial Endpoints for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost to a Dose-Escalated External Beam Boost for High- And Intermediate-Risk Prostate Cancer, International Journal of Radiation Oncology • Biology • Physics (2016), 10.1016 / j. ijrobp. 2016.11.026.
- DOI: 10.1016/j.ijrobp.2016.11.026
- Lawton CA, Yan Y, Lee WR, et al. Long-term results of an RTOG phase II trial (00-19) of external-beam radiation therapy combined with permanent source brachytherapy for intermediate-risk clinically localized adenocarcinoma of the prostate. Int J Radiat Oncol Biol Phys 2012;82: e795ee801.
- Spratt, D. E., Zumsteg, Z. S., Ghadjar, P., Kollmeier, M. A., Pei, X., Cohen, G., Zelefsky, M. J. (2014). Comparison of high- dose (86.4 Gy) IMRT vs combined brachytherapy plus IMRT for intermediate-risk prostate cancer. BJU International, 360 - 367. 10.1111 / bju. 12514
- DOI: 10.1111/bju.12514
- Shilkrut M, Merrick GS, McLaughlin PW, et al. The addition of low-dose-rate brachytherapy and androgen-deprivation therapy decreases biochemical failure and prostate cancer death compared with dose-escalated external-beam radiation therapy for high-risk prostate cancer. Cancer 2013; 119:681e690.


