Риски эмболизационных технологий в хирургии доброкачественных и злокачественных опухолей основания черепа
Автор: Гуляев Д.А., Белов И.Ю., Курносов И.А., Чижова К.А., Самочерных Н.К., Балахнин П.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.24, 2025 года.
Бесплатный доступ
Цель исследования - обобщить мировой и собственный опыт применения эмболизационных технологий в хирургии доброкачественных и злокачественных опухолей основания черепа, детально проанализировав связанные с ними риски и осложнения для совершенствования подходов к лечению и минимизации негативных последствий. Материал и методы. Проведен анализ научных публикаций, найденных в международных медицинских базах данных (PubMed, Cochrane Library, Elibrary и др.), охватывающих исследования за последние 20 лет, а также ретроспективный анализ собственного клинического материала с применением эмболизационных методов у пациентов с опухолями основания черепа. Изучены особенности и специфика эмболизационных техник, применяемые материалы и критерии оценки осложнений, включая классификации, разработанные международными экспертными сообществами. Результаты. Анализ показал, что результаты применения эмболизационных технологий в лечении опухолей основания черепа остаются противоречивыми, а спектр осложнений варьирует от незначительных реакций до тяжелых и инвалидизирующих состояний. Среди наиболее серьезных осложнений выявлены инсульт, нарушения функции черепных нервов, некроз тканей и летальные исходы. Важным аспектом является определение оптимального временного интервала между эмболизацией и последующей хирургической резекцией, т. к. слишком раннее вмешательство не позволяет в полной мере реализовать потенциал эмболизации, а отсроченное ведет к риску реканализации и нарастанию перифокального отека с прогрессированием неврологического дефицита. Особое внимание уделено постэмболизационному неврологическому синдрому (PENS), способному вызывать стойкие и необратимые неврологические нарушения. Заключение. Несмотря на потенциальные преимущества в снижении интраоперационной кровопотери и облегчении хирургического вмешательства, использование эмболизационных технологий требует тщательного анализа и оценки возможных рисков и осложнений. Решение о применении эмболизации должно быть строго индивидуальным и опираться на междисциплинарный подход с учетом особенностей каждого клинического случая.
Эмболизация, химиоэмболизация, опухоли основания черепа, злокачественные опухоли головы и шеи
Короткий адрес: https://sciup.org/140309151
IDR: 140309151 | УДК: 616.714-006-089 | DOI: 10.21294/1814-4861-2025-24-2-150-161
Текст научной статьи Риски эмболизационных технологий в хирургии доброкачественных и злокачественных опухолей основания черепа
В настоящее время одним из предлагаемых методов, используемых в комплексном лечении опухолей головы и шеи, является эмболизация. Однако несмотря на довольно длительный период ее применения в общемировой практике, результаты остаются довольно неоднозначными, точные показания не определены, а число осложнений колеблется от незначительных до внушительных значений [1–4]. В то же время остается открытым вопрос, что считать осложнениями при применении данных медицинских технологий, учитывая, что подобного рода вмешательства используются при разных опухолях, а операции по их поводу осуществляются в различные временные рамки, при этом количество используемых материалов весьма разнообразно. В нашей работе мы рассматриваем многообразие неблагоприятных последствий после эмболизации, обобщая опыт мировых учреждений, сравнивая его со своим, и анализируем вероятные осложнения.
Цель исследования – обобщить мировой и собственный опыт применения эмболизационных технологий в хирургии доброкачественных и злокачественных опухолей основания черепа, детально проанализировав связанные с ними риски и осложнения для совершенствования подходов к лечению и минимизации негативных последствий.
С точки зрения подходов к классификации осложнений эмболизирующих процедур их можно разделить на легкие и тяжелые в зависимости от клинической значимости. Тяжелые требуют дополнительной терапии, увеличивают время госпитализации, приводят к необратимым последствиям, которые включают инсульт, дисфункцию черепных нервов, некроз тканей, контраст-индуцированную нефропатию и летальный исход. Легкие осложнения – это те, которые не требуют специального лечения, кроме наблюдения, и не имеют клинических последствий. Они включают осложнения в месте прокола, не требующие переливания крови и не затрагивающие нервные структуры, а также локальную боль и отек [5]. Также существует общепринятая классификация осложнений, предложенная Cardiovascular and Interventional Radiological Society of Europe, основанная на работе Clavien–Dindo, которая включает в себя 6 градаций осложнений: 1 – которые могут быть разрешены во время текущей хирургической сессии и не требуют дальнейшего наблюдения; 2 – то же, но требуется наблюдение в течение <48 ч; 3 – требующие дополнительных процедур, но не имеющие последствий; 4 – осложнения со стойкими умеренными последствиями, позволяющими работать и самостоятельно себя обслуживать; 5 – осложнения со стойкими тяжелыми, инвалидизирующими последствиями; 6 – смерть [6]. Ввиду того, что осложнения, развивающиеся при лечении новообразований в области головы и шеи, в подавляющем большинстве случаев имеют нейрохирургический характер, в отношении данной группы пациентов будет адекватным применение разработанной нами шкалы осложнений, основанной группой экспертов на многомерной оценке тяжести [7].
По данным J.Y. Chun et al., резекция опухоли менее чем через 24 ч после эмболизации нивелирует возможные преимущества интервенционного вмешательства, не позволяя завершиться процессу деваскуляризации, что, таким образом, никак не влияет на объем кровопотери [8]. Небезынтересно, что гистологическое исследование, проведенное B.K. Pauw et al., показало, что реканализация с последующей реваскуляризацией наблюдается примерно в 30 % эмболизированных сосудов. Кроме того, также по данным анализа гистологических препаратов было показано, что процесс облитерации в эмболизированных сосудах завершается лишь к 7-м сут после вмешательства [9]. По понятным причинам оперативное вмешательство не всегда возможно осуществить в заданные сроки, что увеличивает риск расширения перифокального отека вокруг эмболизированной, частично некротизирующейся опухоли, тем самым обусловливая прогрессирующий нарастающий неврологический дефицит или появление новых симптомов [10]. Кроме того, вышесказанное диктует необходимость назначать таким пациентам возрастающие дозы стероидных препаратов, добавляя долю неблагоприятных эффектов. Таким образом, эмболизация опухолей может привести к драматическому эффекту прогрессирующего отека с последующей дислокацией и вклинением.
Постэмболизационный неврологический синдром
Помимо крупных неврологических осложнений после предоперационной эмболизации наблюдаются незначительные нежелательные явления, включая лихорадку, головные боли, тошноту, рвоту, потерю аппетита или усиление воспалительных реакций. Однако связь этих общих симптомов с неврологическими неизвестна. Тем не менее подобные реакции также временно возникают после трансартериальной эмболизации внутрибрюшин-ных/забрюшинных органов, таких как печень, матка и почки, это называется синдромом постэмболизации (СПЭ). СПЭ может возникать особенно часто после химиоэмболизации [11]. Y. Tanaka et al. оценили связь между неврологическими ослож- нениями после предоперационной эмболизации внутричерепных опухолей/опухолей основания черепа и общими симптомами, указанными выше, и предложили новый термин – постэмболизационный неврологический синдром (PENS) [12]. Авторы выявили закономерность: если симптомы поражения черепных нервов возникали через 14–72 ч после эмболизации (отсроченно), то они включали в себя лишь обострение существующих неврологических симптомов. Именно это обострение существующих неврологических симптомов с поздним началом в сочетании с системными симптомами определяется как PENS. Напротив, у пациентов с ранним началом (через 1–6 ч) все неврологические изменения представляли собой новые симптомы, которых до эмболизации не отмечалось. В двух из трех случаев неврологические симптомы сохранялись в течение как минимум 1 года и более. Эти новые симптомы поражения черепных нервов, возникшие ранее после эмболизации, были интерпретированы как результат стойкой ишемии черепных нервов.
Анастомозы
Анастомозы внутри бассейнов ВСА или НСА, а также между ними могут привести к непреднамеренной внутричерепной эмболизации критических нервных структур, а также органов и тканей головы [5, 10]. Так, после эмболизации по поводу носового кровотечения из опухоли были описаны ипсилатеральная височно-лицевая боль и отек лица [13]. Некроз может возникнуть на коже кончика носа, крыльев и хрящей, на слизистой оболочке твердого неба и кожи лица [14–16].
Среди поражения черепных нервов паралич лицевого нерва является наиболее часто встречающимся [17–20]. Это происходит из-за того, что барабанный и сосцевидный сегменты лицевого нерва имеют перекрестное кровоснабжение – от шилососцевидной артерии и каменистой ветви средней менингеальной артерии. Вероятность паралича выше, если все ветви затылочной, заушной и средней менингеальной артерий эмболизированы из-за перекрытия источников кровоснабжения лицевого нерва [21]. Окклюзии центральной артерии сетчатки с последующим амаврозом могут возникать через анастомоз между наружной (клиновидно-небной и большой небной ветвями верхнечелюстной артерии) и внутренней сонной артериями (передней и задней ветвями глазной артерии) [22, 23].
Менингиомы
Впервые процедура предоперационной эмболизации внутричерепной менингиомы описана C. Manelfe et al. в 1973 г. [24]. С тех пор осложнениям, возникающим после этой процедуры, посвящено довольно много работ [25, 26]. D.F. Carli et al. описали осложнения у 11 из 198 пациентов с 201 эмболизированной менингиомой, большая часть (10) из них были геморрагическими, притом гематомы формировались не только интратумо-розно (n=4), но и в различных вариантах периту-морозного и субарахноидального кровоизлияний. Стоит отметить, что в данном исследовании риск кровоизлияния не связывали со степенью малигни-зации опухоли. Исходя из полученных результатов, авторы отметили, что пересмотрели свои взгляды на эмболизацию менингиом: воздерживаться от эмболизации, когда артериальное кровоснабжение из ветвей внутренней сонной артерии является преобладающим, а если кровоснабжение осуществляется в основном за счет наружных сонных ветвей – эмболизировать только менингиомы с гипертрофированными сосудами, используя более крупные эмболизирующие компоненты во избежание их попадания в небольшие, но значимые функциональные артерии [26].
Одно из проведенных ранее исследований продемонстрировало, что предоперационная эмболизация менингиомы не привела к улучшению клинического результата или значительному уменьшению кровопотери [27]. D.M. Raper et al. также сообщили, что предоперационная эмболизация не изменила продолжительность операции, осложнения или степень резекции при анализе когорты из 224 пациентов с менингиомами [28].
Остается нерешенным вопрос использования антикоагулянтов, которые противопоказаны больным с внутричерепными новообразованиями. Общеизвестно, что в менингиомах, вследствие их биологического развития и поведения, нарушено функционирование каскадов свертывающей и противосвертывающей систем [29]. Это, в свою очередь, вносит свой вклад в формирование тромбогеморрагических исходов после эмболизации у данных больных. Так, по данным M. Bendszus et al., несмотря на использование гепарина, в исследовании произошло 6 ишемических событий. Два из них были предположительно тромбоэмболическими инсультами (у 2 пациентов верифицирован амавроз, у 4 – гемипарез, из них у двух он сопровождался афазией) [25]. Стоит отметить, что у одного из пациентов с амаврозом микрокатетер интраоперационно продвигался дистальнее глазной артерии и глазная ветвь не облитерировалась во время процедуры эмболизации, что тем не менее не помешало развиться амаврозу после операции. В дальнейшем при обследовании у данного больного обнаружился анастомоз между средней оболочечной и глазной артериями.
Весьма интересным представляется исследование, где при сравнении менингиом без и с предшествующей эмболизацией было обнаружено, что по ряду показателей группы не отличались совсем: ни по кровопотере (646 ± 486 vs 636 ± 453 мл), ни по количеству и объему переливаний крови. Кроме того, интраоперационные наблюдения нейрохирур- га относительно гемостаза, консистенции опухоли и внутриопухолевого некроза также существенно не различались между эмболизированными и не-эмболизированными менингиомами. При этом степень резекции опухоли, оцененная по шкале Simpson, не различалась между двумя группами. Средняя продолжительность операции была короче у пациентов, не получавших эмболизацию, чем у пациентов, получавших эмболизацию (234,0 ± 84,6 vs 310 ± 129 мин). Клинические данные также не указали на значительный эффект эмболизации, зато был зарегистрирован один случай стойкой тромбоэмболической окклюзии правой центральной артерии сетчатки во время эмболизации левой средней менингеальной артерии. Данное исследование предполагает, что показания к деваскуляризации каждой менингиомы должны быть пересмотрены и что даже в случаях тотальной деваскуляризации менингиом с последующим снижением кровопотери общая польза остается сомнительной. Недостаточно полагаться на серии случаев эффективности эмболизации без включения контрольной группы [27].
Обращают на себя внимание данные Японского регистра нейроэндоваскулярной терапии (JR-NET3): проведенный многофакторный анализ показал, что эмболизация опухолей, отличных от менингиомы, была значимо связана с развитием осложнений. Но учитывая довольно высокие цифры осложнений при эмболизации менингиом, ранее полученные другими исследователями, очевидно, что иные интракраниальные новообразования, особенно злокачественные, безусловно, подразумевают еще больший риск осложнений [30].
Параганглиомы
Предоперационная артериальная эмболизация параганглиом не является общепринятой [31]. V.R. Litle et al. подчеркивают значительный риск церебральной эмболии при незначительном снижении операционной кровопотери [32]. Сосудистое кровоснабжение опухоли через множественные мелкие коллатерали или наличие опасных анастомозов между ВСА и НСА и/или позвоночными артериями можно рассматривать как противопоказание к эмболизации из-за ограниченной эффективности [33].
Еще одним характерным осложнением при эмболизации параганглиом является дисфункция черепных нервов. B.G. Gaynor et al. обнаружили, что у 18 % пациентов с опухолями яремного гломуса после эмболизации наблюдались поражения черепных нервов без регресса симптоматики в отдаленном периоде [34]. Так, одному из пациентов была проведена суперселективная катетеризация питающего опухоль сосуда из бассейна ВСА с последующей эмболизацией Ониксом, постэмболизационная ангиография показала 90 % деваскуляризацию опухоли, признаков нецелевой эмболизации обнаружено не было. Пациент проснулся после процедуры с полным параличом лицевого нерва с правой стороны. Через семь дней после эмболизации опухоль была полностью удалена с декомпрессией лицевого нерва. Во время операции наблюдалось движение материала оникса вдоль лицевого нерва и его vasa vasorum. В течение 6 мес наблюдения у пациента не восстановилась функция лицевого нерва. Второй пациент в данной статье получил дефицит после эмболизации в виде слабости в плечах и охриплости голоса, дефицит не разрешился через 9 мес наблюдения.
B.C. Gartrell et al. объясняют повышенный риск такого рода осложнений анатомическими изменениями в кровоснабжении черепных нервов, а также частом совместном кровоснабжении наружной сонной артерией гломусных опухолей и черепных нервов, что делает их уязвимыми для окклюзии ониксом во время эмболизации [35].
Гемангиобластома
Применение эмболизации при интракраниальных гемангиобластомах является спорным. Исследования, сообщающие о результатах на данный момент, весьма противоречивы. Более того, выбор эмболизирующего материала и сроки хирургического вмешательства после эмболизации остаются неясными. Так, A.H. Liu et al. зарегистрировали большую интраоперационную кровопотерю и потребность в переливании крови у пациентов без предшествующей эмболизации [36]. Однако S. Takeuchi et al. не продемонстрировали различий в показателях заболеваемости и смертности между пациентами с гемангиобластомами, которым не проводилась предоперационная эмболизация, и больными с предшествующей интервенцией [37]. J.F. Cornelius et al. представили серию из 3 пациентов с ранее эмболизированными гемангиобластомами мозжечка, осложнившимися кровоизлиянием в послеоперационном периоде. Они предположили, что этиологией осложнений является венозная обструкция и последующий застой в опухолевых сосудах, приводящий к их разрыву. Авторы предполагают, что эмболизация гемангиобластом мозжечка из-за близости к стволовым структурам может быть весьма опасной [38].
Ангиофибромы
Осложнения, непосредственно связанные с самой транскатетерной эмболизацией, – окклюзии ветвей вследствие эмболизации через «опасные» транскраниальные артериальные анастомозы и окклюзии сосудов черепных нервов не встречались в когорте A. Gruber et al. [39]. Однако об этом сообщают многие авторы, в литературе зафиксированы случаи окклюзии центральной артерии сетчатки, дисфункции лицевого нерва [40, 41]. В серии из 170 наблюдений A.I. Ogawa et al. зарегистрировано 105 осложнений – из них 4 тяжелых [42]. Кроме того, ранее сообщалось о брадикардии, вызванной тригеминокардиальным рефлексом, в сочетании с манипуляциями на ветвях наружной сонной артерии, которые, вероятно, затрагивают афферентные пути тройничного нерва к блуждающему нерву [43].
Клинический пример 1
Пациентка Е., 49 лет. Из анамнеза было известно, что у больной врожденная гемангиома правой орбиты. До 15 лет несколько раз проводились иссечения гемангиомы. В дальнейшем отмечались увеличение в размере правого глазного яблока, наличие кровянистых выделений из правого глаза. Неоднократно обращалась к офтальмологу. Самостоятельно выполнила МСКТ головы, при которой выявлено многоузловое образование правой орбиты с ремоделированием ее стенок и верхнечелюстной пазухи. В 2017 г. выполнена химиоэмболизация сосудистой сети опухоли лекарственно насыщаемыми сферами HepaSphere с доксорубицином из бассейна верхнечелюстной артерии. В последующем отмечался прогредиентный рост образования. В 2022 г. стала отмечать кровотечения из орбиты ежедневно. Выполнено МРТ головы (4.06.22): новообразование правой орбиты, верхнечелюстной пазухи, размерами 108×96×75 мм, с наличием вторичного новообразования клетчатки правой щечной области, связанных между собой перемычкой; неоднородной структуры, с множественными кистами, распространяющееся вокруг правого глазного яблока, оттесняя его кпереди. В верхних отделах образование распространяется в полость черепа, прилежит к правой лобной и височной долям. На момент поступления клиническая картина представлена экзофтальмом и амаврозом справа, аносмией, умеренными интеллектуально-мнестическими нарушениями (рис. 1 ‒ 3).
Клинический пример 2
Пациент Т., 44 года. Анамнез заболевания с 1996 г., когда возник очаг уплотнения и гиперемии над козелком уха слева, через некоторое время возникло кровотечение из новообразования в наружный ушной проход. Со слов больного, проведена резекция очага (выписки не были предоставлены). В 2007 г. начал отмечать продолженный рост опухоли, гиперемию, распространяющуюся на ушную раковину. В течение длительного времени к врачам не обращался. В 2017 г. отек раковины усилился. При обследовании выявлена артериовенозная мальформация левой ушной раковины с интракраниальным распространением. 11.12.20 выполнена частичная эмболизация опухоли. По месту жительства. проводились повторные эмболизации – 24.03.22, 23.11.22. 27.02.23 проведена тотальная эмболизация неадгезивной композицией. В послеоперационном периоде деваскуля-ризированная ушная раковина очагово приобрела синюшный цвет, отекла, увеличилась в размерах, возникли очаги некроза (рис. 4). 6.03.23 проведено
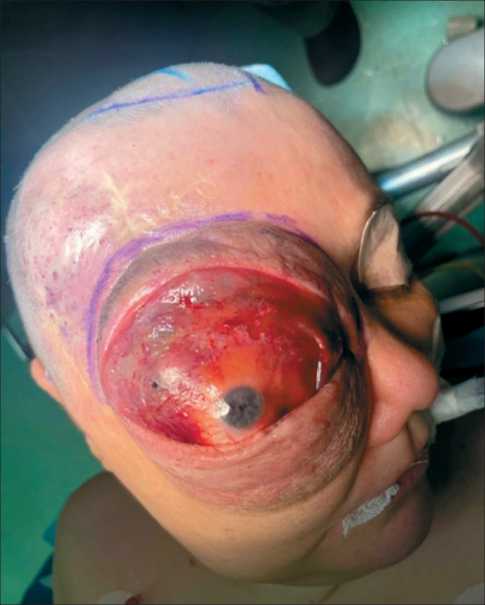
Рис. 1. Вид больной до оперативного вмешательства. Примечание: рисунок выполнен авторами Fig. 1. View of the patient before surgery. Note: created by the authors
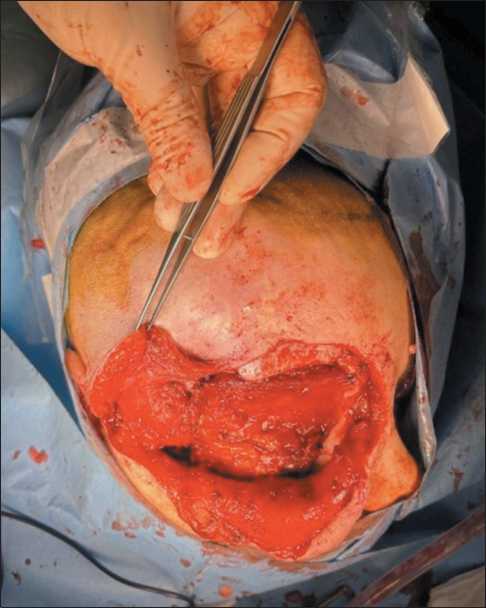
Рис. 2. После экзентерации орбиты височная мышца отделена от кости с помощью распатора, низведена в полость орбиты. Примечание: рисунок выполнен авторами Fig. 2. After exenteration of the orbit, the temporalis muscle is separated from the bone using a rasp and brought down into the orbital cavity. Note: created by the authors
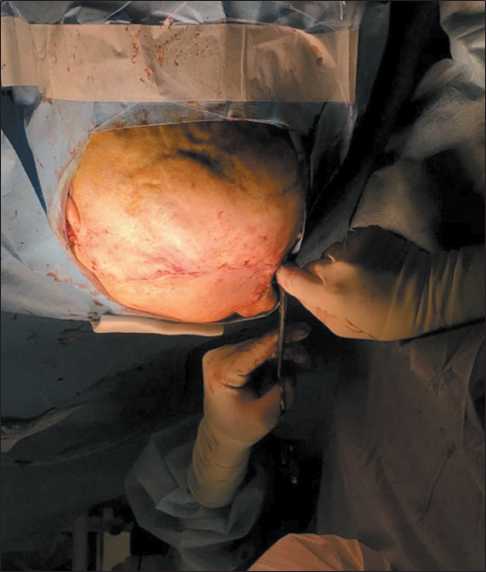
Рис. 3. Послойное ушивание раны. Примечание: рисунок выполнен авторами Fig. 3. Layer-by-layer suturing of the wound. Note: created by the authors
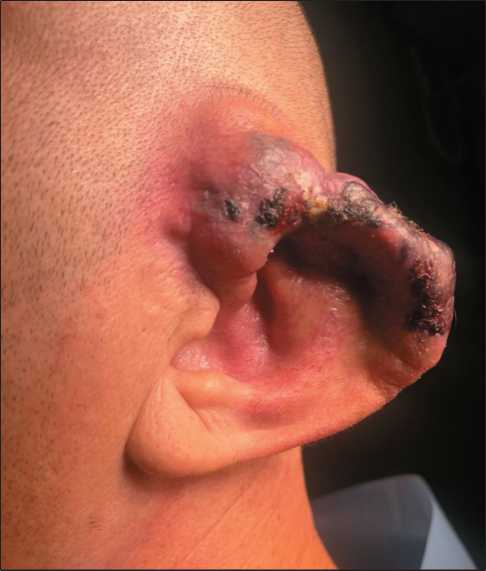
Рис. 4. Вид больного перед операцией. Примечание: рисунок выполнен авторами Fig. 4. View of the patient before surgery.
Note: created by the authors
микрохирургическое удаление опухоли левой ушной раковины с одномоментной пластикой сложносоставным аутотрансплантатом. Гистологическое заключение: солитарная фиброзная опухоль.
Злокачественные опухоли головы и шеи
Принципиально существует несколько вариантов эндоваскулярных пособий, использующихся при злокачественных опухолях головы и шеи: внутриартериальная регионарная химиоинфузия, эмболизация, а также комбинация этих методов в виде химиоэмболизации. Подавляющее большинство внутрисосудистых вмешательств связано с экстренной помощью при кровотечениях на фоне проводимой химиолучевой терапии (ХЛТ) [44]. Так, X. Yang et al. использовали эмболизацию желатиновой губкой и спиралями при острых кровотечениях у пациентов, проходящих химиолучевую терапию по поводу опухоли носоглотки. Эмболизация использовалась как вспомогательный метод в сочетании с задней тампонадой, эндоскопическим гемостазом и имплантацией стентов в магистральные сосуды [45]. T. Takigawa et al. описали случай эмболизации метастаза гепатоцеллюлярного рака в гипофиз при активном кровотечении [46]. T. Sanomura et al. приводят случай эмболизации опухоли верхнечелюстной пазухи из-за рецидивирующих кровотечений. Важно, что авторы отмечают сложность сосудистой архитектоники в данной анатомической зоне и отмечают высокие риски процедуры [47]. C.C. He et al. отмечают, что при кровотечении из опухолей носоглотки применялись эмболизация по экстренным показаниям с тампонадой носа и трахостомией. Кровотечения из бассейна внутренней сонной артерии сопровождались высокой летальностью [48]. N. Shetty et al. определили место эмболизации как опцию у пациентов с нерезектабельными, рецидивными или метастатическими опухолями в случае острого кровотечения [49].
Другим вариантом внутрисосудистых вмешательств является химиоинфузия. Внутриартериальное введение цитостатиков может обеспечить более высокую концентрацию фармакологических агентов, чем при внутривенной инфузии, тем самым ограничить системные побочные эффекты [10]. Для этих целей используются препараты, применяемые при системной терапии, однако они селективно подводятся в артерии, питающие зону расположения опухоли. Одни из первых данных опубликовали A.F. Kovács et al., которые выполняли введение цисплатина в зону кровоснабжения опухоли (в данном наблюдении только язык и дно полости рта) как индукционный метод перед операцией или радиотерапией [50, 51]. В литературе описаны несколько серий наблюдений с использованием данной методики, наибольшая ‒ с использованием суспензии цисплатина и 5-фторурацила ‒ выполнена группой авторов во главе с М.С. Оль- шанским. В их наблюдении проводилось паллиативное лечение пациентов с рецидивом плоскоклеточного рака с положительным эффектом и сравнительно невысокой токсичностью [52, 53]. Несмотря на, казалось бы, локальный метод воздействия, многие авторы описывают значительное количество системных осложнений. В первую очередь наблюдается гематологическая токсичность III и IV степеней ‒ вплоть до 40,3 %, что является серьезным нежелательным явлением и потенциально опасно для жизни [53].
Комбинацией вышеописанных методов является химиоэмболизация. Комбинация эмболизации и химиотерапии сочетает в себе негативные эффекты обеих технологий. Интервенционные радиологи отмечают увеличение числа осложнений при использовании микросфер меньшего размера. Y. Bi et al. выполняли химиоэмболизацию 18 пациентам с распространенными или рецидивными опухолями полости рта, используя цисплатин, 5-фторурацил и частицы поливинилалкоголя или желатиновой губки. Частота осложнений составила 61,1 %, авторы рекомендовали метод как компонент паллиативного лечения, в особенности у пациентов с кровотечениями [54, 55]. S. Rohde et al. в 2006 г. проводили сравнительную оценку эффективности химиоинфузии и химиоэмболизации, без рандомизации пациентов. Авторы отметили, что частота объективных ответов и осложнений после химиоэмболизации гораздо выше и рекомендовали использовать методику с большой осторожностью и только при небольших опухолях языка и дна полости рта [56]. П.Г. Таразов и соавт. в 2008 г. применяли схожую методику у 25 пациентов, где отметили ее определенную эффективность, однако дальнейших исследований на эту тему не проводили [57]. F. Gao et al. выполнили эмболизацию 15 пациентам с опухолевым поражением области головы и шеи с помощью CalliSpheres® Microspheres с цисплатином. Все пациенты ранее получили лечение, соответствующее действующим клиническим рекомендациям. Авторы отмечают положительный эффект от проводимой химиоэмболизации, однако отмечают, что это пилотное исследование с малым размером выборки и не имеет статистической значимости, рекомендуют проведение дополнительных клинических испытаний [58]. А.С. Митрофанов и соавт. проводили исследование эффективности химиоэмболизации (n=23) местнораспространенных опухолей носоглотки III–IVb стадии и сравнение ее со стандартной ХЛТ (n=43). В группе с химиоэмболизацией отмечено увеличение бессобытийной и общей выживаемости [59].
M.I. Koukourakis et al. оценивали важность васкуляризации опухоли для эффективности хи-миолучевой терапии, опухоли головы и шеи имеют U-образный график, что говорит об ожидаемом низком эффекте ХЛТ при слабой и высокой ва- скуляризации новообразования. При эмболизации опухоли целенаправленно снижается плотность сосудов в ней, что закономерно приводит к снижению васкуляризации, а значит, гипоксии ткани опухоли, и уменьшает образование свободных радикалов кислорода вследствие лучевой терапии. Также гипоксия опухоли вызывает ацидоз в зоне ишемии, переход клеток в апоптотическое состояние, снижая их чувствительность к ХЛТ. Эта же причина является обоснованием необходимости выполнения верификации опухоли до выполнения лечебных интервенционных процедур.
Почти все вышеперечисленные исследования имеют малый размер выборки (n<30), отсутствие рандомизации и не дают оснований для рутинного применения данных технологий, а количество и характер осложнений требуют более подробного изучения. Наше мнение совпадает с позицией, изложенной в национальном руководстве по интервенционной радиологии в онкологии, под ред. акад. Б.И. Долгушина (2022). Количество опубликованных работ мало и не позволяет с позиций доказательной медицины сделать достоверные выводы об эффективности данной методики при местнораспространенном раке головы и шеи [53].
Косвенным признаком малой эффективности технологии также является количество публикаций. При поиске в сети PubMed словосочетания «head neck cancer chemoembolisation» отображается 80 статей в период с 1985 по 2023 г., количество этих публикаций не растет, как и количество включаемых в исследования пациентов. В то же время при запросе «hepatocellular carcinoma chemoembolisation» количество публикаций равняется 9 246 и прогрессивно увеличивается от года к году.
Заключение
Эндоваскулярные методы нередко используют при доброкачественных новообразованиях. Несмотря на потенциальное снижение кровопотери и облегчение хирургического доступа, такие вмешательства сопряжены со значимыми рисками и должны проводиться крайне взвешенно. Основная опасность кроется в наличии обширных коллатералей, способных приводить к непреднамеренной эмболизации жизненно важных структур, в том числе черепных нервов и глазной артерии, что нередко вызывает неврологический дефицит, нарушение зрения или некроз мягких тканей. Наблюдаются и отсроченные последствия, связанные с формированием перифокального отека и развитием постэмболизационного неврологического синдрома (PENS), когда имеющиеся симптомы могут обостряться на фоне ишемии и воспалительных изменений в зоне опухоли.
Важную роль играет временной интервал между эмболизацией и хирургическим вмешательством: с одной стороны, слишком ранняя операция не дает развиться достаточной деваскуляризации, с другой – длительная пауза повышает риск реканализации и усиливающегося отека, требующего назначения высоких доз стероидов, и сопряжено с системными побочными эффектами. Использование эмболизирующих частиц малого диаметра потенциально увеличивает вероятность попадания материала в нецелевые сосуды, что особенно опасно при неоднородной васкуляризации.
Следует также помнить, что сама по себе эмболизация, особенно при доброкачественных процессах, не гарантирует радикального излечения, а формирующийся некроз может приводить к инфицированию и нагноению, ухудшая качество жизни пациента. Таким образом, прежде чем прибегать к эндоваскулярному вмешательству, необходимо соотнести выгоды снижения кровопотери и шансы на облегчение операции с вероятными осложнениями. Наш опыт и приведенные примеры подсказывают, что оптимальным представляется индивидуальный, междисциплинарный подход, учитывающий анатомо-топографические особенности, общее состояние пациента, а также возможность альтернативных методов лечения.
Что же касается злокачественных новообразований, то плановая эмболизация и химиоэмболизация злокачественных опухолей головы и шеи не могут рассматриваться в качестве полноценного метода лечения, т.к. отсутствует доказанная эффективность и одновременно возникают существенные риски, связанные с биологическими особенностями опухолевого процесса и характером вмешательства. Во-первых, у злокачественных опухолей нет обособленной сосудистой сети, поэтому перекрытие питающих сосудов само по себе не приводит к тотальному некрозу. Более того, при сохранении лимфатического и венозного оттока частичная ишемия может провоцировать диссеминацию, а при хирургической попытке удалить опухоль – способствовать возникновению местного рецидива. Не менее опасно и то, что ишемизированная ткань подвергается некрозу и распаду, нередко сопровождающихся нагноением и ухудшением общего состояния.
Если планируются химио- и лучевая терапия, их эффективность снижается из-за уменьшения доставки химиопрепаратов и снижения кислородза-висимого радикального механизма при облучении. Одновременно пациенты вынуждены получать гепаринизацию, что повышает риск кровотечений, особенно при существующих эрозиях сосудов, а агрессивная микрофлора полости рта может легко проникать в область распада опухоли. Все это дополнительно усложняет состояние больного и отодвигает начало других, потенциально более результативных видов лечения. К тому же не исключены ситуации, когда эмболизация затрагивает кровоснабжение здоровых тканей, что впоследствии затрудняет расширенную резекцию или делает ее невозможной. Определенные сомнения вызывает и экономическая составляющая: финансовые затраты могут оказаться неоправданными, особенно если учесть вероятность возникновения осложнений, способных безвозвратно снизить функциональный статус пациента и помешать дальнейшему лечению. Поскольку в настоящий момент нет достаточного


