Рясковые как модельный объект в биотестировании водной и почвенной среды
Автор: Цаценко Л.В., Пасхалиди В.Г.
Рубрика: Общее земледелие, растениеводство
Статья в выпуске: 4 (176), 2018 года.
Бесплатный доступ
Рассматриваются вопросы биотестирования водной и почвенной среды на основе видов семейства рясковых. Представлен обзор работ по использованию рясковых как модельных объектов в биологическом тестировании почвы. Рассматриваются несколько блоков вопросов: история развития работ с видами рясковых, ответные реакции тест-объекта на действие тяжелых металлов и поллютантов. Уделено внимание вопросу наличия коллекций с идентифицированными клонами, пригодными для биотестирования. Обсуждается вопрос ответных реакций рясковых на загрязнение и возможность разработки подходов к аналитическим системам или биомаркерам. Дискуссионными остаются вопросы использования генных маркеров в биотестировании на основе ряскового теста, наличие коллекции клонов и визуальных баз данных. Другой блок вопросов, рассмотренных в статье, связан с перспективой использования визуального фенотипирования растений ряски в условиях эксперимента. На сегодняшний день этот подход успешно используется в России, США и Германии, что позволяет обрабатывать визуальную информацию с помощью информационных технологий и детализировать спектр повреждения растений.
Ряска, виды семейства рясковых, биотестирование, соли тяжелых металлов, поллютанты, ответные реакции, тест-системы, биомаркеры
Короткий адрес: https://sciup.org/142216758
IDR: 142216758 | УДК: 582.521.43:576.3] | DOI: 10.25230/2412-608X-2018-4-176-146-151
Текст научной статьи Рясковые как модельный объект в биотестировании водной и почвенной среды
Введение. Рясковые ( Lemnaceae ) – самые маленькие водные растения с простым строением. Виды семейства рясковых распространены по всей Земле, за исключением жарких сухих пустынь и холодных полярных областей. Семейство Lemnaceae состоит из 37 видов, которые распределены в пять родов: Lemna, Spirodella, Landoltia, Wollfia, Wolffiella [16; 17; 31; 33]. Более 30 видов семейства обитают в тропиках и субтропиках, остальные - в умеренном поясе [6; 7]. Простота строения и большая скорость размножения сделали виды семейства рясковых удобным модельным объектом для экологических исследований.
Вегетативное тело – листец или фронд, состоит в основном из губчатого мезофилла с большими воздушными мешками, что делает эти растения плавучими на поверхности воды. Корней мало, у ряда видов один, у много-коренника несколько - 6-10, у вольфии их нет вообще.
Роды рясковых различаются формой ли-стецов (почковидная, округлая, эллиптическая, ланцетная, линейная, шаровидная и овальная), числом корней, архитектоникой клонов. Вегетативное тело рясковых – это одно отдельное растение, от которого вегетативно формируются дочерние листецы [6]. Одно растение может образовывать 10–14 дочерних листецов (колония). У разных видов рясковых дочерние листецы формируются по-разному: у ряски малой из двух боковых кармашков, виды вольфии снабжены одним базальным кармашком из которого образуется дочерний листец [20].
В природе рясковые особенно хорошо растут в эвтотрофных, т.е. обогащенных питательными веществами (нитраты, аммиак, фосфаты) водоемах. Растения устойчивы к очень высоким концентрациям этих веществ – таким, которые наблюдаются в водоемах, куда поступают отработанные коммунальные, сельскохозяйственные и промышленные воды. Благодаря быстрому росту рясковые поглощают огромное количество веществ, тем самым очищая воду. Содержание азота в клетках рясковых может в 2000 раз превышать его концентрацию в воде, фосфора – в 7000, калия – в 5000 раз. Эти свойства рясковых позволили их использовать для очистки технической воды. Созданные рядом фирм США и Германии на основе рясок технические установки по очистке воды представляют собой несколько ванн с поверхностью около 200 м2 с очищаемой водой и рясковыми, агрегаты по сбору и транспортировке растений, устройства по их сушке, ферментации, накопитель метана, генератор и др. [13; 14].
Рясковые могут выступать как индикаторы загрязнения почвы и воды путем приостановки роста, гибели или появления специфических ответных реакций. В 1976 г. William Hillman предложил использовать растения семейства рясковых как модельный объект в экологических исследованиях [15]. Замечательная способность рясковых приспосабливаться к изменению климата без изменения своей структуры позволила им существовать как в водоемах тундры, так и тропических лесах Амазонки.
В задачу настоящего обзора входил анализ имеющихся методов и подходов с использованием видов семейства рясковых в биологическом тестировании водной и почвенной среды, а также рассмотрение дальнейших перспектив использования данного метода в схемах биологического контроля почвы.
Аналитический обзор. К. Линей (1707– 1778) был первым ботаником, который описал четыре вида Lemna . Подробно морфологию и особенности роста рясковых изучили зарубежные авторы Jacobs (1947), Landolt (1986), Lemon, Polsluszny (2000), Sree, Maheshwari (2015) [21; 24; 26; 27]. В России семейство рясковых описано А.Л. Тахтаджяном (1982) в многотомном издании «Жизнь растений». В разделе представлены характеристики видов, обитающих на территории России, приводятся данные о способах размножения, по использованию, имеются великолепные рисунки, позволяющие понять строение рясковых [6].
На основе экспериментов с видами семейства рясковых в конце 1980 г. рясковый тест стал базовым методом для оценки водного загрязнения при анализе воды и почвенных вытяжек [25]. Организация экономического сотрудничества и развития (OECD, 2006) в 2006 г. и международная организация по стандартам (ISO, 2005) утвердили в качестве основного метода рясковый тест за счет небольших размеров самих растений, быстроты роста, простоты содержания и легкости идентификации. Вид ряски малой ( Lemna minor L.) с 1979 г. является первым видом водных макрофитов, который используется в стандартизированной процедуре по установлению загрязнения воды (ЕС, 2007).
На сегодняшний день из 37 видов рясковых в биотестировании используются два вида: ряска малая ( L. minor) и ряска горбатая ( L. gibba) . В Канаде и Европе ряска малая – стандарт в протоколах по биотестированию водной среды, в США – ряска горбатая [28; 30].
Другие виды рясок также используются в биотестировании, но в меньшей степени. В последние годы возрос интерес к многокореннику обыкновенному (Spirodela pollirhiza). Этот вид является самым крупным из всех представителей семейства рясковых. Листец может достигать 1 см. Характерной особенностью этого вида является образование турионов, которые выступают в роли покоящихся почек, содержат питательные вещества в виде крахмала, что позволяет растению переносить понижение температуры в водоеме [11; 18; 22]. Этот вид также удобно содержать в культуре, вести анализ и использовать как индикатор состояния природной среды. Appenroth и другие авторы отмечали, что раннее образование турионов в природной среде может выступать сигналом изменения природной среды. Автор также наблюдала в 2009 г. в водоемах г. Краснодара образование турионов в середине августа, вме- сто привычного конца сентября и начала октября [10; 12].
стецов; сохранение либо отпадание корешков у растений (рис. 1, 2).
Рядом авторов было установлено, что соли тяжелых металлов (ТМ) оказывают негативное влияние на содержание хлорофилла и ка-ратиноидов в листецах рясковых [1; 2; 3; 4; 5; 23; 29; 32]. Для определения действия металлов на растения ряски используют как ростовые характеристики (скорость роста, площадь поверхности листецов, количество колоний листецов, площадь поверхности пластинок, сухой или живой вес), так и физиологические (содержание хлорофилла а и б, концентрация каратиноидов, процесс замедленной реакции хлорофилла). На фоне многообразия тестирующих параметров в стандартной процедуре оценки в рясковом тесте для выявления действия ТМ используют сухой вес, содержание хлорофилла и коэффициент роста. Cedergreen (2007) указал, что такие параметры, как содержание хлорофилла, могут быть разными и не коррелировать с ростовыми характеристиками, особенно если в водной среде находится несколько поллютантов [19]. В этой связи предлагается в качестве биомаркеров брать число листецов в конце эксперимента по отношению к контролю и их вес.

а б
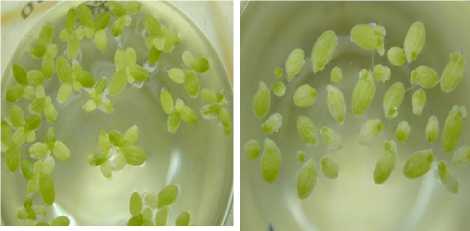
в г
Рисунок 1 – Изменение цвета листецов ряски малой ( Lemna minor L.) в эксперименте: а – контроль (интенсивная зеленая окраска); б – потеря окраски, зеленые только точки роста; в – бедно-зеленые листецы;
г – рассоединение листецов

а а
В большинстве протоколов по биотестированию используется несколько периодов: короткий (7 дней), средний (14 дней) и длительный (21 день). Этот вопрос является важным, т.к. характер действия поллютантов может сказаться либо сразу, либо длительно, а в некоторых случаях умеренно [19; 20]. Кроме продолжительности эксперимента, существует еще несколько дискуссионных вопросов по процедуре тестирования.
Первый блок вопросов связан с созданием базы данных ответных реакций видов рясок на действие поллютантов. При анализе действия ТМ на ряску рядом авторов – Сердюков С.Ю. (2011), Кислицина М.Н., Борисова Г.Г. (2016), Цаценко Л.В., Филипчук О.Д. (1997), Appenroth K.J., Ziegler P., Sree K.S. (2016) [3; 1; 9; 15] кроме приостановки роста, наблюдались специфические ответные реакции листе-цов: пожелтение или побледнение (хлороз), полное обесцвечивание (некроз), в некоторых случаях – голубоватый цвет. Отмечали локализацию и обширность участков с измененной окраской, а также характер изменения окраски у листецов разного возраста. Наблюдали сохранение групп растений ряски (состоящих из 4–8 листецов, связанных гиалиновыми нитями) либо их распад, частичный или полный, до обособленных ли-


Рисунок 2 – Ответные реакции многокоренника обыкновенного ( Spirodella pollyrhiza ): а – контроль; б – частичная потеря окраски; в – частичное побурение листецов; г – отмирание корней и появление турионов
Второй блок вопросов связан с количеством видов рясковых для биотестирования. Стандартно в биотестировании берутся два тест-объекта из разных видов и даже семейств. При анализе почвенных вытяжек в анализ включают семена редиса красного, пшеницы, ячменя, кресс-салата. Поскольку у рясковых чувствительность к поллютантам у разных видов различна, можно брать 2–3 вида из этого семейства. На сегодняшний день наиболее распространенные виды в биотестировании: ряска малая, ряска горбатая и многокоренник [7; 8; 9; 10; 32; 33].
Третий блок вопросов связан с содержанием видов рясок в коллекции. На сегодняшний день в мире существует нескольких научных центров, поддерживающих коллекцию клонов из видов семейства рясковых. Landolf создал и поддерживал коллекцию рясок в культуре (Цюрих, Швейцария). Этой коллекции более 50 лет [24]. В институте физиологии растений университета Йены, Германия, коллекция клонов L. minor с 1946 г. [15]. Большая коллекции рясок находится в Ратгерском университете, Нью Джерси, США [23]. Сравнительно молодая, но уникальная коллекция из 220 клонов видов рясок собрана с острова Хайнан, Китай, отличительной чертой этой коллекции является то, что она содержит местные виды рясок острова, которые разнятся по чувствительности к поллютантам [31].
Заключение. В мире интерес к представителям самых маленьких цветковых растений постоянно увеличивается. Это объясняется многими причинами: ряска удивительно быстро размножается, она нетребовательна к условиям произрастания, встречается повсеместно. Накопившийся объем научной информации позволил использовать ряску как объект в биотестировании почвы и воды, а наличие специфических ответных реакций на определенные поллютанты сделали ее еще и уникальной биологической аналитической системой и модельным объектом в биотестировании. Использование видов рясковых в анализе почвенного загрязнения путем получения почвенных вытяжек в системе агроэкологического мониторинга становится актуальным вопросом сегодняшнего дня.
Возможность использовать эти маленькие растения в биоочистке загрязненных вод послужила причиной проведения ряда интересных исследований по их промышленному использованию как биофильтров. Ранее изучением рясковых занимались ученые-перво- проходцы, работы которых были объединены на одной информационной платформе «Очарование рясковых». Из маленького, таинственного растения рясковые превратились в интенсивный объект исследования специалистов различных областей.
Виды семейства рясковых показали широкий спектр своего применения в качестве модельного объекта в установлении токсичности и разных видов загрязнения водной и почвенной среды. Несмотря на то, что стандартизированы методики с использованием L. minor и L. gibba в качестве тестируемых организмов и они эффективны, вопросы понимания механизмов, приводящих к токсичности различных компонентов водной среды, еще далеки от завершения. Внедрение методов генного анализа, основанного на экспрессии генов генома рясковых, позволит получить объемную информацию о токсичности водной и почвенной среды.
Исследование выполнено при финансовой поддержке РФФИ и Правительства Краснодарского края в рамках научного проекта № 17-13-23001-ОГН/18 "Северный Кавказ: традиции и современность".
Список литературы Рясковые как модельный объект в биотестировании водной и почвенной среды
- Кислицина М.Н., Борисова Г.Г. Ответные реакции Lemna minor L. на действие экзогенных фенольных соединений//Ученые записки Петрозаводского государственного университета. -2016. -№. 4 (157). -C. 54-58.
- Морозова М.Е., Сторчак Т.В. Влияние солей тяжелых металлов на синтез пролина Lemna minor L//Вестник Нижневартовского государственного университета. -2017. -№. 4. -С. 119-123.
- Сердюков С.Ю. Исследование комплексного влияния тяжелых металлов на ряску малую (Lemna minor L.) в рамках биотестирования загрязнения воды//Интеллектуальный потенциал XXI века: ступени познания. -2011. -№ 6. -С. 28-31.
- Сторчак Т.В., Крюкова В.А. Изменение некоторых физиологических показателей ряски малой (Lemna minor L.) при действии солей никеля и цинка//Бюллетень науки и практики. -2017. -№. 3. -С. 99-105.
- Субботин М.А., Григорьев Ю.С. Оценка токсического действия ионов меди на ряску малую (Lemna minor L.) методом регистрации замедленной флюоресценции//Теоретическая и прикладная экология. -2013. -№ 2. -С. 35-38.
- Тахтаджян А.Л. Жизнь растений. Т. 6. -М.: Просвещение, 1982. -С. 493-500.
- Цаценко Л.В., Малюга Н.Г. Чувствительность различных тестов на загрязнение воды тяжелыми металлами и пестицидами с использованием ряски малой Lemna minor L.//Экология. -1998. -№. 5. -С. 407-409.
- Цаценко Л.В., Перстенёва А.А., Гусев В.Г. Оценка фитотоксичности почвы на посевах подсолнечника с помощью биотеста ряски малой (Lemna minor L.)//Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. -2010. -№. 59. -С. 300-309.
- Цаценко Л.В., Филипчук О.Д. Фитотестирование загрязнения агроландшафта//Вестник Российской академии сельскохозяйственных наук. -1997. -№ 3. -С. 39-41.
- Appenroth K.J., Adamec L. Specific turion yields of different clones of Spirodela polyrhiza depend on external phosphate thresholds//Plant Biology. -2015. -Vol. 17. -No s1. -P. 125-129.
- Appenroth K.J., Crawford D.J., Les D.H. After the genome sequencing of duckweed -how to proceed with research on the fastest growing angiosperm?//Plant Biology. -2015. -Vol. 17. -No s1. -P. 1-4.
- Appenroth K.J., Nickel G. Turion formation in Spirodela polyrhiza: The environmental signals that induce the developmental process in nature//Physiologia plantarum. -2010. -Vol. 138. -No 3. -P. 312-320.
- Appenroth K.J., Sree K.S., Bohm V. . Nutritional value of duckweeds (Lemnaceae) as human food//Food chemistry. -2017. -Vol. 217. -P. 266-273.
- Appenroth K.J., Sree K.S., Fakhoorian T. . Resurgence of duckweed research and applications: report from the 3rd International Duckweed Conference//Plant Molecular Biology. -2015. -Vol. 89. -No 6. -P. 647-654.
- Appenroth K.J., Ziegler P., Sree K.S. Duckweed as a model organism for investigating plant-microbe interactions in an aquatic environment and its applications//Endo-cytobiosis Cell Res. -2016. -Vol. 27.-P. 94-106.
- Bog M., Baumbach H., Schween U. . Genetic structure of the genus Lemna L. (Lemnaceae) as revealed by amplified fragment length polymorphism//Planta. -2010. -Vol. 232. -No 3. -P. 609-619.
- Bog M., Shcneider P., Hellwig F. . Genetic characterization and barcoding of taxa in the genus Wolffia Horkel ex Schleid. (Lemnaceae) as revealed by two plastidic markers and amplified fragment length polymorphism (AFLP)//Planta. -2013. -Vol. 237. -No. 1. -P. 1-13.
- Cao H.X., Vu G.T.H., Wang W. . The map-based genome sequence of Spirodela polyrhiza aligned with its chromosomes, a reference for karyotype evolution//New Phytologist. -2016. -Vol. 209. -No 1. -P. 354-363.
- Cedergreen, N., M. Abbaspoor, H. Sorensen, and J.C. Streibig. Is Mixture Toxicity Measured on a Biomarker Indicative of What Happens on a Population Level? A Study with Lemna minor//Ecotoxicology and Environmental Safety. -2007. -No 67. -P. 323-332.
- Henke R., Eberius M., Appenroth K.J. Induction of frond abscission by metals and other toxic compounds in Lemna minor//Aquatic toxicology. -2011. -Vol. 101. -No 1. -P. 261-265.
- Jacobs, D.L. An ecological life history of Spi-rodela polyrhiza (Greater Duckweed) with Emphasis on the Turion Phase//Ecological Monographs. -1947. -V. 17. -P. 437-469.
- Kuehdorf K., Jetschke G., Ballani L. . The clonal dependence of turion formation in the duckweed Spirodela polyrhiza -an ecogeographical approach//Phys-iologia plantarum -2014. -Vol. 150. -No 1. -P. 46-54.
- Lam E., Appenroth K.J., Michael T. . Duckweed in bloom: the 2nd International Conference on Duckweed Research and Applications heralds the return of a plant model for plant biology//Plant Molecular Biology. -2014. -Vol. 84. -No 6. -P. 737-742.
- Landolt E. The Family of Lemnaceae -a Monographic Study. (Vol. 1). Biosystematic Investigations in the Family of Duckweeds (Lemnaceae). (Vol. 2). -Zurich: Veroffentlichungen des Geobotanischen Instituts der Eidg. Techn. Hochshcule, 1986. -566 p.
- Naumann, B., M. Eberius, and K.-J. Appenroth. "Growth Rate Based Dose Response Relationships and EC-Values of Ten Heavy Metals Using the Duckweed Growth Inhibition Test (ISO 20079) with Lemna minor L. Clone St."//Journal of Plant Physiology. -2007. -No 164. -P 1656-1664.
- Sree K.S., Adelmann K., Garcia C. . Natural variance in salt tolerance and induction of starch accumulation in duckweeds//Planta. -2015. -Vol. 241. -No 6. -P. 1395-1404.
- Sree K.S., Appenroth K.J. Increase of starch accumulation in the duckweed Lemna minor under abiotic stress//Albanian Journal of Agricultural Sciences. -2014. -Vol. 13. -P. 11-14.
- Sree K.S., Bog M., Appenroth K.J. Taxonomy of duckweeds (Lemnaceae), potential new crop plants//Emirates Journal of Food and Agriculture. -2016. -Vol. 28. -No 5. -P. 291.
- Topp C., Henke R., Keresztes A. . A novel mechanism of abscission in fronds of Lemna minor L. and the effect of silver ions//Plant biology. -2011. -Vol. 13. -No 3. -P. 517-523.
- Wang, W. Literature Review on Duckweed Toxicity Testing//Environmental Research. -1990. -V. 52. -P. 7-22.
- Xu Y., Ma S., Huang M. . Species distribution, genetic diversity and barcoding in the duckweed family (Lemnaceae)//Hydrobiologia. -2015. -Vol. 743. -No 1. -P. 75-87.
- Ziegler P., Adelmann K., Zimmer S. . Relative in vitro growth rates of duckweeds (Lemnaceae) -the most rapidly growing higher plants//Plant Biology. -2015. -Vol. 17. -No s1. -P. 33-41.
- Ziegler P., Sree K.S., Appenroth K.J. Duckweeds for water remediation and toxicity testing//Toxicological & Environmental Chemistry. -2016. -Vol. 98. -No 10. -P. 1127-1154.


