Робот-ассистированная резекция почки с нулевой ишемией у коморбидных пациентов
Автор: Мосоян М.С., Шанава Г.Ш., Симонян А.М., Гилев Е.С., Айсина Н.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 2 т.16, 2023 года.
Бесплатный доступ
Введение. Выполнение органосохраняющей операции является золотым стандартом хирургического лечения локализованного почечноклеточного рака (ПКР). Резекцию почки можно проводить как в условиях тепловой ишемии, так и без наложения сосудистого зажима. Особенно важно сохранение ренальной функции у коморбидных пациентов при проведении резекции почки по поводу ПКР. Цель. Оценить периоперационные результаты робот-ассистированныхрезекций почки с нулевой ишемией у коморбидных больных с ПКР. Материалы и методы. В ФГБУ «НМИЦ им. В.А. Алмазова» ретроспективно были изучены результаты лечения 11 коморбидных пациентов, которым за период с 2019 по 2022 г. выполнялись робот-ассистированные резекции почек в условиях нулевой ишемии. У 3 (27,3%) пациентов было выявлено новообразование единственной функционирующей почки. Перед планированием операции, на основании результатов мультиспиральной компьютерной томографии, всем больным выполнялась 3D реконструкция с помощью программы моделирования 3D Slicer. Для быстрой мобилизации ренальных сосудов использовался «Способ безопасного выделения почечной артерии и вены при эндовидеохирургической резекции почки», запатентованный в РФ. Границы резекции определялись с помощью ультразвукового исследования внутриполостным датчиком BKFlex Focus 800. Функциональное состояние почек оценивалось по результатам скорости клубочковой фильтрации (СКФ) с помощью формулы Chronic Kidney Desease Epidemiology Collaboration (CKD-EPI). Результаты. Интраоперационных и послеоперационных осложнений во всех случаях не наблюдалось. Медиана консольного времени операции составила 110 мин (58 130). Медиана кровопотери на этапе резекции почки составила 100 мл (50-280). Хирургический край резекции во всех случаях был отрицательным. В послеоперационном периоде СКФ была сопоставима с предоперационными значениями. Выводы. Робот-ассистированную резекцию почки с нулевой ишемией коморбидным пациентам целесообразнее проводить в многопрофильном центре компетенции. Эффективность периоперационныхрезультатов робот-ассистированной резекции почки с нулевой ишемией достигается применением высокоинформативных диагностических методов визуализации и выполнением в ходе операции безопасного способа выделения ренальных сосудов с проведением быстрой реноррафии опытным хирургом.
Почечно-клеточный рак, резекция почки, коморбидность, нулевая ишемия
Короткий адрес: https://sciup.org/142239003
IDR: 142239003 | DOI: 10.29188/2222-8543-2023-16-2-52-57
Текст научной статьи Робот-ассистированная резекция почки с нулевой ишемией у коморбидных пациентов
Почечно-клеточный рак (ПКР) по распространен ности занимает 7-е место среди всех случаев урологи ческих новообразований [1, 2, 3]. По данным литера туры, пик заболеваемости ПКР в последние десятилетия наблюдается у больных в возрасте 60-70 лет [2, 4]. У многих пациентов данной возрастной группы имеются сопутствующие заболевания [5, 6]. Сосуществование двух и более заболеваний, патогенетически взаимосвя занных между собой или совпадающих по времени у од ного пациента, получило определение коморбидность [7]. Наиболее распространенными коморбидными со стояниями являются сердечно-сосудистые заболевания сахарный диабет, хроническая болезнь почек и др. [7]. Наличие коморбидного заболевания отягощает течение ПКР, влияет на выбор тактики лечения новообразова ния, увеличивает койко-день у оперированных пациен тов, способствуют развитию осложнений [8, 9].
По имеющимся современным международным и отечественным рекомендациям,в зависимости от ста дии ПКР, выполняется резекция почки или нефрэкто мия.На сегодняшний день выполнение органосохра няющей операции является золотым стандартом хирур гического лечения опухолей почки при стадии cT1 [10 13]. Эффективность резекции почки обеспечивается 3 факторами («трифекта»): отрицательным хирургиче ским краем, минимальным нарушением почечной функ ции и отсутствием послеоперационных осложнений [14 15]. Ренальная функция напрямую зависит от объема сохраненной почечной ткани и длительности ишемии во время операции [15, 16]. В последнее десятилетие в публикациях все чаще описывается успешное выполне ние резекции почки с нулевой ишемией, что благопри ятно сказывается на показателях скорости клубочковой фильтрации (СКФ) в послеоперационном периоде [14 16]. Однако данных о проведении резекции почки без ишемии коморбидным пациентам в литературе пред ставлено недостаточно.
Выполнение оперативных вмешательств комор бидным пациентам сопряжено с высокими рисками раз вития интра- и послеоперационных осложнений [17].
У пациентов с сердечно-сосудистыми заболеваниями, получающих антикоагулянтную терапию, вероятность развития интраоперационных кровотечений значи тельно выше, чем у больных без коморбидной патоло гии. В случае отмены антикоагулянтной терапии перед операцией возникают риски развития тромбоза сосу дов [9].
На сегодняшний день поиск оперативных техноло гий, позволяющих выполнить резекцию почки с нуле вой ишемией коморбидному пациенту с ПКР, которая обеспечивает эффективные онкологические и функцио нальные исходы и отсутствие послеоперационных осложнений, является актуальной задачей современной урологии.
Цель исследования – оценить периоперационные результаты робот-ассистированных резекций почки с нулевой ишемией у коморбидных больных с ПКР.
МАТЕРИАЛЫ И МЕТОДЫ
В ФГБУ «НМИЦ им. В.А. Алмазова» ретроспек тивно были изучены результаты лечения 11 коморбид ных пациентов, которым за период с 2019 по 2022 г. выполнялась робот-ассистированная резекция почки в условиях нулевой ишемии.
Критерии включения:
-
• клиническая стадия новообразования почек cT1;
-
• индекс коморбидности Charlson > 3;
-
• возраст больных 18-70 лет.
Критерии исключения:
-
• индекс коморбидности Charlson 0, 1-2;
-
• подтвержденный диагноз доброкачественного новообразования или местнораспространенный опухо левый процесс по результатам гистологического иссле дования.
Медиана возраста больных, включенных в иссле дование, составила 64,5 лет [МКР: 63,0-66,3], медиана индекса массы тела (ИМТ) – 29,8 кг/м2 [МКР: 25,6 – 31,1]. У 3 (27,3%) пациентов было выявлено новообра зование единственной функционирующей почки. Рас чет индекса коморбидности определялся по балльной системе, предложенной M. Charlson в 1987 г. [18].
Демографические и предоперационные данные о пациентах представлены в таблице 1.
Таблица 1. Демографические и предоперационные данные пациентов
Table 1. Demographic and preoperative data of patients
|
Показатель Index |
Результат Result |
|
Число пациентов, n The number of patients, n |
11 |
|
Пол Sex Мужской, n (%) / Male, n (%) Женский, n (%) / Female, n (%) |
7 (63,6%) 4 (36,4%) |
|
Медиана возраста, лет Median of age, years |
65 [63-67] |
|
Медиана ИМТ, кг/м2 Median of BMI, kg/m2 |
29,7 [24,8 – 31,1] |
|
Медиана индекса коморбидности Чарлсон Median of CCI |
4 [4-5] |
|
Сторона расположения опухоли / Tumor location Справа, n (%) / Right, n (%) Слева, n (%) / Left, n (%) |
5 (45,5%) 6 (54,5%) |
|
Клиническая стадия / Clinical stage cT1a, n (%) cT1b, n (%) |
10 (90,1 %) 1 (9,9%) |
|
Медиана размеров опухоли, мм Median of tumor size, mm |
33,6 [17,9-52,5] |
|
Медиана баллов по шкале Median of score PADUA RENAL |
7 [6-9] 7 [6-9] |
Все пациенты были госпитализированы в ФГБУ «НМИЦ им. В.А. Алмазова» для проведения плановой операции. Данные об имеющихся коморбидных заболе ваниях у пациентов с ПКР, включенных в исследование указаны в таблице 2.
Таблица 2. Коморбидные заболевания у пациентов с ПКР
Table 2. Comorbidities in patients with RCC
|
Показатель Index |
Результат Result |
|
Число пациентов, n The number of patients, n |
11 |
|
Коморбидные состояния / Comorbidities |
|
|
Гипертоническая болезнь (ГБ),n (%) Hypertension, n (%) |
9 (81,8%) |
|
Ишемическая болезнь сердца (ИБС), n (%) Coronary heart disease, n(%) |
5 (45,5%) |
|
Хроническая сердечная недостаточность, n (%) Chronic heart disease, n (%) |
4 (36,4%) |
|
Нарушения ритма сердца Heart arrhythmia |
|
|
Фибрилляция предсердий (ФП), n (%) Atrial fibrillation , n (%) |
3 (27,3%) |
|
Желудочковая экстрасистолия, n(%) Ventricular extrasystole, n(%) |
2 (18,2%) |
Как показано в таблице 2, у всех пациентов одно временно имелись по несколько заболеваний сердечно сосудистой системы.Все пациенты длительное время принимали антиагреганты. Учитывая характер комор бидных заболеваний, больные были проконсультиро ваны кардиологами. По их рекомендациям пациенты получающие антиагрегантную терапию,были переве дены на прием низкомолекулярного гепарина.
Кроме стандартных методов диагностики, на этапе предоперационной подготовки по результатам мульти спиральной компьютерной томографии (МСКТ) орга нов брюшной полости и забрюшинного пространства нами выполнялась 3D-реконструкция с помощью про граммы моделирования 3D Slicer.
Во время операции для определения точных гра ниц резекции новообразования проводилось ультразву ковое исследование (УЗИ) внутриполостным дат чиком BK Flex Focus 800. В целях оптимизации этапа мобилизации ренальных сосудов применялся «Способ безопасного выделения почечной артерии и вены при эндовидеохирургической резекции почки», запантован ный в Российской Федерации [19]. Для выделения ре нальных сосудов использовались ориентиры условного треугольника, где сторонами являлись медиальный край нижнего полюса почки, гонадная и почечные вены.
Быстрая ренография, позволяющая снизить риски интраоперационной кровопотери, обеспечивалась ар тикуляционными возможностями роботических ин струментов.
Функциональные результаты оценивались по ско рости клубочковой фильтрации (СКФ) в пред- и после операционном периоде по расчетной формуле: Chronic Kidney Desease Epidemiology Collaboration (CKD-EPI).
Операции выполнялись компетентным хирургом с опытом выполнения более 1500 робот-ассистирован ных операций.
РЕЗУЛЬТАТЫ
На этапе предоперационной подготовки выполне ние 3D-реконструкции позволило детально рассмот реть топографо-анатомические особенности располо жения опухоли и почечных сосудов (рис. 1). Это способ ствовало рациональному выбору доступа к ренальным сосудам и к новообразованию.
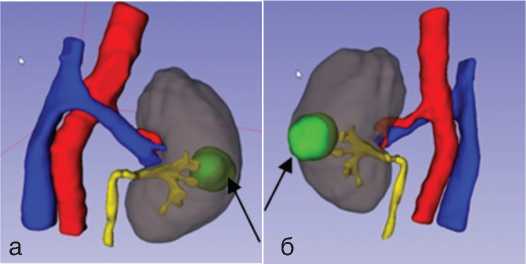
Ри.с 1. 3D – реконструкция расположения опухоли почек и почечных сосудов (а) Передняя поверхность левой почки. (б) Задняя поверхность левой почки. Стрелкой обозначено новообразование левой почки
Fig. 1. 3D-reconsctruction of the lokation of the kidney and renal vessels.
Anterior surface of the left kidney (a). Posterior surface of the left kidney (б). The black arrow indicates the tumor
Резекция почки осуществлялась в традиционном положении пациента на боку. После сформированного трансперитонеального доступа при помощи робота-ас систента мобилизовалась почка и ее сосудистая ножка.


Несмотря на то,что резекция почки выполнялась без ишемии, во всех случаях производилась мобилизация ренальных сосудов (рис. 2).
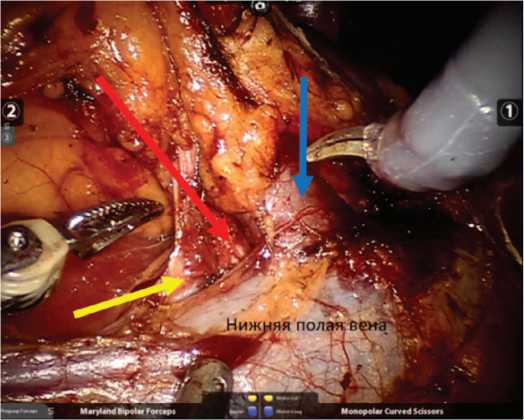
Рис. 2. Мобилизация сосудистой ножки правой почки. Синей стрелкой указана основная почечная вена. Желтой стрелкой обозначена добавочная почечная вена. Красной стрелкой указана почечная артерия
Fig. 2. Mobilization of the right renal pedicle vessels. Main renal vein isindicated by the blue arrow. Accessory renal vein is noted by the yellow arrow. The red arrow indicates renal artery
Быстрый доступ к почечной артерии обеспечи вался ориентирами условного треугольника, где сторо нами были медиальный край нижнего полюса почки, гонадная и почечные вены [19]
Перед началом резекции почки границы ново образования определялись в ходе УЗИ датчиком BK Flex Focus800 (рис. 3).
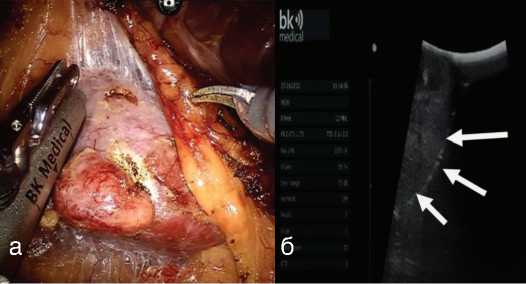
Рис. 3 (а, б) Интраоперационное определение границ резекции новообразования с помощью внутриполостного датчика УЗИ (а). Увеличенное изображение интраренальной части опухоли, обозначенное белыми стрелками (б)
Fig.3 (a, b) Using an intracavitary ultrasound probe for determination the boundaries of resection (a). Enlarged image of the intrarenal part of the tumor, indicated by white arrows (б)
С учетом полученных результатов интраоперационного УЗИ проводилась резекция опухоли с нулевой ишемией в пределах здоровых тканей. Медиана кровопотери этапа резекции почки составила 100 мл [МКР: 50 – 280]. Края резецированной почки ушивались с применением рассасывающихся нитей V-Loc 3-0, которые дополнительно фиксировались эндоскопическими клипсами.
Медиана консольного времени операции составила 110 мин [МКР: 58 – 130]. Интраоперационных и послеоперационных осложнений во всех случаях не наблюдалось. Переливание компонентов крови ни одному пациенту не потребовалось. Средний послеоперационный койко-день пребывания пациентов в стационаре составил 8 дней. Пациенты выписывались из отделения с рекомендациями кардиолога по дальнейшему лечению сердечно-сосудистых заболеваний.
Во всех случаях по данным гистологического исследования хирургический край резекции был отрицательным. В 77,8% случаев гистологическое исследование выявило светлоклеточный рак почки. Остальные 22,2% случая составили хромофобную карциному почки. Осложнений выше I степени по классификации Clavien-Dindo не наблюдалось. В течение 3-х суток после операции у всех пациентов отмечалось повышение СКФ с дальнейшим снижением на 7-е сутки до предоперационных значений (табл. 3).
ОБСУЖДЕНИЕ
С увеличением продолжительности жизни у населения наблюдается тенденция к возрастанию коморбид-ных патологий. В том числе и у пациентов старшего возраста с ПКР наблюдается неуклонный рост числа сопутствующих заболеваний. В настоящее время робот-ассистированная резекция почки является одним из самых эффективных методов лечения локализованного ПКР [20, 21]. Однако многим пациентам с тяжелыми ко-морбидными заболеваниями из-за высоких интра- и послеоперационных рисков развития осложнений в выполнении хирургического вмешательства многие клиники отказывают. Им предлагаются аблятивные способы лечения [13, 22].
Для безопасного выполнения резекции почки пациентам с коморбидными состояниями требуется особый подход. Целесообразно проведение операции
Таблица 3. Дооперационные и послеоперационные показатели СКФ
Table 3. Preoperative and postoperative GFR
|
Медиана СКФ мл/мин/1,73 м2 / Median of GFR ml/min/1,73 m2 |
||||
|
Формула Formule |
До операции Preoperative |
Через 24 часа после операции Postoperatively 24 hours |
Через 72 часа после операции Postoperatively 72 hours |
Через 7 суток после операции Postoperatively 7 days |
|
CKD EPI |
69,3 [60 – 88,2] |
68 [62,6 – 80,7] |
74,1 [60 – 88,9] |
70,1 [64 – 80,5] |
в многопрофильном медицинском учреждении с уча стием в лечении больных профильных специалистов курирующих сопутствующие заболевания. Наше иссле дование продемонстрировало, что участие кардиологов и компетентного хирурга обеспечивает возможность выполнения робот-ассистрованной резекции почки. Применение 3D-реконструкции на предоперационном этапе позволило виртуально спланировать ход опера ции. Использование интраоперационного УЗИ указало на точные границы резекции опухоли. Применение ме тода, предложенного В.Э. Федоровым и соавт. «Cпособ выделения почечной артерии и вены при эндовидеохи рургической резекции почки», обеспечило безопасную и быструю мобилизацию ренальных сосудов [19]. Возможности роботических артикуляционных инстру ментов, обладающих повышенной подвижностью и точностью движений, позволили провести быструю ре норрафию, что нивелировало интраоперационную кро вопотерю.
Мы считаем, что края резецированной почки у ко морбидных пациентов необходимо прочно ушивать.
Для пациентов, получающих антикоагулянтную тера пию, для достижения стойкого гемостаза недостаточно ограничиваться электрокоагуляцией и применением ге мостатического клея. К тому же у больных с гиперто ничекой болезнью всегда остается риск резкого повы шения артериального давления в послеоперационном периоде, что может привести к кровотечению из обла сти резекции почки.
ВЫВОДЫ
Робот-ассистированную резекцию почки с нулевой ишемией коморбидным пациентам целесообразнее про водить в многопрофильном центре компетенции.Эф фективность периоперационных результатов робот ассистированной резекции почки с нулевой ишемией достигается применением высокоинформативных диаг ностических методов визуализации и выполнением в ходе операции безопасного способа выделения реналь ных сосудов с проведением быстрой реноррафии опыт ным хирургом.
ЛНТЕ РАТУРА/REFERE NCE S
Сведения об авторах:
Мосоян М.С. – д.м.н., профессор кафедры урологии с курсом роботической хирургии с клиникой ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, заведующий кафедрой урологии с курсом роботической хирургии с клиникой, руководитель центра роботической хирургии; профессор кафедры урологии ФГБОУ ВО «ПСПбГМУ» им. И.П. Павлова» Минздрава России; Санкт-Петербург, Россия; ; РИНЦ Author ID 388586,
РИНЦ Author ID 638850
Симонян А.М. – аспирант кафедры урологии с курсом роботической хирургии с клиникой ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России; Санкт-Петербург, Россия;
Вклад авторов:
Мосоян М.С. – концепция и дизайн исследования, 40%
Шанава Г.Ш. – дизайн исследования, написание текста, 20%
Симонян А.М. – сбор и обработка материала, написание текста, 20%
Гилев Е.С. – статистическая обработка, написание текста, 10%
Айсина Н.А. – статистическая обработка, написание текста, 10%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование проведено без финансовой поддержки
Статья поступила: 22.02.23
Результаты рецензирования: 25.03.23
Исправления получены: 27.03.23
Список литературы Робот-ассистированная резекция почки с нулевой ишемией у коморбидных пациентов
- Ferlay J, Colombet M, Soerjomataram I, Dyba T, Randi G, Bettio M, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries and 25 major cancers in 2018. Eur J Cancer 2018;103:356-87. https://doi.org/10.1016/j.ejca.2018.07.005.
- Capitanio U, Bensalah K, Bex A, Boorjian SA, Bray F, Coleman J, et al. Epidemiology of Renal Cell Carcinoma. Eur Urol 2019;75(1):74-84. https://doi.org/10.1016/ j.eururo.2018.08.036.
- Padala SA, Barsouk A, Thandra KC, Saginala K, Mohammed A, Vakiti A, et al. Epidemiology of Renal Cell Carcinoma. World J Oncol 2020;11(3):79-87. https://doi.org/10.14740/wjon1279.
- Rosiello G, Larcher A, Montorsi F, Capitanio U. Renal cancer: overdiagnosis and overtreatment. World J Urol 2021;39(8):2821-23. https://doi.org/10.1007/ s00345-021-03798-z.
- Fragkiadis E, Alamanis C, Constantinides CA, Mitropoulos D. Prediction of post radical nephrectomy complications based on patient comorbidity preoperatively. Arch Ital Urol Androl 2021;93(3):251-4. https://doi.org/10.4081/ aiua.2021.3.251.
- Мосоян М.С., Чернявский М.А., Пягай В.И., Чернов А.В., Мамсуров М.Э., Чуйкова И.О. Клинический случай одномоментного малоинвазивного хирургического лечения пациента с новообразованием почки и опухолевым тромбом в нижней полой вене. Патология кровообращения и кардиохирургия 2018;22(3):69-74. [Mosoyan M.S., Chernyavskiy M.A., Pyagay V.I., Chernov A.V., Mamsurov M.E., Chuykova I.O.A A case report of simultaneous mini-invasive treatment of a patient with kidney tumor and tumor thrombus in inferior vena cava I. Patologiya krovoobrashcheniya i kardiohirurgiya = Circulation Pathology and Cardiac Surgery. 2018;22(3):69-74. (In Russian)].
- Оганов Р.Г., Денисов И.Н., Симаненков В.И., Бакулин И.Г., Захарова Н.В., Болдуева С.А., и др. Коморбидная патология в клинической практике. Клинические рекомендации. Кардиоваскулярная терапия и профилактика 2017;16(6):5-56. https://doi.org/10.15829/1728-8800-2017-6-5-56. [Oganov R.G., Denisov I.N., Simanenkov V.I., Bakulin I.G., Zakharova N.V., Boldueva S.A., еt al. Comorbidities in practice. Clinical guidelines. Kardiovaskulyarnaya terapiya = Cardiovascular Therapy and Prevention 2017;16(6):5-56. (In Russian)].
- Gontero P, Mari A, Marra G, Nazzani S, Allasia M, Antonelli A, et al. Is partial nephrectomy safe and effective in the setting of frail comorbid patients affected by renal cell carcinoma? Insights from the RECORD 2 multicentre prospective study. Urol Oncol 2021;39(1):78.e17-78.e26. https://doi.org/10.1016/ j.urolonc. 2020.09.022.
- Chandrasekar T, Boorjian SA, Capitanio U, Gershman B, Mir MC, Kutikov A. Collaborative review: factors influencing treatment decisions for patients with a localized solid renal mass. Eur Urol 2021;80(5):575-88. https://doi.org/10.1016/ j.eururo.2021.01.021.
- Bukavina L, Mishra K, Calaway A, Ponsky L. Robotic Partial nephrectomy: update on techniques. Urol Clin North Am 2021;48(1):81-90. https://doi.org/10.1016/ j.ucl.2020.09.013.
- Campbell S, Uzzo RG, Allaf ME, Bass EB, Cadeddu JA, Chang A, et al. Renal mass and localized renal cancer: AUA guideline. J Urol 2017;198(3):520-9. https://doi.org/10.1016/j.juro.2017.04.100.
- Boga MS, Sönmez MG. Long-term renal function following zero ischemia partial nephrectomy. Res Rep Urol 2019;11:43-52 https://doi.org/10.2147/ RRU.S174996.
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М., Медфорум. 2017. 544 с. [Alyaev Yu.G., Glybochko P.V., Pushkar D.Yu. Urology. Russian clinical guidelines. M., Medforum. 2017. 544 p. (In Russian)].
- Tsivian M, Tsivian E, Stanevsky Y, Bass R, Sidi AA, Tsivian A. Laparoscopic partial nephrectomy for tumors 7cm and above. Perioperative outcomes. Int Braz J Urol 2017;43(5):857-62. https://doi.org/10.1590/S1677-5538.IBJU.2016.0642.
- Tanaka H, Wang Y, Suk-Ouichai C, Palacios DA, Caraballo ER, Ye Y, et al. Can we predict functional outcomes after partial nephrectomy? J Urol 2019;201(4):693-701. https://doi.org/10.1016/j.juro.2018.09.055.
- Damasceno-Ferreira JA, Bechara GR, Costa WS, Pereira-Sampaio MA, Sampaio FJB, Souza DB. The relationship between renal warm ischemia time and glomerular loss. An experimental study in a pig model. Acta Cir Bras 2017;32(5):334-41. https://doi.org/10.1590/s0102-865020170050000002.
- Федоров В.Э., Масляков В.В., Асланов А. Д. Коморбидность при хирургивческих заболеваниях: способы оценки ее тяжести (2 часть). Вестник Национального медико-хирургического Центра им. Н.И. Пирогова 2020;15(3-2):158-65. [Fedorov V.E., Maslyakov V.V., Aslanov A. D. Comboridity in surgical diseases: methods for assessing its severity (Literature review 2 part) Vestnik Nacionalnogo mediko-hirurgicheskogo Centra im. NI Pirogova = Bulletin of Pirogov National Medical & Surgical Center 2020;15(3-2):158-65. (In Russian)].
- Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chron Dis 1987;40(5):373-83)
- Мосоян М.С., Федоров Д.А., Гилев Е.С. Способ безопасного выделения сосудов почечной ножки при эндовидеохирургической резекции почки и радикальной нефрэктомии в процессе проведения лапароскопических и робот-ассистированных операций. Патент Российской Федерации 2742367. URL: https://www.fips.ru/iiss/document.xhtml?faces-redirect=true&id=1b3cb6 acc5042708f56884fbb0894f75. [Mosoyan M.S., Fedorov D.A., Gilev E.S. A method for safely isolating the vessels of the renal pedicle during endovideosurgical resection of the kidney and radical nephrectomy during laparoscopic and robot-assisted operations. Patent of the Russian Federation 2742367. URL: https://www.fips.ru/iiss/document.xhtml?faces-redirect=true&id= 1b3cb6acc5042708f56884fbb0894f75. (In Russian)].
- Antonelli A, Veccia A, Francavilla S, Bertolo R, Bove P, Hampton LJ, et al. On-clamp versus off-clamp robotic partial nephrectomy: A systematic review and meta-analysis. Urologia 2019;86(2):52-62. https://doi.org/10.1177/0391560319847847.
- Anceschi U, Brassetti A, Bertolo R, Tuderti G, Ferriero MC, Mastroianni R, et al. On-clamp versus purely off-clamp robot-assisted partial nephrectomy in solitary kidneys: comparison of perioperative outcomes and chronic kidney disease progression at two high-volume centers. Minerva Urol Nephrol 2021;73(6):739-45. https://doi.org/10.23736/S2724-6051.20.03795-9.
- Shapiro DD, Wells SA, Best SL, Hedican SP, Ziemlewicz TJ, Lubner MG, et al. Comparing outcomes for patients with clinical T1b renal cell carcinoma treated with either percutaneous microwave ablation or surgery. Urology 2020;135:88-94. https://doi.org/10.1016/j.urology.2019.09.024.


