Роль аберрантного метилирования в генах APC, RASSF1A и ITGA4 в диагностике колоректального рака
Автор: Бровкина Ольга Игоревна, Гордиев Марат Гордиевич, Ходырев Дмитрий Сергеевич, Никитин Алексей Георгиевич, Аверьянов Александр Вячеславович, Троицкий Александр Витальевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 (32), 2017 года.
Бесплатный доступ
«Золотым стандартом» диагностики колоректального рака (КРР) является колоноскопия. Несмотря на высокие показатели достоверности, данный метод не применим в масштабных скрининговых проверках населения или для оценки динамики заболевания у конкретного пациента. В настоящей работе было проведено исследование аберрантного метилирования в генах APC, RASSF1A и ITGA4. Исследование включало 150 парных образцов опухолевой ткани с известным статусом мутации генов семейства RAS и окружающей гистологически неизмененной ткани пациентов с аденокарциномой прямой кишки. Изучение профилей метилирования производилось с помощью метода MethyLight PCR. Наибольшая разница в метилировании между опухолевой и здоровой тканью наблюдалась для гена ITGA4 (чувствительность 78%, специфичность 92,7%). Для гена APC чувствительность составила 32%, специфичность - 93,3%, для гена RASSF1 чувствительность была 85,3%, специфичность - 56,7%. Раннее полученные данные по аберрантному метилированию генов SEPT9 и VIM и новые данные по генам APC, RASSF1A и ITGA4 мы сравнили со статусом мутации в генах KRAS и NRAS. Было обнаружено, что в группе пациентов, имеющих мутации в генах KRAS или NRAS, ДНК опухолевых образцов достоверно чаще метилировано в генах SEPT9 (p = 0.0018) и ITGA4 (p = 0.0044), в отличие от ДНК опухолевых образцов пациентов, не имеющих мутации генов семейства RAS. При статистическом анализе эффективности диагностической тест-системы было показано, что наша модель, включающая в себя пять маркеров метилирования (APC, RASSF1A, ITGA4, SEPT9 и VIM) обладает наилучшими показателями чувствительности и специфичности (82,7% и 97,3% соответственно). Полученную модель диагностической тест-системы предлагается использовать для задач диагностики КРР.
Колоректальный рак, колоноскопия, аберрантное метилирование, гены
Короткий адрес: https://sciup.org/143164663
IDR: 143164663
Текст научной статьи Роль аберрантного метилирования в генах APC, RASSF1A и ITGA4 в диагностике колоректального рака
Колоректальный рак (КРР) является одной из основных причин заболеваемости раком и смертности во всем мире [1]. В России КРР занимает второе место по распространенности среди онкологических заболеваний [2].
«Золотым стандартом» диагностики КРР является колоноскопия – эндоскопическое исследование толстой кишки и терминального отдела подвздошной кишки при помощи специального гибкого эндоскопа. Данный метод обладает высокими показателями достоверности, однако сама по себе процедура достаточно болезненна и проводится с применением седации или внутривенного наркоза [3]. Также одним из недостатков колоноскопии является высокая стоимость этого метода диагностики. Учитывая перечисленные недостатки, применять колоноскопию для скрининга широких масс населения нецелесообразно.
В последнее время появляется все больше предложений по генетической диагностике КРР. В этом направлении особый интерес представляют эпигенетические маркеры, такие как профили микроРНК и аберрантное метилирование [4, 5].
Метилированная ДНК является достаточно информативным биомаркером. Наличие и количество метилированной ДНК можно детектировать в образцах крови или плазмы. Метилирование обширных регионов CpG-островков – основное эпигенетическое изменение, характерное для процессов канцерогенеза при КРР [6].
На настоящий момент на рынке представлены зарубежные коммерческие наборы для определения аберрантного метилирования генов SEPT9 и VIM, однако в России они используются только для научных целей, при этом отсут- ствует применение их в клинической практике.
Ранее нами была проведена работа по оценке параметров диагностическй модели из маркеров SEPT9 и VIM, которая показала высокую эффективность данного подхода [7]. В настоящей работе мы определяли наличие аберрантного метилирования в генах APC, RASSF1A и ITGA4 и оценивали возможность создания диагностической тест-системы на основе всех пяти биомаркеров.
Инактивация гена RASSF1A (Ras - ассоциированный домен семейства 1 изоформа А) влияет на развитие многих видов рака, при этом чаще всего подобная инактивация возникает вследствие аберрантного метилирования про-мотерного участка гена. Белок RASSF1A связан с процессами клеточного апоптоза и влияет на клеточный цикл, ингибируя аккумуляцию циклина D1. Таким образом, инактивация гена RASSF1A приводит к подавлению функции опухолевых супрессоров и ингибирует передачу сигнала к клеточному апоптозу [8].
APC белок является негативным регулятором концентрации бета-катенина и взаимодействует с Е-кадгерином, который отвечает за клеточную адгезию. По результатам многочисленных исследований аберрантное метилирование гена APC может приводить к развитию КРР [9–11].
Интегрин-альфа-4, продукт гена ITGA4, участвует в цитолитическом взаимодействии T-лимфоцитов с клетками-мишенями. Метилирование гена ITGA4 также влияет на развитие КРР [12].
При обследовании всех пациентов, включенных в данное исследование, был проведен анализ наличия мутаций в генах KRAS и NRAS. Гены KRAS и NRAS кодируют белки ГТФазы, играющих важную роль в передачах сигнала.
Продукты генов KRAS и NRAS являются ключевыми молекулами в нисходящем сигнальном пути рецептора человеческого эпидермального фактора роста (EGFR) — сложного сигнального каскада, принимающего участие в развитии и прогрессировании рака [13, 14].
Тестирование генов, кодирующих белки семейства RAS (KRAS и NRAS) позволяет отобрать пациентов с диким типом (без мутации) генов KRAS и NRAS, у которых можно достигнуть ответа при лечении моноклональными антителами, блокирующими белок EGFR [15].
В данном исследовании мы сопоставляли статус мутации генов семейства RAS с наличием аберрантного метилирования в выбранных нами генах.
Задачи этого исследования включали в себя анализ метилирования промотерных участков генов APC, RASSF1A и ITGA4 у пациентов с КРР и формирование высокоэффективной диагностической модели на основании полученных нами ранее и новых данных по метилированию.
Материалы и методы
Работа была одобрена локальным этическим комитетом, выполнена в соответствии с требованиями GCP (Good Clinical Practice) и Хельсинской декларацией по защите прав человека.
Исследование включало 150 парных образцов опухолевой ткани с известным статусом мутации генов семейства RAS и окружающей гистологически неизмененной ткани пациентов с аденокарциномой прямой кишки, проходивших лечение в Республиканском клиническом онкологическом диспансере Министерства здравоохранения Республики Татарстан в
Таблица 1
Клиническая характеристика пациентов
|
Пол |
Количество |
|
мужской |
72 |
|
женский |
78 |
|
Возраст |
|
|
>50 |
124 |
|
<50 |
26 |
|
Cтадия опухоли |
|
|
Т2M0 |
11 |
|
Т3M0 |
36 |
|
Т4М0 |
38 |
|
Т2М1 |
2 |
|
Т3М1 |
18 |
|
Т4М1 |
28 |
2008-2012 годах (табл. 1). Каждый пациент подписал добровольное информированное согласие на участие в проведении исследования. Опухоли классифицированы в соответствии с TNM-классификацией Международного противоракового союза и описаны гистологически на основании классификации Всемирной Организации Здравоохранения (ВОЗ). Для отбора образцов с высоким содержанием опухолевых клеток проводили дополнительный гистологический анализ микросрезов. Отбирали образцы из первичных очагов с содержанием опухолевых клеток не менее 70%.
Выделение ДНК осуществлялось набором QIAamp DNA FFPE Tissue Kit («Qiagen», Германия), концентрацию суммарной ДНК в водном растворе оценивали на спектрофотометре NanoVue Plus («GE Healthcare», Великобритания). Бисульфитная конверсия и очистка проводились наборами EpiTect Fast Bisulfite Conversion Kit («Qiagen», Германия) с помощью автоматической станции пробоподготовки QIAcube («Qiagen», Германия). Изучение профилей метилирования производилось с помощью метода MethyLight PCR c олигонуклеотидами (табл. 2), подобранными на локусы, содержащими дифференциальнометилируемые CpG-островки, на приборе StepOnePlus™ Real-Time PCR Systems («Applied Biosystems», США).
Статистический анализ данных проводили с применением точного критерия Фишера. Уровень значимости принят равным 0,05. Конкор-дантность данных по метилированию оценивали с помощью непараметрической ранговой корреляции Спирмана. Значимость корреляции по Спирману (Rs) проверяли с помощью t-теста Стьюдента: с числом степеней свободы ν = N-2, где N – размер выборки. Уровень значимости принят равным 10–6.
Чувствительность и специфичность маркеров оценивались с помощью ROC-анализа (MedCalc.2 software)
Результаты и обсуждение
Поиск и создание новых диагностических методов – одна из главных задач современной медицины, ориентированной на персональный подход к пациентам. Применение этих методов должно обеспечить успешный результат у индивидуума или популяции в целом, а также повлиять на решение врача в вопросах диагностики заболевания и ведения больного (лечения, реабилитации). Для характеристики информативности диагностических методов исследования
Таблица 2
Параметры праймеров и зондов для ПЦР в режиме реального времени
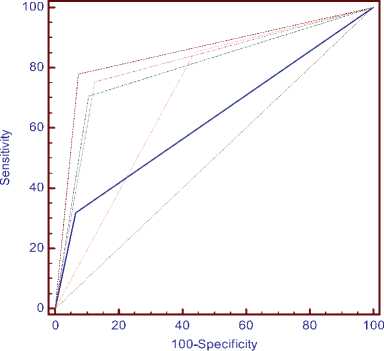
В нашем исследовании подтвердилось наличие метилированных промотерных участков генов APC, RASSF1A и ITGA4. ДНК образцов опухоли было достоверно чаще метилировано, чем ДНК образцов прилежащей ткани. При этом наибольшая разница наблюдалась для гена ITGA4 (чувствительность 78%, специфичность 92,7%) (таблица 3). Метилирование в данных генах является результатом процесса канцерогенеза, при этом ген ITGA4 не является биологически значимыми маркером, однако ценность его как клинического маркера высока, так как в отличие от биологически значимых маркеров, таких как APC (чувствительность 32%, специфичность 93,3%) и RASSF1 (чувствительность 85,3%, специфичность 56,7%) обладает высокими показателями как чувствительности, так и специфичности.
При анализе образцов пациентов с КРР на наличие мутаций в генах KRAS или NRAS, 60% пациентов имели нормальную сигнальную систему EGFR и дикий тип гена KRAS; остальные 40% были носителями мутантного варианта генов семейства RAS. Из обнаруженных 40% мутаций только 10% приходится на ген NRAS, остальные мутации были детектированы в гене KRAS. Распределение частот типов мутаций полностью совпало с представленной информацией по ним в базах COSMIC, ENSEMBL и NCBI.
В данном исследовании мы анализировали наличие мутации в генах KRAS или NRAS
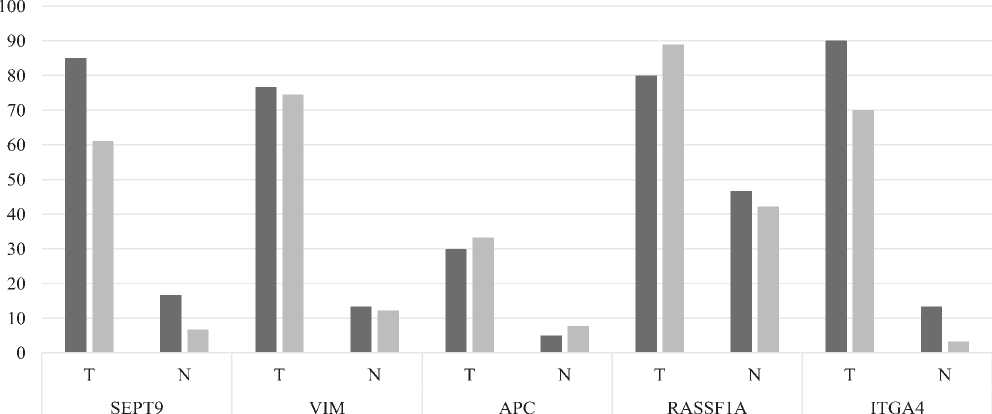
■ RAS+ I RAS-
Рис. 1. Процент метилированных образцов в зависимости от статуса мутации генов, кодирующих белки семейства RAS.
и аберрантного метилирования генов APC, RASSF1A и ITGA4. Полученные данные мы объединили с раннее установленными частотами аберрантного метилирования в генах SEPT9 и VIM. Таким образом, оказалось, что в группе пациентов, имеющих мутации в генах KRAS или NRAS, ДНК опухолевых образцов достоверно чаще метилировано в генах SEPT9 (p = 0.0018) и ITGA4 (p = 0.0044), в отличие от ДНК опухолевых образцов пациентов, не имеющих данные мутации (рис.1).
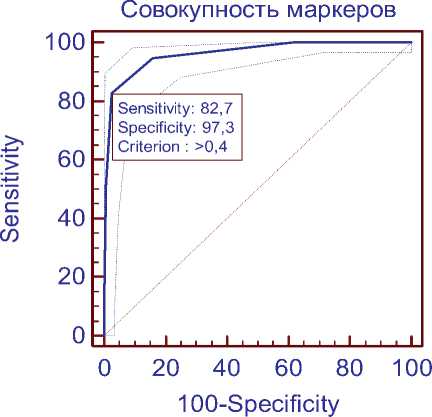
В рамках данной работы был рассчитан индекс метилирования для каждого образца и проверены параметры чувствительности и специфичности как для совокупности маркеров, так и для каждого маркера в отдельности. За пороговое значение для анализа совокупности маркеров был взят индекс метилирования, равный 0,4. Под индексом метилирования понимается отношение числа метилированных локусов к общему числу локусов модели. При этом значении система из маркеров имеет максимальные показатели чувствительности и специфичности (82,7% и 97,3% соответственно) (рис. 2). AUC, показатель интегральной оценки качества и предсказательной способности модели, составляет 0,96, что говорит о высоком качестве модели. По сравнению с нашей предыдущей моделью, состоящей из маркеров SEPT9 и VIM [7], представленная модель, включающая пять маркеров, на 19,3% более специфична.
Эффективность диагностической тест-системы напрямую зависит от показателей, включенных в нее биомаркеров. Гены SEPT9, VIM, ITGA4 показали высокие значения обоих параметров. Для генов APС и RASSF1A высокий показатель был лишь у одного параметра. Тем не менее, в совокупности данные биомаркеры обеспечивают хороший диагностический результат. Учитывая то, что диагностическая система может быть основана на малоинвазивном методе определения статуса метилирования в плазме крови, можно предложить ее использование в обширных скрининговых программах, а также для оценки динамики заболевания у пациентов КРР.
Выводы
В нашей работе было проанализировано наличие метилирования в генах APC, RASSF1A и ITGA4 у пациентов с КРР. В образцах опухолевых тканей было подтверждено наличие метилирования CpG-островков в промотерных областях выбранных генов. Наибольшая разница в метилировании между опухолевой и здоровой тканью наблюдалась для гена ITGA4 (чувствительность 78%, специфичность 92,7%). Для гена APC (чувствительность составила 32%, специфичность – 93,3%), для гена RASSF1 (чувствительность была 85,3%, специфичность – 56,7%.
Ранее полученные данные по аберрантному метилированию генов SEPT9 и VIM и новые данные по генам APC, RASSF1A и ITGA4 мы сравнили со статусом мутации в генах KRAS и NRAS. Было обнаружено, что в группе пациентов, имеющих мутации в генах KRAS или NRAS, ДНК опухолевых образцов достоверно чаще метилировано в генах SEPT9 (p = 0.0018) и ITGA4 (p =
--ARC
— ITGA4
RASSF1A
-- SEPT9
....... VIM
Рис. 2. Сравнение результатов ROC-анализа для каждого маркера в отдельности и для совокупности маркеров.
0.0044), в отличие от ДНК опухолевых образцов пациентов, не имеющих данных мутаций.
При статистическом анализе эффективности диагностической тест-системы было показано, что наша модель, включающая в себя пять маркеров метилирования (APC, RASSF1A, ITGA4,
SEPT9 и VIM), обладает наилучшими показателями чувствительности и специфичности (82,7% и 97,3% соответственно). Полученную модель диагностической тест-системы предлагается использовать для скрининговых задач и оценки динамики КРР.
Список литературы Роль аберрантного метилирования в генах APC, RASSF1A и ITGA4 в диагностике колоректального рака
- Jemal A., Center M.M., DeSantis C., Ward E.M. Global Patterns of Cancer Incidence and Mortality Rates and Trends. Cancer Epidemiol. Prev. Biomark. 2010;19:1893-1907.
- Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2008 г. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2010. Т. 21, прил.1. С. 52-86.
- Шахшаль Г. 2012. Практическая колоноскопия. М.: «МЕДпресс-информ».192 с.
- Khare S., Verma M. Epigenetics of Colon Cancer. In Cancer Epigenetics. 2012. Humana Press, Totowa, NJ. 177-185.
- Соколова Е.А., Боярских У.А., Ширшова А.Н., Кель А.Э., Филипенко М.Л. Биомаркеры для своевременной диагностики колоректального рака. Клиническая лабораторная диагностика. 2015; 60 (12): 15-23.
- Kim M.S., Lee J., Sidransky D. DNA methylation markers in colorectal cancer. Cancer Metastasis Rev. 2010; 29: 181-206.
- Бровкина О.И., Гордиев М.Г., Ходырев Д.С., Никитин А.Г., Аверьянов А.В. Использование аберрантно метилированных генов SEPT9 и VIM для клинической диагностики колоректального рака. Клиническая практика. 2016; 28: 15-19.
- Dammann R., Schagdarsurengin U., Strunnikova M., Rastetter M., Seidel C., Liu L., Tommasi S., Pfeifer G.P. Epigenetic inactivation of the Ras-association domain family 1 (RASSF1A) gene and its function in human carcinogenesis. Histol. Histopathol. 2003; 18:665-677.
- Fodde R. 2002. The APC gene in colorectal cancer. Eur. J. Cancer Oxf. Engl. 1990; 38: 867-871.
- Aoki K., Taketo M.M. Adenomatous polyposis coli (APC): a multi-functional tumor suppressor gene. J. Cell Sci. 2007; 120: 3327-3335.
- Fodde R., Smits R., Clevers H. APC, Signal transduction and genetic instability in colorectal cancer. Nat. Rev. Cancer. 2001; 1: 55-67.
- Gerecke C., Scholtka B., Löwenstein Y., Fait I., Gottschalk U., Rogoll D., Melcher R., Kleuser B. Hypermethylation of ITGA4, TFPI2 and VIM promoters is increased in inflamed colon tissue: putative risk markers for colitis-associated cancer. J. Cancer Res. Clin. Oncol. 2015; 141: 2097-2107.
- Bar-Sagi D., Hall A. Ras and Rho GTPases: a family reunion. Cell. 2000; 103: 227-238.
- Мазуренко Н.Н., Цыганова И.В., Гагарин И.М., Чуев Ю.В., Мочальникова В.В., Коломейцева А.А., Горбунова В.А. Мутации EGFR и KRAS, важные для таргетной терапии немелкоклеточного рака легких. Молекулярная Медицина. 2013;6: 55-59.
- Писарева Е.Е., Любченко Л.Н., Коваленко C.П., Шаманин В.А. Анализ мутаций в генах KRAS и BRAF при раке толстой и прямой кишки в российской популяции. 2016; 15: 36-41.


