Роль адаптации костной ткани бедра вокруг ножки имплантата тазобедренного сустава в развитии остеопении
Автор: Акулич Ю.В., Денисов А.С., Подгаец Р.М., Скрябин В.Л., Сотин А.В., Субботина К.С.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 1 (35) т.11, 2007 года.
Бесплатный доступ
В процессе эксплуатации протеза в кости, окружающей ножку, развивается остеопения (растёт пористость, убывает минеральное содержание) и, как следствие, уменьшается жесткость костной ткани, что ведет к расшатыванию эндопротеза. Рост пористости и деминерализация обусловлены факторами механической природы (адаптационной реакцией кости на снижение нагрузки) и нарушением питания проксимального отдела бедра в результате остеотомии и формирования костного ложа для эндопротеза. Цель работы состоит в количественной оценке влияния пористости костной ткани и деминерализации матрикса на уменьшение массы кости. Изменение во времени пористости и механических свойств костной ткани, окружающей ножку имплантата, моделируется с учётом взаимовлияния внутренней и внешней перестройки. Установлено несущественное влияние внешней перестройки на процесс адаптации плотной кости. Оценка вкладов пористости и деминерализации в общий баланс наблюдаемых потерь кости сделана с помощью полученного в работе уравнения баланса потерь массы костной ткани по известным экспериментальным данным. Согласно расчетам величина потери массы кости в проксимальной части протезированного бедра от деминерализации составила 70% от общей потери, тогда как на долю адаптационной резорбции приходится 30%.
Тазобедренный сустав, эндопротез, остеопения, адаптация, пористость, деминерализация, баланс потерь массы кости
Короткий адрес: https://sciup.org/146215879
IDR: 146215879 | УДК: 531/534:
Текст научной статьи Роль адаптации костной ткани бедра вокруг ножки имплантата тазобедренного сустава в развитии остеопении
Среди основных причин несостоятельности тотального эндопротезирования тазобедренного сустава главной является нестабильность ножки протеза (45% случаев), вывих головки - 8%, перелом ножки - 6%, перипротезный перелом бедра - 4%, износ вкладыша чаши имплантата - 3%, другие причины - 5% [1]. В литературе обсуждаются различные причины асептического расшатывания компонент эндопротеза. К причинам немеханической природы относят: иммунную реакцию организма на имплантат, воспалительную реакцию, действие высокой температуры полимеризации при использовании имплантатов с цементной фиксацией и некротические изменения костной ткани вследствие механической обработки костного ложа. Из причин,
обусловленных механическим воздействием на кость, наиболее обсуждаемыми являются микроподвижность эндопротеза, нефизиологическое перераспределение внешней нагрузки на кортикальную кость, нарушение транспорта внутритканевой жидкости и связанное с ним ухудшение питания кости.
Согласно биомеханической гипотезе основной причиной потери стабильной фиксации эндопротеза в костном ложе является изменение функциональных нагрузок на костную ткань, вызванное установкой имплантата [1 - 3]. Реакция кости выражается в виде изменения состава, структуры и механических свойств костной ткани.
Так, в соответствии с экспериментальным анализом [4] фрагментов "бедро - металлический имплантат с пористым покрытием", изъятых из трупов 12 человек, перенесших операцию эндопротезирования, в областях контакта кости с пористым покрытием ножки эндопротеза наблюдаются малые (менее 20 мкм) упругие относительные перемещения, что говорит о хорошей биофиксации. В наиболее нагружаемых местах кости из-за её микротравмы происходит замещение костной ткани соединительно-тканной капсулой, ослабляющей жесткость соединения кости с имплантатом и блокирующей биофиксацию имплантата. К такому же эффекту приводит начальная микроподвижность ножки эндопротеза. Полученные данные свидетельствуют о положительном эффекте биофиксации. Однако в этой же работе установлены и негативные её последствия. В участках кортикального слоя с недостаточной нагрузкой (частичное экранирование стимулирующей нагрузки на проксимальную часть протезированного бедра биофиксацией ножки эндопротеза) рентгенологически1 выявлена значительная потеря минеральной плотности костной ткани, охватывающей ножку эндопротеза. Причём отмечается устойчивый рост потери минеральной плотности кости вдоль кости от дистальной её части (от конца ножки эндопротеза) к проксимальной: 12% у дистального конца ножки, 14% в срединной части ножки, 46% в проксимальной части протезированного бедра2.
Кроме того, моделирование процесса внутренней перестройки в окружающем имплантат слое кортикальной кости показало, что недогрузка бедра приводит к увеличению пористости структуры [5]. Недогрузка бедра на 30% через 7 лет эксплуатации протеза приводит к увеличению пористости в четыре раза от уровня 0,04 в норме.
Цель настоящей работы состоит в том, чтобы сопоставить величины потерь костной ткани от резорбции при адаптационной перестройке структуры при недогрузке по амплитуде (изменяется пористость) и от деминерализации, обусловленной другими факторами механической и немеханической природы, например, нарушением питания кости, вызванном как уменьшением числа циклов нагружения, так и подготовкой костного ложа.
Уравнение баланса потери массы костной ткани
Эффективная плотность костной ткани р зависит от её структуры и состава и определяется соотношением [6]
р = р m Sm + р marpv , где рm, tm - эффективная плотность и объёмное содержание матрикса, соответственно, рmar - плотность мягких тканей, содержащихся в порах, pv - пористость структуры. Эффективная плотность матрикса учитывает состав костной ткани и определяется соотношением рm = рa ta + рo tо + р wt w , (2)
где р a , t a , р o , t o , р w , t w - плотности и объёмные содержания минералов, органической компоненты и воды в матриксе, соответственно. Первое слагаемое в правой части (2) характеризует минеральную плотность матрикса, которая изменяется при нарушении питания кости путем изменения объёмного содержания минералов t а • Второе и третье слагаемые в данной работе принимаются постоянными, то есть полагается, что нарушение питания кости не влияет на удельную массу воды и органической составляющей в матриксе. Данная ситуация возможна, если деминерализация матрикса происходит за счет образования в нем микропор.
Подставим равенства (2) в соотношение (1) и с учётом соотношения t m = 1 - p v получим функцию эффективной плотности костной ткани от аргументов t а и p v
р(t а ,p v ) = р а t а (1 — p v ) + (р o t о + р w t w )( 1 — p v ) + p v р mar . (3)
Первое слагаемое в правой части (3) является минеральной плотностью костной ткани, которая изменяется как при нарушении питания кости, так и адаптационной резорбции, увеличивающей пористость pv .
Разложение функции (3) в ряд Тейлора в точке (t а 0 , p v0 ), характеризующей состояние костной ткани до операции, с сохранением линейных членов ряда устанавливает связь потери эффективной плотности костной ткани Ар с изменением объёмного содержания минералов в матриксе A t а и изменением пористости костной ткани A p v в виде
Ар = р а ( 1 — pv 0 ) At a + (р mar — р m 0 ) А P v , (4)
где рm0 - эффективная плотность матрикса костной ткани пациента перед операцией рm0 = рata0 + роtо + рwtw . (5)
Уравнение (4) позволяет сопоставить вклады деминерализации кости и резорбции при адаптационной перестройке её структуры в потерю массы кости.
Модель роста пористости
Резорбция костной ткани при недогрузке протезированного бедра является адаптационным процессом, включающим перестройку как внутренней структуры (увеличиваются радиусы гаверсовых каналов r , рис.1), так и внешних размеров кости (уменьшается её наружный радиус R 2 ). Предполагается, что ввиду удаления трабекулярной ткани и остеогенных клеток при операционной подготовке костного ложа на внутренней поверхности кости в районе контакта с металлом отсутствует внешняя перестройка. Следовательно, величина внутреннего радиуса R 1 не изменяется.
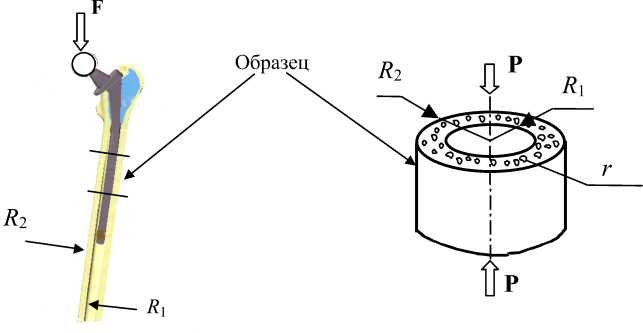
Рис. 1. Фрагмент протезированного бедра. F — реакция таза, P - усилие сжатия, R 1 - внутренний радиус, R 2 - наружный радиус, r - радиус гаверсова канала
Система тензорных уравнений, описывающая процесс внутренней перестройки, получена в работе [7] и для одноосного напряженно-деформированного состояния образца (см. рис. 1), вырезанного из диафиза кости, окружающего ножку эндопротеза, даёт следующее определяющее уравнение адаптационной пороупругости [7]
а = R ( £ - £ eq ) £ + ^ m E £ ,
где точкой обозначены производные по времени, а , £ , ^ m , E — напряжение, деформация, объёмное содержание матрикса и модуль упругости костной ткани, соответственно, £ eq — деформация до операции, R — чувствительность костной ткани к деформационному стимулу перестройки, являющаяся функцией параметров структуры: радиуса гаверсова канала r и плотности пор n в поперечном сечении трубчатой кости.
Функция R находится из кинетического уравнения внутренней перестройки [7]
с учетом равенств
d ( ^ m E ) dt
= R (£-£ eq )
^ m = 2 п rna ( £ - £ eq ) ,
У У
E = ^ m E m ,
где a - коэффициент, характеризуемый активностью и плотностью расположения костных клеток на внутренней (эндостальной) поверхности гаверсовых каналов [8], Em - модуль упругости матрикса в направлении оси остеона. После взятия производной в (7) и соответствующих подстановок выражение для R принимает вид
R = 4 п rna ^ mEm .
Изменение наружного радиуса кости R 2 описывается кинетическим уравнением внешней перестройки в форме [9]
R 2 =- ap ( £-£ eq ) ,
где a p - коэффициент, характеризуемый активностью и плотностью расположения костных клеток на наружной (периостальной) поверхности кости.
Уравнения (6) и (11) связаны, поскольку с изменением внешнего радиуса кости изменяется напряжение продольного сжатия
P
n ( R 2 - R 2 )
и, следовательно, скорость изменения напряжения при постоянной силе P равна
2 PR 2 R 2
^ 9 .
n ( R 2 - R 2 )
Подставляя соотношения (11) и (13) в уравнение (6), получим
2 PR 2 a p ( s-s eq ) n ( R 2 - R 2 ) 2
= R ( s-s eq ) e + ^ mE s.
Уравнение (14) учитывает совместное влияние внешней и внутренней перестройки на процесс адаптации трубчатой кости к новой нагрузке P . При этом изменяются во времени все характеристики структуры (пористость, радиус гаверсовых каналов), формы (радиус R 2 ) и механические свойства (модуль упругости), а деформация восстанавливается к равновесному значению s eq , которое имело место у пациента до операции (состояние в норме).
Результаты моделирования роста пористости
Уравнение (14) интегрировалось численно по схеме Эйлера с временным шагом в один день. На каждом временном шаге вычислялись значения величин s , R , R 2 , r , ^ m , p v , E . Необходимые начальные значения (значения в момент начала действия новой нагрузки после операции) некоторых из этих величин были приняты равными: R 2 = 14 мм , r = 0,03 мм . Значения R , ^ m , p v , E , s eq вычислялись с использованием констант: R i = 6 мм , n = 13 мм - 2 , a = 0,055 мм/день , Em = 18,2 ГПа , Р 0 = 9,751 кН , где Р 0 - наибольшее усилие сжатия бедра в течение одноопорной фазы шага в норме, определяемое с учетом усилий мышц тазобедренной группы [10]. Коэффициент ap принимался равным коэффициенту a . Величина недогрузки составляла 30%.
На рис. 2 представлены графики изменения восстанавливаемой деформации сжатия s. Как видно из сравнения кривых, влияние внешней перестройки на процесс восстановления деформации в норме s eq несущественно. Начальная деформация сжатия, равная 0,0008, меньше деформации до изменения нагрузки s eq , равной 0,00115, поскольку рассматривается случай уменьшения нагрузки на костную ткань после установки эндопротеза с биофиксацией. В течение адаптации происходит восстановление деформации до уровня s eq , что говорит о завершении процесса перестройки через 16 - 17 лет после операции.
w s и cd s a о
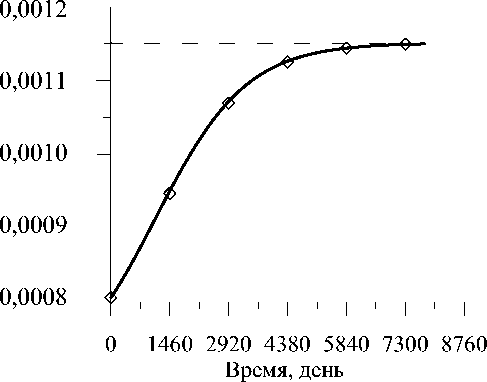
Рис. 2. Изменение восстанавливаемой деформации ε в процессе адаптации. Непрерывная линия обозначает процесс адаптации при совместном действии внешней и внутренней перестройки, квадратами обозначается процесс адаптации при действии только внутренней перестройки, пунктирной линией отмечен уровень восстанавливаемой деформации ε eq
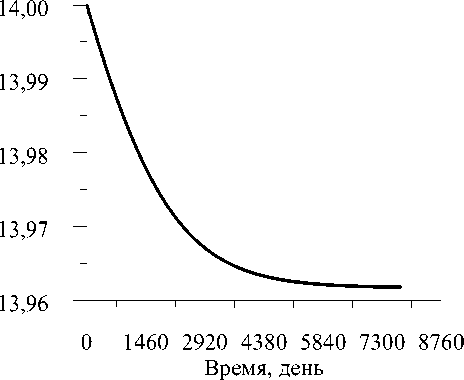
Рис. 3. Изменение наружного радиуса кости R 2 в процессе адаптации
В процессе вычислений восстанавливаемой деформации ε были установлены временные изменения наружного радиуса кости R 2 , радиуса гаверсового канала r и эффективного модуля упругости костной ткани Е .
На рис. 3 представлена кривая изменения наружного радиуса кости R 2 . Анализ кривой показывает, что послеоперационная недогрузка кости приводит к уменьшению её внешнего радиуса. Однако величина уменьшения невелика и составляет 0,27% (0,038 мм). Наибольшая и практически постоянная скорость уменьшения внешнего радиуса кости наблюдается в течение первых пяти лет эксплуатации протеза ( ∼ 5 мкм/год). В последующие годы происходит постепенное уменьшение скорости до нуля, поскольку к нулю стремится стимул адаптации ε - ε eq (рис. 2).
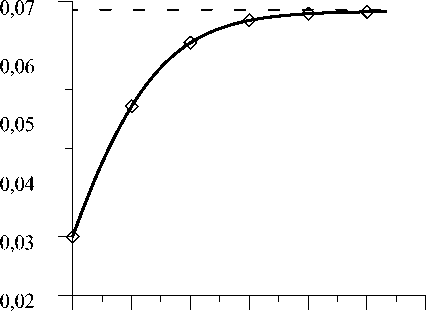
На рис. 4 представлена кривая, иллюстрирующая изменения радиуса гаверсового канала r . Кривая показывает, что внутренняя перестройка при недогрузке кости приводит к расширению гаверсовых каналов. Влияние внешней перестройки
0 1460 2920 4380 5840 7300 8760
Время, день
Рис. 4. Изменение радиуса гаверсового канала r в процессе адаптации. Непрерывная линия обозначает процесс адаптации при совместном действии внешней и внутренней перестройки, квадратами обозначается процесс адаптации при действии только внутренней перестройки, пунктирной линией отмечен предельный уровень r
0 1460 2920 4380 5840 7300 8760
Время, день
Рис. 5. Изменение модуля упругости костной ткани Е в процессе адаптации. Непрерывная линия обозначает процесс адаптации при совместном действии внешней и внутренней перестройки, квадратами обозначается процесс адаптации при действии только внутренней перестройки, пунктирной линией отмечен установившийся уровень Е здесь так же несущественно. В течение первых пяти лет эксплуатации протеза происходит интенсивное расширение просвета гаверсовых каналов со скоростью изменения его радиуса ∼5 мкм/год до величины 0,055 мм (рост на 85%). Площадь сечения гаверсового канала при этом возрастает в 3,4 раза. В последующие годы наблюдается более медленное увеличение радиуса гаверсовых каналов до значения 0,07 мм (рост радиуса на 130%, площади в 5,4 раза).
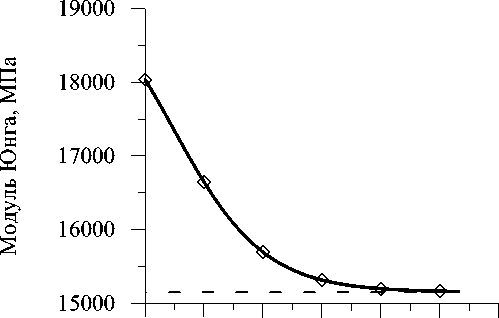
На рис. 5 представлен график изменения модуля упругости костной ткани Е . Анализ кривой показывает, что модуль упругости в процессе перестройки асимптотически уменьшается до нового уровня 15,2 ГПа (на 16%) . Наиболее интенсивное изменение со скоростью ∼ 280 МПа/год наблюдается в первые 8 лет эксплуатации эндопротеза. При этом уменьшение модуля упругости составляет 12%. Такое незначительное снижение жесткости костной ткани в результате структурной
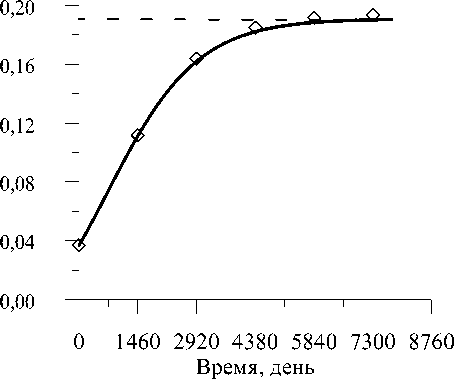
Рис. 6. Изменение пористости плотной костной ткани pv в процессе структурной адаптации. Непрерывная линия обозначает процесс адаптации при совместном действии внешней и внутренней перестройки, квадратами обозначается процесс адаптации при действии только внутренней перестройки, пунктирной линией отмечен установившийся уровень pv адаптации, вызванной недогрузкой кости, говорит о дополнительном влиянии на модуль упругости другого фактора. В соответствии с экспериментальными данными [4] этим фактором, по-видимому, является деминерализация кости, обусловленная нарушением её питания хирургической травмой и, возможно, уменьшением частоты нагрузки.
На рис. 6 представлен график процесса адаптационного изменения пористости p . Кривая показывает, что в силу расширения просветов гаверсовых каналов (рис. 4) существенно увеличивается пористость костной ткани, достигая по завершении процесса перестройки величины 0,19 (возрастание в 4,75 раза). В течение первых восьми лет пористость возрастает интенсивно со скоростью ∼ 0,015 1/год и достигает четырехкратного увеличения к концу этого периода, тогда как в течение последующей половины всего времени адаптации (15 - 16 лет) она увеличивается на 0,03 (на 75%). После 6 - 6,5 лет эксплуатации эндопротеза приращение пористости равно Δ pv = 0,135 .
Расчёт потери массы костной ткани
Потеря массы костной ткани определяется по формуле (4) при следующих значениях входящих величин: pv 0 = 0, 037 (см. рис. 7), ρ m 0 = 2 г/см3 , ρ mar = 1 г/см3 [6]. Абсолютное уменьшение объёмного содержания минералов в матриксе Δ ξ а определяется по экспериментальным данным [4], согласно которым наибольшее относительное уменьшение объёмного содержания минералов в костной ткани δ( ξ а ξ m ) = δ ( ξ a (1 - pv )) равно 0,46. Следовательно, получаем
Δ ( ξ a (1 - p v )) =- 0,46 ξ a 0 (1 - p v 0 ) . (15)
Левая часть соотношения (15) находится разложением функции ξ a (1 - pv ) в ряд Тейлора с удержанием линейных членов
Δ ( ξ a (1 - pv )) = (1 - pv 0) Δξ a - ξ a 0 Δ pv . (16)
Из соотношений (15) и (16) следует равенство
(1 - PvоЖa =-0,46^a0(1 - Pv0) + ^a0APv .(17)
Неизвестная в равенствах (5) и (17) величина объёмного содержания минералов в матриксе до операции ^ а о определяется по экспериментальному значению минеральной плотности кортикальной костной ткани ρ ab до операции [11]
Р ab = Р a (1 - Pv 0)^ a0 = 0,974 г/см3.
Первое слагаемое в равенстве (4) определяет потерю массы кости вследствие её деминерализации
АРa =Ра (1 -Pv0)A^а =-0,312 г/см3,(19)
а второе - потерю массы кости в результате адаптационной резорбции
АР v =(Р m 0 -Р mar )APv =-0,135 г/см3.
Полученные данные показывают, что потеря массы кости вследствие деминерализации её в 2,3 раза превосходит потерю от адаптационной резорбции и составляет 70% от полной потери массы кости, тогда как на долю адаптационной резорбции приходится 30%, что говорит о существенной роли фактора деминерализации в развитии остеопении в проксимальной части протезированного бедра. Следовательно, при построении прогностической модели послеоперационного изменения механических свойств костной ткани, окружающей ножку эндопротеза, необходимо учитывать не только процесс резорбции, вызванный её функциональной недогрузкой, но и процесс деминерализации как следствие недогрузки и хирургического вмешательства.
Заключение
Основной причиной расшатывания бедренной компоненты эндопротеза тазобедренного сустава с биофиксацией является снижение жесткости костной ткани вокруг ножки эндопротеза при его эксплуатации ввиду развития резорбции и остеопении (потеря эффективной плотности костной ткани).
Обширные in vitro экспериментальные исследования [4] выявили значительное снижение минеральной плотности костной ткани, охватывающей ножку эндопротеза, после 6,5-летней его эксплуатации. Причём отмечается устойчивый рост потери минеральной плотности кости вдоль кости от дистальной её части (от конца ножки эндопротеза) к проксимальной: 12% у конца ножки, 14% в срединной части ножки, 46% в проксимальной части протезированного бедра. Наибольшей из этих величин в проксимальной части протезированного бедра в силу соотношения (4) соответствует уменьшение эффективной плотности костной ткани на 0,312 г/см3, что составляет 70% от полной потери массы кости.
Численное моделирование послеоперационного развития пористости костной ткани, окружающей ножку эндопротеза, показало, что потеря костной массы резорбцией кости, вызванной её функциональной недогрузкой, к концу 6,5-летнего периода эксплуатации не превышает величины 0,135 г/см3, что составляет 30% от полной потери массы кости.
Следовательно, фактор деминерализации оказывает превалирующее по сравнению с резорбцией влияние на развитие остеопении на проксимальном конце кости, где есть наибольшая недогрузка и кость имеет раневую поверхность. Полученные данные позволяют утверждать, что прогностическая модель послеоперационного изменения механических свойств костной ткани, окружающей ножку эндопротеза, должна описывать не только процесс резорбции, вызванный её функциональной недогрузкой, но и процесс деминерализации как следствие недогрузки после эндопротезирования и хирургической травмы.


