Роль цАМФ, цГМФ, NO-синтазы, КАТФ-каналов и протеинкиназы С в реализации кардиопротекторного эффекта агониста каннабиноидных рецепторов HU-210
Автор: Лишманов Ю.Б., Маслов Л.Н., Ласукова О.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.27, 2012 года.
Бесплатный доступ
Установлено, что активация СВ1- и СВ2-рецепторов с помощью селективного агониста HU-210 в конечной концентрации 0,1·10-3 и 1,0·10-3 мМ способствует повышению устойчивости миокарда к действию тотальной ишемии и реперфузии. Внутриклеточный механизм кардиопротекторного эффекта селективного агониста HU-210 реализуется за счет активации КАТФ-каналов и ПКС, не будучи связанным с изменением активности NO-синтазы и уровня циклических нуклеотидов.
Каннабиноидные рецепторы, ишемия, реперфузия, изолированное сердце
Короткий адрес: https://sciup.org/14919716
IDR: 14919716 | УДК: 616.12
Текст научной статьи Роль цАМФ, цГМФ, NO-синтазы, КАТФ-каналов и протеинкиназы С в реализации кардиопротекторного эффекта агониста каннабиноидных рецепторов HU-210
Ишемические и реперфузионные повреждения являются главной проблемой современной кардиологии, от успешного решения которой зависит жизнь тысяч, если не миллионов людей. Острота этой проблемы определяется тем, что необратимые повреждения кардиомиоцитов возникают уже после 10-минутной ишемии [13], а тромболизис или ангиопластику пациентам c острым инфарктом миокарда обычно начинают проводить через несколько часов после возникновения ангинозного приступа [8]. В этой ситуации неоценимую пользу могли бы оказать фармакологические агенты, которые имитируют феномен ишемического прекондиционирования (ИП). Суть названного феномена заключается в повышении устойчивости сердца к патогенному действию длительной ишемии после нескольких предварительных сеансов кратковременной коронароокклюзии и реперфузии [16]. Установлено, что феномен ИП способны имитировать экзогенные каннабиноиды [1, 2]. Оставались неизвестными внутриклеточные механизмы кардиопротекторного действия каннабиноидов. Мы предположили, что в этом механизме может участвовать цАМФ. Основанием для подобной гипотезы послужили данные о том, что каннабиноидные (СВ) рецепторы сопряжены через Gi/о-белки с аденилатциклазой [5], а их активация приводит к угнетению активности аденилатциклазы и снижению продукции цАМФ [5]. С другой стороны, защитные эффекты каннабиноидов могли быть опосредованы NO-синтазой, которая, согласно некоторым сведениям, может быть задействована в механизме каннабиноид-индуцированного повышения толерантности сердца к ишемическим и реперфузионным повреждениям [7]. В работе P. Lepicier и со-авт. [6] установлена ключевая роль протеинкиназы С
(ПКС) в защитном эффекте каннабиноида пальмитоилэ-таноламида на модели коронароокклюзии и реперфузии изолированного сердца крысы [6]. Одними из возможных эффекторов в сигнальном каскаде миокардиальных эффектов каннабиноидов могли являться АТФ-чувстви-тельные К+-каналы (КАТФ-каналы). Данное предположение базируется на публикациях о том, что активация КАТФ-ка-налов обеспечивает повышение толерантности кардиомиоцитов к патогенному действию ишемии-реперфузии [12]. Эти данные послужили нам основой для выдвижения гипотезы об участии названных ионных каналов в защитном эффекте каннабиноидов.
Цель: исследовать роль цАМФ, NO-синтазы, протеин-киназы С, КАТФ-каналов в реализации цитопротекторного эффекта агониста каннабиноидных рецепторов HU-210.
Материал и методы
Эксперименты проводились на крысах-самцах линии Вистар массой 250–300 г по следующей схеме: 20 мин адаптации + 10 мин перфузии фармакологическим агентом + 10 мин перфузии без фармакологического агента (“отмывка от препарата”) + 45 мин тотальной ишемии + 30 мин реперфузии. Параметры сократимости регистрировали путем введения в полость левого желудочка латексного баллончика, сопряженного с датчиком давления прибора SS13L (Biopac System Inc., Goleta, Калифорния, США), встроенного в аппарат для физиологических исследований МР36 компании “Biopac Systems Inc” (Goleta, Калифорния, США). В ходе экспериментов проводили запись кривой внутрижелудочкового давления. Раствор Кребса–Хензелайта и все реактивы готовились на дистиллированной воде, которая подвергалась дополнительной очистке на установке “Simplicity” компании Millipore (Millipore, США). Используемые в эксперименте препараты растворяли в диметилсульфоксиде (DMSO) и после стабилизационного периода добавляли в перфузионный раствор. В работе были использованы: селективный агонист СВ1- и СВ2-рецепторов HU-210 (6aR)-trans-3-(1,1-Dimethylheptyl)-6a,7,10,10a-tetrahydro-1-hydroxy-6,6-dimethyl-6H-dibenzo[b,d]pyran-9-methanol), который добавляли в перфузионный раствор в конечной концентрации 0,1·10–3 и 1,0·10–3 мМ [2]. Для изучения роли сигнальных систем были использованы следующие фармакологические агенты: блокатор протеинкиназы С хелеритрин добавляли в перфузионный раствор в конечной концентрации 2·10–3 мМ [4]; блокатор сар-колеммальных и митохондриальных КАТФ-каналов глибенкла-мид добавляли в перфузионный раствор в конечной концентрации 1,0·10–3 мМ [10]; ингибитор NO-синтазы L-NAME (NG-Nitro-L-arginine methyl ester hydrochloride) добавляли в перфузионный раствор в конечной концентрации 100х10–3 мМ [3]. По окончании этих экспериментов сердца также подвергали быстрой заморозке для исследования в них уровня циклонуклеотидов. Для определения содержания цАМФ проводили экстракцию последних из ткани сердца этиловым спиртом [9]. В полученных образцах оценивали уровень цАМФ и цГМФ с помощью стандартных коммерческих радиоиммунных наборов “RIA AMPc/cAMP” и “RIA AMPc/cGMP” (компания “Immunotech”, Марсель, Франция). Измерение радиоактивности в пробах производили на отечественном гамма-счетчике “Гамма-12”. В конце эксперимента в перфузате, собранном за 30 мин реперфузии, определялся уровень креатинфосфокиназы (КФК) с помощью стандартных наборов CK NAC, Германия. Активность КФК определяли на спектрофотометре Smart Spec Plus (Bio-Rad, США). Конечный результат выражали в мкмоль НАДН/мин в пересчете на 1 г ткани сердца за 30 мин реперфузии (мкМ/ г·мин). Статистическая обработка полученных данных проводилась с использованием программы STATISTICA 6.0 (StatSoft). Для проверки нормальности распределения числовых показателей использовался критерий Колмогорова–Смирнова; для оценки статистической значимости различий между группами применялся непараметрический критерий Манна–Уитни для количественных признаков. Статистически значимыми считались различия при p<0,05. Результаты всех экспериментов приведены на рисунках 1–5, где указан разброс значений относительно средних величин.
Результаты и обсуждение
После тотальной ишемии изолированного сердца с последующим возобновлением коронарной циркуляции отмечалось развитие некроза кардиомиоцитов. Об этом свидетельствовало повышение активности КФК в 4,5 раза в растворе, собранном за период 30-минутной реперфузии, по сравнению с исходными значениями (рис. 1). В ходе экспериментов с использованием HU-210 в конечной концентрации 0,1х10–3 мМ было показано, что данный препарат не влиял на исходное содержание креа-
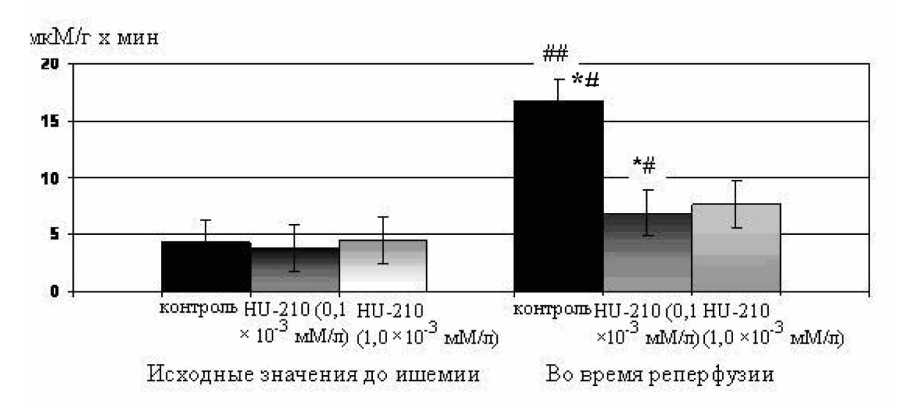
Рис. 1. Влияние агониста каннабиноидных рецепторов HU-210 в концентрации 0,1·10–3 и 1,0·10–3 мМ на активность креатинфосфокиназы в перфузионном растворе до ишемии и во время реперфузии. * – p<0,05 по сравнению с контролем; # – p<0,05; ## – p<0,01 по сравнению с исходными значениями
тинкиназы в доишемическом периоде. Однако названный каннабиноид способствовал снижению степени повреждения кардиомиоцитов в условиях глобальной ишемии и последующей реперфузии. Так, после предварительной перфузии изолированного сердца HU-210 в указанной концентрации повышение активности КФК в реперфузионном периоде оказалось на 47% ниже, чем в контроле.
Увеличение концентрации HU-210 до 1,0·10–3 мМ не приводило к усилению кардиопротекторного эффекта, поэтому в дальнейших экспериментах мы использовали HU-210 в концентрации 0,1·10–3 мМ.
Таким образом, активация каннабиноидных рецепторов препятствует некрозу кардиомиоцитов во время тотальной ишемии и реперфузии изолированного сердца.
Следующим этапом стало выяснение роли цАМФ в кардиопротекторном эффекте исследуемого каннабиноида. Для этого мы провели измерение уровня цАМФ в ткани миокарда на 15-й мин ишемии, а также на 5-й и 30-й мин реперфузии (рис. 2). В контрольной группе нами было обнаружено некоторое увеличение уровня цАМФ на 15-й и 45-й мин тотальной ишемии изолированного сердца по сравнению с исходным уровнем до ишемии. Однако эти изменения были недостоверны. К 30-й мин реперфузии содержание цАМФ практически не отлича- лось от исходного уровня до ишемии. В опытной серии с применением СВ-агониста, вопреки ожиданиям, мы не обнаружили статистически значимых изменений уровня цАМФ относительно контроля в динамике всего эксперимента.
Таким образом, цитопротекторный эффект, наблюдаемый при активации кардиальных каннабиноидных рецепторов, не был связан с изменением внутриклеточного содержания цАМФ.
Мы предположили, что в реализации кардиопротек-торного эффекта HU-210 могут участвовать другие сигнальные системы, такие как NO-синтаза, цГМФ, проте-инкиназа С и КАТФ-каналы. В частности, известно, что каннабиноиды могут активировать синтез оксида азота [15], который играет важную роль в повышении устойчивости миокарда к ишемическим воздействиям [3]. Возможно, что кардиопротекторный эффект каннабиноидов является результатом усиления синтеза NO и, как следствие, повышения уровня цГМФ в миокарде. С этой целью были проведены эксперименты, в которых определяли уровень цГМФ в ткани миокарда на 10-й мин перфузии изолированного сердца раствором, содержащим СВ-агонист HU-210 (0,1·10–3 мМ). Кроме того, в тех же условиях мы определяли уровень цГМФ на 15-й мин ишемии, а также на 5-й и 30-й мин реперфузии. Нам не удалось обнаружить
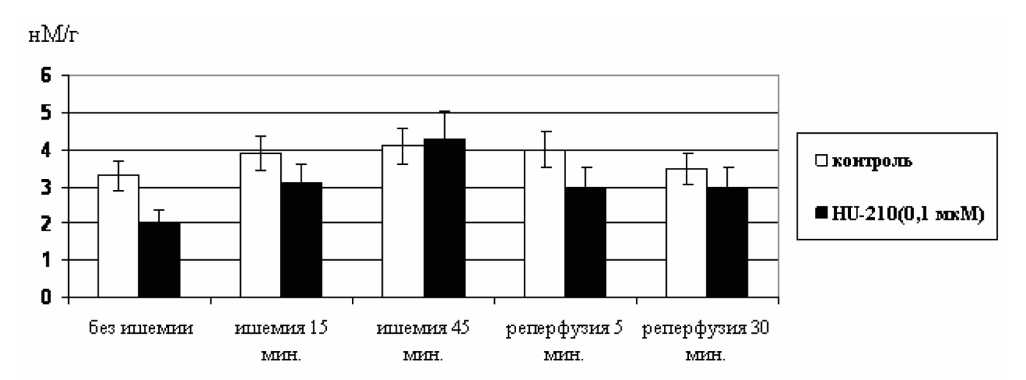
Рис. 2. Влияние активации каннабиноидных рецепторов с помощью селективного агониста HU-210 (0,1·10–3 мМ) на уровень цАМФ в миокарде крыс
HU-210
Исходные значения до ишемии
HU-210
Во время реперфузии
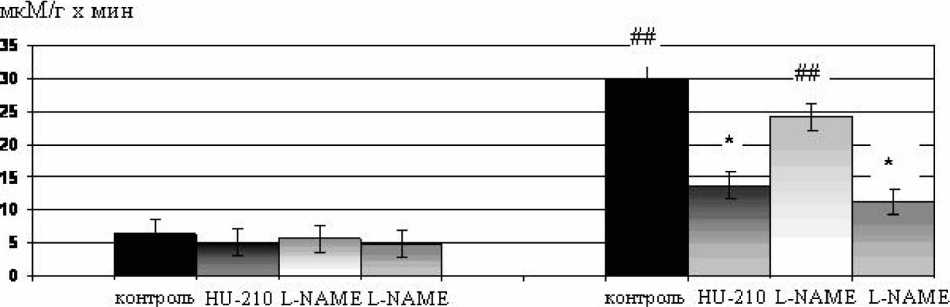
Рис. 3. Влияние блокатора NO-син тазы L-NAME (1,0·10–2 мМ) и агониста каннабиноидных рецепторов HU-210 (0,1·10–3 мМ) на активность креатинфосфокиназы в перфузионном растворе до ишемии и во время реперфузии. * – p<0,05 по сравнению с соответствующим контролем; ## – p<0,01 по сравнению с исходными значениями
статистически значимых изменений уровня цГМФ в миокарде в ответ на стимуляцию СВ-рецепто-ров. Следовательно, защитный эффект HU-210 развивался независимо от цГМФ, т.е. без участия гуанилатциклазы. Оставалось установить роль других NO-зависимых механизмов в реализации кардиопротектор-ных эффектов агониста каннабиноидных рецепторов HU-210. С этой целью были проведены эксперименты с использованием блокатора NO-cинтазы L-NAME, который добавляли в перфузионный раствор в конечной концентрации 100·10–3 мМ непосредственно перед стимуляцией СВ-рецепторов.
Однако в случае предварительной блокады NO-cинтазы с помощью L-NAME кардиопротек-торный эффект каннабиноида HU-210 сохранялся (рис. 3). При этом сам L-NAME не оказывал достоверного влияния на
контроль HU-210 хелеритрин хелеритрин контроль HU-210 хелеритрин хелеритрин
' +HU-210 +HU-210
Исходные значения до ишемии Во время реперфузии
Рис. 4. Влияние блокатора протеинкиназы С хелеритрина (2,0·10–3 мМ) и агониста каннабиноидных рецепторов HU-210 (0,1·10–3 мМ) на активность креатинфосфокиназы в перфузионном растворе до ишемии и во время реперфузии. * – p<0,05 по сравнению с контролем
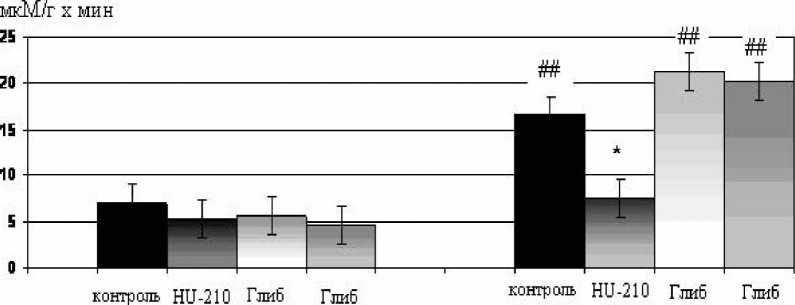
+ +
HU-210 HU-210
Исходные .значения до ишемии Во время реперфузии
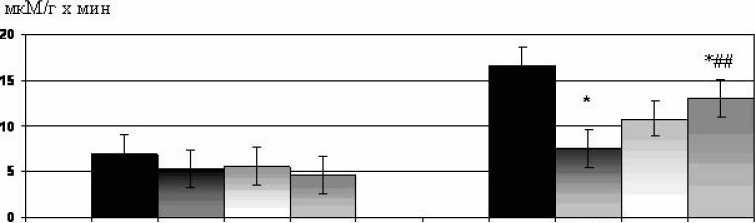
Рис. 5. Влияние блокатора КАТФ-каналов глибенкламида (1,0·10–3 мМ) и агониста каннабиноидных рецепторов HU-210 (0,1·10–3 мМ) на активность креатинфосфокиназы в перфузионном растворе до ишемии и во время реперфузии. * – p<0,05 по сравнению с контролем; ## – p<0,01 по сравнению с исходными значениями. “Глиб” – глибенкламид
Существует ряд публикаций о том, что активация КАТФ-каналов обеспечивает повышение толерантности кардиомиоцитов к патогенному действию ишемии-реперфузии [12]. Мы предположили, что в основе защитного эффекта каннабиноидов может лежать активация КАТФ-кана-лов и провели эксперименты с использованием блокатора КАТФ-каналов глибенкламида. Применение HU-210 в концентрации 0,1·10–3 мМ сопровождалось снижением реперфузионного выброса КФК по сравнению с контролем. Предварительное применение одного глибенкламида не оказывало статистически значимого влияния на уровень КФК в растворе, оттекающем от сердца в реперфузионный период (рис. 5). Стимуляция СВ-рецепторов с помощью агониста HU-210 на фоне блокады КАТФ-каналов глибенкла-мидом приводила к устранению кардиопротекторного эффекта СВ-агониста. Полученные результаты свидетельствуют о том, что КАТФ-каналы участвуют в реализации ци-топротекторного эффекта СВ-агониста HU-210.
уровень КФК. Следовательно, кардиопротекторный эффект HU-210 не был связан с активацией NO-синтазы.
Известно, что протеинкиназа С (ПКС) катализирует фосфорилирование ряда белков, обеспечивающих повышенную устойчивость сердца к ишемическим и реперфузионным воздействиям [14]. Результаты проведенных нами экспериментов показали, что после блокады про-теинкиназы С хелеритрином кардиопротекторный эффект СВ-агониста HU-210 не проявляется (рис. 4). Применение одного хелеритрина сопровождалось снижением реперфузионного выброса креатинкиназы по сравнению с контролем, но эти изменения носили недостоверный характер. Таким образом, протеинкиназа С участвует в формировании кардиопротекторного эффекта агониста каннабиноидных рецепторов HU-210. Полученные результаты в полной мере согласуются с данными P. Lepicier с соавт., которые исследовали кардиопротек-торные эффекты каннабиноидов [6].
Таким образом, ПКС играет ведущую роль в реализации кардиопротекторного эффекта СВ-агониста HU-210. Механизм, с помощью которого протеинкиназа С опосредует свое цитопротекторное действие агониста СВ-ре-цепторов HU-210, до настоящего времени не изучен.
Заключение
Результаты выполненных экспериментов свидетельствуют о важной роли каннабиноидных рецепторов в регуляции устойчивости миокарда к ишемическим и реперфузионным воздействиям. Установлено, что в развитии кардиопротекторного эффекта HU-210 участвует ПКС, КАТФ-каналы. Результаты наших экспериментов свидетельствуют о том, что циклонуклеотиды и NO-синтаза не участвуют в механизме цитопротекторного действия каннабиноида HU-210.
Работа подготовлена при поддержке Федерального агентства по науке и инновациям государственный контракт № 02.740.11.0714, контракт № 11.519.11.2016, № 11.519.11.2028, РФФИ гранты: 10-04-00288, 11-04-00467, 11-04-98001, 11-04-98000, 11-04-98004.
Список литературы Роль цАМФ, цГМФ, NO-синтазы, КАТФ-каналов и протеинкиназы С в реализации кардиопротекторного эффекта агониста каннабиноидных рецепторов HU-210
- Крылатов А.В. Повышение устойчивости сердца к аритмогенным воздействиям и уменьшение зоны ишемического некроза миокарда при активации каннабиноидных рецепторов//Росс. физиол. жур. -2002. -Т. 88, № 5. -С. 560-567.
- Ласукова О.В., Маслов Л.Н., Ермаков С.Ю. и др. Роль каннабиноидных рецепторов в регуляции толерантности сердца к действию ишемии и реперфузии//Известия РАН. -2008. -Т. 35, № 4. -С. 471-478.
- Andelova E. The role of NO in ischemia/reperfusion injury in isolated rat heart//Gen. Physiol. Biophys. -2005. -Vol. 24, No. 4. -P. 411-426.
- Bugge E., Ytrehus K. Ischaemic preconditioning is protein kinase C dependent but not through stimulation of alpha adrenergic or adenosine receptors in the isolated rat heart//Cardiovasc. Res. -1995. -Vol. 29, No. 3. -P. 401-406.
- Howlett A.C. Cannabinoid receptor signaling//Handb. Exp. Pharmacol. -2005. -Vol. 168. -P. 53-79.
- Lepicier P. Endocannabinoids protect the rat isolated heart against ischaemia//Br. J. Pharmacol. -2003. -Vol. 139, No. 4. -P. 805-815.
- Lepicier P., Bibeau Poirier A., Lagneux C. Endothelial CB1 receptors confer cardiac protection through nitric oxide production//J. Mol. Cell. Cardiol. -2004. -Vol. 37. -P. 197-198.
- Mahaffey K.W., Puma J.A., Barbagelata N.A. et al. Adenosine as an adjunct to thrombolytic therapy for acute myocardial infarction: results of a multicenter, randomized, placebo controlled trial: the acute myocardial infarction study of adenosine (AMISTAD) trial//J. Am. Coll. Cardiol. -1999. -Vol. 34, No. 6. -P. 1711-1720.
- Maslov L.N., Lishmanov Y.B. Changes in opioid peptide level in the heart and blood plasma during acute myocardial ischaemia complicated by ventricular fibrillation//Clin. Exp. Pharmacol. Physiol. -1995. -Vol. 22. -P. 812-816.
- McCullough J.R., Normandin D.E., Conder M.L. et al. Specific block of the anti-ischemic actions of cromakalim by sodium 5 hydroxydecanoate//Circ. Res. -1991. -Vol. 69. -P. 949-958.
- Murry C.E., Jennings R.B., Reimer K.A. et al. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium//Circulation. -1986. -Vol. 74, No. 5. -P. 1124-1136.
- Patel H.H., Gross E.R., Peart J.N. et al. Sarcolemmal KATP channel triggers delayed ischemic preconditioning in rats//Am. J. Physiol. Heart Circ. Physiol. -2005. -Vol. 288, No. 1. -P. H445-447.
- Trost S.U., Omens J.H., Karlon W.J. et al. Protection against myocardial dysfunction after a brief ischemic period in transgenic mice expressing inducible heat shock protein 70//J. Clin. Invest. -1998. -Vol. 101, No. 4. -P. 855-862.
- Yellon D.M., Downey J.M. Preconditioning the myocardium: from cellular physiology to clinical cardiology//Physiol. Rev. -2003. -Vol. 83. -P. 1113-1151.
- Yusifzade K., Akin M., Isikgonul I. et al. The protective role of anandamide in mesenteric ischemia reperfusion injury in guinea pig//Bratisl. Lek. Listy. -2009. -Vol. 110, No. 7. -Р. 379-384.


