Роль цитокинов в регуляции функциональной активности и популяционного статуса тучных клеток при аллергическом воспалении в бронхиальном дереве
Автор: Геренг Е.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3-1 т.25, 2010 года.
Бесплатный доступ
Цель исследования: изучение роли цитокинов хелперного клона в формировании гетерогенных популяций тучных клеток при аллергическом воспалении дыхательных путей у пациентов с различными формами бронхиальной астмы. У 30 больных различными клиническими вариантами бронхиальной астмы предпринята попытка оценки морфофункционального статуса тучных клеток в биоптатах слизистой оболочки бронхов, а в бронхиальных смывах - содержания интерлейкина-4, интерлейкина-8, интерферона γ, фактора некроза опухоли α. Показано, что дисбаланс выработки основных иммунорегуляторных молекул (интерферона γ, интерлейкина-4) приводит к гетерогенной направленности атопического воспаления в слизистой оболочки бронхов и ассоциирован с развитием различных клинических вариантов бронхиальной астмы. Более интенсивная аккумуляция и дегрануляция тучных клеток, развивающаяся при действии интерлейкина-8, фактора некроза опухоли α, усугубляют аллергический паттерн воспаления и приводят к тяжелому течению астмы. Воспалительные изменения в бронхопроводящей системе при бронхиальной астме представляют собой комплексный процесс, опосредованный взаимодействием цитокинов и основных эффекторных клеток.
Цитокины, фактор некроза опухоли α, тучные клетки
Короткий адрес: https://sciup.org/14919234
IDR: 14919234 | УДК: 616.233-002-092.19:576.32/.36:616.112.93
Текст научной статьи Роль цитокинов в регуляции функциональной активности и популяционного статуса тучных клеток при аллергическом воспалении в бронхиальном дереве
Аллергическое воспаление дыхательных путей является многообразным процессом, в реализации которого принимают участие различные клеточные элементы, цитокины, ростовые факторы. Сложное взаимодействие между клеточными и молекулярными маркерами играет ведущую роль в формировании ремоделирования слизистой оболочки у пациентов с тяжелой формой бронхиальной астмы (БА) [1, 2].
Тучные клетки (ТК), как доминантные популяции в аллергическом воспалении воздухоносных путей, непосред- ственно причастны к нарушению функций легких при БА и к развитию других патофизиологических проявлений болезни [3, 7]. Многообразие иммуноцитокинов, генерирующих воспаление при астме, вызывает нарушения субпопуляционного статуса лаброцитов дыхательных путей, что изменяет клинико-функциональные проявления болезни. Интерлейкину-8 (ИЛ-8) и фактору некроза опухоли α (ФНОα) отводится значимая роль в формировании нейтрофильного типа воспаления, развивающегося при тяжелых формах БА [4, 5]. В настоящее время диску-табельным остается вопрос о значении данных регуляторных молекул в изменении морфофункционального статуса ТК. Цель настоящего исследования: изучить роль цитокинов хелперного клона в формировании гетерогенных популяций тучных клеток при аллергическом воспалении дыхательных путей у пациентов с различными формами бронхиальной астмы.
Материал и методы
Проведено одномоментное сравнительное нерандомизированное исследование 30 больных БА, стратифицированных по тяжести болезни (87% больных – женщины, средний возраст пациентов – 45,1±14,2 лет, стаж болезни – 8,15±1,34 лет). На основании диагностических критериев документа GINA 2006 [8] у 10 пациентов верифицирована легкая, у 11 – среднетяжелая, у 9 – тяжелая форма БА. Критериями включения в исследование выступали следующие клинико-функциональные параметры. Амбулаторные и стационарные пациенты в возрасте от 33 до 59 лет с ранее подтвержденным диагнозом астма; неконтролируемое течение болезни (АСТ<19 баллов); положительные результаты кожных прик-тестов с одним и более аэроаллергенами; обратимость бронхиальной обструкции; ПК20 в метахолиновом тесте равное или меньше 8 мг/мл; отсутствие в течение последнего месяца острых респираторных симптомов, обострения БА. После включения в исследование всем больным в зависимости от тяжести болезни назначена противовоспалительная терапия в виде моно-и комбинированных ингаляционных кортикостероидов в соответствии с рекомендациями GINA 2008 [8]. Работа проведена по протоколу, утвержденному на заседании локального этического комитета ГОУ ВПО Росздрава 10.11.2008 г. (регистра- ционный № 877). До включения в исследование все пациенты подписывали информированное согласие.
Бронхоскопию проводили в условиях стационара при отсутствии выраженных клинических проявлений обострения болезни. Бронхобиоптаты получали методом щипковой биопсии со слизистой оболочки среднедолевого бронха правого легкого, помещали в 10–12% забу-ференный формалин, заливку гистологических препаратов проводили по стандартной методике. Выявление ТК осуществляли с помощью основного коричневого [3]. В субпопуляции ТК идентифицировали лаброциты с высокой (I), умеренной (II) и низкой (Ш) степенью дегрануляции (соответственно, низко-, умеренно- и высокогра-нулированные клетки). Для оценки активности общей популяции ТК подсчитывали средний цитохимический коэффициент (СЦК), характеризующий усредненную степень гранулированности тучных клеток, а значит, уровень их активности.
Для получения бронхиальных смывов (БС) в сегментарный или субсегментарный бронх правого легкого дробно по 20–60 мл вводили 150 мл стерильного физиологического раствора, предварительно подогретого до 37 °C с последующей аспирацией содержимого в стерильный силиконизированный контейнер. БС центрифугировали при 1500 об/мин в течение 10 мин. Количество интерлейкина-4 (ИЛ-4), ИЛ-8, ФНО α интерферона g (ИНФ g) определяли в надосадке иммуноферментным методом (“Вектор-Бест” Новосибирск, “Roche” Швеция).
Статистическую обработку данных осуществляли с помощью пакета программ Statistica 6.0 (StatSoft, USA). Для оценки статистической значимости различий показателей выборок, не подчиняющихся нормальному закону распределения, использовали непараметрический критерий Манна-Уитни (U-тест) для сопоставления двух независимых групп по количественному признаку. С целью обнаружения связи между исследуемыми показателями проводили корреляционный анализ путем вычисления коэффициента ранговой корреляции Спирмена (R). Коэффициент корреляции и уровень статистической значимости считали достоверным, если вероятность ошибки не превышала 0,05 [11].
Результаты и обсуждение
Согласно критериям включения ни один пациент на “старте” исследования не имел контролируемого течения
Таблица
Сравнительная характеристика цитокинов и иммуноглобулина Е у пациентов с различными клиническими вариантами бронхиальной астмы, Ме (25–75%)
Показатели Бронхиальная астма
|
Легкая, n=10 |
Среднетяжелая, n=11 |
Тяжелая, n=9 |
p1 |
p2 |
p3 |
|
|
IgE, (сыв.)(МE/мл) |
109,3 (105,3–146,5) |
115,7 (108,5–230,2) |
254,1 (233,0–325,6) |
0,4273 |
0,0005 |
0,0643 |
|
ИЛ-4 в БС, пг/мл |
32,0 (25,0–34,0) |
110,6 (100,3–145,3) |
126,0 (95,3–235,0) |
0,0002 |
0,0006 |
0,1509 |
|
ИНФ g , в БС, пг/мл |
6,00 (4,5–8,5) |
28,9 (17,9–33,4) |
99,3 (48,5–123,0) |
0,0004 |
0,0001 |
0,0002 |
|
ИЛ-4/ИНФ г |
5,3 (4,0–5,5) |
3,8 (4,3–5,6) |
1,3 (1,6–1,9) |
0,0003 |
0,0004 |
0,0623 |
|
ИЛ-8 в БС, пг/мл |
104,8 (75,2–154,5) |
125,4 (90,1–240,6) |
327,6 (148,9–550,6) |
0,4496 |
0,0052 |
0,0081 |
|
ФНОα, в БС, пг/мл |
37,2 (15,9–46,5) |
59,0 (36,0–99,0) |
210,9 (188,9–310,0) |
0,0191 |
0,0001 |
0,0002 |
Примечание: p1 – уровень статистической значимости при сравнении показателей у пациентов с легкой и среднетяжелой формой бронхиальной астмы; р2 – уровень статистической значимости при сравнении показателей у пациентов с легкой и тяжелой формой бронхиальной астмы; р3 – уровень статистической значимости при сравнении показателей у пациентов со среднетяжелой и тяжелой формой бронхиальной астмы.
астмы.
Сравнительная характеристика цитокинов в БС и сывороточного IgE у пациентов с различными клиническими вариантами астмы представлена в таблице.
У всех пациентов, независимо от типа болезни, нами установлено повышение количества сывороточного IgE, наиболее выраженное при тяжелом течении болезни. Высокий уровень специфического IgE у этих групп пациентов указывает на атопический характер воспаления, развивающегося в слизистой оболочке бронхиального дерева. При легком течение БА в БС нами обнаружены самые низкие показатели медиаторов аллергического воспаления. Концентрация ИЛ-4 в БС при среднетяжелой и тяжелой форме БА в 3,4 и 3,6 раза, а количество ИНФ γ , соответственно, в 4,6 и 14,8 превышала показатели, полученные при легком фенотипе болезни. Обнаруженная нами разница в концентрации иммунорегуляторных молекул в БС указывает на потенциально более высокую активность воспалительного процесса в слизистой оболочке бронхов, приводящую к тяжелому течению астмы. Это подтверждается и отрицательной корреляционной взаимосвязью, выявленной нами, между концентрацией IgЕ в сыворотке крови (r=–0,59, p=0,0088), ИЛ-4 в БС (r=–0,55, p=0,0018) и показателями пиковой скорости выдоха. В то же время, более высокое соотношение ИЛ-4/ИНФ γ обнаружено при легкой астме – 5,3 (95% CI: 4,0–5,5), наименьшее при тяжелой БА – 1,3 (95% CI: 1,6–1,9). При среднетяжелом течении болезни это соотношение составляло 3,8 (95% CI: 4,3–5,6).
Этот факт свидетельствует о реализации иммунного ответа по Th2 механизму с вовлечением многообразного ансамбля воспалительных клеток. Известно, что под влиянием ИЛ-4, высвобождаемого из дендритных клеток, происходит трансформация нативных Т-лимфоцитов (Тh0) в Th2 фенотип, который регулирует выработку Ig E, что реализует атопический тип аллергических реакций, наблюдаемый нами у пациентов с легкой и средней степенью БА [10, 12]. Нарушение выработки основных иммуномодулирующих молекул в БС с одновременным снижением соотношения ИЛ-4/ ИНФg указывает на нарушение хелперной регуляции иммунного ответа, что нашло свое отражение в более тяжелом типе БА. Участие ИНФ γ в формировании тяжелого неконтролируемого течения болезни подтверждается и в обнаруженной нами статистически значимой (р=0,0001) обратной корреляции между данным цитокином и пиковой скоростью выдоха (p=–0,92). Ряд
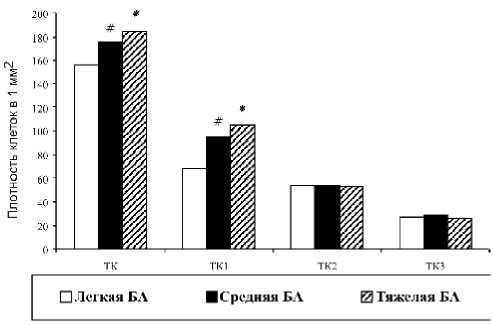
Рис. 1. Плотностные распределения тучных клеток в слизистой оболочке бронхов при различных формах бронхиальной астмы. Примечание: # – достоверность различий при сравнении показателей пациентов с легкой и среднетяжелой формой бронхиальной астмы; * – достоверность различий при сравнении показателей пациентов с легкой и тяжелой формой бронхиальной астмы
Плотность тучных клеток с высокой степенью дсграиуляшш в 1 мм' ткани бронхов
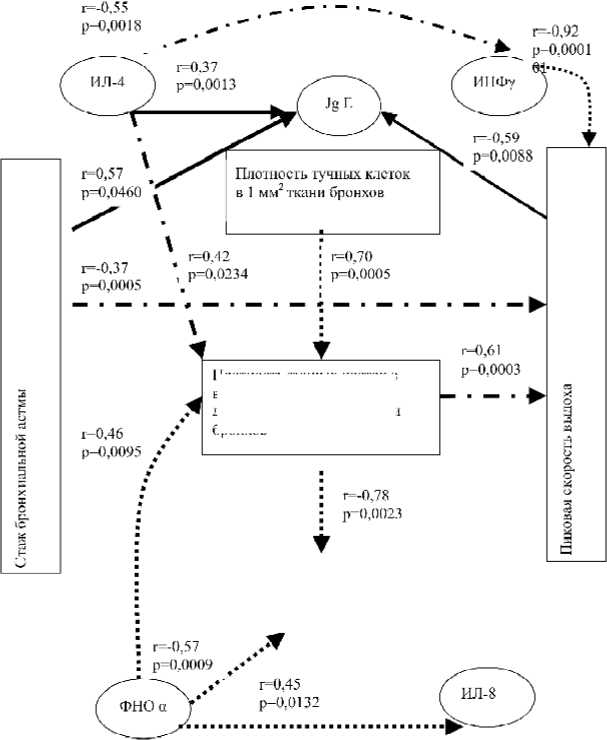
Рис. 2. Результаты корреляционного анализа между содержанием цитокинов и клинико-морфологическим анализом при различных типах бронхиальной астмы: r – коэффициент корреляции Спирмена; p – уровень значимости коэффициента корреляции; —► – взаимосвязи для пациентов с легкой БА;
– взаимосвязи для пациентов со средней степенью БА; ....^ – взаимосвязи для пациентов с тяжелой БА
авторов указывают на важное значение ИНФg, вырабатываемого хелперами 1-го типа, в стимуляции выработки ИЛ-8 макрофагами в слизистой оболочке бронхиального дерева [10]. Результатом этого процесса является обнаруженное нами более высокое количество ИЛ-8 в БС у пациентов с тяжелым течением БА – 327,6 (95% CI: 148,9–550,6), соответственно при легком типе БА – 104,8 (95% CI: 75,2–154,6), при среднетяжелом течение – 125,4 (95% CI: 90,1–240,6). Важная роль в моделировании аллергического воспаления принадлежит ТК, дегрануляция которых приводит к высвобождению множества лимфокинов, регулирующих структурные и функциональные нарушения органов дыхания при различных типах астмы [3, 7, 13].
Тяжелая форма БА отличается от легкого и среднетяжелого фенотипа более высокой плотностью лаброци-тов в слизистой оболочке бронхов с одновременным повышением общего числа низкогранулированных популяций (ТК1) (рис. 1).
Наряду с этим, СЦК у пациентов с тяжелым типом болезни был достоверно (р=0,0126) ниже аналогичных параметров у больных с другими клиническими вариантами астмы. Так, при тяжелом течении СЦК составляет 1,52 (95% CI: 1,5–1,6), при среднетяжелом – 2,8 (95% CI: 2,2– 3,6), при легком – 2,6 (95% CI: 2,4–2,8). Представленные данные указывают на доминантную роль лаброцитов в нарушении структурной архитектоники бронхиальной стенки, приводящей к утяжелению течения заболевания. Возможно, ИЛ-8 активизирует высвобождение ФНО α из лаброцитов, что нашло свое отражение у пациентов с тяжелым течением болезни в повышении общего числа ТК с высокой степенью дегрануляции. Этот факт подтверждается экспериментальными исследованиями S. Rauter et al. [7], которые на овальбуминовой модели БА обнаружили высокую активность ТК по высвобождению ФНО α после предварительной стимуляции их ИЛ-8. Корреляционный анализ, проведенный нами, продемонстрировал, что у пациентов с тяжелым течением болезни имеется статистически значимая (р=0,0132) положительная взаимосвязь между плотностью ТК1 в слизистой оболочке, СЦК и концентрацией ФНО α , ИЛ-8 в БС (рис. 2). Считается, что ФНО α, высвобождаемый из ТК при их активации, приводит к гипертрофии гладкомышечных клеток бронхов и усилению пролиферации фибробластов [4, 9, 13]. Такое сочетание процессов фиброза и гладкомышечной гиперплазии у пациентов с тяжелым течением болезни нарушает функциональную активность мышечных элементов бронхов, что приводит к дисрегуляции их сократительной функции. Это отражается в развитии выраженной бронхиальной гиперреактивности – доминантном патофизиологическом признаке тяжелого течения астмы [7, 9, 13].
Таким образом, изменение выработки основных цитокинов (ИЛ-4, ИНФg) приводит к гетерогенной направленности иммунопатологического воспаления в слизис- той оболочки бронхов и сопровождается развитием различных клинических вариантов БА. Более интенсивная аккумуляция и дегрануляция ТК, развивающаяся при действии ИЛ-8 и ФНОα, усугубляет аллергический паттерн воспаления и приводит к тяжелому течению БА. Воспалительные изменения в бронхопроводящей системе при астме, как показало наше исследование, представляет собой комплексный процесс, опосредованный взаимодействием цитокинов и основных эффекторных клеток.
Список литературы Роль цитокинов в регуляции функциональной активности и популяционного статуса тучных клеток при аллергическом воспалении в бронхиальном дереве
- Чучалин А.Г. Тяжелые формы бронхиальной астмы//Тер. архив. -2001. -Т. 73, №3. -С. 5-9.
- Фисенко В., Чичкова Н. Ремоделирование при бронхиальной астме: принципы формирования и возможности фармакологического воздействия//Врач. -2006. -№ 12. -С. 14-20.
- Зуга М.В., Невзорова В.А., Гельцер Б.И. Тучные клетки и их значение в физиологии и патологии легких//Тер. архив. -1999. -Т. 71, №3. -С. 76-80.
- Старикова И.А., Фрейдлин И.С., Соколов Д.И., Сельков С.А. Изменение свойств эндотелиальных клеток линии ЕА.hy926 под влиянием фактора некроза опухоли α, интерферона γ и интерлейкина 4//Иммунология. -2005. -№2. -С. 83-87.
- Silvestri M., Bontempelli M., Giancomelli M. et al. High serum levels of tumor necrosis factor α and interleukin-8 in severe asthma: markers of systematic inflammation//Clin. Exp. Allergy. -2006. -Vol. 36, №11. -P.1373-1381.
- Boulet L-P., Sterk P.J. Airway remodelling: the future//Eur. Respir. J. -2007. -Vol. 30, №9. -P.831-834.
- Reuter S., Heinz A., Sieren M. et al. Mast cell-derived tumor necrosis factor is essential for allergic airway disease//Eur. Respir. J. -2008. -Vol. 31, №12. -P. 773-782.
- Глобальная стратегия лечения и профилактики бронхиальной астмы/Под ред. А.Г. Чучалина. -М., 2008. -160 с.
- Barnes P.J. New concepts in the pathogenesis of bronchial hyperresponsiveness and asthma//J. Allergy Clin. Immunol. -1999. -Vol. 83. -P. 1013-1026.
- Evaluation of airway inflammation by quantitative Th1/Th2 cytokine mRNA measurement in sputum of asthma patients with asthma and chronic bronchitis/E. Truyen, L. Coteur, E. Dilissen et al.//Thorax. -2006. -Vol. 61. -P. 202-208.
- Реброва О.Ю. Статистический анализ медицинских данных. Применение прикладных программ STATISTICA. -М.: Медиа Сфера, 2002. -305 с.
- Schmidt D., Watson N., Ruhlmann E. et al. Serum IgE levels predict human airway reactivity in vitro//Clin. Exp. Allergy. -2000. -Vol. 30. -P. 917-921.
- Barnes J. Cytokines and chemokines in asthma//Eur. Resp. J. -2007. -Vol. 29. -P. 43-59.


