Роль делокализации атомов в процессе размягчения стеклообразных твердых тел
Автор: Сандитов Булат Дамбаевич, Мункуева Светлана Бадмаевна, Чимитова Оксана Дугарсуруновна, Сандитов Дамба Сангадиевич
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Физика
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Энтропия квазифазового перехода стекло-жидкость совпадает с энтропией плавления кристаллов с «рыхлыми структурами». Доля возбужденных атомов, размороженных при температуре размягчения стекол, по порядку величины близка к доле делокализованных атомов при температуре плавления. Высказана мысль о доминирующей роли делокализации (возбуждения) определенной концентрации атомов в критерии перехода стекло-жидкость.
Размягчение, делокализация атома, плавление
Короткий адрес: https://sciup.org/148180190
IDR: 148180190 | УДК: 539.213
Текст научной статьи Роль делокализации атомов в процессе размягчения стеклообразных твердых тел
Ранее было развито представление о наличии взаимосвязи между условием стеклования жидкостей и критерием плавления кристаллов [1, 2]. В данном сообщении приводятся результаты, полученные в последние годы по этому вопросу.
Предполагалось [2], что как при температуре плавления кристалла, так и при температуре размягчения стекла под действием теплового давления происходит критическая деформация межатомной связи (ее возбуждение). Недавно экспериментально установлено [3], что при температуре плавления полиэтилена межмолекулярные связи растянуты до предельной величины, что подтверждает нашу гипотезу. Элементарным актом размягчения стекла – процесса, обратного стеклованию жидкости, – служит предельная упругая деформация межатомной связи, соответствующая максимуму квазиупру-гой силы [2]. Критерием перехода стекло-жидкость может служить отношение энтальпии предельной деформации межатомной связи ∆H e к средней энергии теплового движения частиц при температуре стеклования T g
д =ДНе, где k – постоянная Больцмана.
В модели возбужденного состояния [1, 4] предельная упругая деформация межатомной связи ∆rm интерпретируется по другому как смещение частицы на критическое расстояние ∆r m , соответствующее максимуму силы притяжения между атомами (рис. 1). Кинетическая единица (атом, группа атомов), способная к критическому смещению, называется возбужденным атомом, а сам подход – моделью возбужденного состояния. Рождение возбужденного атома обусловлено флуктуационной перегруппировкой соседних частиц и носит энтропийный характер. В данной модели величина ∆H e рассматривается как энтальпия возбуждения атома. В качестве возбужденного атома в силикатных стеклах и их расплавах выступает мостиковый атом кислорода в мостике Si-O-Si. Его флуктуационное критическое смещение перед переключением валентной связи [5] представляет собой «процесс возбуждения атома», с которым тесно связана предельная упругая деформация участка кремнекислородной сетки (рис. 2).
Доля флуктуационного объема f = ∆V e /V, образованного за счет критических смещений кинетических единиц из равновесных положений (∆V e = N e ∆ν e ), является функцией давления и температуры
[1, 4],
|
1 —Si-O |
1 -Si- |
1 — Si — |
о |
1 — Si— — |
1 1 Si О Si |
|
|
p |
о |
о |
||||
|
-Si-O |
-Si- |
—Si — |
о |
— Si — |
-Si —C |
Si— |
|
а |
1 |
1 |
6 |
1 |
e |
1 |
Рис. 2. Схема переключения мостиковых связей Si-O-Si в силикатных стеклах [5]. ∆rm – критическое смещение возбужденного мостикового атома кислорода перед переключением мостиковой связи
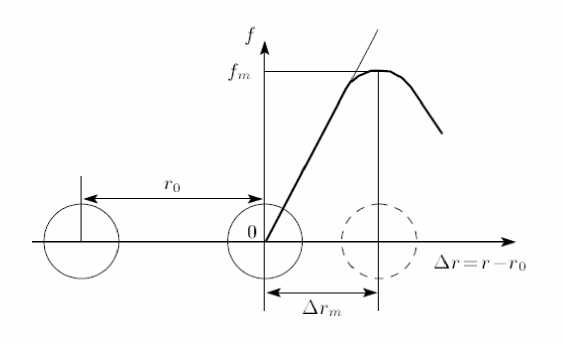
Рис. 1. Схема возбуждения атома (межатомной связи). r0 – равновесное межатомное расстояние, fm – максимум силы притяжения между атомами, соответствующий критическому смещению возбужденного атома ∆rm
f = ( Д1^ > СЭСр f — ^J-^1^ tf \, (2)
V u / V kT J где ∆νe ≈ c∆rm – элементарный флуктуационный объем, необходимый для реализации предельной деформации межатомной связи (для возбуждения атома), ∆εe – энергия возбуждения атома, ν = V/N – атомный объем, Ne – число возбужденных атомов, с – постоянная. Способы расчета fg = f(Tg), ∆νe и ∆He приводятся в работе [4].
Полагая независимость параметров ∆ ε e , ∆ ν e и f g от температуры T g и давления p стеклования, из уравнения состояния (2) для зависимости T g от давления p получаем выражение
dp = ^J211£1>_PjlK2 . (3)
Энтальпия процесса возбуждения атома ∆ H e равна работе, совершаемой против максимального внутреннего p i и внешнего p давлений (∆ ε e = p i ∆ ν e )
∆ H e = ( p i + p )∆ ν e = ∆ ε e + p ∆ ν e . (4)
Эта формула по внешнему виду совпадает с известным уравнением Клапейрона–Клаузиуса для фазовых переходов dp zz At?
dT Tte в котором отношение скрытой теплоты фазового перехода ∆q к температуре перехода Т равно энтропии фазового перехода ∆S = ∆q/T. По аналогии отношение

в равенстве (5) мы назвали энтропией квазифазового перехода стекло-жидкость. Из сравнения соотношений (1) и (7) критерий размягчения стекла (1) приобретает смысл относительной энтропии ква-зифазового перехода g = ∆Se/k (8)
Величину g можно выразить соотношением
^S. — кТа In (Дкг/ fy v) _ In
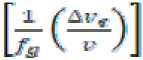
kTs кгв
Отношение объемов ∆ ν e / ν связано с параметрами потенциала Mu ( И = - A r-m + B r-n) [6]: ∆ ν e / ν
9/mn, где произведение mn оказывается однозначной функцией коэффициента Пуассона μ [7]. С уче- том этих соображений для оценки q приходим окончательно к формуле
S — In
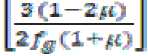
где полагаем, что μ < 0,5.
У стеклообразных систем различной химической природы значения q колеблются в узких пределах около q ≈ 3
У = ^^ * const * 2.5-t- 3.5 (10)
У стекол определенной группы величина q оказывается постоянной. В качестве примеров в табл. 1 и 2 приводятся результаты расчета q по формуле (9) для сульфатно-фосфатных (q ≈ 3.4) и калиевобо-ратных (q ≈ 2.8) стекол. Для щелочносиликатных стекол величина q равна q ≈ 3, для халькогенидных стекол As-S при разных содержаниях As и S имеем q ≈ 2.8–3.3, а у металлических стекол – q ≈ 3.0 – 3/2. У органических аморфных полимеров значение q заметно ниже среднего значения: q ≈ 2.5. Если выше температуры Дебая среднюю энергию тепловых колебаний решетки, отнесенную на атом, принять равной 3 k T, приведенный выше результат можно сформулировать следующим образом: стекло размягчается, когда средняя энергия теплового движения решетки 3 k Tg становится равной или больше работы предельной упругой деформации межатомной связи 3 k T g ∆ H e .
Таблица 1
Доля флуктуационного объема f g , коэффициент Пуассона μ и параметр q для сульфатно-фосфатных стекол NaPO 3 -RSO 4 (R = Zn, Li, Na, K)
|
RSO4, мол.% |
T g , K |
f g |
µ |
∆ ν e , Å3 |
ΔHe , кДж/моль |
q |
|
NaPO 3 |
523 |
0.016 |
0.294 |
16 |
15 |
3.4 |
|
ZnSO 4 10 |
493 |
0.018 |
0.288 |
12 |
13 |
3.3 |
|
20 |
505 |
0.019 |
0.284 |
12 |
14 |
3.3 |
|
30 |
510 |
0.020 |
0.273 |
11 |
14 |
3.3 |
|
40 |
515 |
0.020 |
0.259 |
10 |
14 |
3.3 |
|
LiSO 4 10 |
451 |
0.014 |
0.300 |
13 |
13 |
3.5 |
|
20 |
447 |
0.013 |
0.303 |
14 |
13 |
3.5 |
|
30 |
429 |
0.014 |
0.304 |
12 |
12 |
3.5 |
|
Na 2 SO 4 10 |
496 |
0.016 |
0.299 |
14 |
14 |
3.4 |
|
20 |
493 |
0.016 |
0.292 |
15 |
14 |
3.4 |
|
30 |
490 |
0.015 |
0.288 |
17 |
14 |
3.5 |
|
K 2 SO 4 10 |
444 |
0.013 |
0.316 |
16 |
13 |
3.5 |
|
20 |
453 |
0.014 |
0.316 |
15 |
13 |
3.4 |
Таблица 2
Параметры модели возбужденного состояния для калиевоборатных стекол К 2 О-В 2 О 3
|
К 2 О , мол.% |
T g , К |
µ |
f g |
Δv e , Å3 |
ΔHe, кДж/моль |
q |
|
0 |
578 |
0.262 |
0.034 |
20 |
13 |
2.8 |
|
1.1 |
582 |
0.292 |
0.034 |
16 |
13 |
2.6 |
|
2.5 |
588 |
0.293 |
0.0333 |
15 |
13 |
2.7 |
|
3.9 |
597 |
0.293 |
0.032 |
14 |
13 |
2.7 |
|
8.5 |
623 |
0.293 |
0.030 |
13 |
14 |
2.8 |
|
13.0 |
658 |
0.295 |
0.030 |
13 |
15 |
2.8 |
|
18.0 |
685 |
0.301 |
0.029 |
13 |
16 |
2.8 |
|
22.8 |
711 |
0.295 |
0.028 |
13 |
16 |
2.8 |
|
28.2 |
723 |
0.288 |
0.027 |
12 |
17 |
2.9 |
|
33.5 |
706 |
0.303 |
0.026 |
11 |
17 |
2.9 |
Недавно Магомедов [8] предложил подход, согласно которому элементарным актом процесса плавления кристаллов является делокализация атома, а причиной плавления – резкая делокализация определенной доли атомов решетки. Оказывается, что при плавлении изменение энтропии практически постоянно для определенных групп веществ [8, 9]. Для «рыхлых структур», у которых коэффициент упаковки атомов не превышает Kp ≈ 0.6, изменение энтропии при плавлении составляет [8]
—-— == const =ь 3.S к что совпадает с изменением энтропии при квазифазовом переходе стекло-жидкость (10).
Доля делокализованных атомов при температуре плавления T m также постоянна и составляет око-
ло [8]
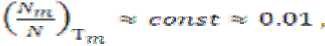
что по порядку величины совпадает с долей возбужденных атомов, размороженных при температуре размягчения стекол [10],
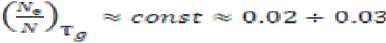
По физическому смыслу процесс делокализации атома [8], на наш взгляд, фактически совпадает с указанным выше процессом критического смещения атома из равновесного положения [1-4], которое трактуется как его возбуждение. В свою очередь возбуждение атома означает возбуждение межатомной связи – ее предельную упругую деформацию, соответствующую максимуму силы притяжения между атомами.
Таким образом, приведенные выше данные можно рассматривать как дополнительные аргументы в пользу развиваемой идеи о том, что размягчение стекла обусловлено плавлением локальных микрообластей структуры – ближнего порядка; элементарные акты переходов кристалл-жидкость и стекло-жидкость в первом приближении имеют общую природу [1, 2, 11]. Они обусловлены делокализацией (возбуждением) определенной доли кинетических единиц решетки – в кристаллах, квазирешетки – в стеклах (рис. 2).


