Роль хорионического гонадотропина в дифференцировке интерлейкин-17-продуцирующих Т-лимфоцитов-хелперов (TH17)
Автор: Заморина С.А., Ширшев С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Изучены эффекты хорионического гонадотропина (ХГ) на дифференцировку интерлейкин (1Ь)-17-продуцирующих лимфоцитов. Установлено, что на тимическом этапе гормон не влиял на количество предшественников Th17 (CD4+CD161+) и на генерацию Th17 (CD4+CD161+IL17A+), однако в низкой концентрации (10 МЕ/мл) увеличивал количество CD4+IL17A+-тимоцитов. На уровне периферических Th17 гормон снижал количество CD4+ROR- t+- и CD4+ROR- Ф+П.-17А+-лимфоцитов. Таким образом, ХГ является эффективным модулятором ^П-лимфоцитов, оказывая разнонаправленные эффекты на тимическом и посттимическом этапах дифференцировки.
Хорионический гонадотропин, интерлейкин-17, тимоциты, т-лимфоциты
Короткий адрес: https://sciup.org/147204656
IDR: 147204656 | УДК: 612.018:612.017.1:611.018.53
Текст научной статьи Роль хорионического гонадотропина в дифференцировке интерлейкин-17-продуцирующих Т-лимфоцитов-хелперов (TH17)
Хорионический гонадотропин (ХГ) – ключевой гормон беременности, активно участвующий в контроле иммунных процессов, сопровождающих гестацию. Однако регуляция активности относительно недавно открытой субпопуляции интерлейкин (IL)-17–продуцирующих лимфоцитов (Th17) со стороны ХГ практически не изучена.
Субпопуляция Th17 была впервые описана в 2005 г. L.E. Harrington и H. Park [Harrington et al., 2005; Park et al., 2005], которые независимо друг от друга опубликовали данные о том, что наивные Т-хелперы (Th) могут дифференцироваться в IL-17–продуциру-ющие клетки, образуя отдельную популяцию лимфоцитов. Клетка-предшественник может дифференцироваться в Th1, Th2, Т-регуляторные лимфоциты (Treg) и Th17 в зависимости от цитокиновых сигналов и до окончательной дифференцировки субпопуляции обладает пластичностью. В процессе формирования Th17 клетка-предшественник дифференцируется в Th17/Treg-интермедиаторную клетку, которая экспрессирует как мастер-регулятор Th17 – RORyt, так и мастер-регулятор T-регуляторных лимфоцитов – FOXP3 (forkhead box P3). Дальнейшая дифференцировка регулируется трансформирующим фактором роста - (TGF- — когда дендритная клетка активирована микроорганизмами, она продуцирует
IL-1—и IL-6, в этом случае сочетание TGF-—-и IL-1-+IL-6 индуцируют дифференцировку по Th17 типу [Saito et al., 2010].
Основным транскрипционным фактором Th17 является RORyt (RORC2) (retinoid orphan nuclear receptor). Важную роль в развитии уже дифференцированных Th17 играет IL-23 и IL-21, в то время как TGF- —-в высоких концентрациях ингибирует развитие Th17. Однако в низких дозах, а также совместно с IL-6, TGF-- индуцирует дифференцировку наивных Т-клеток периферической крови в Th17 [Кетлинский, 2009]. Помимо этого, важным фактором дифференцировки этих клеток является IL-1β, который может усиливать действие IL-6 и IL-23. Из этих факторов складывается стимул для дифференцировки наивных Т-лимфоцитов в Th17. IL-4 и интерферон- °(IFN- *) способны ингибировать развитие Th17, но IL-17 не ингибирует дифференцировку Th1/Th2 [Кетлинский, 2009]. IL-17 (A и F), являясь основным цитокином Th17, вызывает синтез IL-1, IL-6, IL-8 и ряда других воспалительных факторов [Кологривова Кологривова, Суслова, 2011]. Так, IL-17 участвует в развитии аутоиммунных заболеваний и остром отторжении трансплантата. Известно, что IL-17 играет важную роль в патофизиологии ревматоидного артрита [Xie, Wang, Li, 2012], в то время как во время беременности симптомы этого заболевания становятся менее выраженными.
У здоровых людей в периферической крови уровень Th17-клеток составляет 0.64–1.4%. Уровень этих клеток в период беременности сопоставим с таковым у небеременных женщин, но есть данные о том, что в III триместре он ниже [Santner-Nanan et al., 2009]. Однако количество этих клеток в децидуальной оболочке выше, чем на периферии. Вероятно, это связано с необходимым усилением противо-микробного иммунитета.
Нормальная беременность сопровождается снижением Th17 в периферической крови в сравнении с небеременными женщинами [Santner-Nanan et al., 2009]. Повышение уровня Th17 может вести к преждевременным родам или спонтанному аборту [Saito et al., 2010]. Однако повышение IL-17 является следствием гибели плода во время прерывания беременности, но не причиной гибели. В частности, хроническое воспаление ведет к аборту с повышением уровня провоспалительных цитокинов, что влечет за собой изменение баланса между Treg/Th17.
Цель работы – изучение влияния ХГ на тимический и посттимический этапы дифференцировки Th17.
Материалы и методы
ХГ («Profasi», Италия) применяли в концентрациях 10 и 100 МЕ/мл (II-III и I триместр беременности, соответственно). Тимический этап изучали на тимоцитах (CD4+CD8+) детей до 1 года, выделенных из фрагментов тимуса, удаляемых в ходе сердечнососудистых операций. Посттимический этап изучали на выделенных методом магнитной селекции периферических СD4+-лимфоцитах небеременных женщин. Культуры клеток инкубировали с ХГ в полной питательной среде в течение 72 ч. при 37^С в условиях 5% СО 2 , в присутствии стандартных индукторов Th17 (IL-1β (10 нг/мл, «eBioscience», США) и IL-6 (10 нг/мл, «eBioscience», США) [Acosta-Rodrigiez et al., 2007], магнитные частицы с анти-CD3/CD28 моноклональными антителами (Dynabeads Human T-activator CD3/CD28, «Invitrogen», США), и нейтрализующие анти-ИФН- ° и анти-ИЛ-4 антитела (10 мкг/мл, «eBioscience», США). Число Th17 оценивали как процент CD4+-лимфоцитов, экспрессирующих ROR- ° и IL-17A в гейте CD4+-клеток, кроме этого на тимоцитах оценивали экспрессию CD161 (все антитела «eBioscience», США).
Для индукции дифференцировки Th17 из CD4-позитивных Т-лимфоцитов в культуры вносили аналогичные индукторы. После 72 ч. инкубации оценивали количество Th17 как процент CD4+-лимфоци-тов (FITC Anti-Human CD4) («eBioscience», США), экспрессирующих транскрипционный фактор ROR-° (Anti-Mouse/Human ROR-gamma-t-PE), ИЛ-17 (Anti-Human IL17A-PerCP-Cy5.5) («eBioscience», США). В ряде экспериментов количество Th17 также определяли по экспрессии хемокинового рецептора CCR6 CD4+IL17A+(CD196; CCR6-PE)
(«eBioscience», США), поскольку Th17 постоянно экспрессируют этот рецептор [Annunziato et al. 2008]. Измерения проводили на проточном цитофлуориметре FACSCalibur («Becton Dickinson», США). В супернатантах культур параллельно оценивали уровень ИЛ-17 иммуноферментным методом про помощи набора («eBioscience», США).
Статистическая обработка результатов проводилась с использованием парного t -критерия Стьюдента.
Результаты и их обсуждение
При изучении влияния ХГ на индукцию Th17 в культурах IL-1 β - и IL-6-примированных тимоцитов установлено, что гормон в низкой концентрации увеличивал количество CD4+IL-17A+-тимоцитов в культуре, в то время как в высокой концентрации ХГ не оказывал подобного эффекта. Аналогично не выявлено влияния ХГ на уровень CD4 + ROR- ° +, CD4+CD161+, а также CD4+CD161+IL-17A+ в культуре (рис. 1). Таким образом, ХГ стимулирует экспрессию IL17A в CD4-позитивных тимоцитах, этот эффект проявляется только при использовании низкой концентрации гормона. По-видимому, из-за того, что тимоциты характеризуются низкой экспрессией рецепторов для ХГ [Su et al., 2013] отсутствие эффекта высокой концентрации гормона, наблюдаемой в I триместре, объясняется десенситиза-цией его рецепторов, что делает возможным реализацию эффектов ХГ только в низкой концентрации.
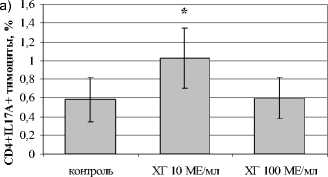
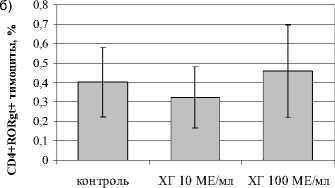
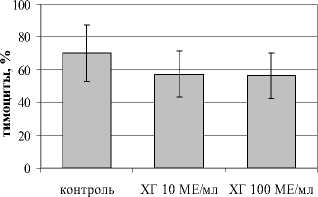
Рис. 1 . Влияние ХГ на тимический этап дифференцировки Th17 (n=7):
-
а) CD4+IL17A+-тимоциты; б) CD4 + ROR t 4-тимоциты; в) CD4+CD161+IL17A+-тимоциты; здесь и далее * – достоверные (p<0.05) по t-критерию Стьюдента различия с контролем
В отношении посттимического этапа дифференцировки Th17 показано, что ХГ снижал количество CD4+-лимфоцитов, экспрессирующих ROR- *t (рис. 2). Кроме того, ХГ достоверно снижал уровень дубль-позитивных ROR- <+1Ъ-17А+-лимфоцитов. Оценка уровня IL-17A в супернатантах фракционированных CD4+-клетках подтвердила угнетающий эффект ХГ на процессы дифференцировки Th в Th17 на уровне периферических Т-лимфоцитов (рис. 2г). Кроме этого, нами показано, что гормон достоверно снижает экспрессию хемокинового рецептора CCR6, необходимого для направленной миграции Th17 в очаг воспаления (рис. 2в).
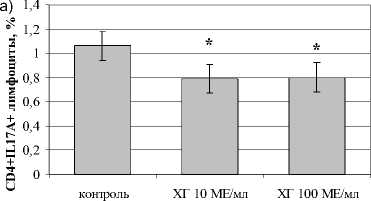
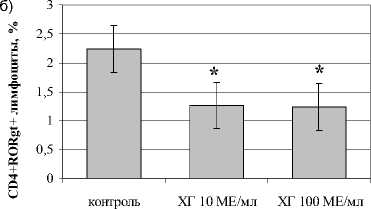
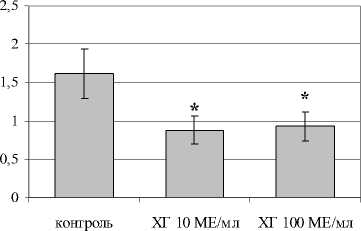
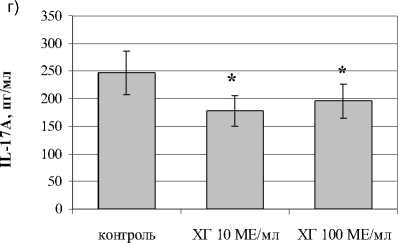
Рис. 2. Влияние ХГ на посттимический этап дифференцировки Th17 (n=7):
а) CD4+IL17A+-лимфоциты; б) CD4 + ROR 1 +-лимфоциты; в) CD4+CCR6+IL17A+-лимфоциты; г) уровень IL-17A в супернатантах культур
Важно отметить, что ХГ реализует Th17-угне-тающий эффект вне зависимости от концентраций т.е. на протяжении всего периода протекающей беременности. Таким образом, ХГ препятствует не только дифференцировке Th0 в Th17, но и угнетает их функциональную активность. С учетом того факта, что ХГ индуцирует экспрессию молекулы FOXP3 [Заморина, Ширшев, 2013], содержащей домен (кодируемый экзоном 2), ответственный за непосредственное связывание транскрипционных факторов семейства ROR [Ichiyama et al., 2008] можно предположить, что это создает условия для поляризации CD4+ T-клеток в Treg, одновременно блокируя процессы дифференцировки в Th17.
Таким образом, ХГ практически не влияет на тимический этап дифференцировки Th17 и угнетает функциональную активность данных эффекторов на уровне периферических лимфоцитов.
Вероятно, продемонстрированное нами на уровне периферических Т-лимфоцитов ХГ-зависи-мое угнетение Th17 способно предотвращать анти-фетальные реакции, тем самым участвуя в поддержании иммунной толерантности при беременности.
Работа поддержана программой Президиума РАН МКБ, 12-П-4-1017.
Список литературы Роль хорионического гонадотропина в дифференцировке интерлейкин-17-продуцирующих Т-лимфоцитов-хелперов (TH17)
- Заморина С.А, Ширшев С.В. Хорионический гонадотропин -фактор индукции иммунной толерантности при беременности//Иммунология. 2013. № 2. С. 105-109.
- Кетлинский С.А. Th17 новая линия дифференцировки Т хелперов: обзор данных//Цитокины и воспаление. 2009. № 2. С. 3-15.
- Кологривова И.В., Кологривова Е.Н., Суслова Т.Е. Молекулярные аспекты функционирования Т-хелперов 17 типа//Бюллетень сибирской медицины. 2011. № 4. С. 93-98.
- Acosta-Rodriguez E.V. et al. Interleukins 1beta and 6 but not transforming growth factor-beta are essential for the differentiation of interleukin 17-producing human T helper cells//Nat. Immunol. 2007. Vol. 8. P. 942-949.
- Annunziato F. et al. The phenotype of human Th17 cells and their precursors, the cytokines that mediate their differentiation and the role of Th17 cells in inflammation//Int Immunol. 2008. Vol. 20. P. 1361-136.
- Harrington L.E. et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages//Nat. Immunol. 2005. Vol. 6. P. 1123-1132.
- Ichiyama K. et al. Foxp3 inhibits RORyt-mediated IL-17A mRNA transcription through direct interaction with RORyt//J. Biol. Chem. 2008. Vol. 283. P. 17003-17008.
- Park H. et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producinginterleukin//Nat. Immunol. 2005. Vol. 6. Р. 1133-1141.
- Saito S. et al. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy//Am. J. Reprod. Immunol. 2010. Vol. 63. P. 601-610.
- Santner-Nanan B. et al. Systemic increase in the ratio between Foxp3+ and IL-17-producing CD4+ T cells in healthy pregnancy but not in preeclampsia//J. Immunol. 2009. Vol. 183. P. 7023-7030.
- Su_S. et al. The compensatory expression of reproductive hormone receptors in the thymus of the male rat following active immunization against GnRH//Gen. Comp. Endocrinol. 2013. Vol. 185, P. 57-66.
- Xie Q., Wang S.C., Li J. IL-17: a potential therapeutic target for rheumatoid arthritis//Clin. Rheumatol. 2012. № 7. Р. 1145-1146.


