Роль хронического экспериментального поражения печени матери в нарушении генеративной функции потомства
Автор: Брюхин Г.В., Сизоненко М.Л., Романов Ю.Н., Зубарев И.В., Ласьков Д.С.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 8 (267), 2012 года.
Бесплатный доступ
Изучено влияние экспериментального поражения печени различного генеза у самок крыс на морфофункциональное становление генеративной функции потомства. Установлено, что патология печени матери в условиях эксперимента обусловливает нарушение фолликулогенеза в яичниках и сперматогенеза в семенниках потомства
Патология печени, потомство, сперматогенез, фолликулогенез
Короткий адрес: https://sciup.org/147153076
IDR: 147153076
Текст научной статьи Роль хронического экспериментального поражения печени матери в нарушении генеративной функции потомства
Одной из важнейших причин перинатальной патологии являются экстрагенитальные заболевания женщин, в структуре которых особое место, в силу своей распространенности, занимают болезни гепатобилиарной системы [9].
Ранее нами было показано, что у самок крыс с хроническим экспериментальным поражением гепатобилиарной системы имеет место задержка наступления беременности, пролонгирование беременности до 28–29 дней. При этом наблюдалось снижение численности пометов, характеризующихся выраженными признаками физиологической незрелости [2], что проявляется нарушением морфофункционального становления систем жизнеобеспечения, в том числе иммунной, кроветворной, пищеварительной, нейроэндокринной [1].
Эти теоретические предпосылки явились причиной изучения особенностей становления генеративной функции у 60-дневного потомства самок крыс с экспериментальным поражением гепатобилиарной системы различного генеза.
Материал и методы исследования. Работа выполнена на белых лабораторных крысах «Вис-тар» (30 взрослых половозрелых самок) и их 60-дневом потомстве (60 крысят из 31 помета). Для достижения поставленной цели у взрослых половозрелых крыс-самок моделировалось хроническое поражение печени токсической и аутоиммунной этиологии.
Хроническое токсическое поражение («токсическая» – «Т»-группа) печени вызывалось путем однократного внутрибрюшинного введения взрослым половозрелым крысам Д (+)-галактозамина гидрохлорида («Sigma – G500», США) на 0,9 %-ном растворе натрия хлорида в дозе 250 мг/кг массы тела животного [3]. Экспериментальную «галактозаминовую» группу («Г»-группу) составили 20 крысят из 10 пометов.
Вторую группу составили животные, у которых создавался аутоиммунный процесс с преимущественным поражением печени («аутоиммунная» – «А»-группа) путем введения им 0,2 мл супернатанта шестидневной культуры E.coli (штамм АТСС 25922) [6]. Эту экспериментальную группу («Е»-группу) составили 17 крысят из 9 пометов.
О развитии патологического процесса в печени экспериментальных животных судили на основании морфологических изменений (очаговые бионекротические изменения гепатоцитов, дис-комплексация гепатоцитов, периваскулярная лим-фогистиоцитарная инфильтрация, гипертрофия и гиперплазия купферовских клеток), биохимических критериев (повышение концентрации билирубина, аланин- и аспартатаминотрансфераз и др.) и высокого титра печеночных аутоантител (1:640 и 1:1280).
Контрольную группу («К»-группа) составили интактные животные (23 крысенка из 12 пометов).
Объектом исследования явилось непосредственно потомство самок крыс с экспериментальным поражением гепатобилиарной системы на 60-й день после рождения, у которого проводилась оценка генеративной функции. Прежде всего осуществлялось определение весового индекса муж- ских и женских половых желез. Оценка генеративной функции семенников проводилась на серийных гистологических срезах, окрашенных железным гематоксилином по Гейденгайну по общепринятой методике [8] с определением площади семенных извитых канальцев, суммарного количества сперматогенных клеток и их субпопуляционного состава, а также количества канальцев со слущенным эпителием и числа гигантских сперма-тогенных клеток.
Одним из показателей, отражающих фертильность сперматозоидов, является характер их подвижности. В связи с этим нами проводилась оценка подвижности эпидидимальных сперматозоидов по общепринятой методике с определением числа неподвижных (0 баллов), «дергающихся» на месте (1 балл), слабоподвижных (2 балла) и прогрессивно-подвижных (3 балла) сперматозоидов. Для постановки этого теста зрелые сперматозоиды получали из придатка семенника [5]. Затем с использованием камеры Горяева в полученной взвеси подсчитывали сперматозоиды в 5 больших квадратах в течение трех часов через каждые 15 минут.
Для оценки фолликулогенеза в яичниках потомства экспериментальных животных на серийных гистологических срезах, окрашенных гематоксилином и эозином, а также железным гепаток-силином, проводился морфометрический анализ, позволяющий произвести дифференцированный подсчет овариальных фолликулов разных пулов. При этом использовалась общепринятая классификация Lintern Moore (1967), по методике Pedesen a Peters [10], основанная на оценке фолликула с определенным количеством фолликулярных клеток и его диаметра. Во избежание ошибок и повторов при подсчете учитывались овариальные фолликулы на максимальных сечениях ооцитов, маркерами которых служили ядрышки. Фолликулы, имеющие в окружении менее 10 клеток, относили к стадии 1–2 (покоящиеся); 1–20 клеток – к стадии 3а; 21–60 клеток – к стадии 3б; 61–100 клеток – к стадии 4; от 101 до 200 клеток – к стадии 5а; 201–400 клеток – к стадии 5б (растущие); 401–
600 клеток – к стадии 6; больше 600 – к стадии 7–8 (полостные). Для активности атрезии подсчитывали общее количество атретических фолликулов.
Полученные результаты обработаны статистически с использованием пакета прикладных программ «Statistica 6,0». Достоверность результатов оценивалась с помощью непараметрического критерии Манна–Уитни.
Результаты исследования и их обсуждение. Площадь поперечного сечения и диаметр семенных извитых канальцев оказались сниженными по сравнению с таковым в контроле. Так, если у интактных 60-дневных крысят диаметр семенных канальцев составил 234,47 ± 5,527, то у подопытных животных токсической и аутоиммунной групп исследуемый показатель составил всего 189,13 ± 5,196 и 198,78 ± 4,69 соответственно. Аналогичная закономерность выявлена и при изучении площади поперечного сечения канальцев. Так, у интактных крысят данный показатель составил 43574 ± 1592 мкм2, а у подопытных крысят всего 28387 ± 1005 мкм2 и 31298 ± 584 мкм2 соответственно.
Важнейшим показателем структурно-функционального состояния семенника является характеристика сперматогенного пласта. Сперматоген-ный пласт изучался нами с учетом суммарного содержания сперматогенных клеток и их субпопуляционного состава. Обнаружено, что у интактных крысят суммарное содержание сперматогенных клеток составляет 265,9 ± 33,53, а у подопытных животных как токсической (235,21 ± 3,29), так и аутоиммунной (242,15 ± 2,63) групп снижено.
Наибольший интерес представляют данные дифференцированного анализа сперматогенных клеток с учетом их зрелости [8].
Нами установлено, что у потомства самок крыс с экспериментальным поражением печени имеет место изменение субпопуляционного состава сперматогенных клеток по сравнению с контролем (табл. 1).
Как видно из табл. 1, какой-либо закономерности в изменении числа сперматогоний различной степени зрелости (А, П, Б) у эксперименталь-
Таблица 1
Субпопуляционный состав сперматогенных клеток семенных извитых канальцев семенников экспериментальных животных (M ± m)
|
Сперматогенные клетки |
Группа |
||
|
Контрольная (К) |
Опытная 1 (О1) |
Опытная 2 (О2) |
|
|
Суммарное содержание сперматогоний |
44,94 ± 0,86 |
13,36 ± 0,66* |
46,12 ± 3,00 |
|
Сперматогонии А |
22,38 ± 0,18 |
20,65 ± 0,31* |
20,72 ± 0,11* |
|
Сперматогонии П |
8,87 ± 0,18 |
9,08 ± 0,4* |
9,75 ± 0,22* |
|
Сперматогонии Б |
13,69 ± 0,3 |
13,63 ± 0,33* |
12,28 ± 0,49* |
|
Сперматоциты I и II |
194,57 ± 1,87 |
179,3 ± 2,5* |
179,79 ± 1,56* |
|
Сперматиды |
16,46 ± 1,19 |
8,61 ± 0,5* |
10,59 ± 0,79* |
|
Сперматозоиды |
9,94 ± 0,86 |
3,93 ± 0,49* |
6,53 ± 0,92* |
|
Суммарное кол-во сперматогенных клеток |
265,9 ± 3,52 |
235,21 ± 3,2* |
242,15 ± 2,6* |
Результаты статистически достоверны по сравнению с контролем (р < 0,05).
Проблемы здравоохранения
ных животных выявить не удается. В то же время содержание сперматоцитов 1 и 2 порядка, сперматид и сперматозоидов в семенных извитых канальцах подопытных крысят снижено по сравнению с интактными животными. Вместе с тем у подопытных крысят выявлено существенное увеличение по сравнению с контрольной группой числа семенных извитых канальцев со слущенным эпителием, являющегося чувствительным индикатором интенсивности апоптотических процессов. Так, если у интактных крысят содержание канальцев со слущенным эпителием составляет 7,11 ± 1,3, то у подопытных животных обеих групп исследуемый показатель оказался существенно увеличенным и составил 25,5 ± 3,1 и 27,44 ± 4,0. Заслуживают внимания также данные, свидетельствующие об увеличении в семенных извитых канальцах подопытных крысят числа гигантских сперматогенных клеток. Так у интактных крысят содержание таких клеток в канальцах составило 0,32 ± 0,02, а у подопытных животных обеих экспериментальных групп этот показатель оказался равным 0,64 ± 0,13 и 0,55 ± 0,08.
Таким образом, анализ результатов данной серии исследования позволяет констатировать, что у потомства самок крыс с экспериментальным поражением гепатобилиарной системы имеет место нарушение процесса сперматогенеза, о чем свидетельствует, прежде всего, снижение суммарного содержания сперматогенных клеток, а также количества сперматоцитов, сперматид и сперматозоидов в семенных извитых канальцах.
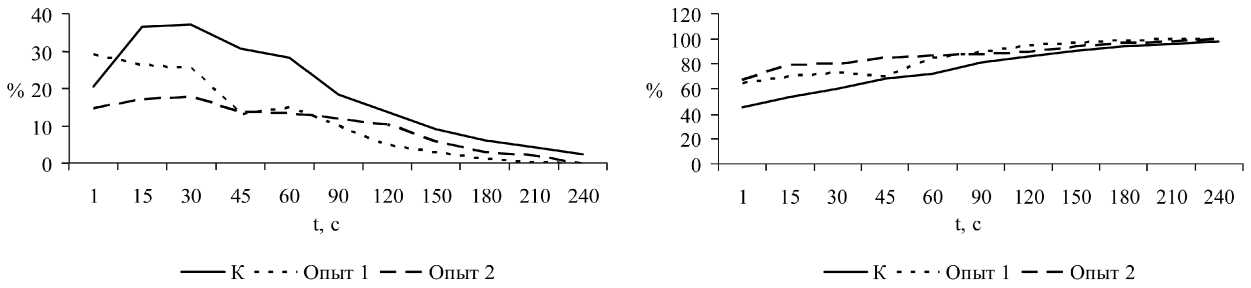
Анализ двигательной активности сперматозоидов позволил выявить следующую закономерность . У подопытных половозрелых крысят общее содержание в 1 мл эпидидимальных сперматозоидов снижено по сравнению с контролем (154,47 ± 2,74)·106 и составляет соответственно (69,24 ± 1,365)·106 и (99,29 ± 1,716)·106. Кроме того, у интактных крысят первоначально содержание прогрессивно-подвижных сперматозоидов составило 18,90 ± 0,691 %, в то время как у крысят опытной группы 1 этот показатель был равен всего 8,25 ± 1,876 %, а у животных второй опытной группы 1,86 ± 1,742 %. Через 15 минут после начала исследования у подопытных крысят отсутствовали прогрессивноподвижные сперматозоиды, в то же время у интактных животных число половых клеток данной популяции составило 0,25 ± 0,125 %. Аналогичная закономерность выявлена и при анализе содержания слабоподвижных сперматозоидов (рис. 1).
Таким образом, на всех сроках исследования у подопытных крысят обеих групп число фертильных сперматозоидов (прогрессивно-подвижных и слабоподвижных) снижено по сравнению с контролем.
При этом у подопытных крысят обеих групп содержание нефертильных («дергающихся» на месте и неподвижных) сперматозоидов на большинстве сроков исследования оказалось повышенным по сравнению с группой сравнения (рис. 2).
В следующей серии нашего исследования проведен анализ особенностей фолликулогенеза в яичниках потомства самок крыс с эксперимен-

Рис . 1. Динамика изменения содержания эпидидимальных слабоподвижных сперматозоидов
а)
б)
Рис. 2. Динамика изменения содержания эпидидимальных «дёргающихся» (а) и неподвижных (б) сперматозоидов
Таблица 2
Популяционный состав фолликулов по степени зрелости в яичниках экспериментальных животных (M ± m)
|
Показатель |
Группа |
||
|
К |
О1 |
О2 |
|
|
Суммар. кол-во фоллик. |
702 ± 53 |
526 ± 34 |
627 ± 58* |
|
Фолликулы 1 типа |
164 ± 28 |
80 ± 4 |
138 ± 22* |
|
Фолликулы 2 - 3 а типа |
90 ± 11 |
47 ± 6* |
58 ± 6* |
|
Фолликулы 3 б типа |
64 ± 5 |
40 ± 4 |
76 ± 7* |
|
Фолликулы 4 типа |
62 ± 6 |
74 ± 6* |
85 ± 5 |
|
Фолликулы 5 а типа |
96 ± 9 |
54 ± 3* |
52 ± 6* |
|
Фолликулы 5 б типа |
112 ± 16 |
107 ± 8 |
98 ± 6 |
|
Фолликулы 6 типа |
42 ± 3 |
40 ± 5* |
54 ± 6 |
|
Фолликулы 7– 8 типа |
96 ± 9 |
84 ± 7* |
66 ± 5 |
|
Малые фолликулы |
254 ± 25 |
127 ± 27 |
196 ± 46* |
|
Средние фолликулы |
222 ± 16 |
168±15 |
213 ± 14* |
|
Большие фолликулы |
226 ± 19 |
231 ± 24 |
218 ± 19 |
Результаты статистически достоверны по сравнению с контролем (р < 0,05).
тальным поражением печени (табл. 2). Одним их важнейших показателей, отражающих функциональное состояние яичников, является суммарное содержание фолликулов различной степени зрелости [4]. Нами установлено, что у подопытных животных суммарное содержание фолликулов снижено по сравнению с контролем.
Так, у интактных крысят этот показатель составил 702 ± 53, в то время как у подопытных животных и токсической (526 ± 34), так и аутоиммунной (627 ± 58) групп суммарное содержание фолликулов различной степени зрелости оказалось сниженным. При этом дифференцированный подсчет овариальных фолликулов позволил выявить определенную закономерность: у подопытных крысят содержание больших фолликулов практически не отличается от контроля, в то время как число малых фолликулов, являющихся резервом будущих половых клеток, существенно снижено (см. табл. 2). Уменьшение числа растущих фолликулов в яичниках подопытных крысят обеих групп в период становления половой зрелости согласуется с результатами, полученными при анализе числа атретических фолликулов в их яичниках. У потомства самок крыс с экспериментальным поражением печени различного генеза число атрети-ческих фолликулов существенно увеличено по сравнению с контролем. Так, у подопытных животных токсической и аутоиммунной групп число атретических фолликулов соответственно составило 39,54 и 31,67 %, в то время как у животных контрольной группы исследуемый показатель оказался равным 30,7 %.
Таким образом, результаты данной серии исследования позволяют констатировать, что у потомства самок крыс с экспериментальным поражением печени, в яичниках имеет место нарушение процесса фолликулогенеза, что, прежде всего, находит свое проявление в уменьшении числа рас- тущих фолликулов и как следствие уменьшение суммарного количества фолликулов, а также в усилении процессов атрезии фолликулов.
Заключение . Нарушение условий внутриутробного развития при моделировании поражения гепатобилиарной системы матери приводит к нарушению процессов формирования коррелятивных взаимоотношений в гипофизарно-тиреоидно-адреналово-половой системе плода, что обусловливает задержку структурного становления репродуктивной системы. Развивающийся комплекс изменений репродуктивной системы потомства может возникнуть в результате массированного проникновения через фетоплацентарный барьер патологических продуктов метаболизма при токсической патологии печени, а также сенсибилизированных цитотоксических Т-лимфоцитов, специфических антител, циркулирующих иммунных комплексов и других гуморальных факторов иммунной системы, что наиболее характерно для аутоиммунного поражения печени. Под влиянием этих факторов происходит нарушение процессов мейоза, усиление дегенеративной гибели половых клеток и уменьшение их суммарного количества. В целом, выявленные нарушения процессов сперматогенеза и фолликулогенеза позволяют говорить, что у самок крыс с экспериментальным поражением гепатобилиарной системы рождается потомство с нарушением становления репродуктивной функции.
Список литературы Роль хронического экспериментального поражения печени матери в нарушении генеративной функции потомства
- Брюхин, Г.В. Влияние хронических заболеваний печени матери на развитие потомства в условиях эксперимента/Г.В. Брюхин//Роль патологии печени матери в нарушении развития, реактивности и резистентности потомства в условиях эксперимента: сб. -Челябинск, 2009. -С. 6-16.
- Венгеровский, А.И. Механизм действия гепатопротекторов при токсическом поражении печени/А.И. Венгеровский, А.С. Саратиков//Фармакология и токсикология. -1988. -№ 1. -С. 89-93.
- Волкова, О.В. Морфогенетические основы развития и функции яичников/О.В. Волкова, Т.Г. Боровая. -М., 1999. -254 с.
- Егорова, Г.М. Токсикология новых промышленных химических веществ/Г.М. Егорова, Н.Г. Иванов, И.В. Саноцкий. -Л., 1966. -С. 33-36
- Моделирование воспалительного процесса в печени/Б.А. Сааков, А.И. Поляк, В.Е. Рычнев и др.//Моделирование, методы изучения и экспериментальная терапия патологических процессов. -М., 1967. -С. 119-123.
- Николаева, Л.Б. Первая беременность и первые роды: моногр./Л.Б. Николаева, Г.А. Ушакова. -М.: ГЭОТАР-Медиа. -2011. -264 с.
- Ухов, Ю.И. Морфометрические методы в оценке функционального состояния семенников/Ю.И. Ухов, А.Ф. Астраханцев//Арх. анат., гистол. и эмбриол. -1983. -№ 3. -С. 66-72.
- Шехтман, М.М. Руководство по экстрагенитальной патологии у беременных/М.М. Шехтман. -М.: Триада-Х, 2003. -816 с.
- Pedersen, T. Proposal for a classification of oocytes and follicules in the mouse ovary/T. Pedersen, H. Peters//J.Reprod. Fertil. -1968. -Vol. 17. -P. 555-557.


