Роль IL-1В и простагландинов в регуляции функциональной активности лимфоцитов в присутствии опиоидных пептидов
Автор: Гейн С.В., Горшкова К.Г., Гейн О.Н., Тендрякова С.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 5, 2007 года.
Бесплатный доступ
Установлено, что в нефракционированной клеточной культуре ??-эндорфин активировал продукцию интерлейкина-1?? (IL-1??) и угнетал продукцию интерлейкина-8 (IL-8) в присутствии липополисахарида (ЛПС), не влияя на продукцию ??-фактора некроза опухолей (TNF-??) и интерлейкина-6 (IL-6). Лёгкий стимулирующий эффект в культуре лейкоцитов пептид оказывал на спонтанную продукцию IL-1??. Показано, что ??-эндорфин способен оказывать как опосредованный, так и прямой эффект на функциональную активность лимфоидных клеток.
Короткий адрес: https://sciup.org/147204405
IDR: 147204405 | УДК: 612-017.1.018
Текст научной статьи Роль IL-1В и простагландинов в регуляции функциональной активности лимфоцитов в присутствии опиоидных пептидов
Опиоидный пептид Р -эндорфин является производным гипофизарного пептида проопиомеланокор-тина и обладает широким спектром иммунорегуля-торной активности (Panerai, Sacerdote, 1997). Показано, что Р -эндорфин в зависимости от влияния различных факторов, таких как тип иммунного ответа (клеточный или гуморальный), доминирование Т-хелперов I или II типов (Th1/Th2), состав клеточного микроокружения, способен оказывать как иммуносупрессивные, так иммуностимулирующие эффекты, выраженность которых может сильно варьировать.
В настоящее время выявлена способность р -эндорфина модулировать функции лимфоцитов, натуральных киллеров (NK-клеток) и макрофагов (Plotnikoff et al., 1999). Роль Р -эндорфина в регуляции секреторной функции моноцитов, в частности продукции цитокинов провоспалительной группы (IL-1 p , TNF- a , IL-6), выполняющих ключевую роль в запуске и формировании иммунного ответа, остаётся достаточно противоречивой (Plotnikoff et al., 1999). Малоизученной является роль отдельных продуктов, секретируемых моноцитами, в регуляции и формировании направленности эффекта опиоидных пептидов на пролиферативную активность лимфоцитов.
Цель работы - оценка роли IL-i p , IL-6 и простагландинов в Р -эндорфин-опосредованной регуляции пролиферативного ответа лимфоцитов.
Методы исследования
Объектом исследования служили моноциты периферической венозной крови здоровых мужчин-добровольцев в возрасте от 22 до 30 лет. Гепаринизированную венозную кровь отстаивали в течение 2 ч при 37 ° С. Затем верхний слой плазмы с лейкоцитами снимали и центрифугировали при 1500 об/мин в течение 20 мин и ресуспендировали в RPMI 1640 (ICN, США) с добавлением HEPES 10 mM (Sigma, США), L-глутамина 2 mM (Sigma, США), 100 мкг/мл гентамицина и 10% ЭТС (ICN, США). Культивирование осуществляли в 24-луночных планшетах Costar (США) 1*106 клеток в 1 мл питательной среды во влажной атмосфере с 5% СО2 при 37 ° С в течение 24 ч в присутствии субоптимальной концентрации фитогемагглютинина (ФГА) (Sigma, США) 2.5 мкг/мл и липополисахарид Escherichia coli O26:B6 (ЛПС) (Sigma, США) 0.1 мкг/мл. β-эндорфин (Sigma, США) вносили в культуры одновременно с ФГА и ЛПС в концентрациях 10-7–10-11М, налоксона гидрохлорид и налтриндола гидрохлорид (ICN, США) – 106М. Супернатанты собирали в пробирки Эппен-дорф и хранили в замороженном состоянии при – 20 ° С.
Оценку выраженности пролиферации производили по стандартной методике с использованием H3-тимидина в культурах лейкоцитов, активированных ФГА 2.5 мкг/мл, в 96-луночных круглодонных планшетах в течение 72 ч. Каждая культура содержала 2*105 клеток в 0.2 мл среды 199 с
добавлением HEPES 10 mM (Sigma), L-глутамина 2 mM (Sigma), 100 мкг/мл гентамицина и 10% ЭТС (ICN). За 18 ч до окончания культивирования в культуры вносили по 2 мкКи H3-тимидина. Радиоактивность проб определяли на сцинтилляционном счетчике "Guardian" (Wallac, Финляндия). Анти-IL-1 β -антитела (Протеиновый контур, Россия) вносили в культуры в концентрации 2 мкг/мл, ингибитор циклооксигеназы – диклофенак натрия – 25 мкг/мл (Ширшев, 1996).
Определение концентрации IL-1 β , TNF- α , IL-6, IL-8 в супернатантах клеточных культур производили с использованием наборов ООО «Цитокин» (Санкт-Петербург) в соответствии с методикой, предложенной производителем.
Результаты определяли с использованием многофакторного дисперсионного анализа для парных данных и парного t-критерия для межгруппового сравнения. Все данные представлены в виде средней и её стандартной ошибки (M±m).
Результаты и их обсуждение
Как видно из таблицы, в нефракционированной клеточной культуре β -эндорфин (10-7-10-11М) активировал ЛПС-индуцированную продукцию IL-1 β , не влияя на синтез IL-6 и TNF- α , одновременно в концентрациях 10-7 и 10-11 М угнетая продукцию IL-8. Лёгкий стимулирующий эффект пептид оказывал на спонтанную продукцию IL-1 β в концентрации 10-7-10-9М. На индуцированную субоптимальной дозой ФГА продукцию исследуемых цитокинов β -эндорфин не влиял.
Влияние β -эндорфина на продукцию IL-1 β , TNF- α , IL-6 в нефракционированной клеточной суспензии
|
Цитокин |
Экспериментальное воздействие |
Концентрация |
β -эндорфина, M |
||
|
контроль |
10 -7 |
10 -9 |
10 -11 |
||
|
IL-1 β . |
Без индуктора |
193.01 ± 39.16 |
271.66 ± 77.96* |
266.57 ± 49.18* |
238.22 ± 50.19 |
|
пг/мл |
ФГА 2.5 мкг/мл |
228.59 ± 48.19 |
220.56 ± 51.70 |
294.13 ± 92.04 |
246.51 ± 68.065 |
|
(n=8) |
ЛПС 0.1 мкг/мл |
190.87 ± 54.43 |
305.76 ± 49.50 *** |
300.95 ± 76.95 *** |
279.41 ± 62.40** |
|
TNF- α . |
Без индуктора |
253.72 ± 52.60 |
286.79 ± 61.43 |
277.46 ± 67.08 |
290.90 ± 62.32 |
|
пг/мл |
ФГА 2.5 мкг/мл |
315.69 ± 56.76 |
354.26 ± 61.82 |
328.50 ± 57.27 |
344.16 ± 64.08 |
|
(n=8) |
ЛПС 0.1 мкг/мл |
269.59 ± 53.90 |
297.93 ± 66.45 |
295.42 ± 68.59 |
295.49 ± 60.45 |
|
IL-6. |
Без индуктора |
1115.41 ± 30.54 |
1084.09 ± 50.23 |
1101.83 ± 56.55 |
1109.70 ± 46.66 |
|
пг/мл |
ФГА 2.5 мкг/мл |
1144.11 ± 24.99 |
1156.29 ± 32.12 |
1133.00 ± 31.49 |
1119.24 ± 39.01 |
|
(n=8) |
ЛПС 0.1 мкг/мл |
1094.73 ± 36.40 |
1082.85 ± 28.72 |
1051.07 ± 36.16 |
1115.41 ± 33.88 |
|
IL-8. |
Без индуктора |
1353.68 ± 114.42 |
1340.28 ± 104.42 |
1664.63 ± 44.10 |
1313.30 ± 156.25 |
|
пг/мл |
ФГА 2.5 мкг/мл |
1443.08 ± 86.30 |
1519.55 ± 44.95 |
1578.30 ± 58.88 |
1147.30 ± 74.92 |
|
(n=4) |
ЛПС 0.1 мкг/мл |
1699.20 ± 68.25 |
1278.40 ± 31.34** |
1635.43 ± 68.31 |
1364.28 ± 59.85** |
* – р < 0.05; ** – р < 0.01; *** – р < 0.001 к контролю.
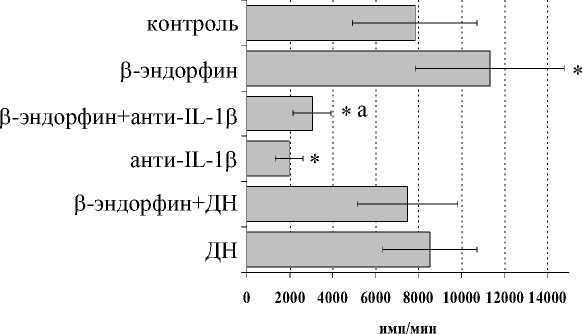
В дальнейшем мы попытались оценить роль IL-1 β , IL-6 и продуктов циклооксигеназного цикла в β -эндорфин-опосредованной регуляции пролиферативного ответа лимфоцитов в присутствии ФГА. Все обследованные здоровые доноры-добровольцы были разделены по индивидуальной чувствительности к β -эндорфину на две группы: у 1-й группы пептид стимулировал пролиферативный ответ, а у 2-й – угнетал его. Как видно из рисунка, А , в 1-й группе доноров на фоне моноклональных антител к IL-1 β наблюдалось резкое снижение пролиферативной активности, в то же время при внесении в культуры анти-IL-1 β -антител в присутствии β -эндорфина наблюдалось усиление пролиферативного ответа, статистически достоверно отличающееся от ответа культур с анти-IL-1 β -антителами.
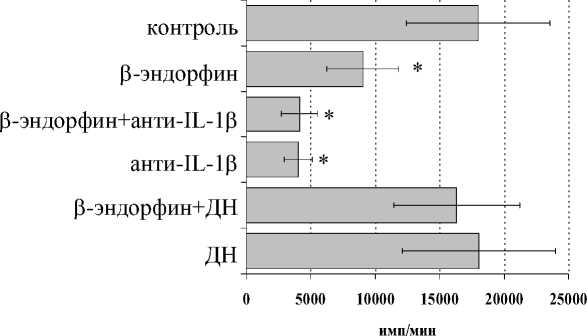
В то же время в условиях угнетения выраженности пролиферации β -эндорфином у 2-й группы доноров (рисунок, Б ) на фоне анти-IL-1 β -антител интенсивность пролиферативного ответа в присутствии β -эндорфина не изменялась.
При культивировании лейкоцитов в присутствии диклофенака натрия как стимулирующий, так и угнетающий эффект β-эндорфина на пролиферативный ответ нивелировался, что подтверждает возможное участии простагландинов, в частности простагландина E2 (PGЕ2), в регуляции функциональной активности лимфоцитов под воздействием опиоидных пептидов (Ширшев, 2002).
Таким образом, β-эндорфин оказывал стимулирующий эффект на уровень IL-1β. Оценка зависимости доза – эффект показала наиболее выраженное влияние β-эндорфина на цитокиновую продукцию в концентрации 10-7М, аналогичное показанному нами ранее влиянию на пролиферативный ответ лимфоцитов (Гейн и др., 2006). Все эффекты β-эндорфина проявлялись преимущественно в нефракционированных культурах, что указывает на необходимость кооперации различных клеточных популяций для реализации эффектов опиоидных пептидов. Другим немаловажным условием получения этих эффектов является активация клеток с рецепторного комплекса CD14/TLR4/MD2 (Fujiharaa et al., 2003), экспрессированного преимущественно на моноцитах. Известно, что активация клеток ведёт к увеличению плотности опи- атных рецепторов (Sharp, 2006). Необходимо отметить, что рецепторный комплекс к ЛПС экспрессируется и на гранулоцитах, в частности нейтрофилах (Симбирцев, 2005), которые в настоящем эксперименте присутствовали в смешанной клеточной фракции. Отсутствие влияния β-эндорфина на продукцию цитокинов в культурах с таточно для запуска экспрессии опиатных рецепторов. Ранее нами была показана необходимость присутствия моноцитов в клеточной культуре для реализации стимулирующего воздействия β-эндорфина на пролиферативный ответ (Гейн и др., 2006). Анализ роли IL-1β в регуляции пролиферации показал, что β-эндорфин частично нивелирует
А
Б
Влияние β -эндорфина на ФГА-индуцированный пролиферативный ответ лимфоцитов в присутствии анти-IL-1 β антител и на фоне блокады синтеза простагландинов диклофенаком натрия (ДН) у доноров 1-й (А, n=9) и 2-й (Б, n=11) групп. * – р<0.05 к контролю; а – р< 0.05 к анти-IL-1 β
ФГА может объясняться тем, что основной мишенью для ФГА являются в первую очередь лимфоциты, которые в процессе пролиферации продуцируют факторы (гамма-интерферон, интерлейкин-2), способные активировать моноциты. Известно, что сайты связывания для β-эндорфина, к которым в первую очередь относятся µ- и δ-опитные рецепторы, экспрессируются на лимфоцитах только в процессе активации и преимущественно субоптимальными дозами ФГА или Кон А (Sharp, 2006). Таким образом, моноциты при такой схеме активируются опосредовано, этого может быть недос- угнетающий эффект анти-IL-1β на пролиферативный ответ. Таким образом, можно говорить о наличии у пептида как опосредованного, так и прямого, независимого от IL-1β (Van den Bergh et al., 1994), ответа на функциональную активность лимфоидных клеток, в то же время направленность этого влияния может напрямую зависеть от функционального состояния моноцитов и факторов, ими синтезируемых.
Работа поддержана грантом программы Президиума РАН «Молекулярная и клеточная биология» и грантом РФФИ № 06-04-49001.
Список литературы Роль IL-1В и простагландинов в регуляции функциональной активности лимфоцитов в присутствии опиоидных пептидов
- Гейн С.В., Баева Т.А., Гейн О.Н., Черешнев В.А. Роль моноцитов в реализации эффектов ??-эндорфина и селективных агонистов ??-и ??-опиатных рецепторов на пролиферативную активность лимфоцитов периферической крови//Физиология человека. 2006. Т. 32, № 3. С. 111-116.
- Симбирцев А.С. Толл-белки: специфические рецепторы неспецифического иммунитета//Иммунология. 2005. № 6. С. 368-377.
- Ширшев С.В. Механизмы иммуномодулирующего действия гормонов репродукции: Автореф. дис.... д-ра мед. наук. М., 1996.
- Ширшев С.В. Механизмы иммуноэндокринного контроля процессов репродукции. Екатеринбург, 2002.
- Fujiharaa M., Muroib M., Tanamotob K. et al. Molecular mechanisms of macrophage activation and deactivation by lipopolysaccharide: roles of the receptor complex//Pharmacology & Therapeutics. 2003. Vol. 100. P. 171-194.
- Panerai A.E., Sacerdote P. Beta-endorphin in the immune system: A role at last//Immunol Today. 1997. Vol. 18. P. 317-319.
- Plotnikoff N.P., Faith R.E., Murgo A.J. et al. Cytokines: stress and immunity. Boca Raton: FL. CRC Press, 1999.
- Sharp B.M. Multiple opioid receptors on immune cells modulate intracellular signaling//Brain, Behavior, and Immunity. 2006. Vol. 20. Р. 9-14.
- Van den Bergh, Dobber R., Ramlal S. et al. Role of opioid peptides in the regulation of cytokine production by murine CD4+ cells//Cell Immunol. 1994. Vol. 154. P. 109-122.


