Роль кателицединов в развитии инфекционных осложнений при эндопротезировании тазобедренного сустава
Автор: Дмитриева Л. А., Морозов А. Н., Сай О. В., Мухомедзянова С. В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 т.13, 2023 года.
Бесплатный доступ
Актуальность. Снижение риска возникновения инфекционных осложнений после эндопротезирования тазобедренного сустава как в ранний, так и в поздний послеоперационный период остаётся важной задачей. В настоящее время идёт поиск лабораторных маркеров развития инфекции в области оперативного вмешательства, обладающих высокой прогностической значимостью. Нарушение выработки кателецидинов LL37 может являться фактором, способствующим развитию инфекционно-воспалительных осложнений.Цель: оценить уровень концентрации кателицидина в динамике у пациентов с эндопротезированием тазобедренного сустава и развитием послеоперационных инфекционных осложнений.Объект и методы. Всего было обследовано 49 человек, которых разделили на три группы: первая группа - 19 пациентов после эндопротезирования тазобедренного сустава с течением послеоперационного периода без особенностей, 2-я группа - 15 пациентов после эндопротезирования тазобедренного сустава: 6 человек - с развитием парапротезной инфекции в ранние сроки и 9 пациентов - с поздними глубокими осложнениями в сроки до 1 года. Третью группу (n = 15) составили клинически здоровые лица. Проведён анализ результатов лабораторного исследования кателецидинов LL37 в периферической крови и дренажной жидкости.Результаты. Выявлены определённые закономерности изменения уровня кателицидинов LL37 в зависимости от развития или отсутствия инфекционного осложнения у пациентов с эндопротезированием тазобедренного сустава в послеоперационный период. Полученные данные позволили составить уравнение, решение которого, с высокой вероятностью, позволяет прогнозировать развитие инфекционных осложнений у пациентов с коксартрозом при эндопротезировании тазобедренного сустава.
Коксартроз, тотальное эндопротезирование тазобедренного сустава, инфекционные осложнения, лабораторные показатели, кателецидины
Короткий адрес: https://sciup.org/143180889
IDR: 143180889 | УДК: 616.728.3-089-06 | DOI: 10.20340/vmi-rvz.2023.6.CLIN.2
Текст научной статьи Роль кателицединов в развитии инфекционных осложнений при эндопротезировании тазобедренного сустава
ОРИГИНАЛЬНАЯ СТАТЬЯ ORIGINAL ARTICLE УДК 616.728.3-089-06
Дегенеративно-дистрофические поражения крупных суставов занимают значительное место в структуре патологии костно-суставной системы. По данным литературы, отмечается рост числа оперативных вмешательств по эндопротезированию тазобедренного сустава, но, как и любое хирургическое вмешательство, не лишено осложнений [1, 2]. Инфекция при эндопротезировании тазобедренного сустава как в ранние, так и в поздние сроки занимает важное место среди осложнений [3]. Частота выявления парапротезной инфекции после первичного тотального эндопротезирования тазобедренного сустава (ТЭТС) составляет 1–2 % [2]. Основным возбудителем, вызывающим инфекционные осложнения, в настоящее время остаётся золотистый стафилококк, способный формировать биопленку [4] на поверхности импланта, тем самым защищая микроорганизм от действия клеток иммунной системы. Развитие инфекционного процесса сопровождается тканевой реакцией и развитием воспаления. Одними из участников этого процесса являются антимикробные пептиды (AMП). Представителями АМП являются кателици-дины (LL-37). Это многофункциональные пептиды, обладающие противомикробным свойством широкого спектра действия как против грамположительных, так и грамотри-цательных бактерий, вирусов и грибов, кроме того они участвуют в цитокиновом ответе и привлечении эффекторных клеток в очаг воспаления, способствуют заживлению ран путём стимуляции повторной эпителизации и ангиогенеза в повреждённых тканях [5]. LL-37 экспрессируется лейкоцитами, включая нейтрофилы, моноциты, тучные клетки, NK-, Т- и В-клетки [6, 7]. Исходя из описанных механизмов действия АМП, можно говорить о том, что недостаточное или чрезмерное образование этих пептидов может негативно отразиться на послеоперационный период и быть дополнительным триггером, способствующим развитию инфекционно-воспалительных осложнений [8]. Исследование каталицидинов в крови и дренажной жидкости может способствовать разработке лабораторных тестов ранней диагностики и оценки риска развития инфекционного осложнения после эндопротезирования тазабедренного сустава.
Цель: оценить уровень концентрации кателицидина в динамике у пациентов с эндопротезированием тазобедренного сустава.
Объект и методы
В исследовании приняли участие 49 человек, из них 34 пациента, проходивших хирургическое лечение с диагнозом «идиопатический коксартроз 3 стадии» на базе ФГБНУ ИНЦХТ, и 15 человек – клинически здоровые лица. Диагноз устанавливался по данным анамнеза и клиникоинструментального обследования. Из общего числа обследованных лиц 44 % - женского пола, 56 % - мужского пола. Средний возраст составил 58,5 ± 10,4 года. В качестве материала для исследования использовали периферическую кровь и дренажную жидкость. Для определения кателицидина LL37 использовалась тест-ситема «ELISA Kitfor Cathelicidin Antimicrobial Peptide (CAMP)» (Китай). Учёт результатов проводили с использованием мультиканального микропланшетного фотометра ELx808 (BioTek, США) при длине волны 450 нм. Обследование проводили трёхкратно: перед эндоротезированием тазобедренного сустава, на 2-е и 10-е сутки после [8].
Исследуемые были разделены на три группы: 1-я группа – 19 пациентов после ТЭТС с течением послеоперационного периода без особенностей, 2-я группа – 15 пациентов после ТЭТС: 6 пациентов – с развитием па-рапротезной инфекции в ранние сроки и 9 пациентов – с поздними глубокими осложнениями в сроки до 1 года; 3-ю группу ( группа контроля) составили клинически здоровые лица – 15 человек.
По данным микробиологического исследования внутрисуставной и дренажной жидкости тазобедренного сустава у пациентов 2-й группы были выделены стафилококки (Staphylococcus aureus) – у 12 (80 %) пациентов, представитель семейства энтеробактерий (Cedecea) – у 1 (6,7 %) пациента, стрептококк (Streptococcus agalactiae) – у 1 (6,7 %) пациента и ещё у 1 пациента имелась смешанная инфекция (Staphylococcus aureus и Klebsiella pneumonia). Статистическую обработку и анализ результатов проводили по общепринятым математическим алгоритмам с использованием пакета прикладных программ Statistica 6.0. Использовали как параметрические, так и непараметрические методы.
Результаты
Анализируя данные литературы, нами не найдена информация о содержании кателицединов в крови и дренажной жидкости у пациентов после ТЭТС. Первым этапом стало определение уровня L37 в крови у группы контроля. Средний уровень составил 5,32 ± 1,6 мкг/мл. Далее был определен уровень LL37 в крови и в дренажной жидкости у пациентов с ТЭТС на разных этапах (табл. 1).
Таблица 1. Уровень кателицидина в крови и дренажной жидкости в динамике у пациентов с ТЭТС в разные сроки
Table 1. The level of cathelicidin in the blood and drainage fluid over time in patients with hip replacement at different times
|
Уровень кателицидина |
Группа контроля, n = 15 |
Без инфекционных осложнений, n = 19 (группа сравнения) |
С инфекционными осложнениями, n = 15 (исследуемая группа) |
|
В крови, мкг/мл |
|||
|
до операции |
5,32 ± 1,6 |
5,84 ± 1,12 |
7,82 ± 1,99 (1*) |
|
1-е сутки после операции |
– |
5,75 ± 1,19 |
6,83 ± 2,42 (1**) |
|
перед выпиской |
– |
4,43 ± 1,8 |
7,64 ± 1,88 (1*) |
|
В дренажной жидкости, мкг/мл |
– |
3,2 ± 2,92 |
7,66 ± 3,46 (1*) |
Примечание: значимость различий между связанными переменными * – p < 0,05; ** – p < 0,01 тест Стьюдента.
При оценке уровня LL-37 установлено достоверное изменение показателей кателицидина в группе с инфекционными осложнениями на всех сроках. Антимикробные пептиды оказывают регуляторные эффекты на макрофаги и способствуют фагоцитозу при наличии микробной флоры в очаге воспаления [9]. По данным микробиологического исследования, у пациентов данной группы подтверждено наличие как грамположительных, так и грамот-рицательных микроорганизмов.
Оценивая результаты содержания кателицидина до операции и на 10-е сутки, в группе сравнения отмечено его снижение, достоверность р = 0,023 по t-критерию Стьюдента (рис. 1). Можно предположить, что развитие такой реакции связано с ответом организма на воздействие агрессивных факторов (хирургическое вмешательство, кровопотеря, действие анестетиков).
В исследуемой группе достоверное изменение концентрации кателицидина до операции и перед выпиской не отмечено. При более тщательном анализе данных выявлено, что у пациентов с развитием инфекционных осложнений в ранний послеоперационный период (n = 6) концентрация достигала 9 мкг/мл и более. А у пациентов с развитием инфекционных осложнений в поздний период до 1 года (n = 9) уровень LL37 достигал 11 мкг/мл.
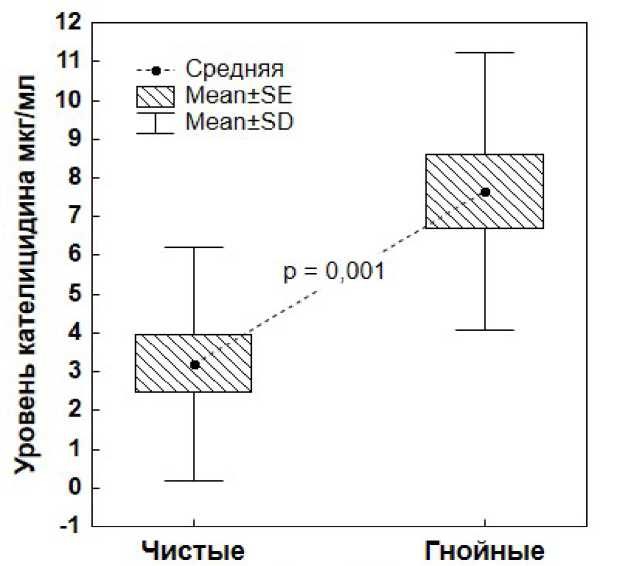
Достоверное увеличение уровня кателицидина в дренажной жидкости также отмечалось у пациентов в группе с инфекционными осложнениями (рис. 2).
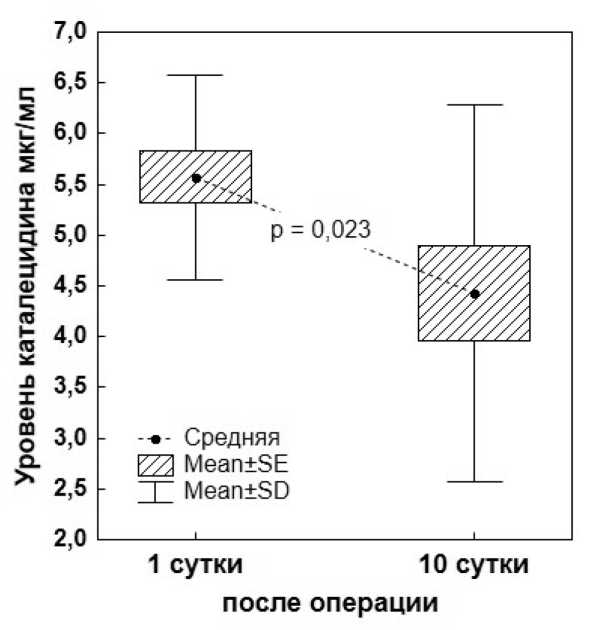
Рисунок 1. Изменение уровня кателицидина в крови у пациентов группы сравнения в исходном состоянии и на 10-е сутки после операци
Figure 1. Changes in the level of cathelicidin in the blood of patients in the comparison group at baseline and on the 10th day after surgery
Группы пациентов
Рисунок 2. Уровень кателицидина в группах с определением достоверности по t-критерию Стьюдента
Figure 2. Cathelicidin levels in groups with significance determined by Student's t-test
Проведённый дискриминантный анализ выявил, что наиболее коррелирующими между собой данными являются уровень кателицидина на 10-е сутки в крови и в дренажной жидкости. Полученные коэффициенты были использованы для составления уравнения. Использование данного равенства позволяет при его решении с большой вероятностью предположить развитие у пациентов после эндопротезировании тазобедренного сустава инфекционных осложнений в ранние сроки:
К = 3,44 – 0,407X – 0,208Y, где X – содержание кателицидина в сыворотке крови на 10-е сутки;
Y – содержание кателицидина в дренажной жидкости.
Используя полученные данные мы провели канонический анализ (рис. 3). Пациенты, у которых отрицательные значения и до +0,5 входят в группу с инфекционными осложнениями. Положительные канонические значения соответствуют группе сравнения.
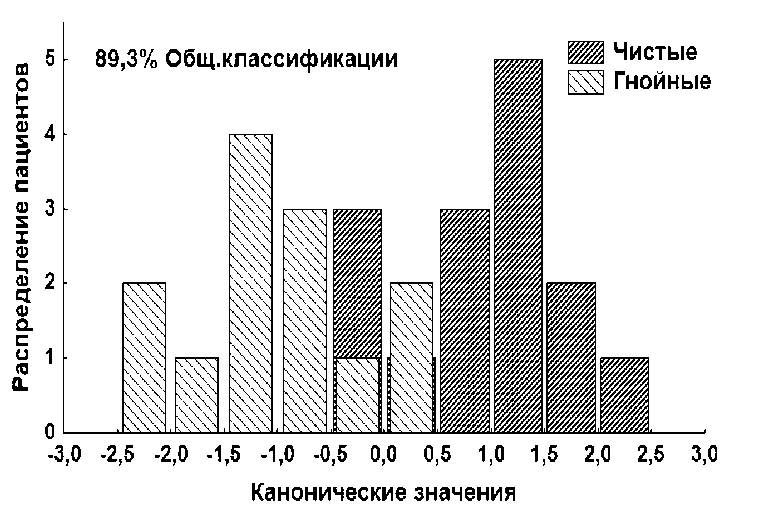
Рисунок 3. Диаграмма распределения пациентов исследуемых групп
Figure 3. Diagram of the distribution of patients in the study groups
Заключение
Оценён уровень кателицидина в крови у клинически здоровых лиц. Полученные данные подтверждают, что уровень кателицидинна увеличивается при развитии инфекционного осложнения. Отмечается увеличение концентрации не только в крови, но и в дренажной жидкости. Определение концентрации LL-37 можно использовать с диагностической целью как биомаркер воспалительного процесса. Также были выявлены сроки определения кате- лецидина в крови и в дренажной жидкости с целью выявления риска развития инфекционных осложнений у пациентов с коксартрозом при эндопротезировании тазобедренного сустава.
Таким показателем явилися уровень кателицидина, определяемый на 10-е сутки после операции. Полученные коэффициенты позволили составить уравнение для прогнозирования развития в ранние сроки инфекционных осложнений после эндопротезирования тазобедренного сустава.
Список литературы Роль кателицединов в развитии инфекционных осложнений при эндопротезировании тазобедренного сустава
- Середа А. П., Кочиш А.А., Черный А.А., Антипов А.П., Алиев А.Г., Вебер Е.В., Воронцова Т.Н., Божкова С.А., Шубняков И.И, Тихилов Р.М. Эпидемиология эндопротезирования тазобедренного и коленного суставов и перипротезной инфекции в Российской Федериции. Травматология и ортопедия России. 2021; 3: 84-92.
- Мясоедов А.А., Торопов С.С., Березин Г.В., Карелкин В.В., Тотоев З.А., Шубняков И.И., Тихилов Р.М. Факторы риска развития перипротезной инфекции после первичного эндопротезирования тазобедренного сустава. Травматология и ортопедия России. 2020; 26 (1): 40-47.
- Мамонова И.А., Бабушкина И.В., Пучиньян Д.М. Этиологическая роль возбудителей инфекционных осложнений после эндопротезирования крупных суставов. Фундаментальные исследования. 2015; 8(1):19-23.
- Тихомиров Д.А., Щеколова Н.Б. Опыт лечения инфекционных осложнений после первичного эндопротезирования тазобедренного сустава. Клинические исследования.2016;23(4):28-32.
- Nguyen HLT, Trujillo-Paez JV, Umehara Y, Yue H, Peng G, Kiatsurayanon C, Chieosilapatham P, Song P, Okumura K, Ogawa H, Ikeda S, Niyonsaba F. Role of Antimicrobial Peptides in Skin Barrier Repair in Individuals with Atopic Dermatitis. Int J Mol Sci. 2020 Oct 14;21(20):7607. https://doi.org/10.3390/ijms21207607. PMID: 33066696; PMCID: PMC7589391.
- Коновалова М.В., Зубарева А.А., Луценко Г.В., Свирщевская Е.В. Антимикробные пептиды в норме и при патологиях. Прикладная биохимия и микробиология. 2018;54(3):236-243.
- Nagaoka I, Tamura H, Reich J. Therapeutic Potential of Cathelicidin Peptide LL-37, an Antimicrobial Agent, in a Murine Sepsis Model. Nagaoka I, Tamura H, Reich J. Therapeutic Potential of Cathelicidin Peptide LL-37, an Antimicrobial Agent, in a Murine Sepsis Model. https://doi.org/10.3390/ijms21175973. PMID: 32825174; PMCID: PMC7503894.
- Морозов А.Н. Роль эндогенных антимикробных пептидов в развитии инфекционных осложнений при эндопротезировании тазобедренного сустава. ВКР. ФГБОУ ВО ИГМУ Минздрава России. 2020.
- Coorens M, Schneider VAF, de Groot AM, van Dijk A, Meijerink M, Wells JM, Scheenstra MR, Veldhuizen EJA, Haagsman HP. Cathelicidins Inhibit Escherichia coliInduced TLR2 and TLR4 Activation in a Viability-Dependent Manner. J Immunol. 2017 Aug 15;199(4):1418-1428. https://doi.org/10.4049/jimmunol.1602164. Epub 2017 Jul 14.PMID: 28710255; PMCID: PMC5544931.


