Роль клеточно-межклеточных взаимоотношений в развитии интимальной гиперплазии внутренней грудной артерии
Автор: Тодоров С.С., Сидоров Р.В., Щетко В.Н., Шлык И.Ф., Поспелов Д.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.12, 2017 года.
Бесплатный доступ
Интимальная гиперплазия внутренней грудной артерии представляет собой сложный клеточно-межклеточный ансамбль, в котором лидирующую роль играют гладкие миоциты. Функциональное состояние гладких миоцитов, их способность к пролиферации, секреторной активности с продукцией гликозаминогликанов может вызывать патологические изменения не только в интиме, но и в медии внутренней грудной артерии со скоплением в них кислых мукополисахаридов. Полученные данные могут помочь обосновать применение таргетных терапевтических препаратов, направленных на ингибирование активности и пролиферации гладких миоцитов, что позволит предупредить возникновение рестенозов после оперативных вмешательств на коронарных сосудах.
Интимальная гиперплазия, внутренняя грудная артерия, гликозаминогликаны, гладкие миоциты, мукополисахариды, пролиферация клеток, клеточно-межклеточные взаимоотношения
Короткий адрес: https://sciup.org/140188706
IDR: 140188706 | УДК: 611.13
Текст научной статьи Роль клеточно-межклеточных взаимоотношений в развитии интимальной гиперплазии внутренней грудной артерии
Как известно, артерии представляют собой кровеносные сосуды, имеющие интиму, медию, адвентицию, включающие клеточные и экстрацеллюлярные компоненты. К клеточным компонентам артерий относятся клетки эндотелия интимы, гладкие миоциты медии, фибробласты адвентиции. Экстрацеллюлярные (внеклеточные) элементы матрикса (ЭЦМ) артерий представлены структурными белками (коллагенами I, III типов, эластином); протеогликанами и гликозаминогликанами (ГАГ); адгезивными и специализированными молекулами (фибронектином, ламинином и другими) [1].
Основной клеткой стенки артерий, обладающей высокоспециализированными свойствами, являются гладкие миоциты (ГМ). Зрелые ГМ артерий имеют мультифунк-циональные возможности, что проявляется сокращением, миграцией, пролиферацией, синтезом компонентов ЭЦМ, секрецией факторов роста и цитокинов [4].
Фенотипически ГМ артерий могут быть контрактильного и синтетического типов. Переход ГМ синтетического типа в контрактильный называется созреванием клеток, которое сопровождается увеличением содержания миофиламентов, контрактильного аппарата, уменьшением синтетических органелл [5].
Переход ГМ из контрактильного в синтетический фенотип называется модуляцией и является специфическим ответом ГМ на повреждение во всех сосудистых бассейнах организма [3, 4]. В этом случае ГМ приобретают свойства миофибробластов, что способствует избыточной пролиферации клеток интимы, развитию атеросклеротических бляшек.
Синтетические ГМ трансформируются из контрактильных ГМ мышечного слоя артерий при их модуля- ции или появляются из незрелых стволовых ГМ стенки сосуда [8].
Есть указания, что модуляция фенотипа ГМ наблюдается при атеросклерозе, рестенозе после ангиопластики или шунтирования коронарных артерий сердца [9, 10].
Важным компонентом ЭЦМ артерий являются ГАГ (кислые мукополисахариды, гиалуроновая кислота), которые принимают участие в клеточной пролиферации, миграции, дифференцировке, созревании структур. В отдельных работах показано, что гиалуроновая кислота играет важную роль в процессах атерогенеза, интималь-ной гиперплазии, рубцовой деформации сосудов после хирургических вмешательств.
В ряде работ обсуждается возможность участия некоторых белков протеогликанов (декорин, перлекан, синдекан-1, версикан) в развитии интимальной гиперплазии [3, 5, 6, 7, 10].
Таким образом, до настоящего времени дискуссионными остаются вопросы участия и роли клеточно-межклеточных взаимоотношений в развитии интимальной гиперплазии и атеросклероза внутренней грудной артерии (ВГА).
В связи с этим целью нашего исследования явилось изучение морфологических и гистохимических особенностей ВГА с полуколичественной оценкой клеточно-экстрацеллюлярных компонентов ее стенки.
Материал и методы
Материалом исследования послужили сегменты ВГА, удаленные интраоперационно в качестве трансплантатов, оперированных в кардиохирургическом отделении РостГМУ. Средний возраст больных составил 57 лет. Фрагменты ВГА разрезали на сегменты в виде колец каждые 1,5 мм, фикси-

ровали в 10% растворе забуференного формалина и после стандартной проводки в восходящей концентрации спиртов заливали в парафин. Гистологические срезы окрашивали гематоксилином-эозином, пикрофуксином по Ван Гизон, Маллори для выявления коллагеновых волокон, состояния гладких миоцитов, на эластические волокна по Вейгерту, проводилась ШИК-реакция с докраской альциановым синим для изучения ГАГ (кислых мукополисахаридов). При изучении гистологических срезов проводили полуколиче-ственную оценку состояния клеточных элементов (гладкие миоциты, эндотелиоциты), волокон (эластических, коллагеновых), ГАГ в стенке ВГА (+слабая реакция, ++умеренная реакция, +++выраженная реакция).
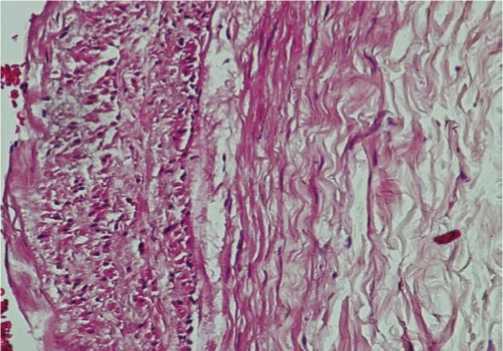
Рис. 1. В ВГА – субинтимально отмечается очаговая гиперплазия гладких миоцитов. В средней оболочке – резковыраженный отек с образованием одиночных кистозных полостей. Окраска гематоксилином - эозином. Ув. х 100
Результаты и обсуждение
Гистологическое исследование стенки ВГА выявило следующие изменения. На всем протяжении строение слоев ВГА было сохранено. В интиме артерии внутренняя эластическая мембрана была извитой, подчеркнутой, с участками ее набухания.
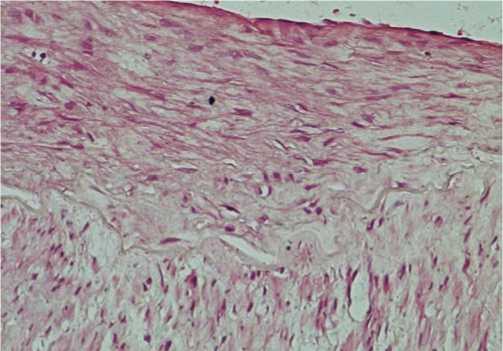
Рис. 2. Утолщение интимы (интимальная гиперплазия) за счет пролиферации веретеновидных гладких миоцитов. Окраска гематоксилином - эозином. Ув. х 100
Субинтимально, под внутренней эластической мембраной отмечалась очаговая гиперплазия гладких миоцитов, имеющих преимущественно веретеновидную форму. В средней оболочке ВГА наблюдался отек волокнистых структур с образованием отдельных кистозных образований, в которых отсутствовали волокнистые структуры (рис. 1).
На ограниченном протяжении в интиме ВГА отмечалась интимальная гиперплазия, представленная пролиферацией веретеновидных ГМ (рис. 2).
В окраске по Маллори в медии эластические волокна были сохранены, продольно ориентированы, умеренно набухшие. Гладкие миоциты имели веретеновидную форму, располагались параллельно эластическим волокнам. На ограниченном протяжении отмечалась очаговая гиперплазия веретеновидных гладких миоцитов, расположенных хаотично.
Эластические волокна стенки ВГА преимущественно были сохранены, внутренняя эластическая мембрана была извитой, резко подчеркнутой при окраске на эластику (рис. 3).
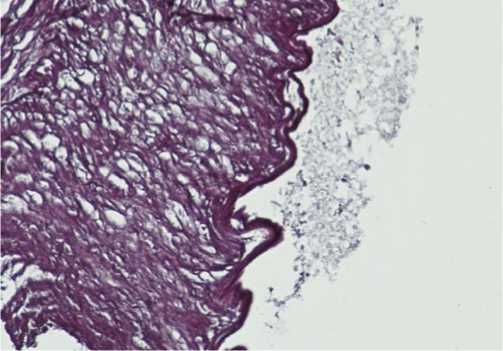
Рис. 3. Внутренняя эластическая мембрана ВГА сохранена, извитая, количество эластических волокон в стенке умеренное. Окраска на эластику. Ув. х 100
При выявлении ГАГ, кислых МПС обращало внимание, что в зонах интимальной гиперплазии вокруг веретеновидных ГМ отмечалось скопление кислых МПС. Внутренняя эластическая мембрана была извитой, хорошо подчеркнутой. В медии ВГА имелась гиперплазия эпителиоидных ГМ, окруженных скоплением кислых МПС (рис. 4).
Интересно отметить, что скопления кислых МПС отмечались не только в зонах интимальной гиперплазии ВГА, но и в субинтимальных ее отделах, средней оболочке по типу мелких «озер слизи» (рис. 5).
По мере накопления кислых МПС (ШИК+ реакция) в средней оболочке артерии гладкие миоциты подвергались дистрофическим изменениям, отмечались очаги гипоэ-ластоза вплоть до очагового исчезновения эластических волокон с развитием в этих зонах тонких коллагеновых волокон.

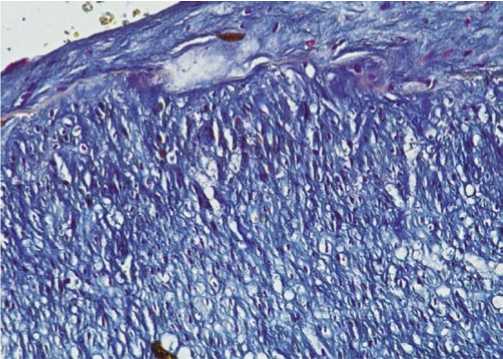
Рис. 4. В зоне интимальной гиперплазии отмечается неравномерное скопление кислых мукополисахаридов (МПС). Внутренняя эластическая мембрана извитая, хорошо подчеркнутая. В медии – гиперплазия эпителиоидных гладких миоцитов, неравномерное скопление кислых МПС. ШИК-реакция с докраской альциановым синим. Ув. х 100
Адвентициальная оболочка ВГА была представлена тонкими коллагеновыми волокнами, ориентированными в продольном направлении, с признаками отека, разволокнения. Vasa vasorum имели обычное строение, были тонкостенные, без признаков патологических изменений.
Полученные нами данные о морфологических, гистохимических изменениях стенки ВГА указывают на различное морфо-функциональное состояние гладких миоцитов (веретеновидные, эпителиодные ГМ), что подтверждается неравномерным накоплением кислых МПС преимущественно в средней оболочке.
По-видимому, ГМ являются крайне нестабильной клеточной структурой, способной находиться в состоянии сокращения, секреции ГАГ, которые, в свою очередь, могут способствовать активации отдельных групп ГМ с развитием гиперплазии клеток. Можно предположить, что гиперплазия ГМ возникает в связи с воздействием отдельных протеогликанов, ГАГ, что согласуется с данными литературы [1]. Кроме того, в отдельных работах показано, что в стенках ВГА может встречаться врожденная аномалия в виде фиброзно-мышечной дисплазии [2].
Вероятно, описанные нами патологические изменения могут быть обусловлены нарушением клеточномежклеточных взаимодействий в стенке ВГА. С одной стороны, секреция ГМ ГАГ может способствовать очаговой пролиферации ГМ не только в средней, но и во внутренней оболочке артерии, что служит основой возникновения интимальной гиперплазии. С другой стороны, по мере накопления ГАГ в средней оболочке ВГА происходит диском-плексация клеточно-волокнистых структур со скоплением между ГМ кислых МПС, которые, в свою очередь, могут активизировать активность ГМ и появление различных их функциональных типов (секреторные, контрактильные).
Таким образом, проведенное морфо-гистохимическое исследование трансплантатов ВГА выявило сво-
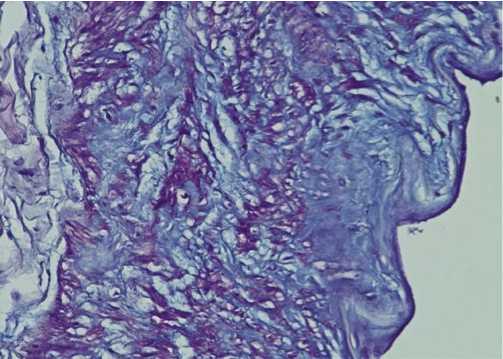
Рис. 5. Неравномерное накопление кислых МПС в интиме, медии с очаговой гиперплазией эпителиоидных гладких миоцитов ВГА. ШИК-реакция с докраской альциановым синим. Ув. х 200
еобразные состояния различных типов ГМ в медии и интиме, неравномерное накопление ГАГ в стенках ВГА, что может служить основой возникновения интимальной гиперплазии артерии.
Полученные данные могут помочь обосновать применение таргетных терапевтических препаратов, направленных на ингибирование активности и пролиферации ГМ, что позволит предупредить возникновение рестенозов после оперативных вмешательств на коронарных сосудах.
Список литературы Роль клеточно-межклеточных взаимоотношений в развитии интимальной гиперплазии внутренней грудной артерии
- Тодоров С.С. Патоморфологические изменения аорты при врожденных заболеваниях сердечно-сосудистой системы у детей первого полугодия жизни. Дис. д-ра мед.наук. Новосибирск, 2011.
- Мурадов М.М., Молочков А.В., Иванова А.Г. и др./Особенности морфологии внутренней грудной артерии у пациентов с ИБС разных возрастных групп//Вестник национального медико-хирургического центра им. Н.И. Пирогова. -2015. -№4. -С. 13-18.
- Nakamura R., Nakamura F., Fukunaga S. Perlecan diverselyregulates the migration and proliferation of distinct cell types in vitro//Cells Tissues Organs. 2015; 200(6): 374-93 DOI: 10.1159/000440950
- Owens G., Kumar M., Wamhoff B. Molecular regulation of vascular smooth cell differention in development and disease//Physiol. Rev. -2004. -V.84. -P. 767-801.
- Sadowitz B., Seymour K., Gahtan V. et al. The role of hyaluronic acid in atherosclerosis and intimal hyperplasia//J. Surg. Res. -2012. -173(2): e63-72.
- Sartore S., Chiavegato A., Faggin E. et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant//Circ. Res. -2001. -Vol.89. -P.1111-1121.
- Segev A., Nili N., Strauss B. The role of perlecan in arterial injury and angiogenesis//Cardiovasc. Res. -2004. -Vol. 63. -P. 603-610.
- Sengbush J., He W., Pinco K. et al. Dual functions of a4b1 integrin on in epicar-dial development: initial migration and long-term attachment//J. Cell Biol. -2002. -Vol.157. -P.873-882.
- Waldo K.L., Hutson M.R., Ward C.C. et al. Secondary heart field contributes myocardium and smooth muscle to the arterial pole of the developing heart//Dev. Biol. -2005. -Vol.281. -P.78-90.
- Wight T.N., Merillees M. Proteoglycans in atherosclerosis and restenosis: key roles for versican//Circ. Res. -2004. -Vol. 94. -P. 1158-1167.


