Роль компьютерной томографии в диагностике саркопении
Автор: Шеберова Е.В., Силантьева Н.К., Агабабян Т.А., Потапов А.Л., Невольских А.А., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Цель исследования - обобщение имеющихся данных о значимости компьютерной томографии для выявления саркопении в клинической практике, в частности у онкологических больных. материал и методы. Поиск соответствующих источников производился в системах Medline, Scopus, Pubmed, Elibrary, включались публикации с 2008 по 2022 г. Найдено более 100 зарубежных и российских публикаций, из которых 45 источников включены в данный литературный обзор. Результаты. Согласно Европейскому консенсусу, под саркопенией понимают сложный клинический синдром, который включает в себя уменьшение мышечной массы тела, снижение функций мышц. В основе саркопении лежит комплекс возрастных и нейрогуморальных изменений, нарушение питания. Трудно переоценить значение саркопении, так как она является одним из пяти основных факторов риска заболеваемости и смертности людей старше 65 лет. Саркопения часто встречается при воспалительных заболеваниях, злокачественных новообразованиях, при органной недостаточности. По мнению большинства исследователей, золотой стандарт неинвазивного определения количества мышц - это КТ, которая является достоверным методом количественного анализа, что показано в работе, основанной на сравнении количественной оценки по данным КТ различных групп мышц с объемом мышц, измеренных на трупных тканях. Анализ литературы показал, что саркопения является важной клинической проблемой современной онкологии. Ее наличие негативным образом влияет на прогноз заболевания и качество жизни пациентов. В основе развития данного патологического состояния лежат изменения метаболизма, обусловленные влиянием опухоли и проводимого лечения, в результате чего деградация мышечного белка начинает преобладать над его синтезом. Заключение. Учитывая большую распространенность и прогностическую значимость саркопении в онкологии, становится очевидной необходимость ее ранней диагностики и последующего лечения. Использование данных рутинных КТ-исследований, проводимых в повседневной практике для диагностики саркопении, позволит найти возможные причины, определить вероятность рисков и тактику лечения на раннем этапе, когда терапия может быть наиболее эффективной.
Саркопения, кт-саркометрия, компьютерная томография, лучевая диагностика, онкология, осложнения в онкологии, прогноз в онкологии
Короткий адрес: https://sciup.org/140300173
IDR: 140300173 | УДК: 616.74-007.23-073.756.8 | DOI: 10.21294/1814-4861-2023-22-3-125-133
Текст научной статьи Роль компьютерной томографии в диагностике саркопении
Согласно Европейскому консенсусу, под сарко-пенией понимают сложный клинический синдром, который включает в себя уменьшение мышечной массы тела, снижение функции и силы мышц. В основе этого сложного клинического синдрома лежит комплекс возрастных и нейрогуморальных изменений, нарушение питания [1, 2]. Трудно переоценить значение саркопении, так как этот синдром является одним из пяти основных факторов риска заболеваемости и смертности людей старше 65 лет [3]. Саркопения часто встречается при воспалительных заболеваниях, злокачественных новообразованиях или при органной недостаточности [4].
В настоящее время для оценки саркопении и ее подтверждения используют такие диагности- ческие методы, как ультразвуковая диагностика (УЗИ), магнитно-резонансная томография (МРТ), компьютерная томография (КТ), двухэнергетическая рентгеновская абсорбциометрия (ДРА) [1]. По мнению большинства исследователей, золотым стандартом неинвазивного определения количества мышц является КТ [4–6], которая точно отражает реальное распределение мышц в теле человека и является достоверным методом для количественного анализа, что было показано в работе, основанной на сравнении КТ-данных количественной оценки различных групп мышц с объемом мышц, измеренных на трупных тканях [7].
Цель исследования ‒ оценка значимости компьютерной томографии для выявления саркопении в клинической практике, в частности у онкологических больных.
КТ – инструмент саркометрии
Согласно классификации, принятой в 2018 г. Европейской рабочей группой по саркопении у пожилых людей (EWGSOP2) (Европейский консенсус), саркопении подразделяются на следующие категории:
-
1. «Первичная» – саркопения, которая связана с возрастом и отсутствует какая-либо иная ее причина.
-
2. «Вторичная» – случаи, когда есть факторы кроме старения или в сочетании со старением.
-
3. «Острые» саркопении – процесс длительностью менее 6 мес.
-
4. «Хронические» саркопении – длительностью 6 и более мес.
Выделяют особое состояние – «саркопени-ческое» ожирение, при котором наблюдается снижение мышечной массы тела при условии избыточного веса [4].
При диагностике саркопении следует учитывать цели и задачи такого анализа. Так, в соответствии с новыми рекомендациями EWGSOP2, в клинической практике при скрининге наиболее уместно использовать недорогой и эффективный метод – SARC-F-опросник для пациентов с предполагаемой саркопенией [4]. При уточняющей диагностике или подтверждении данных, полученных в процессе скрининга, или по результатам клинических данных наиболее точный и достоверный метод – компьютерная томография.
Выбор КТ для оценки состояния мышечной массы у онкологических больных логически вытекает из того, что КТ – стандарт предоперационного обследования этой категории больных и дальнейшего динамического наблюдения за их состоянием [8]. Как у здоровых, так и у онкологических больных показана надежная корреляция площади мышечной и жировой ткани на уровне поясничных позвонков, измеренной при КТ, с общим объемом скелетной мускулатуры и жировой клетчатки всего тела [9–11]. Хотя В.Л. Масенко и соавт. полагают, что среди наиболее распространенных визуализа-ционных методик выявления и оценки саркопении, таких как ДРА, КТ, МРТ и УЗИ, сложно выделить определенный золотой стандарт в силу особенностей их использования и имеющихся ограничений, в обзоре авторы дали подробную характеристику каждого из этих методов, считая одним из главных преимуществ КТ возможность оценки изменения плотности мышц, которая линейно зависит от количества жировой ткани в мышцах [1].
В настоящее время КТ является обязательным методом для планового предоперационного обследования, что имеет большое значение, так как позволяет с большой точностью выявить изменения в мышечной массе больного [12]. Результаты КТ, полученные на дооперационном этапе обследования, можно использовать для выявления саркопении, то есть такой анализ не требует проведения дополнительных исследований или, что очень важно, не увеличивает лучевую нагрузку [13].
Методика КТ заключается в изучении данных, полученных на уровне третьего поясничного позвонка (LIII) (рис. 1) [2]. Анализ данных КТ включает в себя определение следующих показателей:
-
‒ SMA (Skeletal Muscle Area, см2) – площадь поперечного сечения скелетных мышц на уровне третьего поясничного позвонка (LIII);
-
‒ SMI (Skeletal Muscle Index, см2/м2) – площадь поперечного сечения на уровне третьего поясничного позвонка (LIII) с поправкой на квадрат роста [= SMA (см2)/высота2 (м2)].
-
‒ MRA (Mean Attenuation, ед.H) ‒ усредненный коэффициент затухания выбранных пикселей (ден-ситометрическая плотность).
В настоящее время для оценки саркопении при КТ чаще всего используется методика измерения площади поперечного сечения поясничной мышцы с поправкой на квадрат роста на уровне LIII (SMI) [1, 2, 14–16]. Большинство авторов считают пороговым значением SMI, ниже которого состояние мышечной ткани расценивается как саркопения,
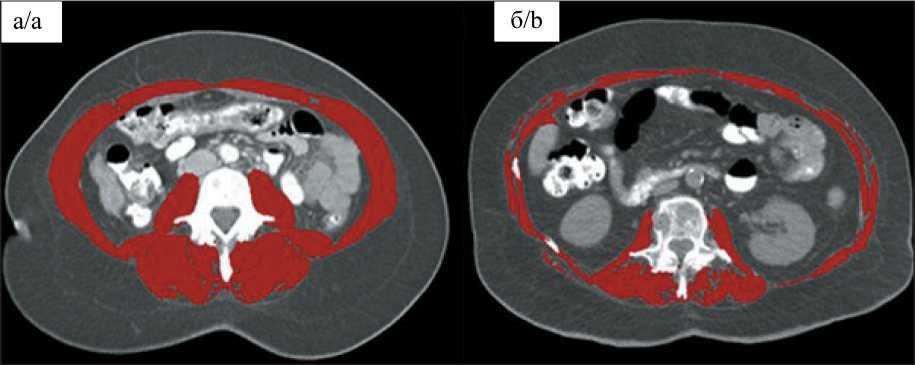
Рис. 1. Нормальная мышечная масса (а) и саркопения у онкологического пациента (б).
ИМТ (индекс массы тела) в обоих случаях – 26 кг/м2
Fig. 1. Normal muscle mass (a) and sarcopenia in a cancer patient (b). BMI (body mass index) in both cases 26 kg/m2
Таблица /table sMi в норме, по данным разных авторов
Healthy reference values for sMi according to different authors
|
Авторы (год)/ Authors (year) |
Показатели SMI у женщин, см2/м2/ Healthy reference values for SMI in females, cm2/m2 |
Показатели SMI у мужчин, см2/м2/ Healthy reference values for SMI in males, cm2/m2 |
|
В.Л. Масенко и соавт./ V.L. Masenko et al. (2019) [1]; Y. Kawaguchi et al. (2019) [15]; J.S. Lee et al. (2018) [16]; K. Jones et al. (2020) [17] |
38,5 |
52,4 |
|
F. Ufuk et al. (2019) [2] |
39–41 |
52–55 |
|
S.-K. Hung et al. (2021) [18] |
38,9 |
55,4 |
52,4 см2/м2 для мужчин и 38,5 см2/м2 для женщин [1, 14– 16]. Ряд исследователей использует в качестве пороговых значений SMI менее 55,4 см2/м2 для мужчин и менее 38,9 см2/м2 для женщин [17]. Проведенный в 2019 г. метаанализ показал, что наиболее распространенные ключевые значения SMI для определения мышечной массы при обследовании на КТ составляют от 52 до 55 см2/м2 для мужчин и от 39 до 41 см2/м2 для женщин [2] (таблица).
Некоторые авторы считают, что поясничная мышца не является репрезентативной для оценки общей саркопении [4], тогда как другие исследователи утверждают, что имеется корреляция между показателем, основанным на измерении поясничной мышцы, и общей массой скелетной мускулатуры и это является предиктором летального исхода для определенной группы больных [3]. Ряд исследователей считает, что лучше использовать методики анализа саркопении, основанные на оценке мышц средней трети бедра, голени и предплечья [4, 18, 19], однако велика вариабельность между пациентами, кроме того, в настоящее время при использовании данной методики нет единых пороговых значений и стандартов исследования.
A. Brian et al. показали, что при невозможности определения индекса скелетных мышц на уровне третьего поясничного позвонка допустимо использование таких уровней позвонков, как: II поясничный, IV поясничный, V поясничный, I поясничный, XII грудной, XI грудной и X грудной [20]. Значимость показателей, по мнению авторов, снижается именно в такой последовательности ‒ от LII до ThX. U. Furkan et al. установили прямую зависимость индекса скелетных мышц на уровне третьего поясничного позвонка (LIIIMI) и второго (CIIMI), третьего (CIIIMI) и четвертого (CIVMI) шейных позвонков, поэтому данный метод можно назвать альтернативным для диагностики саркопе-нии у пациентов с онкологическими заболеваниями области головы и шеи [2].
Исследования, выполненные при изучении сар-копении, показали ее влияние на течение многих заболеваний. Распространенность саркопении, выявленной при КТ, составляет от 15 до 50 % у паци- ентов с онкологическими заболеваниями, от 30 до 45 % у больных с печеночной недостаточностью и от 60 до 70 % у пациентов в критическом состоянии в отделении интенсивной терапии [21]. У тяжелых больных, находящихся на ИВЛ, низкая площадь скелетных мышц, выявленная при КТ-саркометрии на ранней стадии, является фактором риска смерти независимо от пола и данных шкалы APACHE II [22]. Выявлено, что 90-дневная летальность при абсцессе селезенки у пациентов с саркопенией была значительно выше, чем у пациентов без саркопении [17]. J. Bunzel et al. в cистематическом обзоре и метаанализе продемонстрировали значимость показателя SMI для оценки прогноза осложнений, в том числе летальных, у пациентов, перенесших оперативные вмешательства на органах брюшной полости [23]. O. Diogo et al. показали, что пациенты с саркопени-ей имели более низкую 30-дневную выживаемость по сравнению с группой больных без саркопении, а также наличие саркопении было связано с более высокой распространенностью осложнений, в том числе инфекционных, и с летальным исходом [24].
Саркопения – прогностический фактор исходов у онкологических пациентов
Прогрессирующая малнутриция – неизбежный спутник онкологического заболевания. Снижение аппетита и общая слабость являются наиболее ранними и частыми симптомами рака, у 20–25 % пациентов ведущим фактором летальности на финальной стадии онкологического процесса становится рефрактерная кахексия. В настоящее время убедительно доказано, что нутритивная недостаточность (НН) ухудшает функциональный статус и качество жизни пациентов, переносимость специфического лечения, общую и канцерспеци-фическую выживаемость [26]. Для оценки риска и выраженности НН используется ряд шкал (NRS-2002, SGA, MUST, ESMO и др.), в основу которых положены количество и качество потребляемой пищи, антропометрические и лабораторные данные. Основными антропометрическими показателями являются индекс массы тела (ИМТ), величина и скорость снижения веса, которые коррелируют с выживаемостью онкологических пациентов [27].
В последние годы в литературе появляется все больше данных, свидетельствующих о том, что существенное прогностическое значение имеет не только факт снижения общей массы тела, но и изменения ее компонентного состава. Саркопения – это и есть прогрессирующее генерализованное снижение тощей массы за счет мышечного компонента. У пациентов с ожирением может наблюдаться ситуация, когда ИМТ повышен, но мышечная масса снижена, – так называемое сарко-пеническое ожирение [28]. Развитие саркопении в большей мере характерно для солидных опухолей, в первую очередь головы, шеи и верхних отделов желудочно-кишечного тракта, при которых частота встречаемости данного синдрома может достигать 70 %.
Несмотря на то, что потеря мышечной массы является составной частью синдрома анорексии-кахексии онкологического пациента, саркопения может быть единственным и наиболее ранним проявлением НН при злокачественном новообразовании без потери жировой ткани, анемии и общей астенизации. В ее основе лежит ряд молекулярных механизмов, нарушающих баланс синтеза/ деградации мышечного белка [31]. Медиаторы воспаления (IL-1, TNF-α), миостатин и фактор, стимулирующий протеолиз (PIF), вырабатываемые опухолью и иммунными клетками организма, активируют ряд внутриклеточных сигнальных механизмов, способствующих усилению убиквитин-протеасомной и каспазной деградации мышечного белка. Эти же механизмы ответственны за развитие митохондриальной дисфункции, проявляющейся одновременным повышением основного обмена и снижением синтеза АТФ, в результате чего усугубляется энергетический дисбаланс. Снижение концентрации инсулиноподобного фактора роста (IGF-1) приводит к замедлению белкового синтеза. Наконец, сама опухоль активно конкурирует за пул свободных аминокислот, в первую очередь глутамина, который необходим для синтеза мышечных волокон [8].
Проведение специального лечения в онкологии может сопровождаться усугублением саркопении, что может быть связано с развитием побочных эффектов химио- и лучевой терапии (диарея, мукозит), а также со стрессовой реакцией и невозможностью пациентов адекватно питаться в послеоперацион- ном периоде. Интересным является тот факт, что некоторые препараты для лекарственного лечения опухолей сами по себе провоцируют снижение мышечной массы. Подобный эффект описан для некоторых химиотерапевтических (таксаны, цисплатин, доксорубицин, этопозид, FOLFIRI) и таргетных (сорафениб, эверолимус) препаратов [32]. Механизм саркопении, индуцированной лекарственным лечением, до конца не изучен, но в его основе лежит активация тех же внутриклеточных сигнальных путей, нарушающих баланс синтеза/ деградации мышечного белка [33].
P. Begini et al. при многофакторном анализе установили, что у больных с циррозом печени и гепатоцеллюлярным раком с наличием саркопении наблюдалось снижение общей выживаемости. Авторы предложили ввести в повседневную практику измерение показателей саркопении у данной категории больных при КТ-исследованиях [34]. По данным немецких исследователей, у больных раком легких саркопения является фактором плохого прогноза независимо от стадии процесса, поскольку у них отмечено увеличение количества послеоперационных осложнений, большая токсичность и меньшая реакция на химиотерапию [14, 17]. N. Jennifer et al. в метаанализе показали, что у пациентов с саркопенией, оперированных по поводу рака легкого, наблюдались увеличение послеоперационных осложнений, а также уменьшение предполагаемой продолжительности жизни по сравнению с аналогичной группой больных без саркопении [35]. В.К. Лядов и соавт. в 2012 г. доказали, что у больных раком поджелудочной железы высока частота саркопении (у 70 %); отсутствует связь между ИМТ и наличием саркопении; послеоперационная летальность отмечена лишь у больных с сопутствующей саркопенией. Авторы сделали вывод о возможном прогностическом значении феномена саркопении в этой группе больных [13].
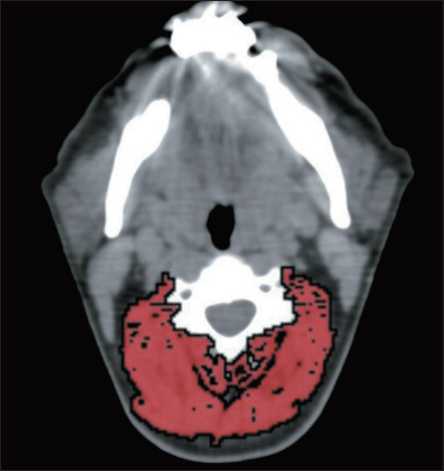
Рис. 2. Измерение массы скелетных мышц на уровне CIII Fig. 2. Measurement of skeletal muscle mass at the level of the CIII vertebrae худшей выживаемости при химиотерапии [25]. В публикации, посвященной анализу токсичности химиотерапии у больных с метастатическим раком молочной железы, отмечено, что токсическое влияние препаратов было выше у пациенток с сопутствующей саркопенией [37].
Многочисленные исследования доказали, что саркопения является фактором, влияющим на продолжительность жизни пациентов с поздними стадиями рака легкого и опухолями желудочнокишечного тракта. V.E. Baracos et al. по данным КТ выявили саркопению у 47 % больных с III–IV стадиями немелкоклеточного рака легкого, при этом не отмечено зависимости от исходного ИМТ. Также показано, что саркопения слабо коррелирует с площадью тела больного. Именно площадь тела больного в настоящее время служит для подсчета дозировки большинства цитостатиков. С этим связано мнение ряда авторов о том, что показатель саркопении SMI может быть более точным прогностическим фактором токсичности, так как распределение химиопрепаратов и связанная с ними токсичность обусловлены преимущественно безжировой массой тела [38, 39].
У пациентов с опухолями головы и шеи выявлена хорошая корреляция (r=0,891) площади по- перечного сечения мышц на уровне СIII (рис. 2) и LIII [40]. Эти данные позволяют использовать сегментацию массы скелетных мышц на этом уровне у больных с опухолями головы и шеи. Выявление саркопении у этой категории больных чрезвычайно важно. С чем это связано? Анализ литературы показывает, что у пациентов с опухолями головы и шеи с саркопенией чаще возникает токсичность при химио- и химиолучевой терапии на основе цисплатина, что приводит к частым перерывам в лечении и снижению дозировок цитостатиков [41]. Саркопения также является прогностическим фактором послеоперационных осложнений у данных больных [41–44]. Кроме того, доказано снижение общей и безрецидивной выживаемости у пациентов с опухолями головы и шеи [45].
Таким образом, саркопения является фактором риска смерти, предиктором худшего ответа на химиотерапию и повышения ее токсичности, увеличения частоты послеоперационных осложнений.
Заключение
Саркопения является важной клинической проблемой современной онкологии. Ее наличие негативным образом влияет на прогноз заболевания и качество жизни пациентов. В основе развития данного патологического состояния лежат изменения метаболизма, обусловленные влиянием опухоли и проводимого лечения, в результате чего деградация мышечного белка начинает преобладать над его синтезом. Учитывая большую распространенность и прогностическую значимость саркопении в онкологии, становится очевидной необходимость ее ранней диагностики и последующего лечения. Использование данных рутинных КТ-исследований для диагностики саркопении позволит провести поиск возможных ее причин и оптимизировать терапию, определить вероятность рисков и стратегию лечения на раннем этапе, когда оно может быть наиболее эффективным. Определение саркопении при помощи расчета SMI по данным КТ у пациентов онкологического и хирургического профиля является неотъемлемой частью диагностического поиска, определяющего ход лечения и течение основного заболевания, а своевременное определение наличия саркопении может способствовать лучшему прогнозу лечения и увеличению продолжительности жизни у пациентов со снижением мышечной массы.
Список литературы Роль компьютерной томографии в диагностике саркопении
- Masenko V.L., Kokov A.N., Grigor'eva I.I., Krivoshapova K.E. Luchevye metody diagnostiki sarkopenii. Issledovaniya i praktika v meditsine 2019; 6(4): 127-37. https://doi.org/10.17709/2409-2231-2019-6-4-13.
- Ufuk F, HerekD., YukselD. Diagnosis of Sarcopenia in Head and Neck Computed Tomography: Cervical Muscle Massasa Strong Indicator of Sarcopenia. Clin Exp Otorhinolaryngol. 2019; 12(3): 317-24. https://doi.org/10.21053/ceo.2018.01613.
- Grigor'eva I.I., Raskina T.A., Letaeva M.V., Malyshenko O.S., Averkieva Yu.V., Masenko L.V., Kokov A.N. Sarkopeniya: osobennosti patogeneza i diagnostiki. Fundamental'naya i klinicheskaya meditsina. 2019; 4(4): 105-16. https://doi.org/10.23946/2500-0764-2019-4-4-105-116.
- Cruz-Jentoft A.J., Bahat G., Bauer J., Boirie Y., Bruyere O., Cederholm T., Cooper C., Landi F., Rolland Y., Sayer A.A., Schneider S.M., Sieber C.C., Topinkova E., Vandewoude M., Visser M., Zamboni M.; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019; 48(1): 16-31. https://doi.org/10.1093/ageing/afy169. Erratum in: Age Ageing. 2019; 48(4): 601.
- Kukosh M.Yu., Ter-Ovanesov M.D. Sarkopeniya v praktike onkologa. Meditsinskii alfavit. 2018; 1(15): 37-43.
- Beaudart C., McCloskey E., Bruyere O., CesariM., Rolland Y., Rizzoli R., Araujo de Carvalho I., Amuthavalli Thiyagarajan J., Bautmans I., Bertiere M.C., Brandi M.L., Al-Daghri N.M., Burlet N., Cavalier E., Cerreta F., Cherubini A., Fielding R., Gielen E., Landi F., Petermans J., Reginster J.Y., Visser M., Kanis J., Cooper C. Sarcopenia in daily practice: assessment and management. BMC Geriatr. 2016; 16(1): 170. https://doi.org/10.1186/s12877-016-0349-4.
- Mitsiopoulos N., Baumgartner R.N., Heymsfield S.B., Lyons W., Gallagher D., Ross R. Cadaver validation of skeletal muscle measurement by magnetic resonance imaging and computerized tomography. J Appl Physiol (1985). 1998; 85(1): 115-22. https://doi.org/10.1152/jappl.1998.85.1.115.
- Leiderman I.N., Gritsan A.I., Zabolotskikh I.B., Mazurok V.A., Polyakov I.V., Potapov A.L., Sytov A.V., Yaroshetskii A.I. Perioperatsionnaya nutritivnaya podderzhka. Metodicheskie rekomendatsii Federatsii anesteziologov i reanimatologov. Vestnik intensivnoi terapii imeni A.I. Saltanova. 2021; 4: 7-20. https://doi.org/10.21320/1818-474X-2021-4-7-20.
- Shen W., Punyanitya M., Wang Z., Gallagher D., St-Onge M.P., Albu J., Heymsfield S.B., Heshka S. Visceral adipose tissue: relations between single-slice areas and total volume. Am J Clin Nutr. 2004; 80(2): 271-8. https://doi.org/10.1093/ajcn/80.2.271.
- Shen W., Punyanitya M., Wang Z., Gallagher D., St-Onge M.P., Albu J., Heymsfield S.B., Heshka S. Total body skeletal muscle and adipose tissue volumes: estimation from a single abdominal cross-sectional image. J Appl Physiol (1985). 2004; 97(6): 2333-8. https://doi.org/10.1152/japplphysiol.00744.2004.
- Mourtzakis M., Prado C.M., Lieffers J.R., Reiman T., McCargar L.J., Baracos V.E. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab. 2008; 33(5): 997-1006. https://doi.org/10.1139/H08-075.
- Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M., Rubinstein L., Shankar L., Dodd L., Kaplan R., Lacombe D., Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009; 45(2): 228-47. https://doi.org/10.1016/j.ejca.2008.10.026.
- Lyadov V.K., Bulanova E.A., Sinitsyn V.E. Vozmozhnosti KT pri vyyavlenii sarkopenii u bol'nykh s opukholevymi i vospalitel'nymi zabolevaniyami podzheludochnoi zhelezy. Diagnosticheskaya i interventsionnaya radiologiya, 2012; 6(1): 13-8. https://doi.org/10.25512/DIR.2012.06.1.03.
- Kawaguchi Y., Hanaoka J., Ohshio Y., Okamoto K., Kaku R., Hayashi K., Shiratori T., Yoden M. Sarcopenia predicts poor postoperative outcome in elderly patients with lung cancer. Gen Thorac Cardiovasc Surg. 2019; 67(11): 949-54. https://doi.org/10.1007/s11748-019-01125-3.
- Lee J.S., Kim Y.S., Kim E.Y., Jin W. Prognostic significance of CT-determined sarcopenia in patients with advanced gastric cancer. PLoS One. 2018; 13(8). https://doi.org/10.1371/journal.pone.0202700.
- Jones K., Gordon-Weeks A., Coleman C., Silva M. Radiologically Determined Sarcopenia Predicts Morbidity and Mortality Following Abdominal Surgery: A Systematic Review and Meta-Analysis. World J Surg. 2017; 41(9): 2266-79. https://doi.org/10.1007/s00268-017-3999-2.
- Hung S.K., Kou H.W., Hsu K.H., Wu C.T., Lee C.W., Leonard Goh Z.N., Seak C.K., Chen-Yeen Seak J., Liu Y.T., Seak C.J.; SPOT investigators. Sarcopenia is a useful risk stratification tool to prognosticate splenic abscess patients in the emergency department. J Formos Med Assoc. 2021; 120(3): 997-1004. https://doi.org/10.1016/j.jfma.2020.08.039.
- Yokota F., Otake Y., Taka M., Ogawa T., Okada T., Sugano N., Sato Y. Automated muscle segmentation from CT images of the hip and thigh using a hierarchical multi-atlas method. Int J Comp Assis Radiol Surg. 2021; 120(3): 997-1004. https://doi.org/10.1007/s11548-018-1758-y.
- Erlandson M.C., Lorbergs A.L., Mathur S., Cheung A.M. Muscle analysis using pQCT, DXA and MRI. Eur J Radiol. 2016; 85(8): 1505-11. https://doi.org/10.1016/j.ejrad.2016.03.001.
- Derstine B.A., Holcombe S.A., Ross B.E., Wang N.C., Su G.L., Wang S.C. Skeletal muscle cutoff values for sarcopenia diagnosis using T10 to L5 measurements in a healthy US population. Sci Rep. 2018; 8(1): 11369. https://doi.org/10.1038/s41598-018-29825-5.
- Peterson S.J., Braunschweig C.A. Prevalence of Sarcopenia and Associated Outcomes in the Clinical Setting. Nutr Clin Pract. 2016; 31(1): 40-8. https://doi.org/10.1177/0884533615622537.
- Weijs P.J., Looijaard W.G., Dekker I.M., Stapel S.N., Girbes A.R., Oudemans-van Straaten H.M., Beishuizen A. Low skeletal muscle area is a risk factor for mortality in mechanically ventilated critically ill patients. Crit Care. 2014; 18(2): 12. https://doi.org/10.1186/cc13189.
- Buenizel J., Heinz J., Bleckmann A., Bauer C., Rover C., Bohnen-berger H., Saha S., Hinterthaner M., Baraki H., Kutschka I., Emmert A. Sarcopenia as Prognostic Factor in Lung Cancer Patients: A Systematic Review and Meta-analysis. Anticancer Res. 2019; 39(9): 4603-12. https://doi.org/10.21873/anticanres.13640.
- Toledo D.O., Carvalho A.M., Oliveira A.M.R.R., Toloi J.M., Silva A.C., Francisco de Mattos Farah J., Prado C.M., Silva J.M. Jr. The use of computed tomography images as a prognostic marker in critically ill cancer patients. Clin Nutr ESPEN. 2018; 25: 114-20. https://doi.org/10.1016/j.clnesp.2018.03.122.
- Weerink L.B.M., van der Hoorn A., van Leeuwen B.L., de Bock G.H. Low skeletal muscle mass and postoperative morbidity in surgical oncology: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2020; 11(3): 636-49. https://doi.org/10.1002/jcsm.12529.
- Arends J., Bachmann P., Baracos V., Barthelemy N., Bertz H., Bozzeiii F, Fearon K., Hunerer E., Isenring E., Kaasa S., Krznaric Z., LairdB., LarssonM., LavianoA., Muhlebach S., MuscarnoliM., OldervollL., Ravasco P., Solheim T., Strasser F., de van der Schueren M., Preiser J.C. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017; 36(1): 11-48. https://doi.org/10.1016/j.clnu.2016.07.015.
- Martin L., Senesse P., Gioulbasanis I., Antoun S., Bozzetti F., Deans C., Strasser F., Thoresen L., Jagoe R.T., Chasen M., Lundholm K., Bosaeus I., Fearon K.H., Baracos V.E. Diagnostic criteria for the classification of cancer-associated weight loss. J Clin Oncol. 2015; 33(1): 90-9. https://doi.org/10.1200/JCO.2014.56.1894. Erratum in: J Clin Oncol. 2015; 33(7): 814.
- Prado C.M., Cushen S.J., Orsso C.E., Ryan A.M. Sarcopenia and cachexia in the era of obesity: clinical and nutritional impact. Proc Nutr Soc. 2016; 75(2): 188-98. https://doi.org/10.1017/S0029665115004279.
- Kuwada K., Kuroda S., Kikuchi S., Yoshida R., Nishizaki M., Kagawa S., Fujiwara T. Clinical Impact of Sarcopenia on Gastric Cancer. Anticancer Res. 2019; 39(5): 2241-9. https://doi.org/10.21873/anticanres.13340.
- Shachar S.S., Williams G.R., Muss H.B., Nishijima T.F. Prognostic value of sarcopenia in adults with solid tumours: A meta-analysis and systematic review. Eur J Cancer. 2016; 57: 58-67. https://doi.org/10.1016/j.ejca.2015.12.030.
- Peixoto da Silva S., Santos J.M.O., Costa E Silva M.P., Gil da Costa R.M., Medeiros R. Cancer cachexia and its pathophysiology: links with sarcopenia, anorexia and asthenia. J Cachexia Sarcopenia Muscle. 2020; 11(3): 619-35. https://doi.org/10.1002/jcsm.12528.
- Bozzetti F. Chemotherapy-Induced Sarcopenia. Curr Treat Options Oncol. 2020; 21(1): 7. https://doi.org/10.1007/s11864-019-0691-9.
- Bruggeman A.R., Kamal A.H., LeBlanc T.W., Ma J.D., Baracos V.E., Roeland E.J. Cancer Cachexia: Beyond Weight Loss. J Oncol Pract. 2016; 12(11): 1163-71. https://doi.org/10.1200/JOP.2016.016832.
- Begini P., Gigante E., Antonelli G., Carbonetti F., Iannicelli E., Anania G., Imperatrice B., Pellicelli A.M., Fave G.D., Marignani M. Sarcopenia predicts reduced survival in patients with hepatocellular carcinoma at first diagnosis. Ann Hepatol. 2017; 16(1): 107-14. https://doi.org/10.5604/16652681.1226821.
- Nishimura J.M., Ansari A.Z., D'Souza D.M., Moffatt-Bruce S.D., Merritt R.E., Kneuertz P.J. Computed Tomography-Assessed Skeletal Muscle Mass as a Predictor of Outcomes in Lung Cancer Surgery. Ann Thorac Surg. 2019; 108(5): 1555-64. https://doi.org/10.1016/j.athoracsur.2019.04.090.
- Su H., Ruan J., Chen T., Lin E., Shi L. CT-assessed sarcopenia is a predictive factor for both long-term and short-term outcomes in gastrointestinal oncology patients: a systematic review and meta-analysis. Cancer Imaging. 2019; 19(1): 82. https://doi.org/10.1186/s40644-019-0270-0.
- Prado CM., Baracos VE., McCargar LJ., Reiman T., Mourizakis M., Tonkin K., Mackey J.R., Koski S., Pituskin E., Sawyer M.B. Sarcopenia as a determinant of chemotherapy toxicity and time to tumor progression in metastatic breast cancer patients receiving capecitabine treatment. Clin Cancer Res. 2009; 15(8): 2920-6. https://doi.org/10.1158/1078-0432.CCR-08-2242.
- Prado C.M., Baracos V.E., McCargar L.J., Mourtzakis M., Mulder K.E., Reiman T., Butts C.A., Scarfe A.G., Sawyer M.B. Body composition as an independent determinant of 5-fluorouracil-based chemotherapy toxicity. Clin Cancer Res. 2007; 13(11): 3264-8. https://doi.org/10.1158/1078-0432. CCR-06-3067.
- Antoun S., Baracos VE., Birdsell L., Escudier B., Sawyer M.B. Low body mass index and sarcopenia associated with dose-limiting toxicity of sorafenib in patients with renal cell carcinoma. Ann Oncol. 2010; 21(8): 1594-8. https://doi.org/10.1093/annonc/mdp605.
- Swartz J.E., Pothen A.J., Wegner I., Smid E.J., Swart K.M., de Bree R., Leenen L.P., Grolman W. Feasibility of using head and neck CT imaging to assess skeletal muscle mass in head and neck cancer patients. Oral Oncol. 2016; 62: 28-33. https://doi.org/10.1016/j.oraloncology.2016.09.006.
- Wendrich A.W., Swartz J.E., Bril S.I., Wegner I., de Graeff A., Smid E.J., de Bree R., Pothen A.J. Low skeletal muscle mass is a predictive factor for chemotherapy dose-limiting toxicity in patients with locally advanced head and neck cancer. Oral Oncol. 2017; 71: 26-33. https://doi.org/10.1016/j.oraloncology.2017.05.012.
- Bril S.I., Al-Mamgani A., Chargi N., Remeijer P., Devriese L.A., de Boer J.P., de Bree R. The association of pretreatment low skeletal muscle mass with chemotherapy dose-limiting toxicity in patients with head and neck cancer undergoing primary chemoradiotherapy with high-dose cisplatin. Head Neck. 2022; 44(1): 189-200. https://doi.org/10.1002/hed.26919.
- Ansari E., Chargi N., van Gemert J.T.M., van Es R.J.J., Dieleman F.J., Rosenberg A.J.W.P., Van Cann E.M., de Bree R. Low skeletal muscle mass is a strong predictive factor for surgical complications and a prognostic factor in oral cancer patients undergoing mandibular reconstruction with a free fibula flap. Oral Oncol. 2020; 101. https://doi.org/10.1016/j.oraloncology.2019.104530.
- Alwani M.M., Jones A.J., Novinger L.J., Pittelkow E., Bonetto A., Sim M.W., Moore M.G., Mantravadi A.V. Impact of Sarcopenia on Outcomes of Autologous Head and Neck Free Tissue Reconstruction. J Reconstr Microsurg. 2020; 36(5): 369-78. https://doi.org/10.1055/s-0040-1701696. Erratum in: J Reconstr Microsurg. 2020.
- Surov A., Wienke A. Low skeletal muscle mass predicts relevant clinical outcomes in head and neck squamous cell carcinoma. A meta-analysis. Ther Adv Med Oncol. 2021; 13: 1-14. https://doi.org/10.1177/1758835921100884.


