Роль культуронегативной инфекции в структуре инфекционных осложнений после эндопротезирования коленных суставов
Автор: Любимова Л.В., Божкова С.А., Пчелова Н.Н., Преображенская Е.В., Любимов Е.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.29, 2023 года.
Бесплатный доступ
Введение. Диагностика хронической перипротезной инфекции вызывает трудности, когда клиника воспаления перипротезной зоны не подтверждается ростом микроорганизма в исследуемом биоматериале, при этом частота культуронегативной инфекции может достигать 42,1 %.Цель. Проанализировать исходы двухэтапного лечения хронической перипротезной инфекции коленного сустава в зависимости от этиологии инфекционного процесса.Материалы и методы. Проведен ретроспективный анализ исходов лечения 103 пациентов: группа I (n = 30) - отсутствие роста микроорганизмов, группа II (n = 73) - положительный рост возбудителей. Верификация диагноза перипротезной инфекции проводилась по критериям ICM, 2018. Благоприятный исход - отсутствие рецидива инфекции в течение не менее двух лет после реимплантации эндопротеза, артродеза, «жизнь со спейсером» без признаков инфекции.Результаты. Доля культуронегативной инфекции составила 29,1 % (n = 30). Пациенты этой группы в 1,5 раза чаще получали антибактериальную терапию на догоспитальном этапе; имели средние уровни СРБ, СОЭ и количество лейкоцитов в суставной жидкости в 1,5-2 раза ниже II группы. Во II группе ведущий патоген - стафилококки (69,8 %), в том числе MRSE - 75 %. Рецидивы инфекции в I группе - 3,4 %, во II - 16,9 % случаев (р = 0,0928), успех двухэтапного лечения - 96,7 % и 74 % соответственно (р = 0,0064).Обсуждение. Причины отсутствия роста микроорганизмов в биологических материалах - предшествующая антибактериальная терапия, дренирование раны, нарушения правил забора биологического материала, отсутствие сред для роста атипичных микроорганизмов, способность микроорганизмов формировать биопленки на поверхностях имплантов. В сомнительных ситуациях для верификации диагноза и выбора хирургической тактики может помочь экстренное гистологическое исследование измененных тканей во время операции. Результаты мета-анализа (2023) показали, что замена инфицированного эндопротеза более эффективна для лечения культуронегативной инфекции в сравнении с санацией и сохранением эндопротеза.Заключение. В нашем исследовании частота успеха двухэтапного метода лечения перипротезной коленного сустава с заменой эндопротеза и эмпирической антибактериальной терапией широкого спектра при двухлетнем сроке наблюдения была выше в группе культуронегативной инфекции. Отрицательный результат микробиологического исследования в этой группе, вероятно, обусловлен приемом антибактериальных препаратов до верификации диагноза перипротезной инфекции.
Перипротезная инфекция, культуронегативная инфекция, культуропозитивная инфекция, ревизионное эндопротезирование, маркеры воспаления, коленный сустав
Короткий адрес: https://sciup.org/142239018
IDR: 142239018 | УДК: 616.728.3-089.843-77-022.1 | DOI: 10.18019/1028-4427-2023-29-4-402-409
Текст научной статьи Роль культуронегативной инфекции в структуре инфекционных осложнений после эндопротезирования коленных суставов
Диагностика хронической перипротезной инфекции (ППИ) не вызывает трудностей при наличии расхождения краев раны, свищевого хода, сообщающегося с полостью сустава или эндопротезом, а также при выделении фенотипически одинаковых микроорганизмов из двух и более образцов биологического материала в сочетании с клинико-лабораторными признаками воспаления. Однако в ряде случаев клиническая картина воспаления в области протезированного сустава не подтверждается ростом микроорганизма в исследуемом биологическом материале. Такую инфекцию называют культуронегативной, и её частота, по данным научной литературы, составляет от 7 до 42,1 % [1-4].
Особый интерес к культуронегативной инфекции (КНИ) связан с проблемами верификации возбудителя, подбора и длительности проведения антибактериальной терапии.
Результаты лечения инфекции в зависимости от наличия роста патогена или его отсутствия весьма противоречивы. В исследовании Mortazavi S.M. et al. (2011) сообщалось, что частота рецидива инфекции после двухэтапного реэндопротезирования была в 4,5 раза выше в группе КНИ в сравнении со случаями лечения ППИ у пациентов с установленной этиологией инфекционного процесса [5]. Вместе с тем, в своем систематическом обзоре M. Reisener, C. Perka (2018) сделали заключение, что лечение КНИ дает такие же или даже лучшие результаты, чем лечение инфекции с положи- тельным посевом. Частота купирования КНИ во включенных в исследование публикациях варьировала от 85 до 95 %, при этом лучший результат по отсутствию инфекции в течение 5 лет получен после двухэтапного эндопротезирования, в результате которого данный показатель составил 95 % [1].
Значимо лучшие (р = 0,006) исходы лечения культуронегативной ППИ (n = 40) в сравнении с группой пациентов с положительными культурами (n = 135) были установлены Choi H.R. с соавт. (2013) [6].
Напротив, в исследовании Huang R., Hu C.C. (2012) не было установлено различий в исходах лечения обоих видов ППИ. Авторы ретроспективно проанализировали 55 случаев КНИ и 295 случаев культуро-положительной инфекции (КПИ) и выявили, что отсутствие рецидива ППИ на сроке наблюдения до 1 года составило в обеих группах наблюдения по 73 % после двухэтапной санации в сочетании с послеоперационной терапией ванкомицином [7].
Имеющиеся противоречивые данные по поводу исходов лечения культуронегативной ППИ, а также отсутствие отечественных публикаций, посвященных данной тематике, послужили причиной проведения данного исследования.
Цель – провести сравнительный анализ исходов двухэтапного лечения ППИ коленного сустава в зависимости от установленной или не установленной этиологии инфекционного процесса.
МАТЕРИАЛЫ И МЕТОДЫ
На основании данных медицинской информационной системы за период 2017-2021 гг. проведен сплошной ретроспективный анализ исходов лечения 103 пациентов с хронической ППИ после первичного или ревизионного эндопротезирования коленного сустава. В исследование включали пациентов, которым был выполнен первый этап двухэтапного лечения с удалением эндопротеза и установкой спейсера, импрег-нированного антибиотиком. Верификацию диагноза ППИ проводили по критериям диагностики ICM, 2018 (International Consensus Meeting) [8].
Из 103 случаев ППИ на амбулаторном этапе отсутствие роста микрофлоры в пунктатах синовиальной жидкости зафиксировано в 35 случаях. На стационарном этапе при исследовании интраоперационного биологического материала в 5 случаях из 35 выявлен положительный рост микроорганизмов. Все случаи были разделены на две группы. В группу I (n = 30) были включены случаи ППИ с отсутствием роста микрофлоры (далее – КНИ), в группу II (n = 73) – наблюдения с положительным ростом возбудителей (далее – КПИ) в дооперационных пунктатах синовиальной жидкости, интраоперационнных тканевых биоптатов и/или смывов с удаленных конструкций.
Группы пациентов были сопоставимы по полу, возрасту, доле пациентов с системными заболеваниями и ИМТ (табл. 1).
Взятие пунктата синовиальной жидкости из коленного сустава проводили в асептических условиях без использования местных анестетиков в стерильный шприц. Доставка биоматерила осуществлялась в течение 05-60 минут. В условиях лаборатории выполнялся количественный подсчет клеточного состава с дифференциацией лейкоцитов и бактериологическое исследование пунктата. Аспират добавляли в аэробный и анаэробный флаконы анализатора Bact/Alert 3D.
Характеристика пациентов исследуемых групп
Таблица 1
|
I группа, абс. число (%) |
II группа, абс. число (%) |
р < 0,05 |
||
|
Возраст, лет |
66,1 (95 % ДИ: 62,6-69,2) |
64,1 (95 % ДИ: 62,3-65,6) |
0,2251 |
|
|
Пол |
мужчины |
7 (23,3) |
28 (38,4) |
0,1737 |
|
женщины |
23 (76,7) |
45 (61,6) |
||
|
ИМТ (кг/м2) |
32,9 (95 % ДИ: 30,9-34,1) |
32,9 ± 5,2 (95 % ДИ: 31,7-34,0) |
0,9116 |
|
|
Доля пациентов, получающих антибактериальную терапию на догоспитальном этапе, % |
16 (53,3) |
26 (35,6) |
0,1845 |
|
|
Системные заболевания (ревматоидный артрит, недифференцированный артрит) |
3 (10,0) |
9 (12,3) |
1,0000 |
|
При объеме пунктата менее 1 мл посев проводили в педиатрические флаконы анализатора или в бульоны, приготовленные рутинным способом. Пересев на плотные питательные среды (колумбийский, шоколадный, Шедлер, Сабуро агары) – по мере выявления роста культуры во флаконах анализатора или бульоне на 5-10 сутки. Для выделения микроорганизмов из микробных биопленок полученные интраоперационно компоненты эндопротезов подвергались обработке в УЗ-машине BRANSON 8510 (США) в течение 5 мин. при частоте 40 ± 2 кГц с последующим посевом смывов на питательные среды и на флаконы анализатора. Посевы инкубировали до 14 суток с созданием условий для культивирования аэробов, анаэробов, капно-филов и грибов. Видовую идентификацию возбудителей с определением чувствительности выполняли на автоматическом бактериологическом анализаторе Vitec 2-compact (Bio Merieux, Франция) и на полуавтоматическом анализаторе Multiskan FC [9].
Длительность антибактериальной терапии на каждом этапе – санации и реимплантации – составляла не менее 6 недель (2 недели внутривенно капельно, 4 недели перорально). Пациенты с КПИ получали этиотропную, с КНИ – эмпирическую антибактериальную терапию (комбинация ванкомицина с цефоперазоном/ сульбактамом внутривенно капельно 2 недели, левофлоксацин – 4 недели перорально на этапе санации, после реимплантации в сочетании с рифампицином) [10]. Из медицинской документации формировали базу данных, включающую следующие параметры:
– наличие сопутствующей патологии (системные заболевания);
– сведения о ранее проводимом лечении ППИ, в том числе курсы антибактериальных препаратов;
– признаки генерализации инфекции: септицемия, полиорганная недостаточность, наличие лихорадки;
– локальные проявления при поступлении на первый этап санации: отек, гиперемия, гипертермия, свищ – как в виде отдельных симптомов, так и в сочетании.
Учитывали результаты лабораторных исследований крови (количество лейкоцитов, СОЭ, уровни СРБ и Д-димера), суставного аспирата (количество лейкоцитов, доля палочкоядерных нейтрофилов (ПЯН), бактериологических исследований (от 1 до 3 последовательно взятых до операции образцов суставной жидкости, интраоперационно забранных тканевых биоптатов, суставной жидкости при её наличии, смывов с удаленных металлоконструкций). В 3 случаях в группе I и в 9 случаях в группе II были учтены результаты исследования крови на стерильность у пациентов с признаками системной воспалительной реакции – повышение уровня прокальцитонина в крови более 1,0 нг/мл.
За эффективность санирующего этапа принимали отсутствие клинико-лабораторных признаков инфекционно-воспалительного процесса на момент поступления на второй этап лечения. Благоприятным исходом двухэтапного лечения считали отсутствие рецидива ППИ в течение не менее 2-х лет после реимплантации эндопротеза или артродезирования или «жизнь со спейсером» без признаков инфекции.
Статистические методы . Полученные данные регистрировали в виде электронных таблиц, визуализацию структуры данных и их анализ проводили с помощью программы MS Office Excel, 2007 (Microsoft, США) и программы Graf Pad. Для описания количественных показателей выполняли проверку на нормальность распределения по критерию Колмогорова-Смирнова. При нормальном распределении для описания признака использовали его среднее значение и среднеквадратичное отклонение с 95 % ДИ. Сопоставление количественных признаков между группами сравнения выполняли с применением критерия Манна–Уитни. Категориальные данные (пол, тип ППИ, исход) описывали условными кодами не измеряемых категорий, не подлежащих упорядочиванию. Для оценки эффективности проведенного лечения в группах проводили расчет точного теста Фишера. Различия показателей между группами считали статистически достоверными при p < 0,05.
РЕЗУЛЬТАТЫ
Доля КНИ в анализируемой выборке составила 29,1 % (n = 30). Несмотря на отсутствие статистической значимости различий (p = 0,1845), пациенты с отрицательными результатами посевов в 1,5 раза чаще в сравнении с группой II получали антибактериальную терапию на догоспитальном этапе.
Операцией, предшествующей развитию ППИ, в подавляющем большинстве случаев было первичное эндопротезирование: в 93,3 % (n = 28) в I группе и в 87,7 % (n = 64) – во II группе (p = 0,5025). У остальных пациентов осложнение развилось после ревизионных вмешательств по поводу других неинфекционных причин.
Согласно критериям диагностики ICM (2018), диагноз ППИ был подтвержден (рис. 1) у 98,6 % пациентов II группы и только у 76,7 % – в I группе (p = 0,0006). Еще в 23,3 % случаев при КНИ данные за диагноз ППИ были не убедительны (n = 6) или отрицали наличие инфекционного процесса (n = 1). В группе сравнения доля таких случаев составила только 1,4 % (n = 1).
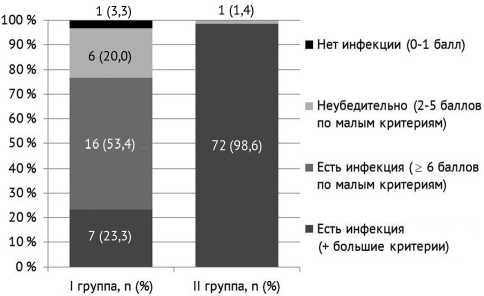
Рис. 1. Частота выявления ППИ согласно критериям диагностики ICM (2018)
Клиническая картина ППИ была сопоставима в обеих группах исследования. У всех пациентов, включенных в исследование, присутствовал болевой синдром. Отек и гиперемия наблюдались в 51,8 и 43,9 % слу- чаев соответственно в группах I и II. Свищевая форма ППИ была диагностирована в I группе в 22,2 %, во II – в 26,8 % случаев; общая гипертермия до фебрильных цифр отмечалась у 48,1 % и 53,7 % пациентов соответственно. Во II группе из проанализированных 9 случаев септицемия выявлена в 2 случаях, в I группе среди проанализированных 3-х случаев положительного роста гемокультуры не было (p = 1,0000).
В обеих группах пациентов отмечено повышение уровней маркеров воспаления в дооперационном периоде (табл. 2). При этом уровень СРБ крови, СОЭ, а также количество лейкоцитов в синовиальной жидкости у пациентов II группы статистически значимо превышали аналогичные показатели в группе I (p < 0,05).
Согласно диагностическому алгоритму ICM (2018), 23,3 % (n = 7) пациентов с КНИ на момент поступления в стационар набрали менее 5 баллов, при этом значения лабораторных маркеров воспаления у них были ниже референсных значений, а средний уровень показателей был значимо ниже, чем у пациентов с подтвержденной ППИ (табл. 3). Однако в этих случаях были выявлены рентгенологические признаки ранней нестабильности эндопротеза (выраженные зоны остеолиза, резорбции, R-просветления).
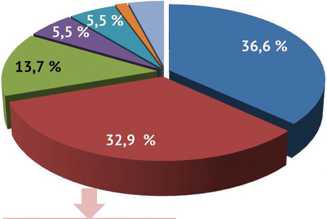
В структуре возбудителей КПИ ведущим патогеном были стафилококки (69,8 %). Стоит отметить, что в исследуемых случаях не было выделено штаммов MRSA, однако выявлен высокий удельный вес MRSE из общего числа коагулазонегативных стафилококков (рис. 2).
Видовой состав грамотрицательных микроорганизмов в виде монокультуры был представлен E. coli, Achromobacter xylosoxidans, Burkholderia cepacia, Enterobacter cloacae , в микробных ассоциациях – Acinetobacter baumannii .
В группе II в 5 случаях (6,8 %) возбудитель был выделен только из интраоперационного материала: в трех случаях – S. aureus и по одному случаю – E. faecalis и S. haemolyticus . Кроме того, еще в четырех случаях (5,5 %) полученный из дооперационных аспиратов рост штаммов – S. aureus (n = 2) и коагулазонегативных стафилококков (n = 2) – не был подтвержден результатами исследования интраоперационного материала.
Средняя длительность интервала между хирургическими этапами лечения ППИ в группах I и II составила, соответственно, 2,5 мес. (ДИ = 95 %; 1,2-4,9) и 2,8 мес. (ДИ = 95 %; 0,2-17,5). При этом после санирующего этапа рецидив ППИ был выявлен только у 12,3 % (9 из 73) пациентов группы II (рис. 3).
Таблица 2
Лабораторные показатели в группах в предоперационном периоде
|
Показатели |
I группа (n = 30) |
II группа (n = 73) |
р |
||
|
Кровь |
СОЭ (мм/ч) |
45,9 ± 26,7 |
64,2 ± 29,2 |
0,0029 |
|
|
СРБ (мг/л) |
33,6 ± 40,9 |
76,1 ± 64,1 |
0,0002 |
||
|
Д-димер (нг/мл) |
2672,8 ± 1663,8 |
2392,6 ± 1383,7 |
0,4231 |
||
|
СЖ |
Лейкоциты (кл/мкл) |
пункция 1 пункция 2 пункция 3 |
16221,4 ± 25920,0 12885,8 ± 27912,7 18876,5 ± 25286,1 |
40492,5 ± 63337,1 21310,6 ± 33027,3 48550,0 ± 76314,7 |
0,0075 0,3178 0,0366 |
|
ПЯН 1 (%) |
пункция 1 пункция 2 пункция 3 |
88,6 ± 7,6 88,8 ± 6,8 80,1 ± 22,0 |
89,1 ± 12,6 88,3 ± 9,0 90,8 ± 6,8 |
0,8169 0,8545 0,1069 |
|
СЖ – здесь и далее суставная жидкость
Таблица 3
Средние значения лабораторных показателей пациентов с КНИ (n = 30) с подтвержденной и не подтвержденной ППИ по критериям ICM (2018)
|
Показатели |
ППИ |
р |
||
|
подтверждена (n = 23) |
не подтверждена (n = 7) |
|||
|
Кровь |
СОЭ (мм/ч) |
53,8 ± 27,0 |
24,3 ± 7,0 |
0,0001 |
|
СРБ (мг/л) |
43,7 ± 44,5 |
8,2 ± 6,3 |
0,0022 |
|
|
Д-димер (нг/мл) |
2753,7 ± 1687,8 |
2418,4 ± 1687,7 |
0,6569 |
|
|
СЖ – пункция 1 |
Лейкоциты (кл/мкл) |
22532,1 ± 28420,8 |
444,6 ± 849,8 |
0,0026 |
|
ПЯН (%) |
88,6 ± 7,6 |
– |
– |
|
Пациенты с
1ПИ, п = 103
1,4% 4’1%
■ Staphylococcus aureus
■ Коагулазонегативные стафилококки
■ Стрептококки
■ Энтерококки
■ Грамотрицательные бактерии
■ Грибы
■ Полимикробная микрофлора в том числе MRSE 75 %
Рис. 2. Видовой спектр возбудителей КПИ
Группа I, п = 30 1 этап
Успех, п = 30 Рецидив, п = 0
(100 %) (0 %)
хЖизнь со спейсером, n = 1 (3,3 %)
2 этап, п = 29 (96,7 %)
Успех, п = 28 Рецидив, п = 1 (96,6 %) (3,4 %)
Группа II, п = 73 1 этап
Успех, п = 64 Рецидив, п = 9 (87,7 %) (12,3 %)
Жизнь со спейсером, п = 5, (7,8 %)
2 этап, п = 59 (80,8 %)
Успех, п = 49 Рецидив, п = 10 (83,1 %) (16,9 %)
Рис. 3. Исходы каждого этапа лечения
Доля пациентов, отказавшихся от выполнения второго этапа лечения, составила 3,3 и 7,8 % соответственно в группах I и II. Причинами «жизни со спейсером» были нежелание пациента принять предложенный план лечения (артродезирование после установки блоковидного спейсера, n = 3), абсолютные противопоказания к оперативному лечению на фоне сопутствующей патологии (n = 2), отказ пациента от оперативного лечения после перенесенной коронавирусной инфекции (n = 1). Показаниями для артроде-зирования являлись большие дефекты мягких тканей и/или костей, формирующих коленный сустав, вследствие предшествующих операций, а также формирование контрактуры.
Реимплантация эндопротеза была выполнена 96,7 и 80,8 % пациентам, включенным в группы I и II, соответственно. Средний срок наблюдения после второго этапа реэндопротезирования в группе I составил 40,1 мес. (ДИ = 95 %; 6,2-77,7), в группе II – 29,4 мес. (ДИ = 95 %; 0,5-57,5), р = 0,0197, при этом рецидивы ППИ с необходимостью повторной санации были диагностированы соответственно в 3,4 и 16,9 % (р = 0,0928) случаев. Средний период от реимплантации эндопротеза до развития рецидива ППИ у пациентов с КПИ составил 20,8 мес. (ДИ = 95 %; 1,7-48,2), у единственного пациента с КНИ – 11,9 месяца (n = 1).
Рецидивы ППИ в 8 случаях из 20 были обусловлены S. aureus , в 4-х случаях – коагулазонегативными стафилококками, в 3-х случаях – стрептококками, в 2-х случаях – грамотрицательными бактериями, в 3-х случаях была установлена полимикробная инфекция. В единственном случае неблагоприятного исхода у пациентов с КНИ был выделен Streptococcus agalactiae . Только в 26,3 % случаев (5 из 19) этиология рецидива КПИ совпадала с этиологией ППИ на этапе санации: в трех случаях был выделен S. aureus и по 1 случаю – E. coli и Streptococcus spp . Несовпадение этиологии КПИ в 9 случаях связано с отсутствием роста микроорганизмов на последующих этапах санации при наличии признаков ППИ. Замещение микрофлоры при рецидивах в группе КПИ произошло в 5 случаях (табл. 4).
Таким образом, эффективность двухэтапного метода лечения ППИ в целом составила 96,7 % (1 из 30) и 74 % (19 из 73) соответственно в группах I и II (p = 0,0064) (рис. 3).
Таблица 4
Этиология КПИ при первичной ППИ и рецидиве
|
Первичная ППИ |
Рецидив ППИ |
|
S. aureus |
S. aureus + S. epidermidis MRSE |
|
S. epidermidis |
S. aureus + Streptococcus oralis |
|
S. aureus |
Acinetobacter baumannii + E. faecalis |
|
S. epidermidis MRSE |
Staphylococcus lugdunensis |
|
Streptococcus pyogenes |
Corynebacterium jeikeium |
ОБСУЖДЕНИЕ
За последние несколько лет возрос интерес исследователей к изучению исходов лечения КНИ протезированных суставов и поиска причин отсутствия роста возбудителей в биологическом материале, о чем свидетельствует увеличение количества научных публикаций по ключевой фразе «Culture-Negative Periprosthetic Joint Infection» в системе PubMed с 33 за 2012-2017 гг. до 100 за период 2018-2023 гг. Однако в российском сегменте научной литературы данная тема не представлена. Одной из причин отсутствия роста микроорганизма может быть наличие инфекции, вызванной трудно-культивируемыми микроорганизмами, такими как грибы, нетуберкулезные микобактерии ( Listeria monocytogens, Propionibacterium acnes, Brucella, Coxiella burnetii ) и другие [11].
Культуральные методы диагностики инфекционного агента в настоящее время являются доступными стандартными тестами во многих областях медицины. Обнаружение микроорганизмов в инфицированных тканях и/или синовиальной жидкости после артропластики суставов позволяет провести этиотропную терапию и повысить шансы на успешный исход санирующего лечения. Однако, по данным зарубежных исследований, процент отрицательных результатов микробиологического исследования при установленном диагнозе инфекционного осложнения имеет широкий диапазон. Частота КНИ колеблется от 7 [10] до 42,1 % [12, 13]. Промежуточные результаты в своих исследованиях освещают Huang et al. (2012) – 11,9 % [7], Tan TL et al. (2018) – средний показатель за 15 лет составил 22 %, при этом в разрезе по годам частота варьировала от 11,9 до 33,3 % [14], Malekzadeh et al. (2010) – 35 % [15]. Настоящее исследование показало частоту возникновения КНИ почти у трети всех выявленных случаев ППИ (29,2 %).
По литературным данным, наиболее частыми причинами отсутствия роста микроорганизмов в исследуемых биологических материалах могут быть предшествующая антибактериальная терапия [16, 17], дренирование раны [18], орошение раны растворами антисептиков перед взятием проб [19], взятие недостаточного количества образцов тканей (необходимо не менее 3-5) или из не инфицированных областей [20], увеличение времени транспортировки образцов, несоблюдение сроков инкубации или отсутствие сред для роста атипичных микроорганизмов. В нашем исследовании наиболее очевидной причиной отсутствия роста микроорганизмов был прием антибактериальных препаратов в период до установленного диагноза ППИ, что было выявлено в 50 % наблюдений в группе I. В нашей медицинской организации взятие биоматериала для бактериологического посева стандартизовано, исследование компонентов эндопротеза проводится с последующей обработкой ультразвуком и инкубацией не менее 14 суток с созданием необходимых условий для культивирования аэробов, анаэробов, капно-филов и грибов.
Не менее важной проблемой идентификации возбудителей ППИ является способность ряда микроорганизмов, таких как стафилококки и синегнойная палочка, из планктонных форм на поверхности имплантатов образовывать биопленку, которая служит барьером для их обнаружения. [21, 22]. Другим фактором, препятствующим идентификации бактерий, является наличие в биопленках их жизнеспособных, но не культивируемых форм. Такие клетки временно теряют способность расти на обычных бактериологических средах, но могут восстанавливать свою метаболическую активность при определенных условиях [23, 24]. Кроме того, особенностями S. aureus, помимо выше описанного, является способность к внутриклеточному существованию при интернализации в остеобласты и остеоциты, что также может способствовать неудаче в идентификации возбудителя.
В настоящее время обсуждение проблемы инфекции с участием микробных биопленок переходит на новый этап, поскольку, помимо культуральных методов идентификации возбудителей, появились молекулярные методы диагностики (использование DTT-технологий и ПЦР-секвенирование). Последний метод позволяет идентифицировать организмы в образце путем высокопроизводительного параллельного секвенирования всей присутствующей микробной ДНК с последующим сравнением сгенерированных считываний последовательностей с биоинформационной базой данных всех известных микроорганизмов [25]. Возможно, в ближайшем будущем с внедрением новых технологий статистика числа ППИ с отсутствием роста микроорганизмов изменится. Следует отметить в качестве недостатков молекулярных методов диагностики их высокую стоимость и невозможность определения чувствительности к антибактериальным препаратам. В современных условиях для улучшения идентификации патогенов рекомендуют повторный отбор проб для микробиологического исследования, при отсутствии роста микроорганизма – проведение инкубации культур не менее 14 дней, выполнение ультразвуковой обработки имплантатов, рекомендуют также воздержаться от назначения антибиотиков до тех пор, пока не будут отобраны образцы для исследования [26].
Несмотря на совершенствование диагностических критериев ППИ (ICM, 2018), демонстрирующих высокую чувствительность (97,7 %) и специфичность (99,5 %) [8] с возможностью верификации инфекционного процесса при отсутствии роста микроорганизма в исследуемых биологических материалах, диагностика КНИ продолжает представлять на практике проблему. В нашем исследовании в 7 случаях с установленным диагнозом КНИ сумма баллов по критериям ICM была менее 5. При этом были установлены статистически значимые различия в уровне маркеров воспаления (СОЭ, СРБ и цитоза) в сравнении со случаями неподтвержденной КНИ; отсутствовали различия только в уровне D-димера. Диагноз ППИ данной группе пациентов был выставлен, опираясь на рентгенологические критерии ранней нестабильности эндопротеза – наличие зон остеолиза или резорбции. По-видимому, в таких сомнительных ситуациях для верификации диагноза и подбора оптимальной хирургической тактики (одноэтапная, а не двухэтапная ревизия) может помочь экстренное гистологическое исследование измененных тканей во время операции. Предложенная L. Morawietz с соавторами методика определения более 23 нейтрофильных гранулоцитов на 10 полях зрения под большим увеличением позволяет провести дифференциальную диагностику между асептическим и инфекционным расшатыванием эндопротеза [27].
По данным литературы, экстренное гистологическое исследование имеет чувствительность 95-98 %, специфичность 98-99 %.
В настоящее время описана возможность автоматизации данной методики с использованием шкалы CD15 focus score и компьютерной программы CD 15 quantifier [28]. Чувствительность данного метода составляет 83 % при специфичности 86,4 %, точность 84,6 %. Данный метод позволяет за меньший временной промежуток, в отличие от микробиологического исследования, верифицировать диагноз ППИ, обусловленной низковирулентными возбудителями. Иммуногистохимические исследования антигена CD15 на поверхности нейтрофилов значительно повышают точность диагностики ППИ, что подтвердили работы Силантьевой Т.А. с соавторами в 2021 г. на материале инфицированных перипротезных мембран [29].
Группа авторов Li H., Yang R., Geng L. (2014), описывая КНИ, предложила гипотезу о том, что инфекционный процесс с отрицательным посевом характеризуется медленным началом и умеренной воспалительной реакцией. По результатам нашего исследования, в группе КНИ средние уровни СРБ, СОЭ и количество лейкоцитов в суставной жидкости были в 1,5-2 раза ниже группы сравнения, что подтверждает гипотезу зарубежных коллег.
В 2018 г. опубликованы данные систематического мета-анализа исходов лечения КНИ, который включал обзор 8 англоязычных статей [30]. По объединенным данным, частота встречаемости инфекции с отрицательным микробиологическим посевом составила 11 % (n = 504) с частотой успеха 85-95 %, не было различий в частоте успеха с КПИ. Результаты недавнего мета-анализа, в который было включено 30 исследований, демонстрируют аналогичную или лучшую эффективность лечения КНИ в сравнении группой культуропозитивной ППИ – соответственно 81 и 76,4 % [30]. Одной их вероятных причин успеха лечения КНИ может быть банальное отсутствие инфекции в протезированном суставе, другой – наличие низковирулентных микроорганизмов, которые легче лечить, чем высоковирулентные, такие как метициллин-резистентный золотистый стафилококк [6].
В литературе S. aureus отводится лидирующая роль в развитии ППИ [31-34]. Анализ 219 случаев КНИ в исследовании Tan TL (2018) демонстрирует, что в случаях рецидива ППИ с положительным микробиологическим ростом на долю метициллин-чувствительного S. aureus приходится 38,5 % (10/26) случаев [14]. Результаты нашего исследования также подтверждают ведущую роль S. aureus в этиологии КПИ как впервые выявленной (в 32,9 % случаев), так и рецидива (в 50 % случаев). Не менее важное значение в этиологии ППИ имеют MRSE стафилококки, которые, по нашим данным, составили 75 % из числа всех выделенных коагулазонегативных стафилококков. Поскольку ведущими возбудителями ППИ в нашем исследовании были S. aureus и коагулазонегативные стафилококки, преимущественно метицилллин-резистентные, очевидной становится обоснованность обязательного применения ванкомицина в составе стартовой эмпи- рической антибактериальной терапии в комбинации с цефоперазон/сульбактамом для расширения спектра антимикробной активности.
Bejon P. et al. (2010) описали 62 случая КНИ с частотой успеха двухэтапной санации 83 % через 5,75 года [31]. В нашем исследовании успешный исход лечения был достигнут в 96,7 и 74 % случаев (p = 0,0064) соответственно при культуронегативной и культуропозитивной ППИ по итогам двухлетнего наблюдения.
Большинство исследований показали преимущество двухэтапного ревизионного эндопротезирования перед радикальной хирургической обработкой с сохранением эндопротеза при лечении пациентов с КНИ. По данным Tan T.L. et al. (2018), инфекция была ку- пирована соответственно в 71,2 и 55,6 % случаев [14]; по результатам Berbari E.F. et al. (2007) – в 94 и 71 % случаев, Huang R. et al. (2012) достигли эффективности соответственно в 70 и 50 % наблюдений. Только Malekzadeh D. et al. (2010) сообщают о сопоставимых результатах лечения 135 случаев КНИ – доля пациентов с купированной инфекцией через 5 лет после санации вне зависимости от сохранения или удаления эндопротеза составила 78 % [15]. Вместе с тем, результаты недавнего мета-анализа (2023) также показали, что выполнение операций с заменой инфицированного эндопротеза – как одно-, так и двухэтапных – было более эффективно для лечения КНИ в сравнении с санацией с сохранением эндопротеза – частота рецидивов составила, соответственно, 11,5, 16,1 и 22,2 % случаев [30].
ЗАКЛЮЧЕНИЕ
В нашем исследовании наиболее очевидной причиной отсутствия роста микроорганизмов был прием антибактериальных препаратов в период до установленного диагноза перипротезной инфекции.
Результаты проведенного исследования свидетельствуют о высокой эффективности метода двухэтапного ревизионного эндопротезирования с назначением эмпирической антибактериальной терапии широкого спектра при лечении культуронегативной инфекции коленного сустава, составившей при 2-летнем наблюдении 96,7 %, что статистически значимо превысило результаты лечения культуропозитивной инфекции с установленной этиологией – 74 %.
Список литературы Роль культуронегативной инфекции в структуре инфекционных осложнений после эндопротезирования коленных суставов
- Reisener M, Perka C. Do Culture-Negative Periprosthetic Joint Infections Have a Worse Outcome Than Culture-Positive Periprosthetic Joint Infections? A Systematic Review and Meta-Analysis. Biomed Res Int. 2018;2018:6278012. doi: 10.1155/2018/6278012
- Yoon HK, Cho SH, Lee DY, et al. A Review of the Literature on Culture-Negative Periprosthetic Joint Infection: Epidemiology, Diagnosis and Treatment. Knee Surg Relat Res. 2017;29(3):155-164. doi: 10.5792/ksrr.16.034
- Kalbian I, Park JW, Goswami K, et al. Culture-negative periprosthetic joint infection: prevalence, aetiology, evaluation, recommendations, and treatment. Int Orthop. 2020;44(7):1255-1261. doi: 10.1007/s00264-020-04627-5
- Божкова С.А., Касимова А.Р., Тихилов Р.М. и др. Неблагоприятные тенденции в этиологии ортопедической инфекции: результаты 6-летнего мониторинга структуры и резистентности ведущих возбудителей. Травматология и ортопедия России. 2018;24(4):20-31. doi: 10.21823/2311-2905-2018-24-4-20-31
- Mortazavi SM, Vegari D, Ho A, Zmistowski B, Parvizi J. Two-stage exchange arthroplasty for infected total knee arthroplasty: predictors of failure. Clin Orthop Relat Res. 2011;469(11):3049-54. doi: 10.1007/s11999-011-2030-8
- Choi HR, Kwon YM, Freiberg AA, Nelson SB, Malchau H. Periprosthetic joint infection with negative culture results: clinical characteristics and treatment outcome. J Arthroplasty. 2013;28(6):899-903. doi: 10.1016/j.arth.2012.10.022
- Huang R, Hu CC, Adeli B, Mortazavi J, Parvizi J. Culture-negative periprosthetic joint infection does not preclude infection control. Clin Orthop Relat Res. 2012;470(10):2717-23. doi: 10.1007/s11999-012-2434-0
- Goh GS, Parvizi J. Diagnosis and Treatment of Culture-Negative Periprosthetic Joint Infection. J Arthroplasty. 2022;37(8):1488-1493. doi: 10.1016/j. arth.2022.01.061
- Николаев Н.С., Пчелова Н.Н., Преображенская Е.В., Назарова В.В., Добровольская Н.Ю. «Неожиданные» инфекции при асептических ревизиях. Травматология и ортопедия России. 2021;27(3):56-70. doi: 10.21823/2311-2905-2021-27-3-56-70
- Trampuz A, Renz N. Pocket Guide to Diagnosis Treatment of Periprosthetic Joint Infection (PJI). PRO-IMPLANT foundation; 2017.
- Berbari EF, Marculescu C, Sia I, et al. Culture-negative prosthetic joint infection. Clin Infect Dis. 2007;45(9):1113-9. doi: 10.1086/522184
- Kim YH, Kulkarni SS, Park JW, Kim JS, Oh HK, Rastogi D. Comparison of infection control rates and clinical outcomes in culture-positive and culture-negative infected total-knee arthroplasty. J Orthop. 2015;12(Suppl 1):S37-43. doi: 10.1016/j.jor.2015.01.020
- Kim YH, Park JW, Kim JS, Kim DJ. The outcome of infected total knee arthroplasty: culture-positive versus culture-negative. Arch Orthop Trauma Surg. 2015;135(10):1459-67. doi: 10.1007/s00402-015-2286-7
- Tan TL, Kheir MM, Shohat N, Tan DD, Kheir M, Chen C, Parvizi J. Culture-Negative Periprosthetic Joint Infection: An Update on What to Expect. JB JS Open Access. 2018;3(3):e0060. doi: 10.2106/JBJS.0A.17.00060
- Malekzadeh D, Osmon DR, Lahr BD, Hanssen AD, Berbari EF. Prior use of antimicrobial therapy is a risk factor for culture-negative prosthetic joint infection. Clin Orthop Relat Res. 2010;468(8):2039-45. doi: 10.1007/s11999-010-1338-0
- Schinsky MF, Della Valle CJ, Sporer SM, Paprosky WG. Perioperative testing for joint infection in patients undergoing revision total hip arthroplasty. J Bone Joint Surg Am. 2008;90(9):1869-75. doi: 10.2106/JBJS.G.01255
- Николаев Н.С., Борисова Л.В., Дидиченко С.Н., Орлова А.В., Пчелова Н.Н. Оптимальные методы лечения инфекционных осложнений при эндопротезировании крупных суставов в современных условиях. Оптимальные методы лечения инфекционных осложнений при эндопро-тезировании крупных суставов в современных условиях. Уральский медицинский журнал. 2015;(10):51-56.
- Yoon HK, Cho SH, Lee DY, Kang BH, Lee SH, Moon DG, Kim DH, Nam DC, Hwang SC. A Review of the Literature on Culture-Negative Periprosthetic Joint Infection: Epidemiology, Diagnosis and Treatment. Knee Surg Relat Res. 2017;29(3):155-164. doi: 10.5792/ksrr.16.034
- Goh GS, Parvizi J. Think Twice before Prescribing Antibiotics for That Swollen Knee: The Influence of Antibiotics on the Diagnosis of Periprosthetic Joint Infection. Antibiotics (Basel). 2021;10(2):114. doi: 10.3390/antibiotics10020114
- Parvizi J, Erkocak OF, Delia Valle CJ. Culture-negative periprosthetic joint infection. J Bone Joint Surg Am. 2014;96(5):430-6. doi: 10.2106/ JBJS.L.01793
- Trampuz A, Piper KE, Jacobson MJ, et al. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med. 2007;357(7):654-63. doi: 10.1056/NEJMoa061588
- Peterson BW, He Y, Ren Y, et al. Viscoelasticity of biofilms and their recalcitrance to mechanical and chemical challenges. FEMS Microbiol Rev. 2015;39(2):234-45. doi: 10.1093/femsre/fuu008
- Oliver JD. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol Rev. 2010;34(4):415-25. doi: 10.1111/j.1574-6976.2009.00200.x
- Lleo MM, Benedetti D, Tafi MC, Signoretto C, Canepari P. Inhibition of the resuscitation from the viable but non-culturable state in Enterococcus faecalis. Environ Microbiol. 2007;9(9):2313-20. doi: 10.1111/j.1462-2920.2007.01345.x
- Tarabichi M, Shohat N, Goswami K, Alvand A, Silibovsky R, Belden K, Parvizi J. Diagnosis of Periprosthetic Joint Infection: The Potential of Next-Generation Sequencing. J Bone Joint Surg Am. 2018;100(2):147-154. doi: 10.2106/JBJS.17.00434
- Kurtz SM, Lau EC, Son MS, et al. Are We Winning or Losing the Battle With Periprosthetic Joint Infection: Trends in Periprosthetic Joint Infection and Mortality Risk for the Medicare Population. J Arthroplasty. 2018;33(10):3238-3245. doi: 10.1016/j.arth.2018.05.042
- Morawietz L, Tiddens O, Mueller M, et al. Twenty-three neutrophil granulocytes in 10 high-power fields is the best histopathological threshold to differentiate between aseptic and septic endoprosthesis loosening. Histopathology. 2009;54(7):847-53. doi: 10.1111/j.1365-2559.2009.03313.x
- Кренн Ф., Колбель Б., Винерт С. и др. Новый алгоритм гистопатологической диагностики перипротезной инфекции с применением шкалы CD15 focus score и компьютерной программы CD15 Quantifier. Травматология и ортопедия России. 2015;(3):76-85. doi: 10.21823/23112905-2015-0-3-76-85
- Силантьева Т.А., Ермаков А.М., Тряпичников А.С. Гистологическая оценка перипротезной инфекции с использованием шкалы HOES и анализа экспрессии CD15 на этапе ревизионного эндопротезирования тазобедренного сустава. Травматология и ортопедия России. 2021;27(2):84-98. doi: 10.21823/2311-2905-2021-27-2-84-98
- Li F, Qiao Y, Zhang H, Cao G, Zhou S. Comparable clinical outcomes of culture-negative and culture-positive periprosthetic joint infections: a systematic review and meta-analysis. J Orthop Surg Res. 2023;18(1):210. doi: 10.1186/s13018-023-03692-x
- Bejon P, Berendt A, Atkins BL, et al. Two-stage revision for prosthetic joint infection: predictors of outcome and the role of reimplantation microbiology. JAntimicrob Chemother. 2010;65(3):569-75. doi: 10.1093/jac/dkp469
- Божкова С.А., Богданова Т.Я., Краснова М.В. и др. Экспериментально-клиническое исследование фенотипических особенностей штаммов S. epidermidis и их роль в возникновении и развитии имплант-ассоциированной инфекции после ортопедических операций. Травматология и ортопедия России. 2014;(2):68-77. doi: 10.21823/2311-2905-2014-0-2-68-77
- Botelho AMN, Nunes ZDG, Asensi MD, et al. Characterization of coagulase-negative staphylococci isolated from hospital indoor air and a comparative analysis between airborne and inpatient isolates of Staphylococcus epidermidis. J Med Microbiol. 2012;61(Pt 8):1136-1145. doi: 10.1099/jmm.0.035931-0
- Николаев Н.С., Любимова Л.В., Пчелова Н.Н., Преображенская Е.В., Алексеева А.В. Использование имплантатов с покрытием на основе двумерно-упорядоченного линейно-цепочечного углерода, легированного серебром, для лечения перипротезной инфекции. Травматология и ортопедия России. 2019;25(4):98-108. doi: 10.21823/2311-2905-2019-25-4-98-108


