Роль межклеточных агрегатов и показателей окислительного стресса в оценке риска сердечно-сосудистых исходов у пациентов после коронарного шунтирования
Автор: Косинова А.А., Гринштейн Ю.И., Мальцева А.Н., Гончаров М.Д., Монгуш Т.С., Савченко А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.40, 2025 года.
Бесплатный доступ
Цель: сравнить уровни С-реактивного белка (СРБ), количества межклеточных агрегатов, в том числе экспрессирующих Р-селектин, липидного профиля, хемилюминесцентной активности тромбоцитов в группах пациентов с нежелательными сердечно-сосудистыми событиями и без таковых после коронарного шунтирования (КШ). Материал и методы. В исследование включены 102 пациента со стенокардией II–IV функциональных классов (ФК), которым выполнялось КШ. До КШ выполнены развернутый анализ крови, оценка липидного профиля, до и после КШ проведены хемилюминесценция тромбоцитов, проточная цитометрия. Регистрация комбинированных конечных точек (увеличение класса стенокардии, увеличение класса сердечной недостаточности, инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК), кардиоваскулярная смерть, повторная реваскуляризация) проводилась после КШ спустя 8–10 сут в стационаре и через 23,3 ± 7,6 мес. Результаты. У 16 пациентов выявлены комбинированные конечные точки. При сравнении групп пациентов без нежелательных исходов и с ними установлены статистически значимые различия до КШ по количеству агрегатов моноцит-тромбоцит (13,4 [5,9; 24,2] против 34,9 [19,05; 50,25] %, р = 0,001), интенсивности флюоресценции (ИФ) агрегатов: нейтрофил тромбоцит, экспрессирующие Р-селектин (4,85 [2,99; 8,79] против 12,5 [5,09; 15,3] у.е., р = 0,005), ИФ моноцит-тромбоцит, экспрессирующие Р-селектин (4,27 [2,6; 7,76] против 9,53 [6,68; 14,8] у.е., р = 0,006). После КШ отличия определены в количестве нейтрофил-тромбоцитарных агрегатов с экспрессией Р-селектина (75,7 [62,36; 90,54] против 92,3 [80; 99,29] %, р = 0,027), ИФ нейтрофил-тромбоцитарных агрегатов (52,6 [18,975; 124] против 129 [95,8; 174], р = 0,014). Медиана времени выхода на максимум индуцированной хемилюминесценции (ХЛ) тромбоцитов с добавлением люцегинина до КШ меньше у пациентов с нежелательными событиями по сравнению с пациентами без нежелательных событий (212 [53; 621] против 885 [257,75; 2087] с, р = 0,032). Меньше до КШ в группе с нежелательными событиями и медиана времени выхода на максимум спонтанной ХЛ нейтрофилов с люцегинином (847 [565; 1018] против 1355 [1065,5; 1898,5] с, р = 0,017). Заключение. Пациенты с комбинированными нежелательными сердечно-сосудистыми явлениями имеют значимо различающиеся показатели индуцированной ХЛ и количества тромбоцит-лейкоцитарных агрегатов до и после КШ, времени достижения максимума ХЛ тромбоцитов и нейтрофилов до КШ, времени проведения искусственного кровообращения (ИК) в сравнении с пациентами без нежелательных сердечно-сосудистых событий. Данные показатели могут быть рассмотрены как предикторы повышенного риска развития нежелательных событий после КШ в дальнейших исследованиях.
Коронарное шунтирование, лейкоцит-тромбоцитарные агрегаты, Р-селектин, С-реактивный белок, нежелательные сердечно-сосудистые события
Короткий адрес: https://sciup.org/149150145
IDR: 149150145 | УДК: 616.12-089.844-036 | DOI: 10.29001/2073-8552-2025-40-4-101-112
Текст научной статьи Роль межклеточных агрегатов и показателей окислительного стресса в оценке риска сердечно-сосудистых исходов у пациентов после коронарного шунтирования
Coronary artery bypass grafting (CABG) is one of the primary surgical approaches for treating coronary heart disease (CHD). However, the postoperative period can be accompanied by adverse outcomes, including thrombotic and inflammatory complications [1].
Despite undergoing CABG, patients remain at risk of coronary events due to atherosclerosis progression or graft failure (arterial conduits or venous bypass grafts) [2]. During the first 5 postoperative years, the following graft occlusion rates are documented: 17.5% for great saphenous vein grafts (SVG), 2.3% and 13.5% for left and right internal thoracic artery grafts (LITA and RITA, respectively), and 9.4% for radial artery grafts (RA) [3]. Ten-year occlusion rates increase to 39% for SVG, 15% for LITA, 20–25% for RITA, and 11–15% for RA [4].
In recent decades, researchers have focused on biomarkers that may serve as predictors of such outcomes. Among these, P-selectin, C-reactive protein (CRP), circulating aggregates, low-density lipoprotein (LDL) levels, and platelet chemiluminescence (CL) have emerged as potential indicators of systemic inflammation and platelet activation. CRP is a marker of systemic inflammation and may reflect the body’s overall inflammatory response [5]. P-selectin, an adhesion molecule, plays a role in the formation of circulating aggregates, which can contribute to thrombus formation [6]. LDL can penetrate the vascular endothelial layer and interact with blood cells, exerting pro-inflammatory effects [7]. Platelet CL reflects the production of reactive oxygen species (ROS), which are key players in the pathogenesis of inflammation and thrombosis [8]. This paper presents the results of a comprehensive analysis of these biomarkers in patients with adverse outcomes following coronary artery bypass grafting (CABG), which may contribute to improved monitoring strategies and complication prevention in this patient population.
Aim
To compare the levels of C-reactive protein (CRP), circulating cell aggregates (including P-selectin-expressing aggregates), lipid profiles, and platelet chemiluminescence activity in patients with and without adverse cardiovascular events following coronary artery bypass grafting (CABG).
Material and Methods
A prospective cohort study included 102 patients (78 men and 24 women) with CHD, aged 47 to 78 years (median age 64 years [60; 68]). Atherosclerotic lesions of the coronary arteries were confirmed by coronary angiography (CAG), and aorto- or mammary-coronary bypass grafting was performed at the Federal Center for Cardiovascular Surgery in Krasnoyarsk.
All study procedures were performed following receipt of written informed consent from participants and in compliance with the ethical principles of the Declaration of Helsinki. The study protocol was approved by the Ethics Committee of the Krasnoyarsk State Medical University named after Prof. V.F. Voyno-Yasenetsky protocol (No. 35/2011 from 31.10.2011).
одобрен этическим комитетом Красноярского государственного медицинского университета им. проф. В.Ф. Во-йно-Ясенецкого (№ 35/2011 от 31.10.2011 г.).
Пациенты наблюдались в трех точках. В стационаре: до КШ, на 8–10-е сут после КШ и после выписки из стационара (контакт происходил по телефону в период 23,3 ± 7,6 мес. после КШ). Регистрировалась комбинированная конечная точка, которая включала госпитальные и отдаленные нежелательные сердечно-сосудистые события после КШ. В госпитальные нежелательные сердечно-сосудистые события входили: периоперационный инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК), сердечно-сосудистая смерть за 8–10 дней в период стационарного наблюдения за пациентом. В качестве отдаленных нежелательных сердечно-сосудистых событий регистрировались: увеличение ФК стенокардии, сердечной недостаточности, острый инфаркт миокарда (ОИМ), ОНМК, повторная реваскуляризация миокарда, сердечно-сосудистая смерть.
Для снижения риска геморрагических осложнений за 5 дней до КШ отменялись антиагреганты в соответствии с принятыми стандартами лечения ФЦССХ г. Красноярска: АСК в дозировке 100 мг назначалась с 1-х сут, клопидо-грел, 75 мг – со 2-х сут при перенесенном остром коронарном синдроме (ОКС) менее 1 года назад. На двойной антиагрегантной терапии находились 35,8% пациентов: АСК (100 мг) + клопидогрел (75 мг). Также пациенты получали ингибиторы АПФ / антагонисты ренин-ангио-тензиновых рецепторов, ингибиторы протонной помпы, β-адреноблокаторы, статины, антагонисты кальция, нестероидные противовоспалительные средства и наркотические анальгетики в раннем послеоперационном периоде; при наличии сахарного диабета – сахароснижающую терапию.
До КШ и на 8–10-е сут после КШ определяли биохимический анализ крови, методом проточной цитометрии исследовали тромбоцитарно-лейкоцитарные агрегаты (ТЛА), определяли ХЛ тромбоцитов. Концентрацию СРБ в плазме крови измеряли латексным иммунотурбидиме-трическим методом.
Определение ТЛА осуществлялось в общей фракции лейкоцитов методом проточной цитометрии с использованием панели моноклональных антител (Beckman Coulter, США; BioLegend, Германия), меченных с флу-орохромами: CD14-FITC (клон RMO52, кат. № B36297, Beckman Coulter, США), CD16-PE (клон 3G8, кат. № A07766 Beckman Coulter,), CD41-PC7 (Beckman Coulter, клон Р2, кат. № 6607115) и CD62P (BioLegend, клон AK4, кат. № 304910). Удаление эритроцитов из образцов проводили по безотмывочной технологии с использованием лизирующего раствора VersaLyse (Beckman Coulter, кат. № A09777), к 975 мкл которого ex tempore добавляли 25
Inclusion criteria: multivessel disease with hemodynamically significant coronary artery stenoses confirmed by CAG, stable exertional angina of functional classes II–IV according to the Canadian Cardiovascular Society classification, and signed informed consent.
Exclusion criteria: exacerbation of peptic ulcer disease, chronic kidney disease (glomerular filtration rate < 60 mL/ min/1.73 m²), transaminase levels exceeding three times the upper limit of normal, and intolerance to or inability to take clopidogrel and acetylsalicylic acid (ASA).
Patients were monitored at three time points: during hospitalization (prior to CABG and on days 8–10 post-CABG) and after discharge (follow-up was conducted via telephone over a period of 23.3 ± 7.6 months post-CABG). A composite endpoint was recorded, which included both in-hospital and long-term adverse cardiovascular events following CABG. In-hospital adverse cardiovascular events included perioperative myocardial infarction, acute cerebrovascular accident (ACVA), and cardiovascular death during the 8–10 days of inpatient observation. Long-term adverse cardiovascular events included an increase in the functional class of angina or heart failure, acute myocardial infarction (AMI), ACVA, repeat myocardial revascularization, and cardiovascular death.
To reduce the risk of hemorrhagic complications, antiplatelet therapy was discontinued 5 days prior to CABG in accordance with the treatment standards of the Federal Center for Cardiovascular Surgery in Krasnoyarsk. Acetylsalicylic acid (ASA) at a dose of 100 mg was prescribed starting from day 1, and clopidogrel at 75 mg was initiated on day 2 in cases of acute coronary syndrome (ACS) occurring less than a year prior. Dual antiplatelet therapy (DAPT) with ASA (100 mg) and clopidogrel (75 mg) was administered to 35,8% of patients. Additional medications included angiotensin-converting enzyme inhibitors/angiotensin receptor antagonists, proton pump inhibitors, β-blockers, statins, calcium channel antagonists, nonsteroidal antiinflammatory drugs, and narcotic analgesics in the early postoperative period. Patients with diabetes mellitus received glucose-lowering therapy.
Before CABG and on postoperative days 8–10, the following tests were performed: biochemical blood analysis, flow cytometry (the determination of platelet-leukocyte aggregates), platelet chemiluminescence assessment, and CRP concentration measurement. Plasma CRP levels were determined using the latex immunoturbidimetric method.
The determination of platelet-leukocyte aggregates was performed in the total leukocyte fraction using flow cytometry with a panel of monoclonal antibodies (manufactured by Beckman Coulter, USA, and BioLegend, Germany) labeled with fluorochromes: CD14-FITC (clone RMO52, cat. no. B36297, Beckman Coulter, USA), CD16-PE (clone 3G8, cat. no. A07766, Beckman Coulter), CD41-PC7 (clone P2, cat. no. 6607115, Beckman Coulter), and CD62P (clone AK4, cat. no. 304910, BioLegend). Erythrocytes were removed from samples using a no-wash technology with VersaLyse lysing solution (cat. no. A09777, Beckman Coulter), to which 25 µL of IOTest 3 Fixative Solution (cat. no. A07800, Beckman Coulter) was added ex tempore to 975 µL of the мкл фиксирующего раствора IOTest 3 Fixative Solution (Beckman Coulter, кат. № A07800). По завершении инкубации исследуемые образцы однократно отмывали от несвязавшихся моноклональных антител забуференным физиологическим раствором (5 мин при 400 g). Клеточный осадок ресуспендировали в 400 мкл забуференного физиологического раствора, содержавшего 1% нейтрального параформальдегида (кат. № HT5011, Sigma-Aldrich, США). По средней интенсивности флуоресценции (ИФ) оценивали уровень экспрессии CD62P и рецепторов на тромбоцитах в агрегатах с лейкоцитами. Анализ образцов проводили на проточном цитофлюориметре Navios™ (Beckman Coulter, США), оснащенном тремя диодными лазерами 405, 488 и 638 нм. Обработку цитофлуориме-трических данных осуществляли при помощи программ Navios Software v.1.2 и Kaluza™ v.2.2 (Beckman Coulter, США).
Для определения хемилюминесцентной активности тромбоцитов применяли метод поэтапного центрифугирования и отмывания клеток [8]. Реакционная смесь включала 50 мкл люцигенина или люминола в концентрации 50 мкг/мл, 50 мкл аденозиндифосфата (АДФ) 0,1 М (для оценки индуцированного синтеза АФК) и 250 мкл (для оценки спонтанного синтеза АФК) или 200 мкл (для оценки АДФ-индуцированного синтеза АФК) буфера (0,13 М NaCl, 0,02 М Трис-HCl буфера, 0,03 М ЭДТА, 0,015 М глюкозы, рН 7,4). Оценку спонтанной и АДФ-индуциро-ванной ХЛ осуществляли в течение 90 мин на 36-канальном биохемилюминесцентном анализаторе БЛМ-3607 (ООО «МедБиоТех», Россия) [9]. Определяли время выхода на максимум (Тmax), максимальное значение интенсивности (Imax), а также площадь под кривой (S) ХЛ. Усиление АДФ-индуцированной ХЛ оценивали отношением площади под кривой индуцированной ХЛ к площади под кривой спонтанной ХЛ (Sинд / Sспонт) и определяли как индекс активации (ИА). Уровень синтеза АФК тромбоцитами определялся с помощью двух индикаторов реакции ХЛ – люцигенина и люминола. Люцигенин не проникает внутрь клеток и взаимодействует только с супероксид анион-радикалом, характеризуя активность мембранной Nox2 (НАДФН-оксидаза). Люминол проникает внутрь клеток и взаимодействует со всеми АФК [6, 7].
Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ SPSS STATISTICS (версия 20.0). Для описания полученных данных вычисляли медиану ( Ме ) и интерквартильный промежуток [ Q1 ; Q3 ]. Для описания категориальных показателей использовали абсолютные и относительные (в процентах) частоты. Статистическую значимость различий между показателями независимых выборок оценивали с помощью непараметрического критерия Манна Уитни. Для сравнения категориальных переменных в двух независимых группах применяли χ 2 -критерий Пирсона. Пороговый уровень значимости при проверке статистических гипотез составлял 0,05.
Результаты
Характеристика пациентов по клинико-лабораторным признакам представлена в таблице 1.
Группы пациентов с ИБС с нежелательными сердечно-сосудистыми событиями и без таковых не отличались по полу, возрасту, клиническим характеристикам, количеству клеток крови по результатам общего анализа крови до КШ. Показаны значимые межгрупповые различия solution. Following incubation, the samples were washed once to remove unbound monoclonal antibodies using buffered saline (5 minutes at 400 g), and the cell pellet was resuspended in 400 µL of buffered saline containing 1% neutral paraformaldehyde (cat. no. HT5011, Sigma-Aldrich, USA).
The level of CD62P expression and receptor levels on platelets in aggregates with leukocytes were assessed based on mean fluorescence intensity (MFI). The analysis was performed on a Navios™ flow cytometer (Beckman Coulter, USA) equipped with three diode lasers (405, 488, and 638 nm). Flow cytometric data were processed using Navios Software v.1.2 and Kaluza™ v.2.2 (Beckman Coulter, USA).
To assess platelet chemiluminescence (CL) activity, platelets were isolated using a stepwise centrifugation and washing protocol [8]. The reaction mixture consisted of 50 μL of lucigenin or luminol at a concentration of 50 μg/mL, 50 μL of 0.1 M Adenosine diphosphate (ADP) (for evaluating ADP-induced reactive oxygen species [ROS] synthesis), and 250 μL (for spontaneous ROS synthesis) or 200 μL (for ADP-induced ROS synthesis) of buffer (0.13 M NaCl, 0.02 M Tris-HCl, 0.03 M EDTA, 0.015 M glucose, pH 7.4).
Spontaneous and ADP-induced CL were assessed over 90 minutes using a 36-channel biochemiluminescent analyzer (BLM-3607, MedBioTech, Russia) [9]. Parameters measured included the time to peak intensity (Tmax), maximum intensity (Imax), and the area under the curve (AUC) of CL. The enhancement of ADP-induced CL was evaluated as the ratio of the AUC of induced CL to that of spontaneous CL (Sind/Sspont) and was termed the activation index (AI).
ROS synthesis by platelets was determined using two CL indicators: lucigenin and luminol. Lucigenin does not penetrate cells and interacts specifically with superoxide anion radicals, reflecting the activity of membrane-bound NADPH oxidase (Nox2). In contrast, luminol penetrates cells and interacts with all ROS species [6, 7].
Statistical analysis was performed using IBM SPSS STATISTICS software (version 20.0). Continuous variables are presented as median ( Me ) with interquartile range [ Q1 ; Q3 ]. Categorical data are expressed as absolute frequencies and relative frequencies (percentages). Between-group comparisons were made using the nonparametric Mann Whitney U test for continuous variables and Pearson's chi-square test ( χ 2 ) for categorical variables. A two-tailed p-value < 0.05 was considered statistically significant.
Results
The clinical and laboratory characteristics of the patients are presented in Table 1.
The groups of CHD patients with and without adverse cardiovascular events did not differ in terms of sex, age, clinical characteristics, or blood cell counts in the complete blood count performed before CABG. Significant between-group differences were observed in total cholesterol levels, with a trend toward significance for LDL-C levels prior to CABG in patients experiencing adverse cardiovascular events compared to those free from adverse cardiovascular events. Additionally, the duration of cardiopulmonary bypass уровня общего холестерина и тенденция к увеличению уровня ЛПНП до КШ в группе пациентов с нежелательными сердечно-сосудистыми событиями. Также при КШ длительность искусственного кровообращения (ИК) была значимо больше в группе пациентов с нежелательными сердечно-сосудистыми событиями – 90 [66,5; 131,5] против 65,5 [31,75; 91,5] мин соответственно.
За весь период наблюдения у 16 пациентов (15,6%) выявлены комбинированные конечные точки. За 10 дней стационарного лечения у 10 пациентов развились нежелательные события (у 4 пациентов – периоперационный ИМ, у 6 пациентов – ОНМК). Через 23,3 ± 7,6 мес. выявлено 8 нежелательных кардиоваскулярных событий (из них: 1 – ОИМ, 3 – увеличение ФК стенокардии, 1 – повторная реваскуляризация, 2 – нарастание ФК сердечной недостаточности, 1 – сердечно-сосудистая смерть). При сравнении групп пациентов без и с совокупными неблагоприятными исходами до КШ выявлены значимые отличия по количеству агрегатов моноцит-тромбоцит (13,4 [5,9; 24,2] против 34,9 [19,05; 50,25] %, р = 0,001), ИФ агрегатов до КШ: нейтрофил тромбоцит, экспрессирующие Р-селектин (4,85 [2,99; 8,79] против 12,5 [5,09; 15,3] у.е., р = 0,005), ИФ моноцит-тромбоцит, экспрессирующие Р-селектин (4,27 [2,6; 7,76] против 9,53 [6,68; 14,8] у.е., р = 0,006).
В таблице 2 представлены результаты, полученные при сравнении двух групп пациентов с нежелательными событиями после КШ и без таковых, согласно основным параметрам ХЛ.
Медиана времени выхода на максимум индуцированной ХЛ тромбоцитов с добавлением люцегинина до КШ была меньше у пациентов с нежелательными явлениями по сравнению с пациентами без таковых (212 [53; 621] против 885 [257,75; 2087] с, р = 0,027). Также до КШ в группе с совокупными нежелательными сердечно-сосудистыми событиями меньше была медиана времени выхода на максимум спонтанной ХЛ нейтрофилов с люце-гинином (847 [565; 1018] против 1355 [1065,5; 1898,5] с, р = 0,017). До КШ медиана ИА ХЛ нейтрофилов была выше в группе пациентов с нежелательными событиями (9 [2; 15] против 2 [2; 7], р = 0,044). По другим показателям ХЛ значимых отличий установлено не было.
Пациенты из группы с нежелательными сердечно-сосудистыми событиями после КШ (на 10-е сут) имели большую медиану количества нейтрофил-тромбоцитар-ных агрегатов с экспрессией Р-селектина (92,3 [80; 99,29] против 75,7 [62,36; 90,54] %, р = 0,027) и значимо большую медиану ИФ нейтрофил-тромбоцитарных агрегатов (129 [95,8; 174] против 52,6 [18,975; 124], р = 0,014).
Обсуждение
Связь воспаления с тромбозом и нежелательными кардиоваскулярными событиями описана неоднократно [10]. Однако до конца не ясен молекулярно-клеточный механизм и не определены четкие маркеры сердечно-сосудистых событий. В данной статье мы провели комплексный анализ маркеров воспаления и межклеточного взаимодействия у пациентов с нежелательными сердечно-сосудистыми событиями после КШ.
Коммуникация тромбоцитов, нейтрофилов, моноцитов происходит в организме постоянно, например, посредством молекулы клеточной адгезии – Р-селектина, выделяемого α-гранулами тромбоцитов с экспрессией на тромбоцитарной мембране и Р-селектин лиганда на поверхности лейкоцита. Согласно полученным данным
(CPB) was longer in the group with adverse events, at 90 [66.5; 131.5] minutes compared to 65.5 [31.75; 91.5] minutes, respectively.
During the observation period, 16 patients (15.6%) experienced composite endpoints. Within 10 days of hospitalization, 10 patients developed adverse events (4 cases of perioperative myocardial infarction and 6 cases of acute cerebrovascular events). At 23.3 ± 7.6 months of followup, 8 adverse cardiovascular events were identified (1 acute myocardial infarction, 3 cases of increased functional class of angina, 1 repeat revascularization, 2 cases of worsening functional class of heart failure, and 1 cardiovascular death).
Comparative analysis between patients without and with composite adverse outcomes prior to CABG revealed significant differences in: monocyte-platelet aggregates: 13.4% [5.9; 24.2] vs 34.9% [19.05; 50.25], p = 0.001; MFI of P-selectin-expressing neutrophil-platelet aggregates: 4.85 AU [2.99; 8.79] vs 12.5 AU [5.09; 15.3], p = 0.005; MFI of P-selectin-expressing monocyte-platelet aggregates: 4.27 AU [2.6; 7.76] vs 9.53 AU [6.68; 14.8], p = 0.006.
A comparison of the primary CL parameters between two groups of patients—those with adverse events after CABG and those without such events—yielded the following results. (Table 2).
The median time to peak lucigenin-induced platelet chemiluminescence before CABG was shorter in patients with adverse events compared to those without adverse events (212 s [53; 621] vs. 885 s [257.75; 2087], p = 0.032). Similarly, before CABG, the median time to peak spontaneous neutrophil chemiluminescence with lucigenin was shorter in the group with composite major adverse cardiovascular events (847 s [565; 1018] vs. 1355 s [1065.5; 1898.5], p = 0.017). Before CABG, the median neutrophil chemiluminescence activation index was higher in the group of patients with adverse events (9 [2; 15] vs. 2 [2; 7], p = 0.044). No significant differences were found in other chemiluminescence parameters.
Patients from the group with major adverse cardiovascular events after CABG (on day 10) had a higher median number of neutrophil-platelet aggregates expressing P-selectin (92.3% [80; 99.29] vs. 75.7% [62.36; 90.54], p = 0.027) and a significantly higher MRI of neutrophil-platelet aggregates (129 [95.8; 174] vs. 52.6 [18.975; 124], p = 0.014).
Discussion
The association between inflammation, thrombosis, and adverse cardiovascular events has been repeatedly described in the literature [10]. However, the molecular and cellular mechanisms, as well as precise markers of cardiovascular events, remain unclear. In this study, we conducted a comprehensive analysis of the markers of inflammation and intercellular interactions in patients with adverse cardiovascular events following CABG.
The communication between platelets, neutrophils, and monocytes occurs continuously in the body, mediated, for example, by the cell adhesion molecule P-selectin, which is released by platelet α-granules and expressed on the platelet membrane, and P-selectin ligand on the leukocyte surface. According to the obtained data, the number of monocyte-platelet aggregates expressing P-selectin on their
Таблица 1 . Клинико-лабораторная характеристика пациентов с ишемической болезнью сердца до коронарного шунтирования
Table 1 . Clinical characteristics of patients with coronary artery disease before coronary artery bypass grafting
|
Показатель / Characteristic |
Пациенты с ИБС и КШ, n = 102 / Patients with CHD and CABG, n = 102 |
Пациенты без нежелательных сердечно-сосудистых событий, n = 86 / Patients without adverse cardiovascular events, n = 86 |
Пациенты с нежелательными сердечно-сосудистыми событиями, n = 16 / Patients with adverse cardiovascular events, n = 16 |
р* / р-value* |
|
Возраст, лет / Age, years |
64 [60; 68] |
64 [60; 68] |
65 [56; 67] |
0,381 |
|
Курение, % / Smoking, % |
32,4 |
31,4 |
37,5 |
0,632 |
|
Стабильная стенокардия, % / Stable angina, % II ФК / II FC III ФК / III FC |
44,1 41,2 |
44,2 41,8 |
43,8 37,5 |
0,974 0,745 |
|
Сахарный диабет, % / Diabetes mellitus, % |
28,4 |
26,7 |
37,5 |
0,381 |
|
Постинфарктный кардиосклероз, % / Post-infarction cardiosclerosis, % |
63,7 |
61,6 |
75 |
0,085 |
|
Ожирение, % / Obesity, % |
49,0 |
48,8 |
50 |
0,932 |
|
Двойная антитромбоцитарная терапия после КШ, % / Dual antiplatelet therapy after CABG, % |
35,8 |
38,4 |
31,2 |
0,588 |
|
Время ИК, мин / CPB time, min |
68 [50,25; 99] |
65,5 [31,75; 91,5] |
90 [66,5; 131,5] |
0,003 |
|
Количество тромбоцитов до КШ, 109 клеток/л / Platelet count before CABG, 109 cells/l |
229,5 [188; 260,5] |
230,5 [191; 258,5] |
201 [179,5; 251,5] |
0,811 |
|
Количество моноцитов до КШ, % / Monocyte count before CABG, % |
8,3 [6,5; 9,35] |
8,35 [6,9; 9,3] |
7,9 [6,15; 9,725] |
0,785 |
|
Количество нейтрофилов, % / Neutrophil count, % |
60,9 [54; 66,5] |
60,9 [53,5; 66,4] |
65,55 [58,93; 67,86] |
0,364 |
|
СОЭ, мм в час / ESR, mm per hour |
19,5 [11,3; 27,8] |
19 [12; 30] |
22 [9,3; 26] |
0,840 |
|
СРБ, мг/л / CRP, mg/l До КШ / Before CABG После КШ (8–10-е сут) / After CABG (8-10 days) |
1 [0,1; 1,9] 50,4 [18,6; 95,5] |
1 [0,1; 2,4] 43,7 [18,5; 88,9] |
1 [0,15; 1,2] 72,5 [50,2; 123,83] |
0,532 0,320 |
|
Уровень общего холестерина, ммоль/л / Total cholesterol level, mmol/l |
4,43 [3,76; 5,6] |
4,34 [3,73; 5,43] |
4,88 [4,3; 6,68] |
0,046 |
|
Уровень ЛПНП, ммоль/л / LDL-С level, mmol/l |
2,5 [2,06; 3,27] |
2,23 [1,99; 2,98] |
2,79 [2,54; 3,47] |
0,060 |
|
Уровень ЛПВП, ммоль/л / HDL-C level, mmol/L |
1,27 [1,08; 1,41] |
1,26 [1,07; 1,39] |
1,39 [1,12; 1,54] |
0,178 |
|
Уровень ТГ, ммоль/л / TG level, mmol/L |
1,35 [0,95; 1,9] |
1,38 [0,94; 2,06] |
1,17 [1,07; 1,66] |
0,830 |
Примечание: * значение р представлено для сравнения групп пациентов с нежелательными событиями и без них. Note: *p-values are presented to compare patient groups with and without adverse cardiovascular events. CABG, coronary artery bypass grafting; CHD, coronary heart disease; FC, functional class; CBP, cardiopulmonary bypass; ESR, erythrocyte sedimentation rate; CRP, C-reactive protein; LDL, low density lipoprotein.
количество экспрессируемых Р-селектин на своей поверхности моноцит-тромбоцитарных агрегатов до КШ выше в группе с нежелательными сердечно-сосудистыми событиями в послеоперационном периоде. Согласно имеющимся литературным данным, повышенный уровень растворимого в сыворотке крови P-селектина связан с повышенным риском отсроченных больших (ИМ, ОНМК, сердечно-сосудистая смерть) сердечно-сосудистых событий у пациентов после реваскуляризации [6]. Также описана связь уровня Р-селектина с сердечно-сосудистыми заболеваниями, сердечно-сосудистой смертностью и внезапной сердечной смертью среди мужчин, находящихся на гемодиализе [11]. Доказано, что повышение концентрации Р-селектина в крови и его экспрессии на тромбоцитах и эндотелии способствует прогрессированию атеросклероза [12]. Однако такой маркер, как межклеточные агрегаты могут быть более чувствительным маркером нежелательных событий [13].
Образование ТЛА является одним из наиболее важных взаимодействий между тромбоцитами и лейкоцитами. У здоровых людей тромбоциты образуют агрегаты преимущественно с моноцитами (4,1–7,2%), а также с нейтрофилами (3,7–5,7%) и лимфоцитами (2,4–5,2%). [13]
В литературе ТЛА широко исследовались при сердечно-сосудистых заболеваниях. Уровень ТЛА, включая моноциты или нейтрофилы, был выше при симптоматической ИБС, ОКС по сравнению со здоровыми людьми surface before CABG was higher in the group with adverse cardiovascular events in the postoperative period. Literature data also suggest that elevated levels of serum-soluble P-selectin are associated with an increased risk of delayed major cardiovascular events (MI, stroke, cardiovascular death) in patients after revascularization [6]. Moreover, the relationship between P-selectin levels and cardiovascular diseases, cardiovascular mortality, and sudden cardiac death has been described in men undergoing hemodialysis [11]. It has been shown that elevated P-selectin concentrations in the blood and its expression on platelets and endothelium contribute to the progression of atherosclerosis [12]. However, markers such as intercellular aggregates may serve as more sensitive indicators of adverse events [13].
The formation of platelet-leukocyte aggregates (PLAs) is one of the most critical interactions between platelets and leukocytes. In healthy individuals, platelets predominantly form aggregates with monocytes (4.1–7.2%), as well as with neutrophils (3.7–5.7%) and lymphocytes (2.4–5.2%) [13]. According to the results of this study, the pre-CABG MFI, reflecting P-selectin and membrane receptor expression on monocyte-platelet and neutrophil-platelet aggregates, postoperative (days 8-10) neutrophil-platelet aggregate MFI levels, significantly could influences on the risks of adverse cardiovascular events. It is likely that more active PLA complexes may lead to the activation of thrombosis in the postoperative period.
Таблица 2 . Сравнение двух групп пациентов после коронарного шунтирования по основным параметрам хемилюминесценции
|
Показатель / Parameters |
Пациенты без нежелательных сердечно-сосудистых событий / Patients without adverse cardiovascular events |
Пациенты с нежелательными сердечно-сосудистыми событиями / Patients with adverse cardiovascular events |
р / р-value* |
До КШ / Before CABG
Хемилюминесцентная активность тромбоцитов с люминолом
Спонтанная хемилюминесценция / / Spontaneous Luminol-Dependent CL of Platelets
|
Tmax, с |
212,5 [51; 960] |
51 [0; 133] |
0,061 |
|
Imax, о.е. × 103 |
73 [63; 94,3] |
79 [59,3; 119] |
0,862 |
|
S, о.е. × с × 106 |
200200 [132500; 268625] |
226700 [177200; 262600] |
0,880 |
Индуцированная хемилюминесценция / ADP-Induced Luminol-Dependent CL of Platelets
|
Tmax, с |
129 [27; 884,25] |
70 [51; 266] |
0,528 |
|
Imax, о.е. × 103 |
74 [62,75; 91,25] |
78 [62,75; 115,5] |
0,853 |
|
S, о.е. × с × 106 |
217500 [156225; 285575] |
248500 [144600; 261700] |
0,792 |
|
ИА |
1,084 [0,836; 1,529] |
1,076 [0,830; 1,818] |
0,736 |
Хемилюминесцентная активность тромбоцитов с люцегинином
Спонтанная хемилюминесценция / Spontaneous Lucigenin-Dependent CL of Platelets
|
Tmax, с |
408 [80; 1234] |
283 [70; 559] |
0,340 |
|
Imax, о.е. × 103 |
66 [61; 76,5] |
66 [60,5; 69] |
0,530 |
|
S, о.е. × с × 106 |
204850 [130150; 261275] |
177300 [94610; 226100] |
0,246 |
Индуцированная хемилюминесценция / ADP-Induced Lucigenin-Dependent CL of Platelets
|
Tmax, с |
885 [257,75; 2087] |
212 [53; 621] |
0,027 |
|
Imax, о.е. × 103 |
67 [59,75; 78] |
64 [58,3; 72,3] |
0,284 |
|
S, о.е. × с × 106 |
227900 [131925; 273975] |
203100 [118600; 238700] |
0,215 |
|
ИА |
1,0 [0,766; 1,455] |
0,9223 [0,788; 1,345] |
0,924 |
После КШ / After CABG
Хемилюминесцентная активность тромбоцитов с люминолом
Спонтанная хемилюминесценция / Spontaneous Luminol-Dependent CL of Platelets
|
Tmax, с |
102 [51; 460,5] |
38,5 [0; 815] |
0,363 |
|
Imax, о.е. × 103 |
72 [63,5; 104,5] |
81 [63; 93] |
0,897 |
|
S, о.е. × с × 106 |
218100 [142350; 269150] |
185850 [142525; 331175] |
0,974 |
Индуцированная хемилюминесценция / ADP-Induced Luminol-Dependent CL of Platelets
|
Tmax, с |
80 [0; 546,5] |
89 [56; 661,75] |
0,502 |
|
Imax, о.е. × 103 |
74 [63,5; 90,5] |
71 [63; 90] |
0,711 |
|
S, о.е. × с × 106 |
207300 [130900; 284150] |
158450 [128850; 206525] |
0,178 |
|
ИА |
0,984 [0,694; 1,261] |
0,884 [0,602; 1,140] |
0,172 |
Хемилюминесцентная активность тромбоцитов с люцегинином
Спонтанная хемилюминесценция / Spontaneous Lucigenin-Dependent CL of Platelets
|
Tmax, с |
399 [99; 1156] |
563,5 [126,75; 1702] |
0,515 |
|
Imax, о.е. × 103 |
64 [59; 77,5] |
65 [60; 72] |
0,914 |
|
S, о.е. × с × 106 |
199900 [151000; 252250] |
196650 [176225; 222025] |
0,739 |
Индуцированная хемилюминесценция / ADP-Induced Lucigenin-Dependent CL of Platelets
|
Tmax, с |
565 [260,5; 1451] |
222 [75,5; 1274] |
0,302 |
|
Imax, о.е. × 103 |
64 [59,5; 72] |
64 [62; 78] |
0,830 |
|
S, о.е. × с × 106 |
187000 [139350; 251350] |
163400 [120400; 200850] |
0,172 |
|
ИА |
0,982 [0,601; 1,333] |
0,992 [0,575; 1,098] |
0,523 |
Примечание: ИА – индекс активации.
Note: * – p-values, CABG, coronary artery bypass grafting; CL, chemiluminescence; ADP, adenosine diphosphate; AI, activation index.
-
[1 4]. Аналогичным образом уровни агрегатов тромбоцитов-моноцитов были выше у пациентов с ОКС с подъемом сегмента ST, нестабильной стенокардией, ОИМ по сравнению с пациентами с неангинозными болями [15]. Более того, повышенный процент ТЛА, содержащих моноциты, был связан с повышенным риском будущих сердечно-сосудистых событий в популяции с ОКС с подъемом сегмента ST [15].
Опубликовано достаточно много данных о влиянии количества отдельных популяций клеток крови на ранние и отдаленные неблагоприятные исходы после КШ (ней-трофил-лимфоцитарное соотношение, тромбоцит-лим-фоцитарное, индекс системного воспаления (нейтро-фил*тромбоцит / лимфоцит)) [16].
Доказано, что в процессе активации тромбоциты осуществляют усиленный синтез АФК ферментами, локализованными как на внешней цитоплазматической мембране, так и внутри клетки (в том числе в митохондриях) [17]. Для тромбоцитов АФК являются сигнальными и регуляторными молекулами, которые инициируют и модулируют их функциональную активность. Синтез АФК в нашем исследовании определен методом ХЛ. Выявлено отличие во времени достижения максимума индуцированной ХЛ тромбоцитов и время достижения максимума спонтанной ХЛ нейтрофилов с люцегинином до КШ – оно значимо меньше у пациентов с нежелательными явлениями по сравнению с пациентами без нежелательных событий. Более короткое время выхода на максимум ХЛ (у пациентов с нежелательными событиями) свидетельствует о том, что NADPH-оксидаза (Nox2) активируется быстрее и генерирует больше АФК за короткий промежуток времени. Это приводит к резкому увеличению концентрации АФК, что может превысить возможности антиоксидантных систем (например, супероксиддисмутазы, каталазы) и вызвать окислительный стресс. Возможно, у пациентов из группы без нежелательных событий лучше работают компенсаторные механизмы, способные сдерживать в последующем быстрый синтез АФК. Так, описана способность тромбоцита подавлять наработку АФК полиморфно-ядерными лейкоцитами и оказывать защитный эффект от токсического действия АФК [18].
С другой стороны, ранее описано, что у резистентных к АСК пациентов с ИБС до и после КШ по сравнению с чувствительными пациентами выявляется меньший уровень синтеза супероксид-радикала нейтрофилами и тромбоцитами, вероятнее всего, вызванный разобщением в межклеточном взаимодействии [19]. Может быть нечто подобное происходит и у пациентов с высоким риском нежелательных событий. Однако, учитывая отсутствие отличий по другим параметрам ХЛ и размер выборки, серьезные выводы преждевременны.
Следующим компонентом комплексной оценки в данном исследовании был СРБ. Пациенты без нежелательных событий и с таковыми имели сопоставимо низкий дооперационный уровень СРБ, ввиду планового вмешательства в стационар госпитализировались стабильные пациенты, с компенсированными сопутствующими заболеваниями. После проведения КШ уровень СРБ повышался, однако также оставался сопоставимым внутри групп, хотя у пациентов из группы с нежелательными событиями уровень СРБ был выше, но разница не достигала статистической значимости. Возможно, уровень СРБ больше подвержен влиянию операционной травмы и может оказаться не таким чувствительным маркером имен-
In the literature, PLAs have been extensively studied in the context of cardiovascular diseases. Elevated PLA levels, including those containing monocytes or neutrophils, have been observed in symptomatic CHD and acute coronary syndrome (ACS) compared to healthy individuals [14]. Similarly, platelet-monocyte aggregate levels were higher in patients with STEMI, unstable angina, and acute myocardial infarction compared to patients with non-anginal pain [15]. Moreover, an increased percentage of PLAs containing monocytes has been associated with a higher risk of future cardiovascular events in the STEMI population [15].
Numerous published studies have investigated the influence of various blood cell populations on early and late adverse outcomes after CABG, including the neutrophil-to-lymphocyte ratio, platelet-to-lymphocyte ratio, and systemic inflammation index (neutrophil*platelet/lymphocyte) [16].
It has been demonstrated that activated platelets exhibit increased ROS synthesis through enzymes located both on the outer cytoplasmic membrane and inside the cell (including within mitochondria) [17]. In platelets, ROS act as signaling and regulatory molecules that initiate and modulate their functional activity. In our study, ROS synthesis was determined using the chemiluminescence method. A difference was found in the time to peak induced platelet CL and time to peak spontaneous neutrophil CL with lucigenin before CABG - it was significantly shorter in patients with adverse events compared to patients without adverse outcomes. The shorter time to peak CL (in patients with adverse events) indicates that NADPH oxidase (Nox2) is activated faster and generates more reactive oxygen species (ROS) over a short period of time. This leads to a sharp increase in ROS concentration, which may exceed the capacity of antioxidant systems (e.g., superoxide dismutase, catalase) and cause oxidative stress. This may suggest that patients in the no-adverse-events group have better compensatory mechanisms capable of subsequently restraining rapid ROS synthesis. It has been described that platelets can suppress ROS production by polymorphonuclear leukocytes and provide a protective effect against the toxic impact of ROS [18].
On the other hand, previous studies have reported that CHD patients resistant to acetylsalicylic acid (ASA) show lower levels of superoxide radical synthesis by neutrophils and platelets both before and after CABG compared to ASA-sensitive patients. This is likely due to disruption in intercellular interactions [19]. A similar phenomenon might occur in patients at high risk of adverse events. However, considering the absence of differences in other chemiluminescence parameters and the sample size, definitive conclusions remain premature.
Another component of the comprehensive assessment in this study was CRP. Patients with and without adverse events had comparable low preoperative CRP levels, as stable patients with compensated comorbidities were hospitalized for the planned intervention in the hospital. After CABG, CRP levels increased but remained comparable between the groups. Although CRP levels were higher in the group with adverse events, the difference did not reach statistical significance. It is possible that CRP levels are more influenced by surgical trauma and may not be as sensitive a marker specifically after CABG as P-selectin levels and но после КШ, как уровни Р-селектина и межклеточных агрегатов. Это согласуется с данными других авторов [5]. Еще одним фактором риска нежелательных событий после КШ может выступать время ИК. У пациентов с нежелательными сердечно-сосудистыми событиями после КШ было значимо более продолжительное время ИК. Эти данные согласуются с результатами работ и других авто- ров [20]. Схема предполагаемого патогенеза увеличения рисков развития нежелательных явлений после КШ пред- ставлена на рисунке 1.
Ограничениями данного исследования являются его одноцентровый дизайн и небольшой размер выборки.
intercellular aggregates. This aligns with the findings of other authors [5].
Another predictor of in-hospital adverse events after
CABG is the duration of cardiopulmonary bypass (CPB). Prolonged CPB duration is associated with an increased risk of adverse cardiovascular events in the early postoperative period. These findings are consistent with results reported by other authors [20]. The proposed pathogenesis of increased adverse event risks following CABG is shown in Figure 1.
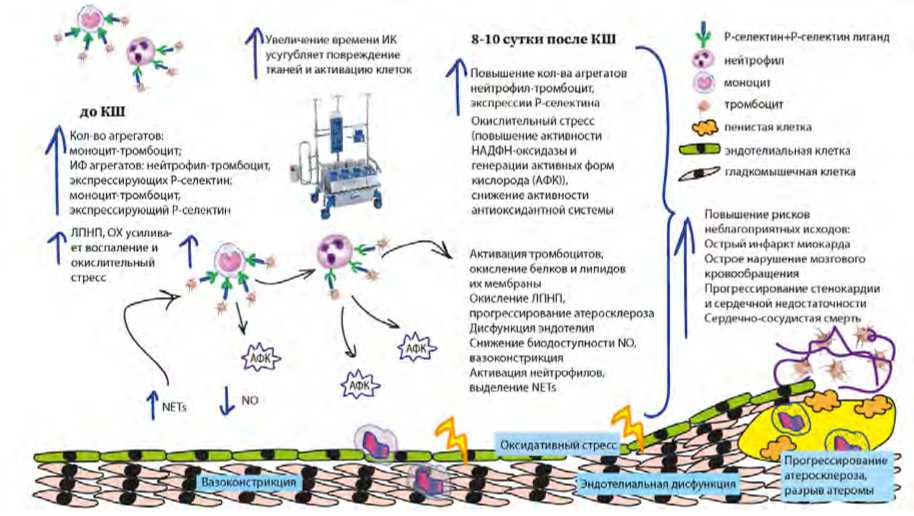
^^
Афл
'АФК
Оксидативныи стресс
Вазоконстрикций
8-10 сутки после КШ до КШ
Г < J эндотелиальная клетка гладкомышечная клетка
АФК1
Увеличение времени ИК I усугубляет повреждение I тканей и активацию клеток
ЛПНП, ОХ усиливает воспаление и окислительны» стресс
Активация тромбоцитов, окисление белков и липидов их мембраны Окисление ЛПНП, прогрессирование атеросклероза Дисфункция эндотелия Снижение биодоступности МО, ва юконстри кция Активация нейтрофилов, выделение NETS
Повышение рисков неблагоприятных исходов: Острый инфаркт миокарда Острое нарушение мозгового кровообращения Прогрессирование стенокардии и сердечной недостаточности Сердечно-сосудистая смерть
Повышение кол-ва агрегатов ней трофил- тромбоцит, экспрессии Р-селектина Окислительный стресс (повышение активности НАДФН оксидазы и генерации активных форм кислорода (АФЮ), снижение активности антиоксидантной системы
Кол во агрегатов: моноцит-тромбоцит;
ИФ агрегатов: нейтрофил-тромбоцит, экспрессирующих Рчелектин;
моноцит-тромбоцит.
экспрессирующий Р-селектин
^эЖ^^^Д^Ж^" ^^ Прогрессирование Иатеросклероза, Эндотелиальная дио^цил^^ pJjpuB леромы
*|f Р<електин+Р-селектин лиганд
% нейтрофил моноцит
4 тромбоцит
Т мст L NO
NETs у|е
Рис. 1. Патогенетический механизм повышения рисков развития нежелательных событий после коронарного шунтирования
Примечание: КШ – коронарное шунтирование, ИК – искусственное кровообращение, АФК – активные формы кислорода, ОХ – общий холестерин, ЛПНП – липопротеиды низкой плотности, NO – оксид азота, NETs – нейтрофильные внеклеточные ловушки, НАДФН-оксидаза – никотинамидаде-ниндинуклеотидфосфат-оксидаза.
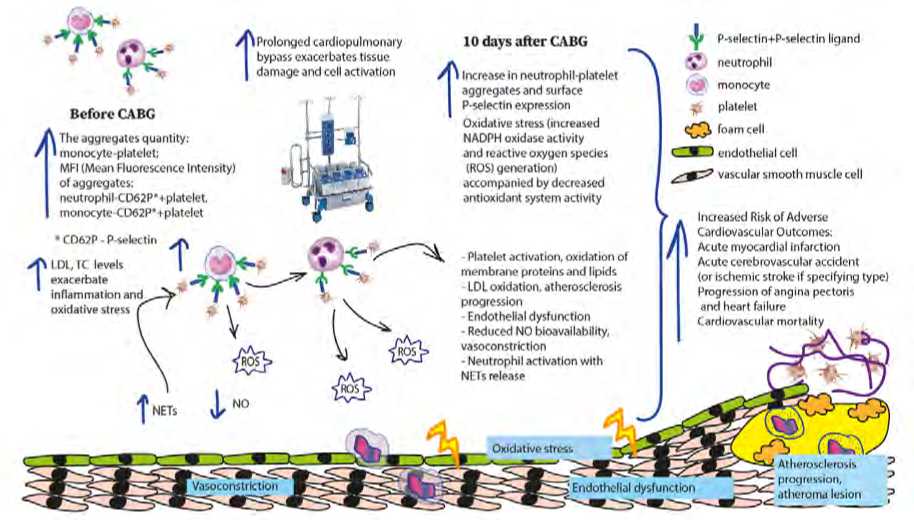
ROS
NETs
Oxidative stress
Vasoconstriction
Endothelial dysfunction
T Prolonged cardiopulmonary bypass exacerbates tissue damage and cell activation
• CD62P - P-selectin
LDLK levels exacerbate inflammation and oxidative stress (
ROS monocyte platelet
*|z P-selectin+P-selectin ligand
** neutrophil dKD endothelial cell
^Ж-^ vascular smooth muscle cell
Atherosclerosis progression, atheroma lesion
Before CABG у \ The aggregates quantity;
/ I monocyte-platelet:
MFI (Mean Fluorescence Intensity) of aggregates:
neutrophil CD62P*< platelet.
monocyte CD62P*+platelet
10 days after CABG
Increase In neutrophil-platelet aggregates and surface P-selectin expression Oxidative stress (increased NADPH oxidase activity and reactive oxygen species (ROS) generation) accompanied by decreased antioxidant system activity
Platelet activation, oxidation of membrane proteins and lipids LOL oxidation, atherosclerosis
Increased Risk of Adverse
Cardiovascular Outcomes;
Acute myocardial infarction
Acute cerebrovascular accident (or ischemic stroke if specifying type) Progression of angina pectoris and heart failure
Cardiovascular mortality progression
- Endothelial dysfunction
- Reduced NO bioavallability, vasoconstriction
- Neutrophil activation with NETs release
Fig. 1. Pathogenetic mechanism of elevated adverse event risks after CABG
Note: CABG – coronary artery bypass grafting, CPB – cardiopulmonary bypass, ROS – reactive oxygen species, TC – total cholesterol, LDL – low-density lipoproteins, NO – nitric oxide, NETs – neutrophil extracellular traps, NADPH oxidase – nicotinamide adenine dinucleotide phosphate oxidase.
Заключение
Таким образом, пациенты с комбинированными нежелательными сердечно-сосудистыми явлениями имеют большие показатели ИФ и большее количество тромбо-цит-лейкоцитарных агрегатов до и после КШ, более короткое время достижения максимума ХЛ тромбоцитов и нейтрофилов до КШ, более продолжительное время проведения ИК по сравнению с пациентами без нежелательных сердечно-сосудистых событий. Данные показатели могут быть рассмотрены как предикторы повышенного риска развития нежелательных событий после КШ в дальнейших исследованиях.
Conclusion
Therefore, patients experiencing combined adverse cardiovascular events exhibited significantly elevated fluorescence intensity and platelet-leukocyte aggregate counts (both pre- and post-CABG), significantly faster platelet and neutrophil chemiluminescence peaks pre-CABG, and longer CPB duration compared to event-free patients. These biomarkers can serve as predictors of increased post-CABG adverse event risk in subsequent investigations.
Study limitations : single-center design, small sample size.


