Роль морфологических изменений паравентрикулярного ядра гипоталамуса и тиротропоцитов аденогипофиза в формировании тиреопатий
Автор: Полякова Л.В., Калашникова С.А., Самусев Р.П., Краюшкин А.И., Фогель А.В., Калашникова Е.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 т.21, 2024 года.
Бесплатный доступ
Тиреопатии включают обширную группу заболеваний щитовидной железы, которые могут быть ассоциированы с синдромом хронической эндогенной интоксикации при различных соматических заболеваниях. Системное влияние эндогенных токсических соединений затрагивает также центральное звено регуляции эндокринной системы, где ведущую роль играет паравентрикулярное ядро гипоталамуса и тиротропоциты аденогипофиза. В связи с этим целью настоящего исследования было выявить закономерности изменений паравентрикулярного ядра и тиротропоцитов аденогипофиза. Исследование было выполнено на белых беспородных крысах самцах массой 120-200 г с моделированием хронической эндогенной интоксикации и оценкой периода после прекращения токсического воздействия. Животные выводились на 67, 90, 120 и 150-е сутки эксперимента с последующим гистологическим исследованием гипоталамуса и гипофиза. Было установлено, что морфологические изменения характеризовались проявлением неспецифических адаптационно-компенсаторных процессов паравентрикулярного ядра и тиротропоцитов, которые проявлялись в виде снижения биологической активности клеток и относительным ее восстановлением к окончанию эксперимента, что морфологически проявлялось в виде увеличения нейросекрета клеток паравентрикулярного ядра, увеличения процента полиядрышковых клеток, а также развития дистрофических изменений тиротропоцитов с появлением клеток «тиреоидэктомии». Относительная компенсация данных патологических изменений происходила на 150-е сутки эксперимента с восстановлением синтетической функции клеток, что проявлялось в виде нормализации ядерно-цитоплазматического соотношения и равномерного распределения субстанции Ниссля. Учитывая тот факт, что щитовидная железа находится под контролем гипоталамо-гипофизарной системы, данные патологические изменения могут играть ключевую роль в развитии тиреопатий при синдроме хронической эндогенной интоксикации.
Паравентрикулярное ядро, гипоталамус, тиротропоциты, гипофиз, щитовидная железа, тиреопатия, эндогенная интоксикация
Короткий адрес: https://sciup.org/142242050
IDR: 142242050 | УДК: 616-091.816
Текст научной статьи Роль морфологических изменений паравентрикулярного ядра гипоталамуса и тиротропоцитов аденогипофиза в формировании тиреопатий
Морфофункциональная перестройка щитовидной железы (ЩЖ) находится под контролем гипоталамо-гипофизарной системы, где первичным уровнем регуляции является гипоталамус и его нейросекреторные ядра [1, 2]. В гипоталамусе имеется большое представительство ядер, которые вырабатывают либери-ны и статины, в том числе тиролиберин и тиро-статин медиальной части паравентрикулярного ядра гипоталамуса. Эффекты тиролиберина не ограничиваются эндокринными клетками гипофиза, о чем свидетельствует широкое представительство рецепторов (TRH-R1, TRH-R2) в различных отделах центральной нервной системы (кора головного мозга и мозжечка, гиппокамп, ствол мозга, спинной мозг), а также активация вторичных внутриклеточных мессенджеров через многокомпонентную систему рецепторов G-белка (GPCR). Известно, что только одна треть от всего вырабатываемого тиролиберина касается гипоталамо-гипофизарной оси, что не только приводит к морфофункциональным изменениям ЩЖ, но и регулирует функцию органов, находящихся под контролем отделов центральной нервной системы, вовлеченных в патогенез развития эндотоксинового шока, боли, а также физиологических циркадных ритмов, двигательной активности, вегетативной регуляции [3]. Таким образом, тиролиберин может играть важную роль в патогенезе соматических заболеваний, сопровождающихся синдромом хронической эндогенной интоксикации (ХЭИ). В экспериментальных исследованиях установлено, что при однократном введении бактериального липополисахарида (ЛПС) при полном отсутствии клинических симптомов была выяв- лена дизрегуляция секреции тиролиберина и тиреотропного гормона [4]. Известно, что при развитии инфекционных заболеваний, что подразумевает наличие эндогенной интоксикации, происходят нарушения в гипоталамо-гипофи-зарно-тиреоидной системе, однако данные о структурно-функциональных изменениях органов эндокринной системы отсутствуют. В связи с этим выявление структурных нарушений паравен-трикулярных ядер гипоталамуса и тиротропоци-тов гипофиза являются актуальной проблемой современной эндокринологии.
ЦЕЛЬ РАБОТЫ
Установить закономерности структурнофункциональных изменений органов гипотала-мо-гипофизарной системы крыс при хронической эндогенной интоксикации.
МЕТОДИКА ИССЛЕДОВАНИЯ
Нами были изучены органы центральной эндокринной системы (гипоталамус, гипофиз) 70 белых беспородных крыс массой 130–200 г при моделировании ХЭИ в течение 60 суток и после прекращения токсического воздействия длительностью 7, 30, 60 и 90 суток. Экспериментальные группы были подразделены следующим образом: 60, 60 + 7, 60 + 30, 60 + 60, 60 + 90 суток, контрольная группа. Для моделирования ХЭИ использовали модель сочетанного введения ЛПС и тетрахлорметана (ТХМ), разработанную в Волгоградском государственном медицинском университете [5].
Животные содержались в стандартных условиях согласно межгосударственному стандарту «Руководство по содержанию и уходу за лабораторными животными» ГОСТ 332162014, получали корма в соответствии с ГОСТ Р 50258-92 «Комбикорма полнорационные для лабораторных животных».
Выведение животных из эксперимента производили путем передозировки нембутало-вого наркоза с последующим забором органов для гистологического исследования, которое включало окраску гемато-ксилином и эозином, по Нисслю, по Маллори.
Анализ изображений производился с помощью аппаратно-программного комплекса для визуализации LASv4 фирмы Leica.
Статистический анализ был произведен с помощью программы Graph Pad Prism 8.0.1.244 с определением распределения нормальности по критерию Шапиро – Уилка с достоверностью p < 0,05. Морфометрические параметры включали в себя расчет объема ядра по формуле Vя =πlb2 / 6, где l – больший диаметр в мкм; b – меньший диаметр ядра в мкм; объема ядрышка Vя-ка = πd3 / 6, где d – диаметр ядрышка, мкм; объемной доли полиядрышковых клеток (ОД,%); объемной доли нейросекрета в клетках (ОД, %); ядерно-цитоплазматического соотношения (ЯЦО) по формуле ЯЦО = Sя/Sц, где Sя – площадь ядра клетки, мкм2; Sц – площадь цитоплазмы, мкм2 объемной доли сосудов (ОД, %).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
При исследовании паравентрикулярного ядра гипоталамуса (ПВЯ) после прекращения токсического воздействия на 7-е сутки (группа 60 + 7) было установлено, что морфологические изменения нейросекреторных клеток включали достаточно плотное их расположение, где определялись крупные нейроны с отчетливо расположенным ядром и ядрышком (рис. 1).
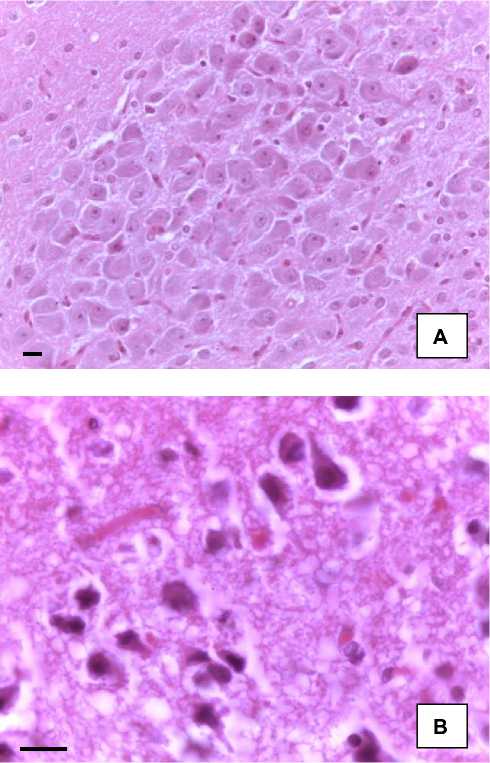
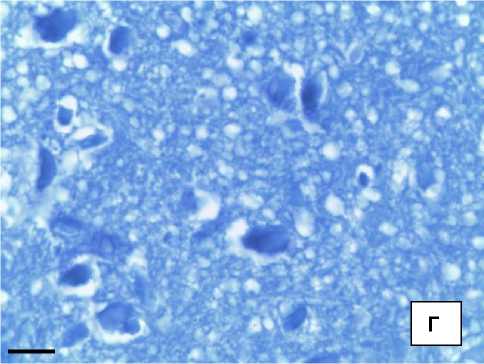
Рис. 1. Морфологические изменения ПВЯ гипоталамуса крыс после прекращения токсического воздействия: А, Б – группа 60 + 7; В, Г – группа 60 + 90. Окр. гематоксилином и эозином (а, г), по Нисслю (б, д).
Об. ×40; ок. 10. Об. ×100; ок. 10. Масштабный отрезок – 10 мкм
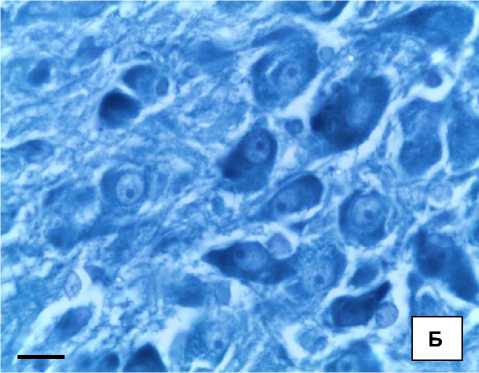
Увеличение объема клеток происходило за счет цитоплазмы, в которой при окраске по Нис-слю было выявлено увеличение ОД субстанции Ниссля в 1,4 раза (p < 0,05), что свидетельствовало об усилении синтетических процессов в клетке, так как по своей структуре оно представляет собой гранулярную эндоплазматическую сеть (грЭПС), что может свидетельствовать о развитии компенсаторно-приспособительной реакции в ответ на длительное повреждение (см. табл.). В связи с этим изменялся Vя, который увеличивался в 1,7 раза (p < 0,05) при от- носительной сохранности ядрышкового аппарата клетки. Однако число полиядрышковых ядер увеличивалось в 2,2 раза (p < 0,05). По мере увеличения сроков эксперимента на 30-е сутки после прекращения токсического воздействия (группа 60 + 30) происходило заметное снижение ОД нейросекрета в клетках, что, по-видимому, связано с функциональной перегрузкой нейронов, которое сочеталось с уменьшением Vя и Vя-ка в 1,5 и 3,4 раза соответственно (p < 0,05), что может свидетельствовать о развитии кариопикноза.
Морфометрические показатели нейроэндокринных клеток ПВЯ гипоталамуса, M ± m
|
Экспериментальные группы |
Морфометрические показатели |
|||
|
V ядер, мкм3 |
V ядрышек, мкм3 |
ОД полиядрышковых клеток,% |
Содержание нейроскрета в клетках,% |
|
|
Контрольная группа |
142,87 ± 7,11 |
5,71 ± 0,29 |
3,51 ± 0,13 |
22,63 ± 1,49 |
|
60 + 7 |
238,09 ± 11,68* |
5,73 ± 0,21 |
7,69 ± 0,38* |
30,78 ± 1,11* |
|
60 + 30 |
94,86 ± 4,66* |
1,66 ± 0,05* |
8,71 ± 0,43* |
17,91 ± 3,25 |
|
60 + 60 |
60,51 ± 2,01* |
2,16 ± 0,11* |
5,88 ± 0,29* |
19,43 ± 0,95 |
|
60 + 90 |
132,01 ± 6,59 |
3,05 ± 0,15* |
3,45 ± 0,17 |
21,13 ± 0,52 |
*p < 0,05 по сравнению с группой контроля.
Наряду с этим увеличивалось количество полиядрышковых клеток в 2,2 раза, что связано с изменением биологической активности клеток в условиях ХЭИ. Изменения морфометрических показателей в группе 60 + 60 характеризовались выраженными изменениями V я и V я-ка с уменьшением в 2,4 и 2,6 раз по сравнению с контрольной группой (p < 0,05).
Данные морфологические изменения соответствовали ядерной гиперхромии, клетки приобретали несколько угловатую форму и наблюдались незначительные явления перицеллюлярного отека.
Со стороны цитоплазмы клетки количество нейросекрета восстанавливалось и распределялось относительно равномерно.
В течение длительного периода после прекращения токсического воздействия в группе 60 + 90, по-видимому, происходило возмещение утраченных ультраструктур с относительным восстановлением ядерного аппарата клетки, о чем свидетельствовало изменение показателей V я и V я-ка , которые не имели достоверных отличий от показателей контрольной группы. Развитие адаптационно-компенсаторных процессво на фоне ХЭИ также проявлялось в снижении ОД полиядрышковых клеток.
Субстанция Ниссля располагалась достаточно компактно в цитоплазме клетки. Таким образом, морфологические изменения ПВЯ гипоталамуса являются обратимыми на фоне ХЭИ и сопровождаются частичным восстановлением нейросекреторных функций клеток.
При анализе следующего звена гипоталамо-гипофизарной системы – аденогипофиза, было установлено, что тиротропоциты располагались неравномерно и составляли от 1 до 5 % клеток в поле зрения, что не имело отличий от контрольной группы.
Известно, что тиротропоциты относятся к базофилам, имеют угловатую форму, где округлое ядро несколько вытянутое, расположенное в центре, а цитоплазма имеет зернистый вид за счет секреторных гранул.
Согласно морфологии клеток, с окраской по Маллори, нами было установлено, что в экспериментальной группе 60 + 7 наблюдались дистрофические изменения с увеличением ОД цитоплазмы (рис. 2) и, в отдельных случаях, формированием мелких вакуолей с появлением на более поздних сроках эксперимента так называемых клеток тиреоидэктомии, которые при различных интоксикациях могут увеличиваться до 16,75 %.
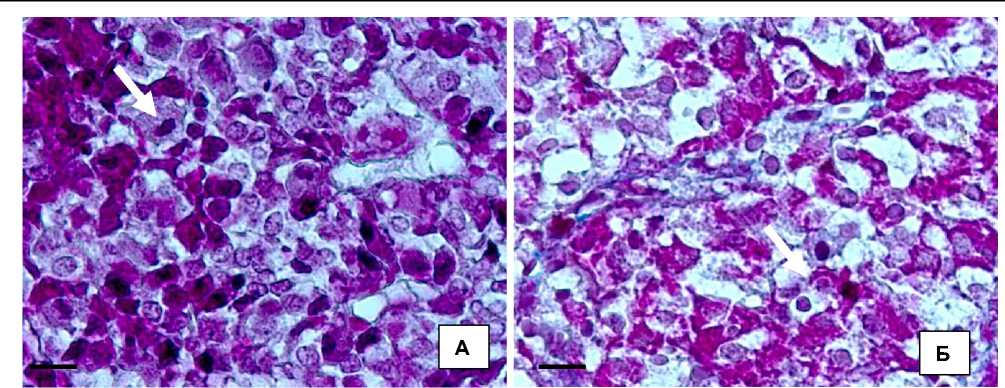
Рис. 2. Морфологические изменения тиротропоцитов аденогипофиза крыс:
А – дистрофические изменения тиротропоцитов в группе 60 + 7; Б – единичные апоптотические тельца и сохранение вакуольной дистрофии тиротропоцитов. Окр. по Маллори. Об. ×100; ок. 10. Масштабный отрезок – 10 мкм
Морфологические изменения тиротропо-цитов в группе животных 60 + 30, характеризовались нарастанием вакуольной дистрофии, где цитоплазма приобретала светлый вид с наличием единичных сохранных участков базофильной зернистой цитоплазмы. Ядро, по-прежнему, находилось в центре и имело вытянутую овальную форму. По мере увеличения сроков эксперимента после прекращения токсического воздействия в группе 60 + 60 наблю- дались единичные клетки тиреоидэктомии (гипертрофированные тиротропоциты), что свидетельствовало о стимуляции процессов восстановления при сохранении признаков ХЭИ.
При сравнительном анализе данных морфометрического исследования происходило снижение ЯЦО за счет нарастания объема цитоплазмы на 7-е сутки после прекращения токсического воздействия и достигало максимума к 30-м суткам (рис. 3).
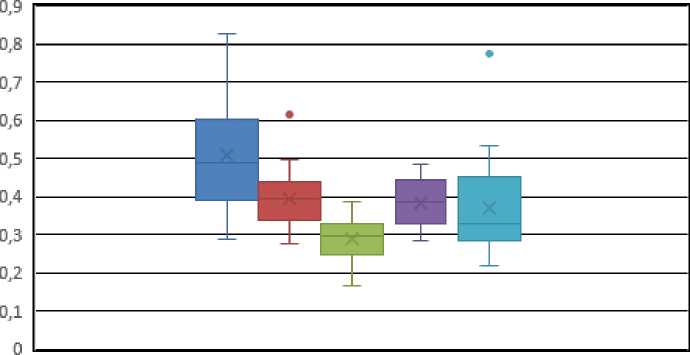
■ контроль ■ 60+7 ■ 60+30 ■ 60+60 ■ 60+90
Рис. 3. Морфометрические показатели ЯЦО тиротропоцитов аденогипофиза крыс на различных сроках эксперимента
В дальнейшем ЯЦО частично восстанавливалось с сохранением единичных клеток в состоянии вакуольной дистрофии, чем обу- словлено отклонение от показателей группы контроля. Так называемые «точки выброса» на сроке эксперимента 60 + 7 и 60 + 90 находятся в пределах значений контрольной группы, что свидетельствует о развитии компенсаторноприспособительных реакций клеток в условиях ХЭИ.
При сравнительном анализе морфологических изменений в ПВЯ гипоталамуса на ранних сроках эксперимента (60 + 7) наблюдалось сохранение общего плана строения клеток с увеличением ОД субстанции Ниссля, а также появлялись полиядрышковые клетки в ответ на длительное повреждение эндогенными токсическими соединениями, что свидетельствует об усилении белково-синтетических функций и может быть связано с адаптивными изменениями [6].
По мере увеличения сроков ХЭИ (60 + 30) наблюдалось относительное истощение нейронов ПВЯ с уменьшением ОД субстанции Ниссля, что может свидетельствовать о ее частичном растворении при развитии набухания, смещением ядра и истощением синтетического потенциала клеток, что подтверждалось морфометрическими показателями.
Интересен тот факт, что при таком же сроке ХЭИ, но при увеличении периода так назы-ваесмого «покоя» без введения препаратов (60 + 60), нейроны ПВЯ относительно восстанавливались, о чем свидетельствовало равномерное распределение субстанции Ниссля в цитоплазме клетки. Наличие компенсаторноприспособительных реакций нейронов ПВЯ к 90-м суткам на после прекращения токсического воздействия подтверждалось также морфометрическими данными, которые не имели отличий от показателей контрольной группы.
Проводя параллель с изменениями в аденогипофизе, можно заключить, что реакции ти-ротропоцитов в ответ на повреждение имели аналогичную тенденцию, где нарастали морфологические признаки неспецифического повреждения клеток в виде вакуольной дистрофии и появлением гипертрофированных тиро-цитов, популяция которых впоследствии снижалась к 90-м суткам после прекращения токсического воздействия.
Основываясь на полученных данных, можно предположить, что данные морфологические изменения гипоталамо-гипофизарной оси приводят к развитию гормонального дисбаланса, отмеченного при токсических воздействиях [7], с последующим влиянием на ЩЖ, и могут лежать в основе формирования тиреопатий, что требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Таким образом, на ранних сроках эксперимента после прекращения токсического воздействия нейросекреторные клетки ПВЯ гипоталамуса повышали свою биологическую активность, что проявлялось в увеличении морфометрических показателей структур, ответственных за синтетическую функцию. По мере увеличения срока эксперимента происходило относительное истощение физиологического резерва гормонов, о чем свидетельствовало снижение нейросекрета в клетках ПВЯ, а также появление клеток «тиреоидэктомии».
Следует отметить, что к 90-м суткам после прекращения токсического воздействия наблюдалась относительная компенсация белковосинтетических процессов в клетке при сохранении дистрофических изменений, что проявлялось в стабилизации ядерного комплекса и восстановлении содержания нейросекрета ПВЯ. Появление апоптотических телец, вакуольная дистрофия и изменение ЯЦО тиротропоцитов свидетельствует об изменении влияния на ЩЖ, что может лежать в основе перестройки тиреоидной паренхимы с формированием тиреопа-тий на фоне ХЭИ. Полученные данные свидетельствуют о том, что при отсутствии коррекции синдрома ХЭИ вероятно развитие морфологических изменений ЩЖ, которая находится под контролем гипоталамо-гипофизарной системы, с развитием гормонального дисбаланса периферического звена эндокринной системы.
Список литературы Роль морфологических изменений паравентрикулярного ядра гипоталамуса и тиротропоцитов аденогипофиза в формировании тиреопатий
- Полякова Л. В., Калашникова С. А., Фогель А. В. Морфогенез тиреопатий по данным экспрессии OCT3/4, PHH3, CK8, CK18 при хронической эндогенной интоксикации. Вестник Волгоградского государственного медицинского университета. 2023; 20(2):105-108. EDN: PDCXMZ
- Трошина Е. А., Мельниченко Г. А., Сенюшкина Е. С., Мокрышева Н. Г. Адаптация гипоталамо-гипофизарно-тиреоидной и гипоталамо-гипофизарно-надпочечниковой систем к новому инфекционному заболеванию - COVID-19 в условиях развития COVID-19-пневмонии и/или цитокинового шторма. Клиническая и экспериментальная тиреоидология. 2020;16(1 ):21-27. EDN: ISXSTK
- Hershman J. M., Beck-Peccoz P. Discoveries Around the Hypothalamic-Pituitary-Thyroid Axis. Thyroid. 2023;30. DOI: 10.1089/thy.2022.0258
- Mikofajczyk A., Zfotkowska D. Subclinical Lipopolysaccharide from Salmonella Enteritidis Induces Dysregulation of Bioactive Substances from Selected Brain Sections and Glands of Neuroendocrine Axes. Toxins (Basel). 2019;11(2):91.
- Новочадов В. В., Писарев В. Б. Эндотоксикоз: моделирование и органопатология: монография. Волгоград: Изд-во ВолгГМУ, 2005. 240 с. EDN: QMOLAL
- Смирнов А. В., Бисинбекова А. И., Файбисович Т. И. Морфофункциональные изменения головного мозга при сахарном диабете. Вестник Волгоградского государственного медицинского университета. 2022;19(3):3-8. EDN: KKQNGY
- Гуров Д. Ю., Туманов В. П., Смирнов А. В. и др. Морфологические изменения нейронов супраоптических ядер гипоталамуса крыс, предрасположенных к алкогольной зависимости. Современные проблемы науки и образования. 2019;2. URL: http://www.science-education.ru/ru/article/view?id=28750.


