Роль нейрегулинов и фактора роста гепатоцитов в развитии кастрационно-рефрактерного рака предстательной железы
Автор: Спирина Людмила Викторовна, Усынин Евгений Анатольевич, Слонимская Елена Михайловна, Кондакова Ирина Викторовна, Горбунов А.К.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 (70), 2015 года.
Бесплатный доступ
Развитие кастрационно-резистентного рака предстательной железы является важной проблемой современной онкологии, ухудшающей течение и качество жизни пациентов. Основное внимание в обзоре сосредоточено на системе ростовых факторов - нейрегулинов и факторе роста гепатоцитов (HGF) - непосредственных лигандов тирозиновых протеинкиназ ErbB и рецептора фактора роста гепатоцитов c-Met, активация которых запускает каскад сигнальных путей, завершающийся стимуляцией пролиферации раковых клеток, их миграцией в условиях развития нечувствительности к кастрационному лечению.
Рак предстательной железы, нейрегулины
Короткий адрес: https://sciup.org/14056566
IDR: 14056566 | УДК: 616.65-006.6:577.2
Текст обзорной статьи Роль нейрегулинов и фактора роста гепатоцитов в развитии кастрационно-рефрактерного рака предстательной железы
Только 80 % больных с метастатическим раком предстательной железы реагируют на 1-ю линию гормональной терапии в виде химической или хирургической кастрации, у оставшихся больных развивается кастрационно-рефрактерный рак (КРРПЖ), что ухудшает их выживаемость [18].
Общеизвестным является факт, что развитие резистентности к антиандрогенной терапии ассоциировано с активацией сигнальных путей, которая приводит к стимуляции пролиферации раковых клеток, их миграции и инвазии, в связи с чем особое внимание уделяется тирозинкиназным рецепторам ErbB и c-Met и их лигандам, которые принимают активное участие в этих процессах [37]. С этих позиций в настоящее время активно изучаются новые патогенетические подходы для диагностики и лечения КРРПЖ.
Семейство нейрегулинов и тирозинкиназа
ErbB, роль в онкогенезе
ErbB представляет собой семейство тирозинки-наз, состоящее из 4 членов: рецептор EGFR (EGFR, ErbB1), HER2 (ErbB2, p185neu), HER3 (ErbB3) и HER4 (ErbB4). EGFR связывается с 6 различными лигандами, включающими эпидермальный фактор роста, TGF-α, амфирегулин, гепарин связывающий эпидермальный фактор роста (heparin binding epidermal growth factor – HB-EGF), бетацеллюлин и эпирегулин [12]. Кроме того, существуют и другие лиганды, способные активировать ErbB, образующие семейство херегулинов (heregulin proteins) или нейрегулины (NRG). Они связываются с ErbB3 и
ErbB4 тирозинкиназами. В настоящее время выделено 3 таких ErbB лиганда: нейрегулин-2 (NRG-2) [7] нейрегулин-3 (NRG-3) и нейрегулин-4 (NRG-4) [13, 42]. Кроме того, показано, что HB-EGF, бета-целлюлин и эпирегулин могут активировать рецепторы ErbB3 и ErbB4 [7, 13, 42]. При связывании рецептора со своим лигандом происходит активация соответствующих сигнальных эффекторов, связанных с MAPK киназным сигнальным каскадом (mitogen-activated protein kinase pathway) и одновременно с фосфотидилинозитол-3-киназным путем (PI-3K).
Посредством связывания с соответствующими мембранными белками нейрегулины оказывают свое влияние на различные ткани, вызывая рост и дифференцировку клеток. Сигнальные пути, активирующиеся при связывании нейрегулинов с тирозикиназными рецепторами на поверхности нервных клеток ErbB, играют ключевую роль в регулировке пролиферации и дифференциации Шванновских клеток, формирующих миелиновый слой в периферической нервной системе.
Считается, что система нейрегулинов играет важную роль в развитии опухолей за счет регуляции HER2 рецепторов, называемых также ErbB2 [25, 29]. Велико значение нейрегулинов и их тирозинкиназных рецепторов в развитии ряда опухолей: рака молочной железы, плоскоклеточных карцином головы и шеи, а также рака предстательной железы [9, 15, 33].
В литературе показано разнонаправленное действие NRG на жизнедеятельность клетки, которое связано с типом активированного рецептора.
Развитие процесса клеточной гибели происходит при связывании с рецепторами ErbB-2/ErbB-3, а увеличение пролиферативной активности – при связывании с рецепторами ErbB-1/ErbB-1 или ErbB-1/ErbB-2. Такая модификация передаваемого сигнала от лиганда NRG и запускающаяся следом активация соответствующих тирозинкиназ объясняются активацией сигнального пути JNK (c-Jun N-terminal kinase), что осуществляется независимо от состояния протеинкиназы m-TOR, классически участвующей в передаче сигналов с активированных рецепторов [31]. Считается, что JNK внутриклеточный каскад активируется в ответ на действие внеклеточных стрессовых сигналов, следствием чего является изменение транскрипционной активности белков, регулирующих процессы клеточного деления и апоптоз. Также известно, что активация JNK сигнального пути находится в ассоциации с экспрессией рецепторов андрогенов, уровнем ПСА [35].
В ряде работ представлены данные о том, что ErbB3 связывающий протеин 1 (ErbB3 binding protein 1 – EBP1) осуществляет регуляцию экспрессии андрогеновых рецепторов (AR) и связанных с ними генов. H. Zhou (2011) предполагает, что одним из возможных механизмов развития КРРПЖ является отсутствие белка EBP1, что приводит к инициации транскрипции неактивных или поврежденных белков, составляющих AR [43]. Дополнительным действием ростовых факторов NRG является их влияние на процесс ангиогенеза. Нейрегулины способны усиливать продукцию VEGF за счет активации ErbB3 через аутокринные и паракринные механизмы, а именно за счет стимуляции p85 PI-3K/Akt, ERK1/2 (MAPK3/MAPK1) и p38 MAPK путей (MAPK14, MAPK11, MAPK12/ERK6 и MAPK13) [40].
Показано значение нейрегулинов в прогнозировании исхода рака предстательной железы. Высокое содержание лигандов связано с благоприятным прогнозом заболевания и увеличением безрецидивной и общей выживаемости больных. При этом снижение их экспрессии ассоциировано с развитием КРРПЖ [11].
С этих позиций становится понятным интерес исследователей к изучению применения препаратов, влияющих на выбранные сигнальные мишени. Так, в экспериментальных условиях показано, что длительная андрогенная аблация на культуре опухолей предстательной железы приводит к активации тирозинкиназ, Akt-m-TOR сигнального пути. При этом использование гормональной терапии на фоне применения ингибиторов m-TOR способствует увеличению цитотоксического эффекта и апоптозу опухолевых клеток, что, вероятно, обусловлено увеличением чувствительности опухоли к данным препаратам [28]. Также показано, что развитие нечувствительности к терапии ингибиторами тирозинкиназ на культуре клеток, резистентных к действию антиандрогенной терапии, связано с HER3 рецептором (ErbB3) [6]. В экспериментальных работах D. Carrion-Salip et al. (2012) представлен факт того, что ингибирование HER3 моноклональным антителом снижает уровень активации Akt-m-TOR сигнального пути и способствует восстановлению чувствительности данных клеток к действию ингибиторов тирозинкиназ.
Фактор роста гепатоцитов (HGF)
и его рецептор c-Met, роль в онкогенезе
Протоонкоген c-Met локализован на 7 хромосоме 7q21-31, его продуктом является тирозинкиназа c-Met. Этот рецептор расположен в большинстве эпителиальных клеток таких органов, как печень, поджелудочная железа, предстательная железа, почки [8]. Его лигандом является фактор роста гепатоцитов (HGF), который оказывает разнообразное действие на жизнедеятельность клеток, в том числе на их способность к миграции, процессы клеточной дифференцировки и морфогенеза тканей [5]. Данный ростовой фактор секретируется мезенхимальными клетками в качестве предшественника, который при действии экстраклеточных протеаз превращается в его активную форму.
При связывании рецептора с его лигандом происходит фосфорилирование тирозинкиназ, находящихся в составе рецептора, что сопровождается активацией сигнальных эффекторов, таких как рецептор ростового фактора, связанный с протеином 2 (growth factor receptor-bound protein 2 – GRB2), Src, представленный гомологом 2 (Src homology-2-containing – SHC) и других. Результатом подобного действия является активация различных сигнальных каскадов: MAPK, связанного с пролиферацией клеток, изменением клеточной подвижности и регуляцией клеточного цикла [27]; PI3K/Akt, JNK, [10], STAT3 [38], что сопровождается активацией процессов инвазии и распространения опухолевых клеток [34].
В последнее время большое значение придается взаимодействию между изучаемыми ростовыми факторами [20]. Так, тирозинкиназа c-Met связана с системой эпидермального фактора роста (EGFR). Выявлена активация c-Met при связывании EGFR с соответствующими лигандами (EGF, TGF-α) [17]. Существуют доказательства связи с-Met c другими членами EGFR семейства, такими как ErBb2 и ErbB3 [3]. Также существуют свидетельства его связи с рецепторами тромбоцитарного фактора роста (platelet-derived growth factor receptor – PDGFR) и Axl, что играет важную роль в развитии рака мочевого пузыря [39].
Фактор роста гепатоцитов и его рецептор c-Met играют важную роль в прогрессировании рака предстательной железы. В ряде работ показан высокий сывороточный уровень фактора при развитии метастатического рака предстательной железы [26], что ассоциировано с плохим исходом заболевания [14]. Активация с-Met выявлена в 75– 100 % метастатических опухолей и ассоциирована с развитием КРРПЖ [19]. В целом высокий уровень экспрессии c-Met, по мнению ряда авторов, может рассматриваться в качестве дополнительного информативного показателя, позволяющего идентифицировать больных с неблагоприятным прогнозом заболевания [30].
Учитывая важную роль гиперактивации c-Met в развитии гормонрезистентного рака предстательной железы, в настоящее время формируются подходы для оценки в качестве мишеней таргетной терапии основных метаболитов этого сигнального пути [21]. В условиях эксперимента показано, что применение ингибиторов c-Met в комбинации с антиандрогенной терапией демонстрирует противоопухолевую активность на культуре клеток рака предстательной железы [36], а также способствует увеличению чувствительности клеток опухоли к ионизирующему излучению [41].
На основании данных патогенетических механизмов разрабатываются подходы к развитию таргетной терапии КРРПЖ [37]. Так, известно, что препарат лапатиниб (lapatinib) может снижать уровень активации ErbB при их связывании с лигандом NRG, а кризотиниб (crizotinib) – с-MET при связывании с HGF. Результатом подобного действия является снижение активации сигнального метаболита Akt и снижение пролиферативной активности опухолевых клеток.
Протеолитическая регуляция ErbB и c-Met сигнальных путей
Важное регулирующее влияние на каскады сигнальных систем в клетке оказывают внутриклеточные протеиназы [1]. Известна роль протеасом в модификации и расщеплении основных компонентов сигнальных каскадов, активируемых тиро-зинкиназой ErbB. Показано, что 26S протеасомы осуществляют разрушение убиквитинированного белка p185HER2 – одного из компонентов мембранной части рецептора эпидермального фактора роста, что коррелирует с интенсивностью эндо-цитоза самого рецептора [24]. Значимое влияние на направленность и интенсивность протеолитической регуляции оказывают интегрины. Так, интегрин alpha6/beta1 способствует протеасом-зависимому разрушению лиганда Erb2 в опухоли молочной железы [32].
В настоящее время показано участие изучаемых лигандов в функционировании самой протеасом-ной системы. Имеются данные о том, что под влиянием нейрегулина происходит активация синтеза S4 АТФ-зависимой субъединицы 26S протеасом [4]. В ряде работ представлены данные о роли протеасом как основного регуляторного механизма связи нейрегулинов с компонентами других сигнальных систем. Отмечается зависимость между функционированием белков теплового шока Hsp70 и снижением нейрегулин-зависимой активации за счет усиления протеасомной деградации компонентов c-Jun сигнального пути [22].
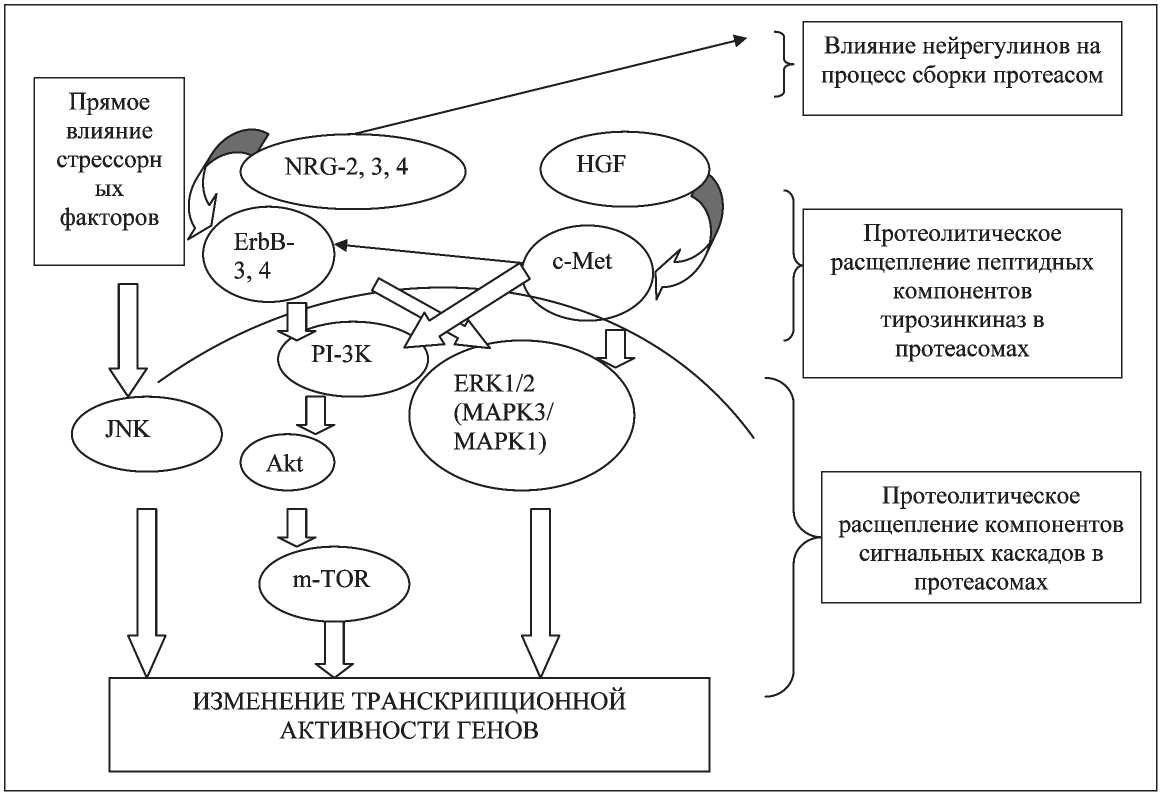
Рис. 1. Схема протеолитической регуляции тирозинкиназ ErbB, с-Met в клетке.
Примечание: NRG – нейрегулин; c-Met – тирозинкиназа c-Met; HGF – фактор роста гепатоцитов; ErbB – тирозинкиназа ErbB; PI-3K – фосфатидилинозитол-3-киназа; AKT – протеинкиназа B; ERK1/2 – митоген-активируемая киназа (MAPK3/MAPK1);
JNK–c-Jun N-терминальная киназа
Протеолитическая регуляция системы фактора роста гепатоцитов (HGF) и его непосредственного рецептора также возможна при помощи протеасом. Цитоплазматическая часть рецептора c-Met разрушается в протеасомах, в то время как C-терминальные и N-терминальные части деградируют за счет презелин-регулируемого внутримем-бранного протеолиза (PS-RIP, presenilin-regulated intramembrane proteolysis) или при участии лизосом [16, 2]. Также выявлено, что бортезомиб – ингибитор протеасом – способен снижать уровень экспрессии HGF в клетках множественной миеломы в условиях эксперимента [23].
Можно полагать, что протеолитическая регуляция тирозинкиназ ErbB и c-Met возможна при участии протеасом на разных уровнях (рис. 1). Основными ключевыми мишенями протеолиза являются как сами рецепторы, так и компоненты сигнальных путей: PI-3K/Akt, ERK1/2 (MAPK3/ MAPK1). Стоит отметить, что существуют данные о том, что регуляторные взаимосвязи могут иметь непрямой характер за счет влияния лигандов на
Список литературы Роль нейрегулинов и фактора роста гепатоцитов в развитии кастрационно-рефрактерного рака предстательной железы
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Коломиец Л.А., Чойнзонов Е.Л., Мухамедов М.Р., Чернышова А.Л., Шарова Н.П. Активность протеасом в тканях злокачественных опухолей различных локализаций//Сибирский онкологический журнал. 2009. № 5. С. 49-52.
- Ancot F., Leroy C., Muharram G., Lefebvre J., Vicogne J., Lemiere A., Kherrouche Z., Foveau B., Pourtier A., Melnyk O., Giordano S., Chotteau-Lelievre A., Tulasne D. Shedding-generated Met receptor fragments can be routed to either the proteasomal or the lysosomal degradation pathway//Traffic. 2012. Vol. 13 (9). P. 1261-1272 DOI: 10.1111/j.1600-0854.2012.01384.x
- Bachleitner-Hofmann T., Sun M.Y., Chen C.T., Tang L., Song L., Zeng Z., Shah M., Christensen J.G., Rosen N., Solit D.B., Weiser M.R. HER kinase activation confers resistance to MET tyrosine kinase inhibition in MET oncogene-addicted gastric cancer cells//Mol. Cancer Ther. 2008. Vol. 7 (11). P. 3499-3508 DOI: 10.1158/1535-7163.MCT-08-0374
- Barnes C.J., Li F., Talukder A.H., Kumar R. Growth factor regulation of a 26S proteasomal subunit in breast cancer//Clin. Cancer Res. 2005. Vol. 11 (8). P. 2868-2874.
- Basilico C., Arnesano A., Galluzzo M., Comoglio P.M., Michieli P. A high affinity hepatocyte growth factor-binding site in the immunoglobulinlike region of Met//J. Biol. Chem. 2008. Vol. 283. P. 21267-21277.
- Carrion-Salip D., Panosa C., Menendez J.A., Puig T., Oliveras G., Pandiella A., De Llorens R., Massaguer A. Androgen-independent prostate cancer cells circumvent EGFR inhibition by overexpression of alternative HER receptors and ligands//Int. J. Oncol. 2012. Vol. 41 (3). P. 1128-1138 DOI: 10.3892/ijo.2012.1509
- Chang H., Riese D.J., Gilbert W., Stern D.E., McMahan U.J. Ligands for ErbB-family receptors encoded by a neuregulin-like gene//Nature. 1997. Vol. 387. P. 509-512.
- Comoglio P.M., Giordano S., Trusolino L. Drug development of MET inhibitors: targeting oncogene addiction and expedience//Nat. Rev. Drug Discov. 2008. Vol. 7. P. 504-516.
- Cruz J.J., Ocana A., Del Barco E., Pandiella A. Targeting receptor tyrosine kinases and their signal transduction routes in head and neck cancer//Ann. Oncol. 2007. Vol. 18. P. 421-430.
- Garcia-Guzman M., Dolfi F., Zeh K., Vuori K. Met-induced JNK activation is mediated by the adapter protein Crk and correlates with the Gab1 -Crk signaling complex formation//Oncogene. 1999. Vol. 1. P. 7775-7786.
- Grimsley S.J., Shini S., Underwood M.A., Edwards J. Heregulin expression and prognosis in prostate adenocarcinoma//Urol. Int. 2011. Vol. 87 (3). P. 363-368 DOI: 10.1159/000328627
- Groenen L.C., Nice E.C., Burgess A.W. Structure-function relationships for the EGF/TGF-alpha family of mitogens//Growth Factors. 1994. Vol. 11. P. 235-257.
- Harari D., Tzahar E., Romano J., Shelly M., Pierce J.H., Andrews G.C., Yarden Y. Neuregulin-4: a novel growth factor that acts through the ErbB-4 receptor tyrosine kinase//Oncogene. 1999. Vol. 18. P. 2681-2689.
- Humphrey P.A., Halabi S., Picus J., Sanford B., Vogelzang N.J., Small E.J., Kantoff P.W. Prognostic significance of plasma scatter factor/hepatocyte growth factor levels in patients with metastatic hormonerefractory prostate cancer: results from cancer and leukemia group B 150005/9480//Clin. Genitourin. Cancer. 2006. Vol. 4. P. 269-274.
- Hynes N.E., Lane H.A. ERBB receptors and cancer: the complexity of targeted inhibitors//Nat. Rev. Cancer. 2005. Vol. 5. P. 341-354.
- Jefferd M., Taylir M., Weidner K.M., Omura S., Vande Wiude G.F. Degradation of the Met tyrosine kinase receptor by the ubiquitin-proteasome pathway//Mol. Cell Biol. 1997. Vol. 17 (2). P. 799-808.
- Jo M., Stolz D.B., Esplen J.E., Dorko K., Michalopoulos G.K., Strom S.C. Cross-talk between epidermal growth factor receptor and c-Met signal pathways in transformed cells//J. Biol. Chem. 2000. Vol. 275. P. 8806-8811.
- Kehinde E.O., Maghrebi M.A., Anim J.T. The importance of determining the aggressiveness of prostate cancer using serum and tissue molecular markers//Can. J. Urol. 2008. Vol. 15 (2). P. 3967-3974.
- Knudsen B.S., Edlund M. Prostate cancer and the met hepatocyte growth factor receptor//Adv. Cancer Res. 2004. Vol. 91. P. 31-67.
- Lai A.Z., Abella J.V., Park M. Crosstalk in Met receptor oncogenesis//Trends Cell Biol. 2009. Vol. 19 (10). P. 542-551 DOI: 10.1016/j.tcb.2009.07.002
- Lee R.J., Smith M.R. Targeting MET and VEGFR Signaling in Castration-Resistant Prostate Cancer//Cancer J. 2013. Vol. 19 (1). P. 90-98.
- Li C., Ma J., Zhao H., Blagg B.S., Dobrowsky R.T. Induction of heat shock protein 70 (Hsp70) prevents neuregulin-induced demyelination by enhancing the proteasomal clearance of c-Jun//ASN Neuro. 2012. Vol. 4 (7). P. 425-437 DOI: 10.1042/20120047
- Li J.X., Fei X.M., Lu H., Hu H.J., Li J.Y. Effect of proteasome inhibitor on migration ability and hepatocyte growth factor expression of bone marrow mesenchymal stem cells in multiple myeloma patients//Zhongguo Shi Yan Xue Ye Za Zhi. 2011. Vol. 19 (5). P. 1204-1208.
- Magnifico A., Tagliabue E., Ardini E., Casalini P., Colnaghi M.I., Menaed S. Heregulin beta1 induces the down regulation and the ubiquitinproteasome degradation pathway of p185HER2 oncoprotein//FEBS Lett. 1998. Vol. 422 (2). P. 129-131.
- Montero J.C., Rodriguez-Barrueco R., Ocana A., Diaz-Rodriguez E., Wsparis-Ogando A., Pandiella A. Neuregulins and cancer//Clin. Cancer Res. 2008. Vol. 14 (11). P. 3237-3241.
- Naughton M., Picus J., Zhu X., Catalona W.J., Vollmer R.T., Humphrey P.A. Scatter factor-hepatocyte growh factor elevation in the serum of patients with prostate cancer//J. Urol. 2001. Vol. 165. P. 1325-1328.
- Paumelle R., Tulasne D., Kherrouche Z., Plaza S., Leroy C., Reveneau S., Vandenbunder B., Fafeur V. Hepatocyte growth factor/scatter factor activates the ETS1 transcription factor by a RAS-RAF-MEK-ERK signaling pathway//Oncogene. 2002. Vol. 21. P. 2309-2319.
- Pfeil K., Edel I.E., Putz T., Ramonet R., Culig Z., Ueberall F., Bartsch G., Klocker H. Long-term androgen-ablation causes increased resistance to PI3K/Akt pathway inhibition in Prostate cancer cells//Prostate. 2004. Vol. 58 (3). P. 259-268.
- Pignon J.C., Koopmansch B., Nolens G., Delacroix L., Waltregny D., Winkler R. Androgen receptor controls EGFR and ERBB2 gene expression at different levels in prostate cancer cell lines//Cancer Res. 2009. Vol. 69 (7). P. 2941-2949 DOI: 10.1158/0008-5472.CAN-08-3760
- Ryan C.J., Rosenthal M., Ng S., Alumkal J., Picus G., Gravis G., Fizazi K., Forget F., Machiels J.P., Srinivas S., Zhu M., Nabg R., Oliner K.S., Jiang Y., Loh E., Dubey S., Gerritsen W.R. Targeted MET inhibition in castration-resistant prostate cancer: a randomized phase II study and biomarker analysis with rilotumumab plus mitoxantrone and prednisone//Clin. Cancer Res. 2013. Vol. 19 (1). P. 215-224 DOI: 10.1158/1078-0432.CCR-12-2605
- Schmukler E., Shai B., Ehrlich M., Pinkas-Kramarski R. Neuregulin promotes incomplete autophagy of prostate cancer cells that is independent of mTOR pathway inhibition//PloS One. 2012. Vol. 7 (5). e36828 DOI: 10.1371/journal.pone.0036828
- Shimizu H., Seiki T., Asada M., Yoshimatsu K., Koyama N. Alpha6-beta1 integrin induces proteasome-mediated cleavage of erbB2 in breast cancer cells//Oncogene. 2003. Vol. 22 (6). P. 831-839.
- Slamon D.J., Clark G.M., Wong S.G., Levin W.J., Ullrich A., McGuire W.L. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene//Science. 1987. Vol. 235. P. 177-182.
- Syed Z.A., Yin W., Hughes K., Gill J.N., Shi R., Clifford J.L. HGF/c-met/Stat3 signaling during skin tumor cell invasion: indications for a positive feedback loop//BMC Cancer. 2011. Vol. 11. P. 180 DOI: 10.1186/1471-2407-11-180
- Tinz M., Chtn B., Chqn S.Y., Semenas J., Abrahamson P.A., Diveyi N. Interaction between c-jun and androgen receptor determines the outcome of taxane therapy in castration resistant prostate cancer//Plos One. 2013. Vol. 8 (11). e79573 DOI: 10.1371/journal.pone.0079573
- Tu W.H., Zhu C., Clark C., Christensen J.C., Sun Z. Efficacy of c-Met inhibitor for advanced prostate cancer//BMC Cancer. 2010. Vol. 10. P. 556 DOI: 10.1186/1471-2407-10-556
- Wicha M.S. B4 androgen ablation: attacking the prostate cancer stem cell//J. Clin. Invest. 2013. Vol. 123 (2). P. 563-565 DOI: 10.1172/JCI67460
- Xiao G.H., Jeffers M., Bellacosa A., Mitsuuchi Y., Vande Woude G.F., Testa J.R. Anti-apoptotic signaling by hepatocyte growth factor/Met via the phosphatidylinositol 3-kinase/Akt and mitogen-activated protein kinase pathways//Proc. Natl. Acad. Sci. USA. 2001. Vol. 98. P. 247-252.
- Yeh C.Y., Shin S.M., Yeh H.H., Wu T.J., Shin J.W., Chang T.Y. Transcriptional activation of the Axl and PDGFR-alpha by c-Met through a ras-and Src-independent mechanism in human bladder cancer//BMC Cancer. 2011. Vol. 11. P. 139 DOI: 10.1186/1471-2407-11-139
- Yonezawa M., Wada K., Tatsuguchi A., Akamatsu A., Gudis K., Seo T., Mitsui K., Nagata K., Tanaka S., Fujimori S., Sakamoto C. Heregulin-induced VEGF expression via the ErbB3 signaling pathway in colon cancer//Digestion. 2009. Vol. 80 (4). P. 215-225 DOI: 10.1159/000229775
- Yu H., Li X., Sun S., Gao X., Zhou D. c-Met inhibitor SU11274 enhances the response of the prostate cancer cell line DU145 to ionizing radiation//Biochem. Biophys. Res. Commun. 2012. Vol. 427 (3). P. 659-665 DOI: 10.1016/j.bbrc.2012.09.117
- Zhang D., Sliwkowski M.X., Mark M., Frantz G., Akita R., Sun Y., Jillan K., Crowley C., Brush J., Godowski P.J. Neuregulin-3 (NRG3): a novel neural tissue-enriched protein that binds and activates ErbB4//PNAS (USA). 1997. Vol. 94 (18). P. 9562-9567.
- Zhou H., Zhang Y., Hamburger A.W. EBP1 inhibits translation of androgen receptor mRNA in castration resistant prostate cancer cells//Anticancer Res. 2011. Vol. 31 (10). P. 3129-3135.


