Роль нутритивной поддержки в снижении послеоперационных осложнений у больных колоректальным раком с мальнутрицией
Автор: Тулина И.А., Васильев А.Е., Тимченко И.Е., Нековаль В.М., Балабан В.В., Царьков П.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 2 (92), 2025 года.
Бесплатный доступ
Введение. Мальнутриция является одной из ключевых проблем у пациентов с колоректальным раком, влияя на частоту послеоперационных осложнений, длительность госпитализации и общую выживаемость. Настоящее исследование направлено на оценку влияния послеоперационной нутритивной поддержки на клинические исходы у пациентов с колоректальным раком и мальнутрицией. Материалы и методы. Проведено проспективное, рандомизированное, контролируемое исследование с участием 170 пациентов с колоректальным раком и выявленной мальнутрицией, перенесших плановое хирургическое вмешательство. Пациенты были случайным образом разделены на две группы: группа специализированного лечебного питания и контрольная группа. Оценивались частота послеоперационных осложнений, уровень альбумина, маркеры воспаления (CRP, NLR, PLR, APRI) и длительность госпитализации. Результаты. Применение специализированного лечебного питания метаболической направленности в послеоперационном периоде способствовало снижению частоты всех послеоперационных осложнений (21 % против 41 %, p<0,006), включая инфекционные осложнения (8 % против 22 %, p=0,018). У пациентов, получавших лечебное питание, наблюдалось более быстрое восстановление уровня альбумина и значительное снижение маркеров воспаления (CRP, NLR, PLR, APRI). Средняя длительность госпитализации в группе лечебного питания была достоверно ниже (14 [12; 17] дней против 17 [14; 22] дней, p<0,0001). Обсуждение. По результатам исследования мальнутриция является значимым фактором риска послеоперационных осложнений. Использование специализированного лечебного питания метаболической направленности улучшает нутритивный статус пациентов и оказывает выраженный противовоспалительный эффект, снижая риск осложнений и ускоряя восстановление. Данное исследование впервые доказало эффективность послеоперационного специализированного лечебного питания у пациентов с колоректальным раком и мальнутрицией. Заключение. Настоящее исследование является первым в своем роде не только в России, подтвердившим клинические преимущества специализированного лечебного питания метаболической направленности у пациентов с колоректальным раком в состоянии мальнутриции в послеоперационном периоде, что подчеркивает необходимость внедрения стандартизированных протоколов нутритивной поддержки для снижения частоты осложнений и улучшения послеоперационного восстановления.
Мальнутриция, лечебное питание, колоректальный рак, хирургия, онкология
Короткий адрес: https://sciup.org/142244475
IDR: 142244475 | УДК: 617-089 | DOI: 10.17238/2072-3180-2025-2-108-120
Текст научной статьи Роль нутритивной поддержки в снижении послеоперационных осложнений у больных колоректальным раком с мальнутрицией
Мальнутриция, или неполноценное питание, – это состояние, связанное с дисбалансом потребляемых организмом калорий и питательных веществ, которое может проявляться как их дефицитом, так и избытком [1]. Недостаточность питания остаётся одной из ключевых проблем у пациентов с колоректальным раком, выявляясь не менее чем у 50 % больных, перенесших хирургическое вмешательство [2, 3]. В российской популяции распространенность мальнутриции среди пациентов с раком верхнеампулярного отдела прямой кишки составляет 31,8 % [4], а среди старшей возрастной группы с колоректальным раком распространенность недостаточности питания достигает 78 % [5, 6].
Мальнутриция оказывает значительное негативное влияние на частоту послеоперационных осложнений, функциональный статус, восстановление после операции и общую выживаемость [7, 8]. При этом данное состояние нередко остаётся недиагно-стированным, а отсутствие своевременной коррекции может приводить к повышению риска инфекционных осложнений, замедленному заживлению ран, удлинению госпитализации и увеличению послеоперационной летальности [9]. Кроме того, выраженная мальнутриция, высокий риск её развития по результатам скрининговых шкал, а также наличие саркопении рассматриваются как независимые прогностические факторы послеоперационных осложнений и общей выживаемости у пациентов с опухолями желудочно-кишечного тракта [6].
Например, исследование Lohsiriwat [10] демонстрирует, что предоперационная мальнутриция значительно ухудшает послеоперационные результаты у пациентов с колоректальным раком, оперированных в рамках программы ускоренного восстановления (ERAS). Согласно оценке по шкале Subjective Global Assessment (SGA), у 36 % пациентов была выявлена умеренная или тяжёлая мальнутриция. Эти пациенты имели замедленное восстановление кишечной функции, удлинённую госпитализацию и более высокий риск послеоперационных осложнений (31 % и 40 %) против 11 % у пациентов с нормальным нутритивным статусом.
Систематический обзор семи клинических исследований [11], изучавших связь недостаточности питания пациентов с исходами лечения колоректального рака, демонстрируют устойчивую тенденцию, согласно которой мальнутриция, выявленная с помощью шкалы MUST, негативно влияет на восстановление, увеличивает продолжительность госпитализации и ассоциируется с более высокой частотой послеоперационных осложнений и смертности.
Коррекция недостаточности питания у больных колоректальным раком, в свою очередь, приводит к улучшению послеоперационных результатов, уменьшению частоты послеоперационных осложнений и ускоренному восстановлению пациентов после операции.
Так, в исследовании, проведенном в МНИОИ им. П.А. Герцена [12], установлено, что у пациентов с колоректальным раком, имеющим недостаточность питания различной степени, после коррекции мальнутриции в периперационном периоде с помощью специализированного лечебного энтерального питания наблюдается более низкая частота инфекционных послеоперационных осложнений (13 % против 21 %, р=0,23), а также более низкая частота несостоятельности межкишечных анастомозов (3,3 % против 11,5 %, р=0,16).
В рандомизированном исследовании Kabata и соавторов [13] уменьшение частоты послеоперационных осложнений на фоне назначения в предоперационном периоде специализированного лечебного питания удалось продемонстрировать также и у пациентов, оперированных по поводу различных заболеваний желудочно-кишечного тракта, у которых не было исходных признаков мальнутриции.
Таким образом, мальнутриция является значимой проблемой среди пациентов с колоректальным раком, оказывая существенное влияние на послеоперационные исходы, длительность госпитализации и общую выживаемость. Высокая распространенность недостаточности питания, особенно в старших возрастных группах, делает его своевременную диагностику и коррекцию необходимым компонентом комплексного лечения. Исследования подтверждают, что предоперационная мальнутриция ассоциируется с повышенным риском осложнений, тогда как специализированное лечебное питание способствует снижению их частоты и улучшает восстановление пациентов. Это подчёркивает важность раннего выявления и вмешательства для повышения эффективности хирургического лечения колоректального рака.
Целью настоящего исследования было изучение влияния специализированного лечебного питания метаболической направленности на течение послеоперационного периода у больных колоректальным раком в состоянии недостаточности питания, которым было выполнено плановое хирургическое вмешательство. В качестве энтерального питания использовались углеводные и белковые смеси метаболической направленности, обеспечивающие снижение интоксикации [14, 15, 16], повышение уровня белка, улучшающие работы ЖКТ за счет наличия пребиотиков, повышающие репаративные процессы и энергию.
Материалы и методыДизайн исследования
Исследование представляло собой проспективное, одноцентровое, двухгрупповое, рандомизированное, контролируемое, открытое исследование, проведенное в Клинике колопроктологии и малоинвазивной хирургии Сеченовского университета. Все последовательно поступавшие пациенты, соответствующие критериям включения и давшие письменное информированное согласие, были отобраны для участия в исследовании.
Скрининг проводился на основе медицинского анамнеза пациентов, клинических данных и результатов радиологических исследований.
Для участия в исследовании пациенты должны были соответствовать всем критериям включения. Все участники были взрослыми в возрасте от 18 до 75 лет с морфологически подтвержденной аденокарциномой ободочной или прямой кишки, которым планировалось радикальное хирургическое лечение с удалением опухоли и лимфодиссекцией в объеме D2 или D3. У пациентов должен был быть выявлен как минимум один из маркеров белково-энергетической недостаточности на предоперационном этапе, включая индекс массы тела (ИМТ) <19 кг/м² (но ≥15,5 кг/м²), общий белок <66 г/л (но ≥50 г/л), альбумин <35 г/л (но ≥25 г/л), потерю веса >5 % за последние 6 месяцев, уровень трансферрина <2 г/л, показатель MUST ≥2 или балл PG-SGA ≥9.
Индекс массы тела (ИМТ) рассчитывается как отношение массы тела в кг к квадрату роста в метрах и используется для оценки нутритивного статуса пациента. Шкала MUST (Malnutrition Universal Screening Tool) – это универсальный инструмент скрининга нутритивного статуса, разработанный для выявления риска недостаточности питания. Включает три критерия: индекс массы тела, потерю веса за последние 3–6 месяцев и острые заболевания, сопровождающиеся снижением потребления пищи. Шкала PG-SGA (Patient-Generated Subjective Global Assessment) – субъективная глобальная оценка, основанная на опросе пациента и клиническом осмотре. Она включает вопросы о потере веса, изменении аппетита, наличии желудочно-кишечных симптомов, физической активности и степени стресса, связанного с болезнью.
Пациенты с тяжелыми сопутствующими заболеваниями, влияющими на нутритивный статус, а также с почечной или печеночной недостаточностью, не включались в исследование.
До госпитализации в стационар и в стационаре до хирургического вмешательства все пациенты получали стандартную терапию, рекомендованную лечащим врачом, которая назначалась с учетом клинических проявлений основного заболевания и сопутствующих заболеваний. Всем пациентам без клинических проявлений опухолевой кишечной непроходимости рекомендовалась привычная диета, а пациентам с признаками частичного нарушения кишечной проходимости рекомендовалась диета с низким содержанием пищевых волокон и употребление препаратов на основе полиэтиленгликоля для предотвращения формирования плотных каловых масс. Специализированное лечебное питание в предоперационном периоде не применялось.
После однодневной или двухдневной подготовки, включавшей механическую очистку кишечника (антеградный лаваж с использованием специализированных лекарственных препаратов), всем пациентам было выполнено плановое хирургическое вмешательство в радикальном объеме открытым, лапароскопическим или роботическим доступом.
После хирургического вмешательства всем пациентам проводилось стандартное послеоперационное ведение в соответствии с принятым в клинике модифицированным протоколом ускоренного восстановления после операции, который включает: раннюю активизацию пациентов, ограничение внутривенной инфузионной терапии, раннее удаление назогастрального зонда и внутрибрюшных дренажей, проведение сочетанной продленной анальгезии, раннее кормление.
Сразу после операции пациенты были случайным образом распределены в одну из двух параллельных групп исследования – интервенционную или контрольную. Для этого использовалась кластерная рандомизация без блокирования и стратификации через программу «Random Allocation Software».
В контрольной группе (группа «стандартный протокол») пациенты получали лечение и питание согласно утвержденному в клинике стандартному протоколу. В интервенционной группе (группа «лечебное питание») пациенты получали лечение и питание согласно утвержденному в клинике стандартному протоколу, а также специализированные пищевые продукты диетического лечебного питания метаболической направленности ЛЕОВИТ ONCO ™ (ООО «ЛЕОВИТ нутрио») согласно разработанной схеме приема. В первый день после операции они принимали детоксикационный углеводный напиток объемом 200 мл три раза в сутки. Со второго дня после операции и до выписки из стационара первый прием пищи дополнялся детоксикационным углеводным напитком объемом 200 мл, второй прием пищи – детоксикационным белковым коктейлем объемом 200 мл, третий прием пищи – восстанавливающим белковым коктейлем объемом 200 мл.
Таким образом, пациенты из интервенционной группы получали дополнительно в сутки за счет специализированных пищевых продуктов диетического лечебного питания ЛЕОВИТ ONCO ™ (ООО «ЛЕОВИТ нутрио»): в первые сутки после операции 216 ккал за счет углеводов (54 г), в каждые последующие сутки после операции 221 ккал за счет белков (10,0 г), жиров (3,9 г) и углеводов (36,6 г), а также пищевые волокна 3,0 г.
Все пациенты проходили четырехкратную оценку нутритивного статуса. Первичная оценка проводилась при включении в исследование, последующие – на 3, 7 и 11 сутки послеоперационного периода.
Первичный скрининг включал оценку возраста пациента, текущего веса, индекса массы тела (ИМТ) и потери веса за 6 месяцев до включения в исследование. Также проводился забор крови для определения уровней альбумина, общего белка, трансферрина, аланинаминотрансферазы (АЛТ), АСТ (аспартатаминотрансферазы), С-реактивного белка (СРБ), а также индексов APRI, NLR и PLR. Оценка потери веса осуществлялась путем сопоставления данных о массе тела пациента 6 месяцев назад и его фактического веса на момент включения в исследование.
APRI (Aspartate Aminotransferase to Platelet Ratio Index), NLR (Neutrophil-to-Lymphocyte Ratio) и PLR (Platelet-to-Lymphocyte Ratio) – это лабораторные индексы, используемые для оценки воспалительных и метаболических нарушений у пациентов, включая онкологических больных. APRI рассчитывается как отношение уровня АСТ к количеству тромбоцитов и может отражать системное воспаление и метаболические изменения. NLR представляет собой соотношение абсолютного количества нейтрофилов к количеству лимфоцитов в крови. Повышенные значения NLR указывают на усиление системного воспаления и подавление иммунного ответа. PLR определяется как отношение количества тромбоцитов к количеству лимфоцитов. Данный показатель также отражает воспалительный статус.
В послеоперационном периоде на 3, 7 и 11 сутки проводилась оценка следующих показателей: индексы-маркеры воспаления APRI, NLR и PLR, уровень общего белка, альбумина, АСТ, АЛТ, трансферрина, СРБ. При выписке пациентов из стационара дополнительно измерялась масса тела пациентов.
Для оценки послеоперационных осложнений применялась шкала Clavien-Dindo – стандартизированная система классификации послеоперационных осложнений, основанная на степени их тяжести и необходимости дополнительного лечения. Шкала включает следующие категории: Степень I – минимальные отклонения от нормального течения послеоперационного периода, не требующие специфического лечения; Степень II – осложнения, требующие медикаментозного лечения, включая антибиотики, переливание крови или нутритивную поддержку; Степень III – осложнения, требующие инвазивного вмешательства: IIIa – без общего наркоза; IIIb – с общей анестезией; Степень IV – жизнеугрожающие состояния, требующие интенсивной терапии; Степень V – летальный исход.
Первичной конечной точкой исследования являлась общая частота развития послеоперационных осложнений в течение 30 дней после операции. Вторичными конечными точками были продолжительность госпитализации, динамика биохимических маркеров белково-энергетической недостаточности и воспаления.
Статистический анализ
Для определения объема выборки, мы исходили из предположения, что общая частота осложнений составляет 35 % у пациентов, не получающих нутритивную поддержку, а у пациентов, получающих специализированное энтеральное питание в послеоперационном периоде, может наблюдаться значительно более низкий уровень осложнений – 15 % (Kabata 2015). Размер выборки был рассчитан при вероятности ошибки I рода 5 % и мощности исследования 85 %, составив 83 пациентов в каждой группе, общее число пациентов – 166 человек. С учетом возможного выбытия пациентов из исследования, было решено увеличить общий объем выборки до 170 человек.
Статистический анализ проводился с использованием критерия Манна-Уитни для сравнения медиан. Нормальность распределения количественных переменных оценивалась с помощью критерия Колмогорова-Смирнова с поправкой Лиллиефорса. Данные с ненормальным распределением представлялись в виде медианы (Me) и межквартильного интервала (Q1-Q3), тогда как при нормальном распределении они выражались как среднее арифметическое (сред. знач.) со стандартным отклонением (станд. отклон.). Для сравнения категориальных переменных использовались критерий хи-квадрат и критерий Вилкоксона. Статистическая значимость различий принималась при уровне p<0,05.
Результаты
В период с января 2023 года по февраль 2024 года первичный скрининг для включения в исследование прошли 178 пациентов, из них 8 человек отказались от участия в исследования на этапе скрининга. Таким образом, окончательно в исследование было включено 170 пациентов, прошедших первичный скрининг и соответствующих критериям включения. В ходе проведения исследования ни один пациент не был исключен.
Основные клинические характеристики пациентов на момент включения в исследование представлены в таблице 1.
На этапе включения в исследование группы пациентов были сравнимы по полу и возрасту, а также другим клиническим параметрам. Отбор пациентов осуществлялся на основании диагностических показателей мальнутриции, поэтому у всех участников исследования уровень общего белка в сыворотке крови не превышал 66 г/л (табл. 2). Дополнительно, у 160 человек (94,1 %) за последние шесть месяцев наблюдалась потеря массы тела более чем на 5 %, у 2 пациентов (1,2 %) индекс массы тела был ниже 19, а у 11 (6,5 %) выявлен пониженный уровень трансферрина (<2 г/л). В соответствии с оценкой по шкале MUST, 97 % пациентов набрали 2 и более баллов, а 100 человек (58,8 %) получили 3 и более баллов по шкале PG-SGA. У 97 пациентов (57,1 %) уровень альбумина оказался ниже 35 г/л. Среди всех обследуемых только у 3 был выявлен один диагностический критерий мальнутри-ции, у 5 – два, у 37 (21,8 %) – три, у 45 (26,5 %) – четыре, у 79 (46,5 %) – пять, и лишь у одного пациента присутствовали все шесть критериев.
Таблица 1
Клинические характеристики пациентов при включении в исследование
Table 1
Clinical characteristics of patients included in the study
|
Клиническая характеристика / Clinical characteristics |
Группа «лечебное питание» (N=85) / Group «therapeutic nutrition» (N=85) |
Группа «стандартный протокол» (N=85) / Group «standard protocol» (N=85) |
P |
|
Пол пациентов абс. (%) / Sex of patients abs. (%) |
|||
|
Мужчины / Men |
48 |
40 |
0,23 |
|
Женщины / Women |
45 |
37 |
|
|
Возраст пациентов сред. знач. ± станд. откл. / Age of patients mean value ± standard deviation |
59,45 ± 9,94 |
59,91 ± 11,14 |
0,7773 |
|
ИМТ сред. знач. ± станд. откл. / BMI mean value ± standard deviation |
23,23 ± 2,74 |
23,17 ± 1,76 |
0,8679 |
|
Локализация опухоли абс. (%) / Tumour localisation abs. (%) |
|||
|
слепая кишка / cecum |
2 (2 %) |
3 (4 %) |
0,6023 |
|
восходящая ободочная кишка / ascending colon |
7 (8 %) |
2 (2 %) |
|
|
селезеночный изгиб / splenic flexure |
0 |
1 (1 %) |
|
|
нисходящая ободочная кишка / descending colon |
1 (1 %) |
2 (2 %) |
|
|
сигмовидная кишка / sigmoid colon |
23 (27 %) |
21 (25 %) |
|
|
ректосигмоидный переход / rectosigmoid junction |
1 (1 %) |
1 (1 %) |
|
|
прямая кишка / rectum |
51 (60 %) |
55 (65 %) |
|
Таблица 2
Оценка нутритивного статуса до операции
Nutritional status assessment before surgery
Table 2
|
Клиническая характеристика / Clinical characteristics |
Группа «лечебное питание» (N=85) / Group «therapeutic nutrition» (N=85) |
Группа «стандартный протокол» (N=85) / Group «standard protocol» (N=85) |
P |
|
ИМТ, ср. знач. ± ст. откл. / BMI mean value ± standard deviation |
23.23 ± 2.74 |
23.17 ± 1.76 |
0.8679 |
|
Общий белок (г/л), Me [Q1-Q3] / Total protein (g/l), Me [Q1-Q3] |
62,70 [61,70; 64,20] |
62,90 [62,20; 64,80] |
0,3108 |
|
Альбумин (г/л), Me [Q1-Q3] / Albumin (g/l), Me [Q1-Q3] |
33,00 [28,00; 37,00] |
32,00 [28,00; 36,00] |
0,0512 |
|
≥2 баллов по шкале MUST, n (%) / ≥2 points on the MUST scale, n (%) |
82 (96 %) |
83 (98 %) |
0.879 |
|
≥3 баллов по Шкале NRS-2002, n (%) / ≥3 points on the NRS-2002 scale, n (%) |
17 (20 %) |
18 (21 %) |
1,000 |
|
PG-SGA A, n (%) |
3 (4 %) |
2 (2 %) |
1.000 |
|
PG-SGA B, n (%) |
62 (73 %) |
63 (74 %) |
1.000 |
|
PG-SGA C, n (%) |
20 (24 %) |
20 (24 %) |
1.000 |
|
Потеря массы тела >5% за 6 месяцев, n (%) / Body weight loss >5% over 6 months, n (%) |
32 (38 %) |
37 (44 %) |
0,827 |
|
Индекс NLR >3,5 / NLR index >3.5 |
11 (13 %) |
21 (25 %) |
0,049 |
|
Индекс PLR >180 / PLR index >180 |
41 (48 %) |
38 (45 %) |
0,77 |
|
Индекс APRI >1,5 / APRI index >1,5 |
8 (9 %) |
18 (21 %) |
0,049 |
У 135 пациентов (79,4%) за время госпитализации отмечено уменьшение массы тела. При этом, медиана уменьшения массы тела в группе «лечебное питание» составила – 0,6 кг, в то время как медиана потери массы тела у пациентов группы «стандартный протокол» составила – 2,74 кг (р<0,0001).
Масса тела за время госпитализации не изменилась у 17 пациентов (16 пациентов из группы «лечебное питание» и 1 пациент из группы «стандартный протокол»). Увеличение массы тела за время госпитализации отмечено у 18 пациентов, все они входили в группу «лечебное питание».
У 73 пациентов в предоперационном периоде отмечалась гипоальбумиемия уровня <30 г/л. На всех этапах послеоперационного периода в группе «стандартный протокол» количество пациентов, имеющих гипоальбуминемию <30 г/л, было достоверно больше, чем в группе пациентов «лечебное питание» (табл. 3).
При этом, к завершению госпитализации у пациентов группы пациентов, получающих лечебное питание, не было отмечено тяжелой гипоальбуминемии, в то время как каждый пятый пациент в группе стандартного протокола имел этот признак недостаточности питания.
Таблица 3
Динамика уровня альбумина сыворотки крови в послеоперационном периоде
Table 3
Dynamics of serum albumin level in the postoperative period
|
Уровень альбумина в сыворотке крови <30 г/л / Serum albumin level <30 g/L |
Группа «лечебное питание» (N=85) / Group «therapeutic nutrition» (N=85) |
Группа «стандартный протокол» (N=85) / Group «standard protocol» (N=85) |
P |
|
3 сутки п/о / 3 |
28 |
46 |
0,042* |
|
days p/o |
(33 %) |
(54 %) |
|
|
7 сутки п/о / 7 |
18 |
33 |
0,047* |
|
days p/o |
(21 %) |
(39 %) |
|
|
11 сутки п/о / 11 days p/o |
0 |
16 (19%) |
<0,001* |
В раннем послеоперационном периоде у пациентов обеих групп отмечалось увеличение уровня маркеров воспаления и интоксикации в обеих группах пациентов. Это отражалось в значимом увеличении к 3 суткам после операции уровней С-реактивного белка, АЛТ, АСТ, а также индексов NLR, PLR и APRI. Однако к 7 и 11 суткам после операции наблюдалась положительная динамика уменьшения этих маркеров воспаления и интоксикации у больных как группы лечебного питания, так и группы стандартного протокола (рис. 1).
Следует отметить, что уже на 7 сутки после операции уровень С-реактивного белка, индексов NLR, PLR, APRI был значимо ниже у пациентов, получавших лечебное питание, по сравнению с больными, не получавших его. Достоверная разница сохранялась и на 11 сутки послеоперационного периода.
Динамика уровня С-рективного белка в сыворотке крови
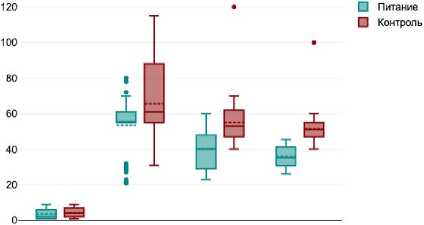
СРБ, до операции СРБ, 3-е сутки СРБ, 7-е сутки СРБ, 11 -е сутки
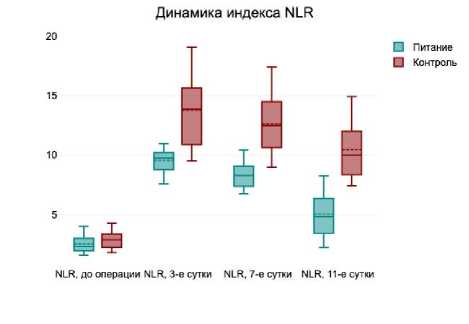
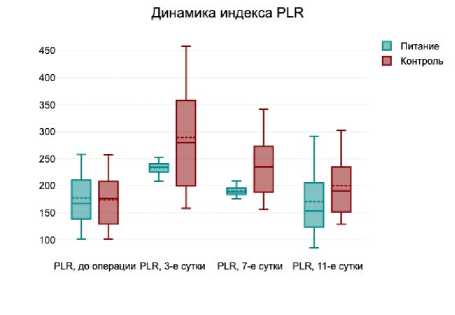
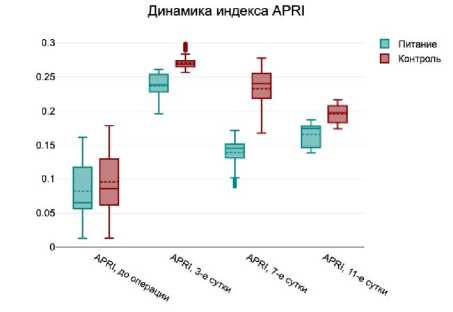
Рис. 1. Динамика маркеров воспаления на 3, 7 и
11 сутки послеоперационного периода
Fig. 1. Dynamics of inflammatory markers on 3, 7 and 11 days of the postoperative period
Частота всех осложнений в общей когорте пациентов составила 30 %, при этом среди пациентов, получавших лечебное питание, уровень всех осложнений был достоверно ниже (21 %), чем у больных из контрольной группы (41 %, р<0,006). Инфекционные осложнения также отмечены достоверно чаще в группе пациентов, получавших лечение по стандартному протоколу (22 %), чем в группе пациентов, получавших лечебное питание (8 %, р=0,018). При этом, отношение шансов между группами для частоты всех и инфекционных осложнений составило OR=2,89 и OR=3,18 соответственно.
Наибольшее число осложнений были купированы медикаментозными методами (Clavien-Dindo I), это были незначительные кровотечения и нагноения ран. Такие осложнения зарегистрированы достоверно чаще у больных, пролеченных в рамках стандартного протокола (21 %), по сравнению с пациентами, получавшими лечебное питание (7 %, р=0,0141). Несостоятельность кишечного анастомоза отмечена у 5 (6 %) пациентов группы, получавших лечебное питание, и у 9 (11 %) пациентов из группы стандартного протокола (р=0,415).
При проведении унивариантного анализа факторов, влияющих на развитие послеоперационных осложнений, установлено, что достоверно влияющими факторами риска являются: низкий уровень альбумина до операции (р<0,001), высокие значения маркеров воспаления и интоксикации APRI, NLR и PLR (р<0.001), а лечебное питание в послеоперационном периоде ассоциируется с достоверно меньшей частотой послеоперационных осложнений (p=0,0024).
Среди 96 пациентов, не имевших клиническую картину тяжелой мальнутриции перед операцией, не зарегистрировано ни одного осложнения. Все пациенты, у которых развились послеоперационные осложнения (n=51), изначально перед операцией находились в состоянии тяжелой мальнутриции. Таким образом, частота развития осложнений среди 74 па- циентов, находившихся в состоянии тяжелой мальнутриции перед операцией, составила 67 %.
При этом, среди 74 пациентов с исходной тяжелой маль-нутрицией частота всех осложнений, была значимо меньше у тех, кто принимал лечебное питание (47 %), по сравнению с теми, кто проходил лечение по стандартному протоколу (88 %, р=0,003). Достоверно отличалась и частота инфекционных осложнений: 21 % в группе лечебного питания и 48 % в группе стандартного протокола (р=0,0270, (рис. 2).

Рис. 2. Частота осложнений среди пациентов с исходной тяжелой мальнутрицией (n=74) Fig. 2. Frequency of complications among patients with initial severe malnutrition (n=74)
Наблюдалась взаимосвязь между применением лечебного питания и длительности госпитализации: в группе питания средняя длительность госпитализации составила 14 [12; 17] дней, а в контрольной группе 17 [14; 22] дней (p<0,0001).
Обсуждение
В данном исследовании было показано, что у пациентов, перенесших радикальную операцию по поводу колоректального рака, мальнутриция в предоперационном периоде является одним из самых важных факторов, приводящих к развитию послеоперационных осложнений. Степень мальнутриции коррелировала с тяжестью послеоперационных осложнений, и чем выраженнее был дефицит питания, тем выше оказывался риск развития инфекционных и неинфекционных осложнений. Употребление пациентами, имеющими тяжелую мальнутрицию, с первых суток после операции специального лечебного питания приводит к быстрому восстановлению уровня альбумина сыворотки, а также почти к двухкратному снижению частоты послеоперационных осложнений. Применение специального лечебного питания в послеоперационном периоде является до- стоверным фактором снижения частоты послеоперационных осложнений, в том числе инфекционных.
При раке толстой кишки пациенты сталкиваются с комплексным взаимодействием различных факторов, которые влияют на их благополучие, включая ухудшение питания, как, например, анорексия или уменьшение количества потребляемой пищи. Эти изменения приводят к росту потребностей в энергии и белках, в то время как анаболические процессы в организме уменьшаются, а катаболические – увеличиваются, особенно на фоне общего повышения метаболизма. Эти изменения усугубляются послеоперационным стрессом, который усиливает катаболизм и снижает способность тканей к регенерации, что приводит к замедленному заживлению и увеличенному риску осложнений. Также отмечается снижение физической активности. Обычно, это сопровождается рядом жалоб от пациентов, связанных с недостаточным употреблением необходимых питательных веществ, включая потерю веса, уменьшение способности к физической активности, усиленную утомляемость и даже депрессию. Все эти факторы в комплексе негативно сказываются на качестве жизни больных и их шансах на выживание, подчеркивая мультимодальную природу мальнутриции при данной заболевании [7, 8].
Несмотря на серьёзные последствия недостаточного питания у больных колоректальным раком, её диагностика остаётся сложной задачей. В клинической практике отсутствует единый, универсально принятый диагностический критерий мальнутриции, что затрудняет своевременную интервенцию и может приводить к запоздалому началу нутритивной поддержки. В связи с этим необходим комплексный подход, объединяющий клиническую оценку, лабораторные показатели и инструментальные методы, что позволит минимизировать влияние мальнутриции на течение колоректального рака и улучшить результаты лечения.
В проспективном исследовании, изучавшем влияние нутритивной поддержки у больных, перенесших плановое хирургическое вмешательство по поводу опухолей желудочнокишечного тракта [13], было показано, что пациенты с высоким нутритивным риском или недостаточностью питания имели значительно более длительное послеоперационное пребывание в стационаре — медиана составила 8 дней (IQR: 4,5–11,5) по сравнению с пациентами без нутритивных нарушений. Кроме того, среди всех участников исследования 37 % испытали хотя бы одно послеоперационное осложнение, а 24 % были повторно госпитализированы в течение 30 дней после выписки. В то же время анализ данных не выявил связи между ранним началом кормления (в среднем через 3,3 дня после операции) и увеличением частоты послеоперационных осложнений, что подтверждает безопасность раннего нутритивного вмешательства и подчеркивает необходимость своевременной коррекции нутритивного статуса для улучшения клинических исходов.
Результаты проведенного нами исследования показали, что наличие мальнутриции было достоверно связано с более высокой частотой послеоперационных осложнений, а проведение специализированного лечебного питания пациентов сопровождалось достоверно меньшей частотой осложнений. При этом, пациенты, получавшие лечебное питание, имели более выраженную динамику снижения воспалительных маркеров (CRP, NLR, PLR, APRI), что свидетельствует о его противовоспалительном и иммуномодулирующем эффекте.
Исследование Kabata и соавт. [17] показало, что предоперационное специализированное энтеральное питание снижает частоту осложнений у онкологических пациентов (p<0,001), что согласуется с нашими данными. В нашем исследовании нутритивная поддержка в послеоперационном периоде также привела к значительному уменьшению осложнений: их частота была ниже в два раза (21 % против 41 %, p<0,006), а инфекционные осложнения встречались реже почти в три раза (8 % против 22 %, p=0,018). Стоит отметить, что в нашем исследовании дополнительное влияние на уменьшение воспалительного ответа оказало нутритивное вмешательство в послеоперационный период, в отличие от Kabata и соавт., где изучалось исключительно предоперационное питание. Эти результаты подтверждают важность нутритивной поддержки не только перед операцией, но и в послеоперационный период, способствуя снижению риска осложнений и улучшению восстановления пациентов с колоректальным раком.
В исследовании Sharma и соавт. [18] применялись низкообъемные высококалорийные оральные добавки в послеоперационном периоде у пациентов, перенесших радикальную плановую операцию по поводу колоректального рака. На этом фоне удалось добиться более высокого общего среднесуточного калорийного приема (818,5 ккал против 528 ккал; P = 0,002). В нашем исследовании включение в рацион пациентов после операции специализированных продуктов лечебного питания метаболической направленности ЛЕОВИТ ONCO (ООО «ЛЕОВИТ нутрио») позволило в первые сутки обеспечить пероральное поступление 216 ккал, а со вторых суток дополнительные 221 ккал за счет белков, жиров и углеводов. В отличие от нашей работы, в это исследование включались пациенты, не имеющие дефицита питания на момент включения. Тем не менее, оно продемонстрировало, что специализированное лечебное питание метаболической направленности приводит к снижению продолжительности пребывания в стационаре (6,5 против 9 дней, p=0,037). В нашем исследовании также отмечено, что специализированное лечебное питание сокращает среднюю длительность госпитализации с 17 до 14 дней (p<0,0001) даже у пациентов, которые изначально находились в состоянии мальнутриции. Снижение частоты послеоперационных осложнений в нашем исследовании дополнительно коррелировало со снижением уровня воспалительных маркеров и гипоальбуминемии, что не было детально рассмотрено в исследовании Sharma и соавторов [18]. Также, отличие от работы Sharma и соавт., в нашем исследовании были проанализированы уровни воспалительных маркеров (CRP, PLR, NLR, APRI), что позволило дополнительно оценить влияние лечебного питания на системное воспаление и иммунный ответ.
Работа Manasek и соавторов [19] показала, что высокобелковая нутритивная поддержка пациентов, перенесших плановую операцию по поводу колоректального рака, не только улучшает клинические исходы, но и снижает затраты на лечение, что в первую очередь связано с уменьшением частоты послеоперационных осложнений и длительности госпитализации с 12 ± 4 дней до 9,4 ± 4,97 дней. Кроме того, отмечалось достоверное снижение частоты осложнений: нагноение операционных ран (в 2,2 раза меньше), инфекционных осложнений (в 4,3 раза меньше), несостоятельность анастомоза (в 2 раза меньше). В нашем исследовании также показано достоверное снижение риска послеоперационных осложнений: в 2,89 раз для всех осложнений и 3,18 раз для инфекционных осложнений.
Хотя достоверного уменьшения риска несостоятельности анастомоза в нашей работе отмечено не было, что, вероятно, связано с тем, что в отличие от других подобных исследований мы включали только пациентов в состоянии мальнутриции. Исходно у всех этих пациентов более высокий риск всех осложнений, включая несостоятельность анастомоза.
Проведенное нами исследование впервые установило, что даже у пациентов с выраженной мальнутрицией и гипоаль-бумиемией в предоперационном периоде можно добиться почти трехкратного уменьшения риска послеоперационных осложнений, включая инфекционные осложнения. Несмотря на то, что среднее количество употребляемого белка в составе продуктов специализированного лечебного питания метаболической направленности ЛЕОВИТ ONCO (ООО «ЛЕОВИТ нутрио») меньше, чем в других распространенных продуктах лечебного питания, значительного увеличения уровня альбумина сыворотки крови к концу госпитализации удалось добиться у всех пациентов, получавших лечебное питание, в то время как каждый пятый пациент из группы стандартного протокола ведения продолжал иметь выраженную гипоальбумиемию.
Кроме того, благодаря включению в состав продуктов специализированного лечебного питания ЛЕОВИТ ONCO (ООО «ЛЕОВИТ нутрио») компонентов с антиоксидантными и детоксикационными свойствами, в проведенном нами исследовании было продемонстрировано, что пациенты, получавшие данное питание после операции, имели достоверно более низкие показатели воспалительного ответа и токсической реакции, чем пациенты, не получавшие такого питания. Так, уровень С-реактивного белка, а также индексы PLR, NLR и APRI были значительно ниже на всех контрольных точках послеоперационного периода: 3, 7 и 11 суток.
Похожие результаты продемонстрированы Дайхес и соавторами [20]: включение в рацион продуктов питания, разработанных специально для лечебных и профилактических целей в диете онкологических пациентов, в частности, белковых коктейлей с детокс эффектом и коктейлей, направленных на восстановление, оказывает значительное положительное воз- действие на уровень белков в крови. Наблюдалось увеличение общего содержания белка на 11,5 %, альбуминов – на 19 %, α1- и α2-глобулинов – на 18 и 37 % соответственно, а уровень γ-глобулинов повышается на 26 %. Кроме того, использование специфических детоксикационных продуктов способствовало снижению уровня С-реактивного белка на 37,1 %, что является ключевым показателем воспалительных процессов.
Таким образом, настоящее исследование продемонстрировало, что мальнутриция у пациентов с колоректальным раком, подвергающихся плановому хирургическому вмешательству, является значимым фактором риска развития послеоперационных осложнений. Использование специализированного лечебного питания в послеоперационном периоде способствовало значительному снижению частоты всех осложнений в 2 раза и инфекционных осложнений почти в 3 раза. Кроме того, нутритивная поддержка привела к более быстрому восстановлению уровня альбумина, снижению выраженности воспалительных реакций (CRP, NLR, PLR, APRI) и достоверному уменьшению длительности госпитализации.
В отличие от других исследований, направленных на оценку предоперационного питания, данное исследование продемонстрировало клиническую эффективность послеоперационной нутритивной поддержки, что делает его уникальным. Анализ данных показал, что специализированное лечебное питание оказывает не только нутритивный, но и противовоспалительный эффект, снижая уровень маркеров воспаления и интоксикации, что дополнительно способствует более быстрому восстановлению пациентов.
Настоящее исследование является первым в своем роде не только в России, но и в международной хирургической практике, в котором доказаны клинические преимущества специализированного лечебного питания метаболической направленности у больных колоректальным раком с маль-нутрицией в послеоперационном периоде. Данные подчеркивают необходимость дальнейшего изучения и внедрения нутритивной поддержки в стандарты лечения данной категории пациентов.
Выводы
-
1. Мальнутриция в предоперационном периоде достоверно увеличивает риск послеоперационных осложнений, особенно инфекционных, и требует своевременной коррекции.
-
2. Применение специализированного лечебного питания метаболической направленности в послеоперационный период значительно снижает частоту осложнений, сокращает длительность госпитализации и способствует более быстрому восстановлению уровня альбумина.
-
3. Влияние лечебного питания выходит за рамки нутритивной поддержки, оказывая выраженный противовоспалительный эффект, что подтверждается снижением уровней CRP, NLR, PLR и APRI.
-
4. Полученные результаты подчеркивают необходимость внедрения стандартизированных протоколов нутритивной поддержки для пациентов с колоректальным раком, находящихся в состоянии мальнутриции, что позволит значительно улучшить исходы лечения.


