Роль полиморфизмов генов ренин-ангиотензиновой системы в развитии углеводных нарушений у пациентов с артериальной гипертензией
Автор: Журавлева Л.В., Куликова М.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Артериальная гипертензия (АГ) и сахарный диабет (СД) 2-го типа являются наиболее распространенной коморбидной патологией. Сосуществование этих нарушений ускоряет развитие микро- и макрососудистых осложнений, значительно увеличивает сердечно-сосудистый риск, риск инсульта и терминальной стадии почечной недостаточности. Синергичность этих двух патологий обусловлена единством патогенетических механизмов, в том числе генетической предрасположенностью. Известно, что блокада ренин-ангиотензиновой системы (РАС) замедляет развитие СД 2-го типа, а также снижает частоту случаев кардиоваскулярных или почечных событий у больных с данными нарушениями. Полиморфизмы генов РАС активно изучаются в контексте развития кардиоваскулярных заболеваний. В настоящее время не установлена роль полиморфизмов этих генов в развитии углеводных нарушений, однако существует большая вероятность их участия. Цель обзора: проанализировать накопленные данные о влиянии полиморфизмов генов РАС на развитие АГ и СД 2-го типа.
Артериальная гипертензия, сахарный диабет 2-го типа, полиморфизмы генов ренин-ангиотензиновой системы
Короткий адрес: https://sciup.org/149125320
IDR: 149125320 | УДК: 616.12-008.331.1: | DOI: 10.29001/2073-8552-2019-34-3-33-39
Текст научной статьи Роль полиморфизмов генов ренин-ангиотензиновой системы в развитии углеводных нарушений у пациентов с артериальной гипертензией
Артериальная гипертензия (АГ) является главным фактором риска развития заболеваний системы кровообращения и одним из самых распространенных хронических заболеваний. Сегодня около 25% взрослого населения мира страдают АГ, по прогнозам к 2025 г. распространенность данного заболевания вырастет до 1,5 млрд человек, а 7,6 млн преждевременных смертей возникают именно вследствие высокого артериального давления (АД) [1]. Риск возникновения осложнений и смерти при АГ растет в соответствии с количеством сопутствующих факторов риска. По данным многих эпидемиологических исследований, лишь у 1% больных с повышенным АД не обнаружено других факторов риска. Так, 61% больных имеют три или более факторов риска, что ассоциировано с высоким относительным риском общей смерти – 3,8% [2].
Таким образом, в изолированном виде АГ встречается только в 8% случаев, а в остальных случаях она сочетается с одним или двумя и более факторами сердечно-сосудистого риска. В 20–22% случаев АГ сочетается с гиперлипидемией, в 30% случаев – с гиперлипидемией и ожирением, тогда как 32% больных имеют АГ, дислипидемию, ожирение и разнообразные нарушения углеводного обмена нарушение толерантности к глюкозе, инсулинорезистентность (ИР), сахарный диабет (СД) 2-го типа [3, 4].
Повышение АД у пациентов с СД 2-го типа развивается с участием эффектов активации ренин-ангиотензиновой системы (РАС). Именно гипергликемия является одним из важнейших факторов, ведущих к гиперреактивности РАС. Кроме того, участие РАС в развитии ИР в значительной степени определяется ее способностью усиливать развитие ожирения. Выявлено, что такой компонент РАС, как ангиотензин II (АТ ІІ), принимает участие в регуляции роста и развития жировой ткани [5].
По данным многих авторов, известно, что блокада РАС приводит к снижению ИР, которая является принципиальным признаком СД 2-го типа [6, 7]. Именно поэтому важным является изучение особенностей РАС, основными компонентами которой являются ангиотензиноген (AGT), ангиотензинпревращающий фермент (АПФ) и ангиотензин II (АТ II) у больных АГ и сопутствующими углеводными нарушениями. До сих пор остается до конца не определено, что же первично: АГ или СД 2-го типа?
Имеются данные о том, что ИР еще до развития клинических проявлений СД 2-го типа и АГ способствует повреждению сосудистой стенки. Так, результаты исследования Atherosclerosis Risk in Communities (ARIC) продемонстрировали, что жесткость сосудистой стенки, увеличение которой провоцирует ИР, являлась предиктором развития АГ: риск развития АГ увеличивался на 15% на фоне снижения эластичности сосудистой стенки на одно стандартное отклонение [8].
В течение многих десятилетий значительное внимание уделяется определению роли РАС в развитии нарушений деятельности сердечно-сосудистой системы, а именно в патогенезе АГ. АТ II – основной компонент РАС, который способствует констрикции гломерулярных артериол, меняя таким образом скорость клубочковой фильтрации. В коре надпочечников АТ II вызывает выделение альдостерона, который, в свою очередь, усиливает реабсорбцию натрия за счет вытеснения ионов калия в почечные канальцы. Кроме этого, АТ II способен повышать воспалительный потенциал, провоцировать развитие ок-сидативного стресса и дисфункции эндотелия, активировать атерогенез [9–11].
Влияние АТ ІІ на сердце и сосуды осуществляется при участии двух типов рецепторов. Через рецепторы АТ ІІ 1-го типа (АТ1-рецепторы) опосредованы основные физиологические и патофизиологические эффекты АТ II, роль рецепторов 2-го типа (АТ2-рецепторы) остается противоречивой. Экспрессия этих рецепторов значительно увеличивается при разных патологических состояниях, связанных с воспалением и ремоделированием сердца и сосудов (АГ, атеросклерозе, СД 2-го типа, инфаркте миокарда) [12, 13].
Высокая активность компонентов РАС также сопряжена с развитием СД 2-го типа, а именно с развитием механизма ИР. Применение современных молекулярно-биологических технологий позволило установить, что пострецепторные сигнальные системы АТ II и инсулина тесно взаимосвязаны (рис. 1).
Инсулин после взаимодействия со своими рецепторами на поверхности клетки индуцирует тирозин-фос-форилирование белков, которые являются субстратами инсулиновых рецепторов типов 1 и 2 (IRS 1 и IRS 2). Далее молекулы IRS активируют фосфатидилинозитол-3-киназу (PI3-K), через которую осуществляется передача сигнала
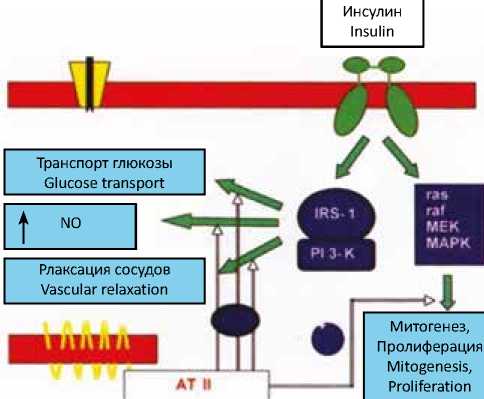
Рис. 1. Влияние АТ ІІ на развитие ИР (Folli F., 1999)
Fig. 1. Effects of AT II on the development of insulin resistance (Folli
F., 1999)
и реализация метаболических и сосудорасширяющих эффектов инсулина (транспорт глюкозы в клетки, синтез оксида азота). АT II блокирует PI3-K – сигнальный путь инсулина в клетках сосудов и других инсулинозависимых тканей, одновременно стимулируя другую сигнальную систему инсулина (ras, raf, MEK, MAPK), которая приводит к активации митогенных и пролиферативных процессов [14–17]. Таким образом, АТ II блокирует основной метаболический эффект инсулина – транспорт глюкозы в клетки, усиливает пролиферативное и атерогенное действие инсулина. Другими словами, гиперактивность РАС сопровождается усилением ИР периферических тканей.
Наименее изученными сегодня остаются генетические механизмы предрасположенности к развитию метаболических нарушений, развивающихся на фоне сердечно-сосудистых заболеваний. В последнее время доказано, что развитию АГ способствует генетическая склонность. Генетические факторы могут играть существенную роль в развитии АГ, подтверждать ее полиген-ный характер, способность потенциировать развитие других сопутствующих патологических состояний.
Поэтому поиск генетических маркеров РАС, отвечающих за развитие АГ и сопутствующих нарушений углеводного метаболизма, является очень актуальной проблемой и представляет интерес для многих ученых. Сложность их изучения заключается в большом количестве генов, которые могут участвовать в формировании наследственной предрасположенности как самостоятельно, так и путем взаимодействия друг с другом. В последнее время накоплено значительное количество информации как о полиморфных участках генома человека в целом, так и об их корреляции с различными заболеваниями [18]. Стоит отметить, что полиморфизм можно обнаружить во всех структурных элементах генома: экзонах, интронах, регуляторных участках и т. д.. При этом вариации, непо- средственно затрагивающие кодирующие фрагменты гена (экзоны), которые отражаются на аминокислотной последовательности их продуктов, наблюдаются относительно редко, однако именно они представляют наибольшую ценность. Большинство случаев полиморфизма выражаются в заменах одного нуклеотида (SNP – single nucleotide polymorphism) или в изменении количества фрагментов, которые дублируются [19].
Сегодня обнаружены полиморфизмы десятков генов, претендующих на роль наследственных маркеров атеросклероза, АГ, ишемической болезни сердца (ИБС), инфаркта миокарда, хронической сердечной недостаточности (ХСН) и микрососудистых осложнений СД 2-го типа, а именно диабетической ретинопатии и нефропатии [20, 21]. Однако остается не до конца понятным их клиническое и прогностическое значение, кроме того, данные литературы отличаются заметным противоречием.
В связи с тем, что одним из главных механизмов развития синергичной патологии (АГ и СД 2-го типа) является дисбаланс нейрогуморальных систем организма, в частности патологическое повышение активности РАС, именно поиск и изучение полиморфизмов генов этой системы является сегодня наиболее актуальным.
Одним из ключевых компонентов РАС является АПФ. Известный полиморфизм гена АПФ типа I/D (insertion/ deletion) в 16-м интроне ассоциирован с активностью АПФ в крови: носители генотипа II имеют самый низкий уровень фермента, тогда как у людей с DD генотипом он максимальный. Таким образом, наличие аллельного варианта D сочетается с повышенным содержанием АТ II, снижением уровня брадикинина и может быть фактором риска развития сердечно-сосудистой патологии [22].
До настоящего времени накоплено множество данных об ассоциации полиморфизма гена АПФ с инфарктом миокарда, внезапной смертью, АГ, гипертрофией левого желудочка (ЛЖ), гипертрофической кардиомиопатией, дисфункцией эндотелия, заболеваниями почек и микро-сосудистыми осложнениями СД [22–25]. В частности, в одном из исследований было установлено, что наличие аллеля D в генотипе пациентов ассоциировалось с более высокими уровнями АД (как систолического, так и диастолического), склонностью к кризовому течению АГ и статистически значимо большей выраженностью гипертрофии миокарда ЛЖ. Наличие генотипа II у пациентов с АГ, наоборот, было связано с бессимптомным течением и статистически значимо более поздним возрастом манифестации [26]. Кроме того, показано, что генотип DD чаще встречается у пациентов с ИБС, СД и наличием других факторов риска (гиперлипидемией, курением, семейным анамнезом сердечно-сосудистых заболеваний) [22, 26, 27].
Во многих исследованиях получены данные о том, что неблагоприятные варианты генотипов полиморфизма I/D гена АПФ – ID и DD ассоциированы с развитием АГ. Так, выяснено, что присутствие полиморфизма I/D гена АПФ согласуется с уровнями АПФ в плазме – гомозиготы DD соответствуют повышенному уровню АПФ. DD вариант генотипа был ассоциирован с инфарктом миокарда, а также инсультом и развитием АГ [28].
При обследовании достаточно большой популяции (3145 человек) в рамках Фремингемского исследования было установлено, что наличие D аллеля гена АПФ ассоциируется с более высоким уровнем АД у мужчин. Особенно выраженной была связь D аллеля с уровнем диастолического АД. Для женщин таких закономерностей не обнаружено [29].
Среди большого количества генов-кандидатов ген рецептора 1-го типа к ангиотензину II (AGTR1) также привлекает к себе внимание, потому что через него опосредовано не только вазоконстрикторное действие АТ II, но также экспрессия факторов роста, пролиферация гладкой мускулатуры, высвобождение ингибитора тканевого активатора плазминогена и ряд других важных эффектов [30, 31]. Ген, кодирующий AGTR1, расположен на 3-й хромосоме (3q24). Наиболее активно изучался полиморфизм 1166C, который приводит к замене аденина (А) на цитозин (С) в 1166-м положении гена AGTR1 . А. Bonnardeaux и соавт. доказали, что мутация именно в 1166-м положении нуклеотидной последовательности гена AGTR1 влияет на функциональную активность рецептора и АТ II [32]. Полиморфизм A1166C в AGTR1 ассоциирован с ИБС, инфарктом миокарда и развитием АГ [32, 33]. Другими авторами также установлено, что АС генотип ассоциирован с более высокой активностью АТ II у пациентов с ИБС, с жесткостью сосудистой стенки у пациентов с АГ [34–36].
Не менее важной составляющей РАС является белок ангиотензиноген (AGT). Описаны несколько полиморфных вариантов генов, кодирующих AGT, однако наиболее значимыми являются полиморфные варианты М235Т и Т174М, связанные с уровнем активности AGT плазмы крови, содержанием АТ II и, следовательно, с риском сердечно-сосудистых заболеваний [37, 38]. По данным литературы, наличие аллеля риска 174М гена AGT гораздо чаще встречается у пациентов с ИБС, перенесенным инфарктом миокарда и гипертрофией миокарда ЛЖ [38, 39]. При изучении М235Т полиморфизма установлено, что вариант 235Т является независимым фактором риска развития инфаркта миокарда, ИБС. Кроме того, было обнаружено, что наличие одного или двух Т аллелей сопровождается существенным повышением уровня AGT в плазме, что приводит к повышению содержания АТ II, чем большинство
Список литературы Роль полиморфизмов генов ренин-ангиотензиновой системы в развитии углеводных нарушений у пациентов с артериальной гипертензией
- Медико-демографическая ситуация и основные показатели медицинской помощи населению в региональном аспекте: 2012 год. Киев: ГУ "Украинский институт стратегических исследований Минздрава Украины"; 2013:190.
- Нетяженко В.З., Амбросова Т.Н., Гидзинская И.Н., Ковалева О.Н., Мелина И.Н., Сиренко Ю.Н. и др. Артериальная гипертензия. Обновленный и адаптированный клинический протокол, основанный на доказательствах (2012). Рабочая группа по артериальной гипертензии Украинской ассоциации кардиологов. Артериальная гипертензия. 2012;1(21):96-152.
- De Boer I.H., Bangalore S., Benetos A., Davis A.M., Michos E.D., Muntner P. et al. Diabetes and hypertension: a position statement by the American Diabetes Association. Diabetes Care. 2017;40(9):1273-1284. DOI: 10.2337/dci17-0026
- Мамедов М.Н., Горбунов Н.В., Кисeлева Н.В., Оганов Р.Г. Особенности структурно-функциональных изменений миокарда и гемодинамических нарушений у больных с метаболическим синдромом: вклад артериальной гипертонии в формирование суммарного коронарного риска. Кардиология. 2005;45(11):11-16.
- Leoncini G., Ratto E., Viazzi F., Vaccaro V., Parodi D., Parodi A. et al. Metabolic syndrome is associated with early signs of organ damage in nondiabetic, hypertensive patients. J. Intern. Med. 2005;257: 454-460.
- Wei Y., Whaley-Connell А.Т., Chen К., Habibi J., Uptergrove G.M., Clark S.E. et al. NADPH oxidase contributes to vascular inflammation, insulin resistance and remodeling in the transgenic (mren2) rat. Hypertension. 2007;50:384-391.
- Whaley-Connell A., Johnson M.S., Sowers J.R. Aldosterone: role in the cardiometabolic syndrome and resistant hypertension. Prog. Cardiovasc. Dis. 2010;52:401-409.
- DOI: 10.1016/j.pcad.2009.12.004
- Ермакова Е.А., Аметов А.С., Черникова Н.А. Сахарный диабет и артериальная гипертензия. Медицинский совет. 2015;12:12-17.
- Callera G.E., Touyz R.M., Tostes R.C., Yogi A., He Y., Malkinson S. et al. Aldosterone activates vascular p38MAP kinase and NAD (P) H oxidase via c-Src. Hypertension. 2005;45:773-779.
- Giacchetti G. Aldosterone as key mediator of the cardiometabolic syndrome is primary aldosteronism: an observation study. J. Hypertens. 2007;25:177-186.
- Kobayashi N., Yoshida К., Nakano S., Ohno T., Honda T., Tsubokou Y. et al. Cardioprotective mechanisms of eplerenone on cardiac performance and remodeling in failing rat hearts. Hypertension. 2006;47:671-679.
- DOI: 10.1161/01.HYP.0000203148.42892.7a
- Heeneman E., Slumer J.C., Deamen M.G. Angiotensin-converting enzyme and vascular remodeling. Circ. Res. 2007;101:441-454.
- DOI: 10.1161/CIRCRESAHA.107.148338
- Henke N., Schmidt-Ulrich R., Dechend R. Vascular endothelial cell-specific NF-kappaB suppression attenuates hypertension-induced renal damage. Circ. Res. 2007;101:268-276.
- Дедов И.И., Шестакова М.В. Сахарный диабет и артериальная гипертензия. Москва: ООО "Медицинское информационное агентство"; 2006:344.
- Muscogiuri G., Chavez A.O., Gastaldelli A. The crosstalk between insulin and renin-angiotensin-aldosterone signaling systems and its effect on glucose metabolism and diabetes prevention. Current Vascular Pharmacology. 2011;6:301-312.
- Sironi A.M., Sicari R., Folli F., Gastaldelli A. Ectopic fat storage, insulin resistance, and hypertension. Current Vascular Pharmacology. 2011;17:3074-3080.
- Jandeleit-Dahm K., Cooper M.E. Hypertension and diabetes: role of the renin-angiotensin system. Endocrinol. Metab. Clin. North Am. 2006;35:469-490.
- DOI: 10.1016/j.ecl.2006.06.007
- Новиков П.В. ДНК-тестирование: моногенные и мультифакториальные болезни. Русский медицинский журнал. 2011;12: 794-799.
- Горбунова В.И. Медицинская генетика. СПб.: СПбГПУ; 2007:351.
- Forstermann U., Munzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace. Circulation. 2006;113:1708-1714.
- DOI: 10.1161/CIRCULATIONAHA.105.602532
- Song G.G., Lee Y.H. Angiotensin-converting enzyme insertion/deletion polymorphism and susceptibility to systemic sclerosis: a meta-analysis. Genet. Mol. Res. 2014;13(4):74-83.
- DOI: 10.4238/2014.October.7.12
- Kondo H., Ninomiya T., Hata J., Hirakawa Y., Yonemoto K., Arima H. et al. Angiotensin I-сonverting enzyme gene polymorphism enhances the effect of hypercholesterolemia on the risk of coronary heart disease in a general japanese population: the hisayama study. J. Atheroscler. Thromb. 2014;16:3078-3097.
- DOI: 10.5551/jat.24166
- Abbas S.I., Raza S.T., Chandra A., Rizvi S., Ahmed F., Eba A. et al. Association of ACE, FABP2 and GST genes polymorphism with essential hypertension risk among a North Indian population. Ann. Hum. Biol. 2014;30:1-9.
- DOI: 10.3109/03014460.2014.968206
- Bai Y., Wang L., Hu S., Wei Y. Association of angiotensin-converting enzyme I/D polymorphism with heart failure: a meta-analysis. Mol. Cell Biochem. 2012;361:297-304.
- DOI: 10.1007/s11010-011-1115-8
- Pereira S.B., Velloso S.W., Chermont S., Quintão M.M., Nunes Abdhala R., Giro C. et al. β-adrenergic receptor polymorphisms in susceptibility, response to treatment and prognosis in heart failure: implication of ethnicity. Mol. Med. Report. 2013;7(1):259-265.
- DOI: 10.3892/mmr.2012.1120
- Mulder H.J., van Geel P.P., Schalij M.J., van Gilst W.H., Zwinderman A.H., Bruschke A.V. et al. DD ACE gene polymorphism is associated with increased coronary artery endothelial dysfunction: the PREFACE trial. Heart. 2003 May;89(5):557-558.
- DOI: 10.1136/heart.89.5.557
- Sakhteh M.I., Poopak B., Amirizadeh N., Shamshiri A.R. Polymorphism and synergism of angiotensin-converting enzyme (ACE) and plasminogen activator inhibitor-1 (PAI-1) genes in coronary artery disease. Journal of the Renin-Angiotensin-Aldosterone System. 2015;16(4):1168- 1174.
- DOI: 10.1177/1470320314561247
- Keavney B., McKenzie C., Parish S. Large-scale test of hypothesised associations between the angiotensin-converting-enzyme insertion/ deletion polymorphism and myocardial infarction in about 5000 cases and 6000 controls. International Studies of Infarct Survival (ISIS). Lancet. 2000;355:434-442.
- Govindaraju D.R., Adrienne Cupples L., Kannel W.B., O'Donnell C.J., Atwood L.D., D'Agostino R.B. et al. Genetics of the Framingham Heart Study Population. Adv. Genet. 2008;62:33-65.
- DOI: 10.1016/S0065-2660(08)00602-0
- Schmieder R.E., Hilgers K.F., Schlaich M.P., Schmidt B.M. Renin-angiotensin system and cardiovascular risk. Lancet. 2007;369:1208-1219.
- Целуйко В.И., Брегвадзе Т.Р., Мищук Н.Е., Вашакидзе З.С. Полиморфизм гена рецептора ангиотензина II 1-го типа и его влияние на эффективность терапии олмесартаном в пациентов с гипертонической болезнью. Український кардiологiчний журнал. 2013;4:21-27.
- Bonnardeaux A., Davies E., Jeunemaitre X. Angiotensin II type 1 receptor gene polymorphisms in human essential. Hypertension. 1994;24:9-63.
- Canavy I., Henry M., Morange P.E. Genetic polymorphisms and coronary artery disease in the south of France. Thromb. Haemost. 2000;83(2):212-216.
- Van Geel P.P., Pinto Y.M., Voors A.A. Angiotensin II type 1 receptor A1166C gene polymorphism is associated with an increased response to angiotensin II in human arteries. Hypertension. 2000;35:717-721.
- Buraczyńska M., Pijanowski Z., Spasiewicz D., Nowicka T., Sodolski T., Widomska-Czekajska T. et al. Renin-angiotensin system gene polymorphisms: assessment of the risk of coronary heart disease. Kardiol. Pol. 2003;58(1):1-9.
- Danser A.H., Schunkert H. Renin-angiotensin system gene polymorphisms: Potential mechanisms for their association with cardiovascular diseases. Eur. J. Pharmacol. 2000;410:303-316.
- Wang Q.S., Li Y.G., Chen J.F., Yu J.F., Wang J., Sun J. et al. Angiotensinogen polymorphisms and acquired atrial fibrillation in Chinese. J. Electrocardiol. 2010;43(4):373-377.
- Dickson M.E., Sigmund C.D. Genetic basis of hypertension: revisiting angioten-sinogen. hypertension. 2007;48:14-20.
- Нгуен Т.Ч. Исследование ассоциации Т174М и M235T гена ангиотензиногена с ишемической болезнью сердца в Ростовской популяции. Фундаментальные исследования. 2010;3:114-121.
- Sethi A.A., Nordestgaard B.G., Gronholt M.L. Angiotensinogen single nucleotide polymorphisms, elevated blood pressure, and risk of cardiovascular disease. Hypertension. 2003;6:102-111.
- Спивак И.М.,Сейлиева Н.А., Смирнова Т.Ю. Полиморфизмы генов ренин - ангиотензиновой системы и их корреляция с психологическими проявлениями родового стресса. Цитология. 2008;50(10):899-906.
- Van Rijn M.J., Bos M.J., Isaacs A., Yazdanpanah M., Arias-Vásquez A., Stricker B.H.Ch. et al. Polymorphisms of the renin - angiotensin system are assotiated with blood pressure, atherosclerosis and cerebral white matter pathology. J. Neurol. Neurosurg. Psychiatry. 2007;78:1083- 1087.
- DOI: 10.1136/jnnp.2006.109819
- Ji L.D., Zhang L.N., Shen P. Association of angiotensinogen gene M235T and angiotensin-converting enzyme gene I/D polymorphisms with essential hypertension in Han Chinese population: a meta-analysis. J. Hypertens. 2010;28:419-428.
- Fang Y.J., Deng H.B., Thomas G.N. Linkage of angiotensinogen gene polymorphisms with hypertension in a sibling study of Hong Kong Chinese. J. Hypertens. 2010;28:1203-1209.


