Роль провоспалительных цитокинов в развитии антрациклин-индуцированной сердечной недостаточности
Автор: Тепляков А.Т., Шилов С.Н., Попова А.А., Березикова Е.Н., Гракова Е.В., Неупокоева М.Н., Копьева К.В., Ратушняк Е.Т., Степачев Е.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.35, 2020 года.
Бесплатный доступ
Цель: изучить патогенетическую и прогностическую роль цитокинов (фактора некроза опухоли-α - ФНО-α и интерлейкина-1β - ИЛ-1β) при развитии антрациклин-индуцированной хронической сердечной недостаточности (ХСН).Материал и методы. Обследованы 176 женщин с раком молочной железы (РМЖ), получавших антрациклиновые антибиотики в составе схем полихимиотерапии (ПХТ). По итогам обследования через 12 мес. после окончания ПХТ пациентки, находящиеся в состоянии ремиссии основного заболевания, были разделены на 2 группы: больные с развитием кардиотоксического ремоделирования (группа 1 - 52 человека) и женщины с сохраненной функцией сердца (группа 2 - 124 человека). Всем больным до начала курса химиотерапии, в динамике лечения антрациклинами и после терапии проводили эхокардиографическое (ЭхоКГ) исследование. Биохимическое исследование крови для определения уровней ФНО-α и ИЛ-1β осуществляли до начала курса ПХТ, после завершения ПХТ и через 12 мес. после завершения ПХТ. Определение полиморфизмов генов ФНО-α (-308G/A, rs1800629) и ИЛ-1β (+3953, rs1143634) проводили методом полимеразной цепной реакции.Результаты. В группе 1 более высокий уровень ФНО-α и ИЛ-1β ассоциировался с развитием ХСН через 12 мес. после окончания ПХТ. Уровень ФНО-α более 7,5 пг/мл (чувствительность - 44,2%, специфичность - 75,8%, AUС = 0,600; 95% CI = 0,524-0,673; р = 0,035) после завершения курса ПХТ позволил с наибольшей вероятностью прогнозировать развитие сердечно-сосудистых осложнений у женщин, получавших терапию антрациклинами. Исследование не выявило значимых различий в распределении частот встречаемости генотипов полиморфизма 308G/A (rs1800629) гена ФНО-α и полиморфизма +3953 (rs1143634) гена ИЛ-1β в исследованных группах.Заключение. У больных с РМЖ и развившейся антрациклин-индуцированной ХСН через 12 мес. после окончания ПХТ выявляется повышенный уровень ФНО-α и ИЛ-1β, что свидетельствует о патогенетической роли провоспалительных цитокинов в развитии поражения сердца при терапии антрациклинами.
Кардиотоксичность, антрациклины, сердечная недостаточность, цитокины, фактор некроза опухоли-α, интерлейкин-1β
Короткий адрес: https://sciup.org/149126183
IDR: 149126183 | УДК: 616.12-008.46:577.112 | DOI: 10.29001/2073-8552-2020-35-2-66-74
Текст научной статьи Роль провоспалительных цитокинов в развитии антрациклин-индуцированной сердечной недостаточности
–74
Teplyakov A.T., Shilov S.N., Popova A.A., Berezikova E.N., Grakova E.V., Neupokoeva M.N., Kopeva K.V., Ratushnyak E.T., Stepachev E.I. The role of proinflammatory cytokines in the development of anthracycline-induced heart failure. The Siberian Medical Journal. 2020;35(2):66– 74.
Сердечно-сосудистые и онкологические заболевания являются ведущей причиной заболеваемости и смертности в промышленно развитых странах. Тем не менее есть основания для оптимизма. Современные стратегии лечения привели к значительному улучшению прогноза у больных с данными заболеваниями. Так, 5-летняя выживаемость при раке молочной железы (РМЖ) ранней стадии увеличилась с 79% в 1990 г. до 88% в 2012 г.; аналогичные показатели достигнуты и при других солидных и гематологических злокачественных опухолях, в том числе при неходжкинской лимфоме и раке яичка [1]. При долгосрочном прогнозе по выживаемости больных с онкологическими заболеваниями ожидаемое увеличение в течение 10 лет, начиная с 2012 г., составит примерно 30%, достигнув 18 млн к 2022 г. в США [2]. Многие современные методы противоопухолевого лечения ассоциируются с различной степенью выраженности осложнениями, в том числе со стороны сердечно-сосудистой системы (кардиотоксичность, ишемия, артериальная гипертония, аритмии). Встречаемость кардиологических осложнений варьирует в широких пределах в зависимости от используемой схемы терапии рака, продолжительности лечения, а также от основных сопутствующих заболеваний пациента [3–6].
В обзоре, касающемся РМЖ, у выживших в США женщин был отмечен высокий риск смерти от сердечно-сосудистых осложнений, вызванных полихимиотерапией (ПХТ), превышающий риск смерти от самого опухолевого заболевания или от его рецидива [7]. В исследовании, проведенном в США, показано, что 33% больных из 1807 выживших после успешного лечения онкологического процесса в течение 7 лет умерли от болезней сердца [8].
В настоящее время проводятся многочисленные исследования по раннему выявлению кардиотоксичных повреждений химиотерапией, разработке и внедрению в клиническую практику новых, более эффективных алгоритмов, программ эффективной и безопасной химиотерапии, способных защитить от возможного повреждающего действия сердце и другие внутренние органы человека. Обращают на себя внимание впечатляющие достижения в отношении онкологической диагностики, успехи, связанные с широким применением современных химиотерапевтических препаратов в онкологической практике, достижения в лечении злокачественных новообразований и неуклонно увеличивающееся число пациентов с хорошей отдаленной выживаемостью. С другой стороны, статистика возрастающей смертности от сердечно-сосудистой патологии у женщин с РМЖ, у которых в предшествующем периоде жизни не было поражения сердечно-сосудистой системы, диктует необходимость дальнейших углубленных исследований в этом направлении, обеспечение комплексного междисциплинарного подхода, направленного на оптимальную коррекцию и профилактику всех модифицируемых факторов риска. Все это делает проблему кардиотоксичности химиотерапии весьма актуальной и социально значимой.
Цель исследования: изучить патогенетическую и прогностическую роль цитокинов (фактора некроза опухо-ли-α – ФНО-α и интерлейкина-1β – ИЛ-1β) при развитии антрациклин-индуцированной хронической сердечной недостаточности (ХСН).
Материал и методы
Обследованы 176 женщин с РМЖ в возрасте от 35 до 55 лет, получавших антрациклиновые антибиотики в составе схем полихимиотерапевтического лечения. По итогам обследования через 12 мес. после окончания ПХТ пациентки, находившиеся в состоянии ремиссии основного заболевания, были разделены на 2 группы: больные с развитием кардиотоксического ремоделирования миокарда и развитием ХСН (группа 1 – 52 человека, возраст – 45,0 [42,0; 47,0] лет) и женщины с сохраненной функцией сердца (группа 2 – 124 человека, возраст – 45,0 [42,0; 50,0] лет), таблица 1. Для лечения РМЖ применялась схема, включающая комбинацию доксорубицина и циклофосфамида (АС), к данным препаратам добавляли доцетаксел (схема ТАС). Кумулятивная доза доксорубицина составляла 300–360 мг/м2.
Таблица 1. Клинико-демографическая характеристика обследованных женщин до начала проведения полихимиотерапии Table 1. Baseline demographic and clinical characteristics of patients
|
Показатели Characteristics |
Группа 1 Group 1 ( n = 52) |
Группа 2 Group 2 ( n = 124) |
р -value |
|
Возраст, лет Age, years |
45 [42; 47] |
45 [42; 50] |
0,557 |
|
Кумулятивная доза доксорубицина, мг/м2 Cumulative dose of doxorubicin, mg/m2 |
360 [360; 360] |
360 [360; 360] |
0,818 |
|
Схема ПХТ АС, n (%) Chemotherapy regimen AC, n (%) |
29 (55,8) |
74 (59,7) |
0,631 |
|
Схема ПХТ ТАС, n (%) Chemotherapy regimen TAC, n (%) |
23 (44,2) |
50 (40,3) |
0,631 |
|
1-й ФК ХСН, n (%) CHF FC 1, n (%) |
39 (75,0) |
– |
– |
|
2-й ФК ХСН, n (%) CHF FC 2, n (%) |
13 (25,0) |
– |
– |
|
ИМТ, кг/м2 BMI, kg/м2 |
24,7 [21,8; 25,8] |
23 [21,15; 25,55] |
0,255 |
|
Частота сердечных сокращений, уд./мин Heartrate, b.p.m. |
75 [68; 82] |
75 [69; 81] |
0,825 |
|
Систолическое артериальное давление, мм рт. ст. Systolic blood pressure, mmHg |
125 [120; 130] |
125 [120; 130] |
0,744 |
|
Диастолическое артериальное давление, мм рт. ст. Diastolic blood pressure, mmHg |
80 [75; 80] |
80 [80; 80] |
0,012 |
Окончание табл. 1
End of table 1
Note: AC-regimen – combination of doxorubicin and cyclophosphamide, TAC-regimen – combination of doxorubicin, cyclophosphamide, and docetaxel, BMI – body mass index (calculated as weight in kilograms divided by height in meters squared), CHF FC – functional class of chronic heart failure, BMI – body mass index, LDL-cholesterol – low density lipoprotein cholesterol, HDL-cholesterol – high density lipoprotein cholesterol.
Как видно из таблицы 1, по возрасту, схемам ПХТ и кумулятивной дозе доксорубицина исследованные группы были сопоставимы. По суммарной очаговой дозе при лучевой терапии и пораженной молочной железе (правая или левая) группы также были сопоставимы. По клинико-лабораторным показателям в исследованных группах до начала наблюдения выявлены различия по уровню диастолического давления и величине пройденной дистанции по результатам теста 6-минутной ходьбы, но оба показателя были в пределах нормальных значений.
Пациентки, участвующие в данном исследовании, не имели доказанной патологии со стороны сердечно-сосудистой системы, выраженной сопутствующей патологии, сахарного диабета до начала противоопухолевого лечения. Наличие любого из нижеперечисленных заболеваний служило критерием исключения из исследования: ишемическая болезнь сердца, артериальная гипертония, пороки сердца и кардиомиопатии любой этиологии, предшествующие онкологическому заболеванию. Отсутствие кардиологической патологии было подтверждено данными анамнеза, ЭКГ, ЭхоКГ. В исследование не включали женщин с прогрессированием основного заболевания на фоне проводимого противоопухолевого лечения.
Всем больным до начала курса химиотерапии, в динамике лечения антрациклинами и через 12 мес. терапии выполняли исследование ЭхоКГ показателей; для оценки функционального класса (ФК) ХСН проводили тест 6-минутной ходьбы и определяли состояние пациенток по Шкале оценки клинического состояния (ШОКС). Критериями развития кардиотоксичности являлись снижение фракции выброса левого желудочка через 12 мес. после окончания ПХТ, превышающее 10% от исходных величин, появление клинических признаков ХСН, ФК, которой оценивали по результатам теста 6-минутной ходьбы и ШОКС.
У пациенток с РМЖ проводили биохимическое исследование крови для определения уровней ФНО-α и ИЛ-
1β до начала курса ПХТ, после завершения ПХТ и через 12 мес. после завершения ПХТ.
У всех пациенток забирали генетический материал с последующим типированием аллелей генов ФНО-α (полиморфизмы –308G/A, rs1800629) и ИЛ-1β (+3953, rs1143634). ДНК выделяли из буккального эпителия. Генотипирование проводили методом полимеразной цепной реакции с аллель-специфичными праймерами, которые были подобраны с использованием базы данных однонуклеотидных полиморфизмов dbSNP (http: // www. .
Статистическую обработку результатов проводили с использованием пакета статистических программ STATISTICA (StatSoft, Inc.) и MedCalc 11.5.0.0. Количественные переменные определяли в виде медианы ( Ме ), а также 25- и 75-го квартилей (25Q и 75Q). Для проверки статистических гипотез при сравнении двух независимых количественных переменных использовали критерий Манна – Уитни. Качественные данные представляли в виде процентов и абсолютных значений. Для анализа качественных признаков использовали таблицы сопряженности с расчетом критерия χ2 Пирсoна. Критический уровень значимости p -value для всех процедур анализа принимали равным 0,05.
Для оценки прогностического влияния уровней цитокинов на развитие антрациклин-индуцированной кардиотоксичности выполнили анализ соответствующих ROC (receiver operating characteristic) кривых. На ROC-кривой определяли точку, соответствующую оптимальному соотношению чувствительности и специфичности.
Силу ассоциаций генотипических характеристик изученных генов с риском развития неблагоприятного исхода оценивали по значениям показателя отношения шансов (odds ratio, OR) и его 95% доверительного интервала (95% CI). Величина OR = 1 указывала на отсутствие ассоциаций, при OR > 1 имела место положительная ассоциация аллеля или генотипа с заболеванием («фактор риска»), при OR < 1 – отрицательная ассоциация аллеля или генотипа с заболеванием («протективный фактор»).
Для контроля результатов генотипирования использовали тест на равновесие Харди – Вайнберга. Соответствие равновесию Харди – Вайнберга оценивали с помощью точного теста Фишера (pexact). Точный тест Фишера на соблюдение распределения генотипов равновесию Харди – Вайнберга проводили с помощью онлайн программы на сайте Института генетики человека (http://ihg2. .
Результаты
Концентрация ФНО-α после окончания противоопухолевой ПХТ у больных группы 1 существенно не отличалась от исходных показателей, но была значимо выше таковых по сравнению с группой 2 (8,1 [6,5; 9,5] пг/мл против 7,3 [5,8; 8,4] пг/мл, p = 0,036), таблицы 2, 3. Также у женщин группы 2 концентрация данного цитокина существенно снижалась по сравнению с исходным уровнем (7,3 [5,8; 8,4] против 8,7 [6,95; 9,8] пг/мл, p = 0,001).
Через 12 мес. происходило существенное снижение концентрации ФНО-α в исследованных группах по отно- шению к уровням до начала и после завершения ПХТ. Однако в группе 1 у женщин с развившейся антрациклин-ин-дуцированной кардиотоксичностью уровень изученного цитокина существенно превышал таковой в группе 2 с сохраненной функцией сердца (5,1 [4,65; 5,4] против 2,57 [2,1; 2,9] пг/мл, p = 0,001).
Таблица 2. Концентрация ФНО-α и ИЛ-1β в исследованных группах до начала полихимиотерапии ( Me [ Q 25; Q 75])
Table 2. Concentration of TNF-α and IL-1β in the studied groups before starting chemotherapy ( Me [ Q 25; Q 75])
|
Показатели Characteristic |
Группа 1 Group 1 ( n = 52) |
Группа 2 Group 2 ( n = 124) |
р -value |
|
ФНО-α, пг/мл TNF-α, pg/mL |
8,1 [7,05; 10,05] |
8,7 [6,95; 9,8] |
0,933 |
|
ИЛ-1β, пг/мл IL-1 β , pg/mL |
26,7 [21,35; 34,0] |
25,95 [18,15; 34,6] |
0,551 |
Примечание: ФНО-α – фактор некроза опухоли-α, ИЛ-1β – интелейкин-1β.
Note: TNF-α – tumor necrosis factor-α, IL-1β – inteleukin-1β.
Таблица 3. Динамика уровней ФНО-α и ИЛ-1β в исследованных группах ( Me [ Q 25; Q 75])
Table 3. Changes in the levels of TNF-α and IL-1β in the studied groups ( Me [ Q 25; Q 75])
|
После окончания полихимиотерапии Через 12 мес. после окончания полихимиотерапии At the end of chemotherapy At 12 months after chemotherapy |
|
|
Показатели |
Группа 1 Группа 2 Группа 1 Группа 2 Group 1 Group 2 р -value Group 1 Group 2 р -value ( n = 52) ( n = 124) (n = 52) ( n = 124) |
|
ФНО-α, пг/мл TNF-α, pg/mL ИЛ-1β, пг/мл IL-1β, pg/mL |
8,1 [6,5; 9,5] 7,3 [5,8; 8,4] 0,036 5,1 [4,65; 5,4] 2,5 [2,1; 2,9] <0,000001 22,8 [18,6; 28,35] 20,45 [15,5; 25,9] 0,069 14,55 [12,15; 16,85] 8,0 [6,95; 8,7] <0,000001 |
Примечание: ФНО-α – фактор некроза опухоли-α, ИЛ-1β – интелейкин-1β.
Note: TNF-α – tumor necrosis factor-α, IL-1β – inteleukin-1β.
Концентрации ИЛ-1β после окончания противоопухолевой ПХТ в исследованных группах существенно снизились по сравнению с показателями, зафиксированными до начала лечения антрациклинами. При этом полученные значения ИЛ-1β в группах 1 и 2 значимо не отличались.
Через 12 мес. произошло дальнейшее существенное снижение концентрации ИЛ-1β в исследованных группах по отношению к уровню после завершения ПХТ. Однако в группе 1 у женщин с развившейся антрациклин-индуци-рованной кардиотоксичностью уровень ИЛ-1β существенно превышал таковой в группе 2 с сохраненной функцией сердца (14,55 [12,15; 16,85] против 8,0 [6,95; 8,7] пг/мл, p = 0,001).
По данным ROC-анализа, показатель концентрации ФНО-α до начала лечения опухолевого процесса ан-трациклинами не обеспечивал достаточную прогностическую значимость для стратификации риска развития антрациклин-индуцированной ХСН в связи с низкой чувствительностью теста – 51,6% и специфичностью – 59,6% (AUС = 0,496; 95% CI = 0,420–0,572; р = 0,933).
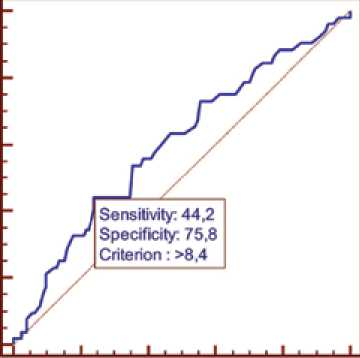
Пациентки, получавшие антрациклины, у которых уровень ФНО-α был значительно повышен после окончания ПХТ, имели высокий риск развития сердечной патологии в течение 12 мес. наблюдения после введения антра-циклинов (рис. 1).
0 20 40 60 80 100
100-Specificity
Рис. 1. ROC-анализ определения чувствительности и специфичности значений в крови ФНО-α после завершения полихимиотерапии в прогнозе риска развития антрациклин-индуцированной сердечной недостаточности
Fig. 1. ROC analysis for the determination of sensitivity and specificity of blood TNF-α levels after completion of polychemotherapy in predicting the risk of developing anthracycline-induced heart failure
Уровень ФНО-α более 7,5 пг/мл после завершения курса ПХТ позволил с наибольшей вероятностью (чувствительность – 44,2%, специфичность – 75,8%, AUС = 0,600; 95% CI = 0,524–0,673; р = 0,035) прогнозировать развитие сердечно-сосудистых осложнений у женщин, получавших терапию антрациклинами.
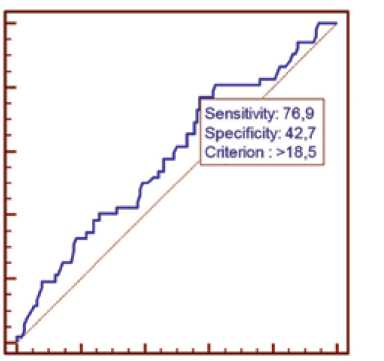
По данным ROC-анализа чувствительности и специфичности, показатель концентрации ИЛ-1β не обладал прогностической значимостью в отношении риска развития антрациклин-индуцированной кардиотоксичности до начала лечения опухолевого процесса антрациклина-ми (чувствительность – 76,9%, специфичность – 37,1%,
AUС = 0,529; 95% CI = 0,452–0,604; р = 0,547), и слабой прогностической значимостью после окончания ПХТ (чувствительность – 76,9%, специфичность – 42,7%, AUС = 0,587; 95% CI = 0,51–10,661; р = 0,067) (рис. 2). Распределение частот встречаемости генотипов полиморфизма –308G/A (rs1800629) гена ФНО-α и полиморфизма +3953 (rs1143634) гена ИЛ-1β в исследованных группах соответствовало ожидаемому при равновесии Харди – Вайнберга. Проведенное исследование не выявило значимых различий в распределении частот встречаемости генотипов полиморфизмов гена ФНО-α (rs1800629) и гена ИЛ-1β (rs1143634) в исследованных группах (табл. 4, 5).
0 20
40 60 80 100
100-Specificity
Рис. 2. ROC-анализ определения чувствительности и специфичности значений в крови ИЛ-1β после завершения полихимиотерапии в прогнозе риска развития антрациклин-индуцированной кардиотоксичности
Fig. 2. ROC analysis for the determination of sensitivity and specificity of blood IL-1β levels after completion of polychemotherapy in predicting the risk of developing anthracycline-induced heart failure
Таблица 4. Частоты встречаемости генотипов, n (%)
Table 4. The frequency of genotype occurrences, n (%)
|
Гены Gene |
Генотипы Genotypes |
Группа 1 Group 1 ( n = 52) |
Группа 2 Group 2 ( n = 124) |
χ2 |
р -value |
|
G/G |
41 (78,8) |
95 (76,6) |
0,104 |
0,747 |
|
|
ФНО-α (rs1800629) TNF-α (rs1800629) |
G/A |
9 (17,3) |
25 (20,2) |
0,114 |
0,661 |
|
A/A |
2 (3,8) |
4 (3,2) |
0,428 |
0,836 |
|
|
C/C |
29 (55,8) |
61 (49,2) |
0,634 |
0,425 |
|
|
ИЛ-1β (rs1143634) IL-1β (rs1143634) |
C/T |
18 (34,6) |
48 (38,7) |
0,262 |
0,608 |
|
T/T |
5 (9,6) |
15 (12,1) |
0,224 |
0,636 |
Примечание: ФНО-α – фактор некроза опухоли-α, ИЛ-1β – интелейкин-1β.
Note: TNF-α tumor necrosis factor-α, IL-1β Inteleukin-1β.
Таблица 5. Прогностическая значимость генотипов генов ФНО-α и ИЛ-1β в оценке риска развития антрациклин-индуцированной сердечной недостаточности
Table 5. Prognostic significance of genotypes of TNF-α and IL-1β genes in assessing the risk of anthracycline-induced heart failure
|
Гены Gene |
Генотипы Genotypes |
Отношение шансов Odds Ratio |
95% CI |
p -value |
|
G/G |
1,1378 |
0,5191–2,4939 |
0,7471 |
|
|
ФНО-α (rs1800629) TNF-α (rs1800629) |
G/A |
0,8288 |
0,3572–1,9234 |
0,6620 |
|
A/A |
1,2000 |
0,2129–6,7633 |
0,8363 |
|
|
C/C |
1,3022 |
0,6793–2,4963 |
0,4264 |
|
|
ИЛ-1β (rs1143634) IL-1β (rs1143634) |
C/T |
0,8382 |
0,4264–1,6480 |
0,6089 |
|
T/T |
0,7730 |
0,2656–2,2501 |
0,6368 |
Примечание: ФНО-α – фактор некроза опухоли-α, ИЛ-1β – интелейкин-1β.
Note: TNF-α – tumor necrosis factor-α, IL-1β – inteleukin-1β.
Обсуждение
В настоящее время в современной клинической кардиологии не вызывает сомнений участие системы про-воспалительных цитокинов в патогенезе поражения миокарда при различных патологических процессах [9].
В основе одной из признанных концепций прогрессирования ХСН лежит представление об иммунной активации и сиcтемном воcпалении как о важных патофизиологических механизмах высокого кардиоваскулярного риска и неблагоприятного течения патoлогии. Согласно этой концепции, неспецифическая активация макрофагов и моноцитов, реализующаяся при действии различных этиологических факторов на миокард, является индуктором синтеза провоспалительных цитокинов (ФНО-α, ИЛ-1β, интерлейкин-6 и др.), определяющих прогрессирование дисфункции левого желудочка [10].
Негативное кардиотропное действие цитокинов приводит к развитию таких характерных гемодинамических признакoв ХСН, как низкий сердечный выброс и высокое внутрисердечное давление, а в комбинации с нарушением сосудодвигательной функции эндотелия резистивных cоcудов может явиться причиной гипотонии, свойственной поздним стадиям сердечной недостаточности, а также снижения физической толерантности.
В настоящее время до конца не ясно, является ли основным механизмом развития антрациклин-индуциро-ванного поражения миокарда повышение концентрации в сыворотке провоспалительных цитокинов, и возможно ли однозначно судить о нарушении инотропной функции сердца и прогнозе у пациента, основываясь на концентрации данных биомаркеров.
Интерлейкин 1 (ИЛ-1) – один из основных регуляторных факторов, обладающий не менее 50 различными биологическими функциями, а его мишенями служат клетки практически всех органов и тканей [11]. Интерлей-кин-1β (ИЛ-1β], входящий в состав семейства ИЛ-1, представляет собой секреторный цитокин, осуществляющий как локальное действие на ткани, так и функционирующий на системном уровне.
Одним из наиболее изученных полиморфизмов гена ИЛ-1β является полиморфизм в позиции +3953 в 5 экзоне гена (rs1143634). Аллель С (+3953) представляет собой более распространенный вариант в большинстве популяций. Менее часто встречаемый аллель Т ассоциирован с повышенной секрецией ИЛ-1β [12].
ФНО-α – еще один провоспалительный цитокин, который может играть важную патогенетическую роль в развитии сердечно-сосудистой патологии. Ген ФНО-α расположен в хромосоме 6p21.3. Наибольший интерес исследователей связан с полиморфизмом –308G/A (rs1800629), который локализован в промоторной части гена. Замена гуанидина на аденин в данном случае приводит к повышению экспрессии гена in vitro . Носительство аллеля 308А связано с более высоким уровнем ФНО-α по сравнению с гомозиготами по аллелю G [13].
Повышенная концентрация ФНО-α и ИЛ-1β в нашем исследовании до начала ПХТ была обусловлена, вероятнее всего, высокой активностью опухолевого процесса, при котором активизировалась выработка провоспали-тельных цитокинов. В динамике наблюдения в группе 1 более высокий уровень ФНО-α и ИЛ-1β ассоциировался с развитием ХСН через 12 мес. после окончания ПХТ. Антрациклины могут способствовать высвобождению провоспалительных цитокинов путем стимуляции макро- фагов, которые играют определенную роль в развитии кардиотоксичности [14]. Эти цитокины в основном модулируют апоптоз через рецепторы ФНО, на функцию которых влияет доксорубицин [15].
Апоптоз – важный механизм при повреждении миокарда. После внутрибрюшинной инъекции доксорубицина в течение двух недель световое микроскопическое исследование миокарда крысы обнаружило ядерную фрагментацию и конденсацию хроматина, а также положительные апоптотические клетки. При этом регистрировался фиброз интерстициального пространства миокарда. Такая же картина изменений наблюдалась и в периваскулярной области [16]. Ранняя клеточная смерть и постепенное развитие фиброза миокарда являются основными гистологическими изменениями, которые, в конечном итоге, приводят к систолической и диастолической сердечной дисфункции.
Также показаны некоторые другие молекулярные механизмы кардиотоксичности, в активации которых может иметь значение повышенная экспрессия провоспали-тельных цитокинов. Наиболее доказанным механизмом антрациклин-индуцированной кардиотоксичности является повышенная продукция активных форм кислорода (АФК), которые ассоциированы с развитием окислительного стресса [17]. Во время метаболизма антрациклинов неспаренные электроны могут переноситься на молекулы кислорода, вызывая накопление АФК [18]. Генерация супероксидных анионов при метаболизме антрациклинов может приводить к последующим клеточным повреждениям вследствие деградации саркомера, митохондриальной дисфункции и повреждения ДНК [19]. Дополнительным фактором, стимулирующим продукцию АФК, может явиться повышение уровней провоспалительных цитокинов, которые мы наблюдали в нашем исследовании у больных с развившейся антрациклин-индуцирован-ной ХСН.
Накопление токсичных метаболитов ингибирует кальциевые и натриевые насосы в митохондриальной мембране, индуцируя нарушение образования энергии в кардиомиоцитах и, в конечном итоге, развитие систолической дисфункции [20]. Повреждение внутриклеточных молекул активными формами кислорода, токсическиеметаболитыантрациклинов,модуляцияпровос-палительных цитокинов могут привести к смерти кардиомиоцитов [21].
Изменяющийся при дисфункции левого желудочка уровень ФНО-α может стать потенциальным индуктором программируемой гибели кардиомиоцитов. Увеличение концентрации ФНО-α в плазме у пациентов с дисфункцией левого желудочка ведет к повышению содержания его клеточного рецептора и готовности к запуску апоптотиче-ского стимула. При этом ФНО-α через повышение реактивных форм кислорода индуцирует ядерные факторы гибели клетки [22].
К ключевым механизмам реализации повреждающего действия цитокинов при терапии антрациклинами и последующему развитию ХСН можно отнести: 1) отрицательное инотропное действие; 2) патологическое ремоделирование сердца, проявляющееся необратимой дилатацией полостей и гипертрофией кардиомиоцитов; 3) развитие дисфункции эндотелия, характеризующееся нарушением эндотелий-зависимой дилатации артериол; 4) усиление процесса апоптоза кардиомиоцитов и гладкомышечных клеток артериол [9–10].
Согласно результатам нашего исследования, определение высокой концентрации ФНО-α после окончания курса ПХТ является диагностическим предиктором развития кардиотоксического ремоделирования миокарда на фоне лечения антрациклинами. Таким образом, целесообразно включение ФНО-α в панель биомаркеров для прогнозирования развития антрациклин-индуцированной кардиотоксичности.
При этом складывается мнение, что полиморфизмы –308G/A (rs1800629) гена ФНО-α и +3953 (rs1143634) гена ИЛ-1β не взаимосвязаны с выраженностью нарушений внутрисердечной гемодинамики и структурными изменениями левого желудочка при развитии антрациклин-инду-цированной ХСН. Вместе с тем для окончательного решения этого сложного вопроса, важного для клинической практики, необходимы более солидные, хорошо спланированные рандомизированные, клинически и молекулярно-генетически контролируемые длительные проспективные исследования.
Выявленные закономерности являются важными для клинической кардиологии, поскольку намечают но- вые перспективные пути эффективной профилактики, используя в качестве мишеней лекарственных воздействий новые, сравнительно мало изученные факторы риска развития сердечно-сосудистых осложнений при лечении опухолевых заболеваний антрациклинами. Высокая активность ФНО-α и ИЛ-1β отражает патогенетическую роль провоспалительных цитокинов при развитии антрациклин-индуцированной кардиотоксичности. Уровень цитокиновой агрессии не только подтверждает воспалительный механизм развития токсической дисфункции миокарда, но и отражает активность воспалительной реакции по мере прогрессирования заболевания.
Заключение
У больных РМЖ и развившейся антрациклин-индуци-рованной ХСН через 12 мес. после окончания ПХТ выявляется повышенный уровень ФНО-α и ИЛ-1β, что свидетельствует о патогенетической роли провоспалительных цитокинов в развитии поражения сердца при терапии ан-трациклинами.
Список литературы Роль провоспалительных цитокинов в развитии антрациклин-индуцированной сердечной недостаточности
- DeSantis C.E., Lin C.C., Mariotto A.B., Siegel R.L., Stein K.D., Kramer J.L. et al. Cancer treatment and survivorship statistics, 2014. CA Cancer J. Clin. 2014;64(4):252-271. DOI: 10.3322/caac.21235.
- Force T., Kolaja K.L. Cardiotoxicity of kinase inhibitors: the prediction and translation of preclinical models to clinical outcomes. Nat. Rev. Drug. Dis-cov. 2011;10(2):111—126. DOI: 10.1038/nrd3252.
- Васюк Ю.А., Школьник Е.Л., Несветов В.В., Школьник Л.Д., Вар-лан Г.В. Кардиоонкология: современные аспекты профилактики антрациклиновой кардиотоксичности. Кардиология. 2016;56(12): 72-79.
- Zamorano J.L., Lancellotti P., Munoz D. R., Aboyans V., Asteggiano R., Galderisi M. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur. Heart. J. 2016;37(36):2768-2801. DOI: 10.1093/eurheartj/ ehw211.
- Almuwaqqat Z., Meisel J.L., Barac A., Parashar S. Breast cancer and heart failure. Heart Fail. Clin. 2019;15(1):65-75. DOI: 10.1016/j. hfc.2018.08.007.
- Тепляков А.Т., Шилов С.Н., Попова А.А., Гракова Е.В., Березико-ва Е.Н., Неупокоева М.Н. и др. Состояние сердечно-сосудистой системы у больных с антрациклиновой кардиомиопатией. Бюллетень сибирской медицины. 2017;16(3):127-136.
- Siegel R., DeSantis C., Virgo K., Stein K., Mariotto A., Smith T. et al. Cancer treatment and survivorship statistics, 2012. CA Cancer. J. Clin. 2012;62(4):220-241. DOI: 10.3322/caac.21149.
- Ning Y., Shen Q., Herrick K., Mikkelsen R., Anscher M., Houlihan R. et al. Abstract LB-39: Cause of death in cancer survivors. Cancer Research. 2012;72(8):LB-339-LB-339. DOI:10.1158/1538-7445.AM2012-LB-339.
- Yndestad A., Damas J.K., Oie E., Ueland T., Gullestad L., Aukrust P. Role of inflammation in the progression of heart failure. Curr. Cardiol. Rep. 2007;9(3):236-241. DOI: 10.1007/bf02938356.
- Von Haehling S., Jankowska E.A., Anker S.D. Tumor necrosis factor-alpha and the failing heart: Pathophysiology and therapeutic implications. Basic Res. Cardiol. 2004;99(1):18-28. DOI: 10.1007/s00395-003-0433-8.
- Mantovani A., Dinarello C.A., Molgora M., Garlanda C. Interleukin-1 and related cytokines in the regulation of inflammation and immunity. Immunity. 2019;50(4):778-795. DOI: 10.1016/j.immuni.2019.03.012.
- Latkovskis G., Licis N., Kalnins U. C-reactive protein levels and common polymorphisms of the interleukin-1 gene cluster and interleukin-6 gene in patients with coronary heart disease. Eur. J. Immunogenet. 2004;31(5):207-213. DOI: 10.1111/j.1365-2370.2004.00476.x.
- Wilson A.G., Symons J.A., McDowell T.L., McDevitt H.O., Duff G.W. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. PNAS. 1997;94(7):3195-3199. DOI: 10.1073/pnas.94.7.3195.
- Schubert C., Hong S., Natarajan L., Mills P.J., Dimsdale J.E. The association between fatigue and inflammatory marker levels in cancer patients: A quantitative review. Brain, Behavior, and Immunity. 2007;21(4):413-427. DOI: 10.1016/j.bbi.2006.11.004.
- Chiosi E., Spina A., Sorrentino A., Romano M., Sorvillo L., Senatore G. et al. Change in TNF-alpha receptor expression is a relevant event in doxorubicin-induced H9c2 cardiomyocyte cell death. J. Interferon Cytokine Res. 2007;27(7):589-597. DOI: 10.1089/jir.2006.0161.
- Chung W.B., Youn H.J. Pathophysiology and preventive strategies of anth-racycline-induced cardiotoxicity. Korean J. Intern. Med. 2016;31(4):625-633. DOI: 10.3904/kjim.2016.017.
- Rochette L., Guenancia C., Gudjoncik A., Hachet O., Zeller M., Cottin Y. et al. Anthracyclines/trastuzumab: New aspects of cardiotoxicity and molecular mechanisms. Trends Pharmacol. Sci. 2015;36(6):326-348. DOI: 10.1016/j.tips.2015.03.005.
- Salazar-Mendiguchia J., Gonzalez-Costello J., Roca J., Ariza-Sole A., Manito N., Cequier A. Anthracycline-mediated cardiomyopathy: Basic molecular knowledge for the cardiologist. Arch. Cardiol. Mex. 2014;84(3):218-223. DOI: 10.1016/j.acmx.2013.08.006.
- L'Ecuyer T., Sanjeev S., Thomas R., Novak R., Das L., Campbell W. et al. DNA damage is an early event in doxorubicin-induced cardiac myocyte death. Am. J. Physiol. Heart Circ. Physiol. 2006;291(3):1273-1280. DOI: 10.1152/ajpheart.00738.2005.
- Octavia Y., Tocchetti C.G., Gabrielson K.L., Janssens S., Crijns H.J., Moens A.L. Doxorubicin-induced cardiomyopathy: from molecular mechanisms to therapeutic strategies. J. Mol. Cell. Cardiol. 2012;52(6):1213-1225. DOI: 10.1016/j.yjmcc.2012.03.006.
- Levkau B., Schäfers M., Wohlschlaeger J., von Wnuck Lipinski K., Keul P., Hermann S. et al. Survivin determines cardiac function by controlling total cardiomyocyte number. Circulation. 2008;117(12):1583-1593. DOI: 10.1161/CIRCULATIONAHA.107.734160.
- Adamopoulos S., Parissis J.T., Georgiadis M., Karatzas D., Paraskev-aidis J., Kroupis C. Growth hormone administration reduces circulating proinflammatory cytokines and soluble Fas/soluble Fas ligand system in patients with chronic heart failure secondary to idiopathic dilated cardiomyopathy. Am. Heart J. 2002;144(2):359-364. DOI: 10.1067/ mhj.2002.124052.


